放射治疗对兔肢体软组织肿瘤血液供应及细胞增殖的影响
闫悦,王崇文,杨磊,李文婷,时广力,何传宇,白靖平
(1新疆医科大学附属肿瘤医院,乌鲁木齐830011;2新疆医科大学第一附属医院)
放射治疗对兔肢体软组织肿瘤血液供应及细胞增殖的影响
闫悦1,王崇文1,杨磊2,李文婷1,时广力1,何传宇1,白靖平1
(1新疆医科大学附属肿瘤医院,乌鲁木齐830011;2新疆医科大学第一附属医院)
目的 探讨放射治疗对兔肢体软组织肿瘤血液供应及细胞增殖的影响。方法 建立30只兔VX2肢体软组织肿瘤模型,随机分为对照组10只、调强放疗(IMRT)组10只及容积弧形调强放疗(VMAT)组10只,IMRT组、VMAT组分别进行IMRT、VMAT,放疗后第7天行三维能量多普勒超声血管成像(3D-PDA)检查,记录肿瘤血管分型及血管形成指数(VI)、血流指数(FI)、血管血流指数(VFI)。对照组不予处理,检查方法及时间同VMAT组。3D-PDA检查后处死动物取肿瘤组织,采用免疫组化SP法检测Ki-67阳性表达率及微血管密度(MVD)。结果 IMRT组血管分型为Ⅰ型7例、Ⅱ型1例、Ⅲ型0例,VMAT组为10、0、0例,对照组为0、2、8例;IMRT组和VMAT组血管分型明显优于对照组(P均<0.01)。IMRT组和VMAT组VI、FI、VFI及Ki-67阳性表达率、MVD均低于对照组(P均<0.05),IMRT组和VMAT组上述指标比较差异无统计学意义(P均>0.05)。结论 IMRT、VMAT均可减少兔肢体软组织肿瘤的血液供应并抑制肿瘤细胞增殖。
软组织肉瘤;放射治疗;三维能量多普勒超声血管成像;Ki-67;微血管密度
软组织肉瘤(STS)来源于中胚层的机体间充质组织,手术是其首选治疗方式,而辅助应用放射治疗(放疗)能够显著降低局部复发率[1,2]。新辅助放疗可使原本不能切除的病灶缩小、临床分期降低,从而提高根治性切除率[3]。肿瘤血供为其增殖、转移提供营养物质,可作为评价放疗疗效的指标。兔VX2肿瘤是通用的肿瘤模型,其发生、发展及转移等生物学行为与STS极其相似,即在局部呈浸润性生长,突破间室[4]。2014年11月~2015年6月,我们建立兔VX2肢体软组织肿瘤模型,并观察了其血液供应及细胞增殖情况,现将结果报告如下。
1 材料与方法
1.1 材料 动物:纯种新西兰雄性大白兔39只,体质量3.5~4 kg,6~8月龄,由新疆医科大学动物中心提供(编号: SYXK2010-0002)。试剂及仪器:冰冻VX2肿瘤细胞悬液由新疆维吾尔自治区医学影像研究所提供;Ki-67免疫组化试剂盒(美国Pierce公司),CD34血管内皮标志物免疫组化试剂盒(武汉博士德生物工程有限公司);三维超声GE LOGIQ E9型超声诊断仪(美国GE公司),三维超声探头(探头型号:RSP 6-16-D),VARIAN IX直线加速器(RapidArcTM),飞利浦MX800多层螺旋CT扫描机(荷兰飞利浦公司)。
1.2 兔VX2肢体软组织肿瘤模型制备 随机选择9只新西兰雄性大白兔,用于VX2肿瘤细胞传代。将冰冻VX2肿瘤细胞悬液按一般细胞培养技术复苏,800 r/min离心5 min,去除上清液,加入PBS液后再离心5 min;弃上清液,加入PBS液并用玻璃棒搅匀;取悬液台朌蓝染色,计数活细胞和死细胞;将悬液调制成1×106活细胞密度。取0.5 mL细胞悬液接种于9只兔左后肢肌肉内,待肿瘤生长至直径3.0~3.5 cm时切取肿瘤,切成大小约0.5 cm×0.5 cm的碎块制备肿瘤细胞混悬液。剩余30只兔肌肉注射3%戊巴比妥钠1.5 m/kg麻醉,B超引导下将0.5 mL肿瘤细胞混悬液注射入其左后肢毗邻股骨约0.5 cm的肌肉内。造模后2周B超检查示左后肢肿瘤直径为3.0~3.5cm,证实模型制备成功。
1.3 分组处理 采用随机数字表法将30只VX2肢体软组织肿瘤兔分为调强放疗组(IMRT组)、容积弧形调强放疗组(VMAT组)及对照组,每组10只。采用大孔径增强CT扫描定位,将兔取俯卧位放置,热塑体膜固定,并做体表摆位标记。经耳缘静脉快速推入对比造影剂碘帕醇2 mL/kg,扫描范围为骨盆至膝关节,扫描层厚为2.5 mm。CT影像通过Varis局域网传输到Varian Eclipse 10.0计算机平台,由放疗医师勾画靶区。VMAT组将肿瘤周边毗邻骨骼的区域作为肿瘤靶区推量(GTVboost),整个肿瘤作为肿瘤靶区(GTV);临床靶区(CTV)在GTV基础上X轴、Z轴外扩0.3~0.5 cm,Y轴外扩3 cm;计划靶区(PTV)在CTV基础上外扩0.3~0.5 cm;采用同步推量计划:GTVboost:3 Gy/次,GTV:2.5 Gy/次,CTV:2.5 Gy/次,PTV:2.5 Gy/次,每周5次,共3周。IMRT组将肿瘤定义为GTV,依次勾画CTV、PTV;采用常规分割PTV:2Gy/次,5野,每周5次,共5周。计划完成前校对放疗中心,采用Varian IX医用直线加速器6 MV射线完成放疗。对照组不予处理。
1.4 相关指标观察
1.4.1 肿瘤组织血液供应 放疗后第7天三组均行三维能量多普勒超声血管成像(3D-PDA)检查。采用GE LOGIQ E9彩超诊断仪联合三维探头,频率7~12 MHz。探头标记处与股骨长轴平行,动态三维容积探头在仪器设置的muscle条件下,启动三维成像程序,显示X、Y、Z三个不同方向切面的能量多普勒图像,进行存储。调出三维数据库中的3D-PDA容积资料,选用Vocal手动模式,旋转角度15°。以A平面作为参考平面,紧贴骨面勾画肿瘤边缘显示肿瘤立体血流,按照血管的分布与走行,参照Ohishi等[5]的方法将肿瘤血管分布分为Ⅰ、Ⅱ、Ⅲ型(Ⅰ型血供不丰富,Ⅲ型血供丰富,Ⅱ型血供介于二者之间)。通过计算机软件自动计算并显示血流和血管参数,包括血管形成指数(Ⅵ)、血流指数(FI)、血管血流指数(VFI)。
1.4.2 肿瘤组织病理情况 3D-PDA检查结束后处死三组动物,完整切取其左后肢肿瘤标本,选取肿瘤毗邻股骨处的肿瘤组织进行标记、取材。中性甲醛溶液固定24 h,石蜡包埋、切片,行HE染色,100倍光镜下观察肿瘤组织病理情况。
1.4.3 肿瘤组织 Ki-67表达及微血管密度(MVD) Ki-67表达:采用免疫组化SP法,严格按照试剂盒说明书操作。选取有代表性的5个高倍视野,每个视野计数100个细胞,计算阳性细胞(细胞核呈棕黄色)所占的比例,其平均数记为Ki-67表达,可反映细胞增殖情况。MVD:经CD34多克隆抗体标记微血管后,免疫组化染色显示肿瘤血管呈棕黄色。先于40倍镜下寻找切片MVD丰富区域,再于400倍视野下计数染成棕色并可与周围血管、肿瘤及其他结缔组织区分开的内皮细胞或细胞簇数目。计数时将单一走行的血管记为1,如果血管走行中有分支则以最终的分支数为准;单个散在或聚集成簇尚未形成管腔的内皮细胞亦计数为1。管腔横截面中内皮细胞总数>8的血管不是新生血管,不作计数。

2 结果
IMRT组放疗过程中2只死亡(一只死于麻醉过量,一只肿瘤破溃至皮肤予安乐死),最终存活8只;其余两组均存活。
2.1 三组肿瘤组织血液供应情况 IMRT组肿瘤内部未见血管分布,仅周边可见点状、线状血管。VMAT组可见整个肿瘤血管结构明显减少。对照组肿瘤实质有部分树枝状血管存在,分支复杂,走行迂曲,周边可见环绕的粗大血管。IMRT组血管分型为Ⅰ型7例、Ⅱ型1例、Ⅲ型0例,VMAT组为10、0、0例,对照组为0、2、8例;IMRT组和VMAT组血管分型明显优于对照组(P均<0.01)。IMRT组和VMAT组VI、FI、VFI均低于对照组(P均<0.05),IMRT组与VMAT组VI、FI、VFI比较差异无统计学意义(P均>0.05)。见表1。
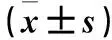
表1 三组VI、FI、VFI比较
注:与对照组比较,*P<0.05。
2.2 三组肿瘤组织病理情况 IMRT组镜下可见肿瘤实质及肿瘤边缘组织大片坏死细胞,伴有炎细胞浸润及纤维组织增生;在其他视野仍可观察到少许肿瘤细胞残留。VMAT组GTVboost区域可见肿瘤细胞坏死明显,纤维组织增生;纤维组织周围有炎细胞浸润,表现出坏死细胞逐渐被纤维细胞替代的演化改变;在其他视野仍可观察到少许肿瘤细胞残留。对照组镜下可见肿瘤细胞侵犯横纹肌,正常的细胞结构受到损害,细胞边界与周围组织不清。
2.3 三组肿瘤组织Ki-67阳性表达及MVD比较 IMRT组和VMAT组Ki-67阳性表达率、MVD均低于对照组(P均<0.05),IMRT组和VMAT组Ki-67阳性表达率、MVD比较差异无统计学意义(P均>0.05)。见表2。Pearson相关分析结果显示,VI与MVD呈正相关(r=0.91,P<0.01)。
2.4 VI与MVD的关系 Pearson相关分析结果显示,VI与MVD呈正相关(r=0.91,P<0.01)。
3 讨论
在临床和实验研究中, 放疗对实体肿瘤治疗效果的评估一直存在争议。Le Grange等[6]研究认为,大多数STS患者新辅助放疗后肿瘤体积会缩小,但仍有小部分的肿瘤体积会增大,并且进一步证实肿瘤体积的变化与手术切除后的局部控制率无相关性。研究显示,肿瘤组织的内部代谢和血供变化可更好地评估治疗效果[7]。在肿瘤的生长和转移中,血管生成起关键作用[8,9]。CT能够通过病变区域的密度判断肿瘤的存活或坏死,但对于表现为低密度且不能明显增强的区域,可能还包括少量存在于纤维组织中的存活肿瘤细胞[10]。MRI在评价肿瘤治疗效果方面有一定优势,坏死的组织表现为T1WI低信号和T2WI高信号,对比增强的T1WI无强化,同时残留的肿瘤组织在增强MRI中表现为高信号,但在术后早期出现的炎症区域也同样表现为明显强化[11]。
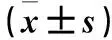
表2 三组Ki-67阳性表达率及MVD比较
注:与对照组比较,*P<0.05。
3D-PDA为观察肿瘤内部及周边的血管结构提供了一种动态、立体及直观的方式,能够客观显示肿瘤的血液供应[12]。应用Vocal软件对靶器官内的血流信号进行自动分析计算出总的血流振幅与彩色值,从而生成VI、FI、VFI。VI表示整个感兴趣容积内血流信号所占的比例,FI表示整个感兴趣容积内血流信号的平均强度,VFI是血管数量与血流信号强度的结合[13]。研究显示,VI、FI、VFI可全面、客观、量化评估活体组织内的血管密度和灌注情况[14]。本研究结果显示,对照组肿瘤周边有丰富的血管网,而肿瘤实质仍有部分树枝状的血管存在,但血管结构不是很丰富,可能与兔肢体软组织肿瘤的生长速度以及发生凋亡、坏死的过程都明显快于人体肿瘤有关;IMRT组和VMAT组血管分型明显优于对照组,VI、FI、VFI均低于对照组,而IMRT组和VMAT组之间无明显差异,说明IMRT、VMAT均可降低兔肢体软组织肿瘤的血管形成及血液供应。但因无法保证每次3D-PDA检查是探头的角度相同,且之后三维图像生成的立体血流图亦不相同,因此无法完全保证测量的真实性。
Ki-67阳性表达率与恶性肿瘤的发展、转移、预后相关,可反映恶性肿瘤增殖率,是判断肿瘤生物学行为的良好指标[15]。亦逐渐成为肿瘤放疗疗效的评价指标[16]。子宫颈鳞状上皮细胞癌患者Ki-67阳性表达率从放疗前的49.7%降低至放疗后的24%,细胞增殖活性显著降低[17]。经CD34多克隆抗体标记微血管后,可以间接反映MVD,为肿物组织内微血管进行定量研究提供依据[18]。本研究结果显示,IMRT组和VMAT组Ki-67阳性表达率、MVD均明显低于对照组,IMRT组和VMAT组Ki-67阳性表达率、MVD比较差异无统计学意义,表明放疗可明显抑制兔肢体软组织肿瘤的血液供应及细胞增殖。本研究Pearson相关分析结果显示,VI与MVD呈正相关。Hui等[19]应用3D-CPA检测宫颈癌上皮内瘤变的研究,也得到了与VI与MVD呈正相关的结果。
综上所述,IMRT、VMAT均可减少兔肢体软组织肿瘤的血液供应并抑制其细胞增殖。3D-PDA能够从立体血供角度评价肿瘤的放疗效果,可作为临床评价软组织肉瘤放疗效果的新方法。但是本研究存在一定的局限性,由于动物存在肿瘤负荷,尽管加强护理,但每天接受放疗及麻醉后已相当虚弱。因此放疗后观察时间较短,只能参照文献[20]在放疗后第7天记录3D-PDA相关参数,而对照组也选择在周期较短的VMAT组放疗完成后第7天采集资料,故缺少长期观察的相关数据。
[1] Kim B, Chen YL, Kirsch DG, et al. An effective preoperative three-dimensional radiotherapy target volume for extremity soft tissue sarcoma and the effect of margin width on local control[J]. Int J Radiat Oncol Biol Phys, 2010,77(3):843-850.
[2] Sampath S, Schultheiss TE, Hitchcock YJ, et al. Preoperative versus postoperative radiotherapy in soft tissue sarcoma: multi-institutional analysis of 821 patients[J]. Int J Radiat Oncol Biol Phys, 2011,81(2):498-505.
[3] Dagan R, Indelicato DJ, McGee L, et al. The significance of a marginal excision after preoperative radiation therapy for soft tissue sarcoma of the extremity[J]. Cancer, 2012,118(12):3199-3207.
[4] Handal JA, Schulz JF, Florez GB, et al. Creation of rabbit bone and soft tissue tumor using cultured VX2 cells[J]. J Surg Res, 2013,179(1):127-132
[5] Ohishi H, Hirai T, Yamada R, et al. Three-dimensional power Doppler sonography of tumor vascularity[J]. J Ultrasound Med, 1998,17(10):619-622.
[6] Le Grange F, Cassoni AM, Seddon BM. Tumour volume changes following pre-operative radiotherapy in borderline resectable limb and trunk soft tissue sarcoma[J]. Eur J Surg Oncol, 2014,40(4):394-401.
[7] Huang YF, Cheng YM, Wu YP, et al. Three-dimensional power Doppler ultrasound in cervical carcinoma: monitoring treatment response to radiotherapy[J]. Ultrasound Obstet Gynecol, 2013,42(1):84-92.
[8] Huang SF, Chang RF, Moon WK, et al. Analysis of tumor vascularity using three-dimensional Power Doppler ultrasound images[J]. IEEE Trans Med Imaging, 2008,27(3):320-330.
[9] Deng J, Rhee TK, Sato KT, et al. In vivo diffusion-weighted imaging of liver tumor necrosis in the VX2 rabbit model at 1.5 Tesla[J]. Invest Radiol, 2006,41(4):410-414.
[10] Yang WT, Johnson PJ. Monitoring response to treatment in liver tumours.Baillieres Best Pract Res Clin Gastroenterol. 1999 Dec;13(4):637-54.
[11] Li S, Xue H D, Wang X H, et al. MR diffusion weighted imaging for evaluation of radiotherapeutic effects on rabbit vx2 tumor modeL[J]. Chin Med Sci J, 2008,23(3):172-177.
[12] Alcázar JL, Jurado M, Lopez-Garcia G. Tumor vascularization in cervical cancer by 3-dimensional power Doppler angiography: correlation with tumor characteristics[J]. Int J Gynecol Cancer, 2010, 20(3):393-397.
[13] Pairleitner H, Steiner H, Hasenoehrl G, et al. Three-dimensional power Doppler sonography: imaging and quantifying blood flow and vascularization[J]. Ultrasound Obstet Gynecol, 1999, 14(2):139-143.
[14] Kalmantis K, Rodolakis A, Daskalakis G, et al. Characterization of ovarian tumors and staging ovarian cancer with 3-Dimensional power doppler angiography: correlation with pathologic findings[J]. Int J Gynecol Cancer, 2013,23(3):469-474.
[15] Lala PK. Significance of nitric oxide in carcinogenesis, tumor progression and cancer therapy[J]. Cancer Metastasis Rev, 1998,17(1):1-6.
[16] Li R, Heydon K, Hammond ME, et al. Ki-67 staining index predicts distant metastasis and survival in locally advanced prostate cancer treated with radiotherapy: an analysis of patients in radiation therapy oncology group protocol[J]. Clin Cancer Res, 2004,10(12):4118-4124.
[17] Kuznetsova ME, Pozharisskiǐ KM, Vinokurova VL, et al. Ki-67 expression as a predictor of the effectiveness of radiotherapy and of outcome in locally advanced squamous cell carcinoma of the uterine cervix (immunohistochemical study)[J]. Vopr Onkol, 2007,53(2):175-180.
[18] Dall′Oglio MF, Ribeiro-Filho LA, Antunes AA, et al. Microvascular tumor invasion, tumor size and fuhrman grade: a pathological triad for prognostic evaluation of renal cell carcinoma[J]. J Urol, 2007,178(2):425-428.
[19] Hui L, Min F, Fu-Min L, et al. Transvaginal three-dimensional color power Doppler ultrasound and cervical MVD measurement in the detection ofcervical intraepithelial neoplasia[J]. Eur Rev Med Pharmacol Sci, 2014,18(14):1979-1984.
[20] Mardor Y, Pfeffer R, Spiegelmann R, et al. Early detection of response to radiation therapy in patients with brain malignancies using conventional and high b-value diffusion-weighted magnetic resonance imaging[J]. J Clin Oncol, 2003,21(6):1094-1100.
Effect of radiotherapy on blood supply and cell proliferation of rabbit limb soft-tissue tumor
YANYue1,WANGChongwen,YANGLei,LIWenting,SHIGuangli,HEChuanyu,BAIJingping
(1TheAffiliatedTumorHospitalofXinjiangMedicalUniversity,Urumqi830011,China)
Objective To investigate the effect of radiotherapy on blood supply and cell proliferation of rabbit limb soft-tissue tumor. Methods Thirty VX2 limb soft-tissue tumor models were established and were randomly divided into three groups: the control group (n=10), intensity modulated radiotherapy (IMRT) group (n=10) and volumetric modulated arc therapy (VMAT) group (n=10). IMRT group received IMRT and VMAT group received VMAT. Three-dimensional power Doppler angiography (3D-PDA) was performed on the first week after radiation. Types of tumor blood vessels were recorded. Vascularization index (VI), flow index (FI) and vascularization flow index (VFI) were calculated. The control group received the same examination at same time without any treatment. Animals were sacrificed and tumor tissues were sectioned after 3D-PDA, then the positive expression rate of Ki-67 and micro vessel density (MVD) was assessed by immunohistochemical SP method. Results Types of tumor blood vessels: in the IMRT group, there were 7 cases of typeⅠ, 1 case of type Ⅱ and 0 case of type Ⅲ; all were 0 in the VMAT group; and 0, 2 and 8 cases in the control group. The types of tumor blood vessels in the IMRT group and VMAT group were better than that of the control group (allP<0.01). VI, FI, VFI, positive expression rate of Ki-67 and MVD in the IMRT group and VMAT group were lower than those of the control group (allP<0.05). No significant difference was found in the above index between the IMRT group and VMAT group (allP>0.05). Conclusion IMRT and VMAT can reduce blood supply and inhibit tumor cell proliferation of rabbit limb soft-tissue tumor.
soft tissue sarcoma; radiotherapy; three-dimensional power Doppler angiography; Ki-67; microvessel density
新疆维吾尔自治区自然科学基金资助项目(2015211C114)。
闫悦(1988-),男,硕士研究生,研究方向为骨与软组织肿瘤。E-mail: xjyanyue1988@163.com
简介:白靖平(1958-),男,主任医师,研究方向为骨与软组织肿瘤。E-mail: xjbaijingping@163.com
10.3969/j.issn.1002-266X.2016.36.006
R738.6
A
1002-266X(2016)36-0020-04
2015-12-03)

