氯化甲基汞灌胃对成年大鼠海马神经细胞凋亡的影响及机制
范玉芹,吕伟,王树才,曹秉振,胡怀强
(1山东省妇幼保健院,济南250014;2中国人民解放军济南军区总医院)
氯化甲基汞灌胃对成年大鼠海马神经细胞凋亡的影响及机制
范玉芹1,吕伟2,王树才2,曹秉振2,胡怀强2
(1山东省妇幼保健院,济南250014;2中国人民解放军济南军区总医院)
目的 探讨不同剂量氯化甲基汞(MMC)不同蓄积时长对成年大鼠海马神经细胞凋亡的影响及其作用机制。方法 将120只SD大鼠随机分为正常对照组及MMC小、中、大剂量组各30只。正常对照组不进行任何干预,MMC小、中、大剂量组分别用MMC 0.5、1、2 mg/kg灌胃,1次/d。每周称量各组体质量,观察进食量、反应能力及毛色变化。各组分别于中毒1、2、4周各取10只大鼠处死取海马组织,用TUNEL法检测各组海马组织神经细胞凋亡;用免疫组化染色法检测海马组织Bcl-2、Caspase-3的表达。结果 与正常对照组比较,中毒1~4周MMC小、中、大剂量组体质量逐渐减轻,进食量减少,反应差,毛色逐渐凌乱并失去光泽,MMC大剂量组变化最明显。与正常对照组比较,中毒第1、2、4周MMC小、中、大剂量组海马神经细胞凋亡增多、Bcl-2表达降低、Caspase-3表达升高(P均<0.05);中毒第4周,MMC大剂量组以上指标变化最明显(P均<0.05)。结论 MMC可通过介导脑组织内Bcl-2、Caspase-3的表达促进大鼠海马神经细胞凋亡,且细胞凋亡程度与氯化甲基汞的剂量、中毒时间有关。
汞中毒;氯化甲基汞;细胞凋亡;Bcl-2;半胱氨酸天冬氨酸蛋白水解酶3;大鼠
环境中的汞可通过微生物甲基化作用生成持续性有机污染物甲基汞,具有强烈的神经毒性作用,极易透过血-脑脊液屏障[1],促进脑细胞发生退行性变,出现中枢神经系统损害[2~4],目前汞中毒对中枢神经系统损害的机制缺乏深入研究。2010年2~6月,我们研究了不同剂量氯化甲基汞(MMC)不同蓄积时长对成年大鼠海马神经细胞凋亡的影响,并探讨其作用机制。
1 材料与方法
1.1 动物分组及试剂 成年SPF级雄性SD大鼠120只,16~18周龄,体质量250~300 g,由山东鲁抗医药股份有限公司质监中心实验动物室提供(鲁动质号0005957)。将大鼠随机分为正常对照组及MMC小、中、大剂量组各30只。动物饲养及取材均遵守实验动物管理和保护的有关规定。MMC(德国Labor Dr.Ehrenstorfer Schaefers公司),Rabbit Anti-Bcl-2、Rabbit Anti-Caspase-3及细胞凋亡检测试剂盒(武汉博士德生物工程有限公司),浓缩型DAB试剂盒(北京中杉金桥生物科技有限公司)。
1.2 大鼠MMC中毒方法 正常对照组不进行任何干预。根据前期研究[5],MMC小、中、大剂量组分别用0.5、1、2 mg/kg MMC灌胃,1次/d。每周称量大鼠体质量并记录,观察其进食量、反应能力及毛色变化。1.3 各组海马神经细胞凋亡及Bcl-2、Caspase-3表达检测 各组分别于中毒1、2、4周各取10只大鼠,用水合氯醛腹腔麻醉,4%多聚甲醛灌注,断头取脑,距离大脑皮质后缘向前约5 mm位置切开,钝性分离海马组织,用4%多聚甲醛固定,常规石蜡包埋,切片。采用TUNEL法检测细胞凋亡,按照试剂盒说明书进行操作,细胞凋亡染色呈棕黄色,计数凋亡细胞数。取相同层面切片用免疫组化染色法检测海马组织Bcl-2、Caspase-3的表达,Bcl-2、Caspase-3阳性表达细胞呈棕黄色,计数阳性细胞数。均在统一放大倍数(×400)下,运用HPIAS-1000高清晰度彩色病理图文报告分析系统进行分析,随机选5个视野计数细胞数,取其中均值。

2 结果
2.1 MMC对大鼠行为的影响 正常对照组进食正常,反应较好,体质量逐渐增加。与正常对照组比较,MMC小剂量组前3周内进食量、体质量无明显变化,4周时大鼠体质量增长减缓(P<0.05);MMC中剂量组第3周进食量减少,反应差,体质量下降(P<0.05),与其2周时比较体质量下降(P<0.05),活动减少,毛色逐渐凌乱并失去光泽;甲基汞大剂量组2周时体质量下降(P<0.05),且与其2周时比较体质量下降(P<0.05),至4周时体质量下降接近25%,出现典型中毒表现:精神萎靡,毛色发黄,不能利用后肢站立,步态不稳,平地只能爬行。至实验结束时大剂量组大鼠体质虚弱,叫声低微,几乎丧失活动能力,进食能力差,毛色较前更暗及凌乱。各组大鼠体质量变化见表1。
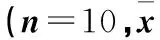
表1 各组不同中毒时间体质量变化±s)
注:与同时间点正常对照组比较,△P<0.05;与同时间点小剂量组比较,▼P<0.05;与同时间点中剂量组比较,☆P<0.05;与同组中毒1周比较,▼P<0.05;与同组中毒2周比较,#P<0.05;与同组中毒3周比较,﹡P<0.05。
2. 2 MMC 对大鼠海马神经细胞凋亡的影响见 表2。
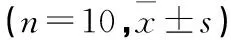
表2 各组不同中毒时间海马神经细胞凋亡细胞计数
注:与同时间点正常对照组比较,△P<0.05;与同时间点小剂量组比较,#P<0.05;与同时间点中剂量组比较,▲P<0.05;与同组中毒1周比较,*P<0.05;与同组中毒2周比较,☆P<0.05。
2.3 MMC对大鼠海马组织Bcl-2表达的影响 见表3。
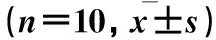
表3 各组不同中毒时间海马组织Bcl-2阳性细胞计数
注:与同时间点正常对照组比较,▲P<0.05;与同时间点小剂量组比较,◆P<0.05;与同时间点中剂量组比较,※P<0.05;与同组中毒1周比较,▼P<0.05;与同组中毒2周比较,★P<0.05。
2.4 MMC对大鼠海马组织Caspase-3表达的影响 见表4。

表4 各组不同中毒时间海马组织Caspase-3阳性细胞计数
注:与同时间点正常对照组比较,△P<0.05;与同时间点小剂量组比较,◇P<0.05;与同时间点中剂量组比较,※P<0.05;与同组中毒1周比较,▼P<0.05;与同组中毒2周比较,★P<0.05。
3 讨论
神经细胞凋亡是脑细胞退行性变的主要机制之一,是由基因编程调控的细胞主动自杀过程。本研究凋亡细胞染色结果表明,单位时间内给予MMC的剂量越大,其大鼠脑组织海马神经细胞的凋亡数目相应增多,随着汞在体内蓄积时间的延长其神经细胞凋亡的数目也显著增多,说明神经细胞的凋亡与体内汞的蓄积量明显相关。细胞凋亡作为病理现象的最终结局,其调节机制十分复杂,与此有关的Bcl-2、Caspase对细胞凋亡的调控有举足轻重的作用[6]。
研究发现,Bcl-2家族蛋白是在细胞凋亡过程中起重要作用的一类编码同源蛋白的一个大基因家族[7],决定着细胞是否进入凋亡通路。抗凋亡蛋白Bcl-2对由呼吸链解偶联剂所引起的基质贮存Ca2+的释放也有抑制作用,能增强线粒体内质子的外排,提高线粒体对Ca2+的缓冲能力,并对线粒体通透性转变孔的开放具有调节作用[8~10]。本研究结果显示,MMC组海马神经细胞内Bcl-2在给予MMC后即高表达,表明Bcl-2在受到凋亡信号刺激后即抑制凋亡的发生,随着大鼠体内汞蓄积量的增加Bcl-2的表达却减少,说明汞蓄积至一定量的情况下Bcl-2抑制细胞凋亡的水平下降。
Caspase是细胞凋亡过程中最重要的蛋白酶,是一切凋亡信号传导的共同通路,凋亡的最后实施是通过Caspase的激活而实现的[11]。Caspase-3是Caspase家族中重要一员,处于凋亡有序级联反应的下游,为最重要的效应型Caspase。Caspase-3是细胞凋亡的关键执行蛋白酶,也是多种凋亡刺激信号传递的汇聚点,在各种程序启动的凋亡程序中起最后枢纽的作用,其活化是细胞凋亡进入不可逆阶段的标志[12,13],与急慢性神经细胞的变性密切有关,是神经细胞凋亡的有效标记物[14]。本研究结果表明,MMC组海马神经细胞Caspase-3的表达较正常对照组明显升高,同一观察时间点给予MMC的剂量越大其表达越高,MMC中毒时间越长其Caspase-3的表达越高,表明随着大鼠体内汞的蓄积其海马神经细胞凋亡增加。
综上所述,MMC可介导脑组织内Bcl-2、Caspase-3表达,致中毒大鼠神经细胞发生凋亡,且细胞凋亡程度与氯化甲基汞的剂量、中毒时间有关。
[1] Rocha JB, Rocha LK, Emanuelli T, et al. Effect of mercuric chloride and lead acetate treatment during the second stage of rapid post-natal brain growth on the behavioral response to chlorp romazine and on delta-ALA-D activity in weaning rats[J]. Toxicology letters, 2001,125(1-3):143-150.
[2] 胡卫萱,王文华,瞿丽雅,等.环境中汞神经毒性的自由基机制研究进展[J].中华劳动卫生职业病杂志,2003,21(6):470-472.
[3] 刘薇薇,江朝强,胡志兵,等.慢性汞中毒患者脑脊液汞含量的探讨[J].中华劳动卫生职业病杂志,2006,24(7):403-405
[4] Kerper LE, Ballatori N, Clarkson TW. Methylmercury transport across the blood-brain barrier by an amino acid carrier[J]. Am J Physiol, 1992(262):761-765.
[5] Bingzhen Cao, Wei Lv, Shan Jin, et al. Degeneration of peripheral nervous system in rats experimentally induced by methylmercury intoxication[J]. Neurol Sci, 2013,34(5):663-669.
[6] 谢宁,姚辛敏,孟菲,等.地黄饮子含药脑脊液对Aβ25-35诱导的PC12细胞损伤凋亡基因bax/bcl-2和caspase-3表达的影响[J].中华中医药学刊,2007,23(9):1772.
[7] Ji HB, Zhai QW, Liu XY, et al. Transcription regulation of bcl-2 gene[J]. Sheng Wu Hua Xue Yu Sheng Wu Wu Li Xue Bao, 2000,32(2):95-99.
[8] Kuo TC, Lin-Shiau SY. Early acute necrosis and delayed apoptosis induced by methyl mercury in murine peritoneal neutrophils[J]. Basic Clin Pharmacol Toxicol, 2004,94(6):274-281.
[9] Degterev A, Lugovskoy A, Cardone M, et al. Identification of small-molecule inhibitors of interaction between the BH3 domain and Bcl-xL[J]. Nat Cell Biol, 2001,3(2):173-182.
[10] Sulejczak D, Czarkowska-Bauch J, Macias M, et al. Bcl-2 and Bax proteins are increased in neocortical but not in thalamic apoptosis following devascularizing lesion of the cerebral cortex in the rat: an immunohistochemical study[J]. Brain Res, 2004,1006(2):133-149.
[11] Alam SA, Ikeda K, Oshima T, et al. Cisplatin-induced apoptotic cell death in Mongolian gerbil cochlea[J]. Hear Res, 2000, 141(1-2):28-38.
[12] Faubel S, Edelstein CL. Caspases as drug targets in ischemic organ injury[J]. Curr Drug Targets Immune Endocr Metabol Disord, 2005,5(3):269-287.
[13] Doseff AI. Apoptosis the sculptor of development[J]. Stem Cells Dev, 2004,13(5):473-483.
[14] Barbouti A, Amorgianiotis C, Kolettas E, et al. Hydrogen peroxide inhibits caspase-dependent apoptosis by inactivating procaspase-9 in an iron-dependent manner[J]. Free Radic Biol Med, 2007,43(10):1377-1387.
Effect of methyl-mercuric chloride on hippocampal neuron apoptosis of adult rats
FANYuqin1,LYUWei,WANGShucai,CAOBingzhen,HUHuaiqiang
(1ShandongMaternalandChildHealthHospital,Jinan250014,China)
Objective To investigate the effect of different doses of methyl-mercuric chloride (MMC) on hippocampal neuron apoptosis of adult rats in different courses and its mechanism. Methods Totally 120 SD rats were randomly divided into the normal control group, low-dose, medium-dose and high-dose MMC groups. Each group consisted of 30 rats. The normal control group was not given any intervention. Rats in the low-dose group, medium-dose group and high-dose MMC group were respectively given 0.5, 1 and 2 mg/kg MMC by lavage once a day. All were weighed every week, and we observed the changes of food intake, response capacity and coat color changes. At the first, second and fourth week after MMC poisoning, we separately took ten rats to obtain the hippocampus from every group. The hippocampal neuron apoptosis of all groups were observed by TUNEL and the expression of Bcl-2, Caspase-3 was detected by immunohistochemistry. Results Compared with the normal control group, the body weight, food intake and response capacity of the low-dose, medium-dose and high-dose MMC groups decreased gradually, and coat color of rats was messy and not shiny, these changes of high-dose group were the most obvious. At the first, second and fourth week after MMC poisoning, the neuron apoptosis and Caspase-3 expression increased, while Bcl-2 expression decreased in the low-dose, medium-dose and high-dose MMC groups as compared with that of the normal control group (allP<0.05). At the fourth week after MMC poisoning, the changes of all indexes were the most obvious in the high-dose group (allP<0.05). Conclusion MMC can mediate Bcl-2, Caspase-3 expression in the brain to promote hippocampal neuron apoptosis, and the degree of apoptosis is related with the dose of MMC and poisoning time.
mercury poisoning; methyl-mercuric chloride; apoptosis; Bcl-2; Caspase-3; rats
中国博士后科学基金资助项目(20080431409)。
范玉芹(1978-),女,硕士,主治医师,研究方向为孕产及优生遗传。E-mail: fanyuqinhu@126.com
简介:胡怀强(1978-),男,博士,副主任医师,研究方向为神经系统疾病的诊治。E-mail: huhuaiqiang@126.com
10.3969/j.issn.1002-266X.2016.36.005
R971
A
1002-266X(2016)36-0017-03
2016-07-10)

