脐带间充质干细胞移植治疗肌萎缩侧索硬化症的短期疗效及安全性分析
乔利军,卢爱丽,冯梅,高红霞,招远祺
(广东省中医院,广州 510006)
论著·
脐带间充质干细胞移植治疗肌萎缩侧索硬化症的短期疗效及安全性分析
乔利军,卢爱丽,冯梅,高红霞,招远祺
(广东省中医院,广州 510006)
目的 探讨脐带间充质干细胞(UC-MSCs)移植治疗肌萎缩侧索硬化症(ALS)的效果及安全性。方法 29例ALS患者接受4次UC-MSCs移植治疗(蛛网膜下腔注射,2×107~5×107个细胞/次)。比较治疗前后肌萎缩侧索硬化功能评分量表(ALSFRS-R)评分、改良医学研究委员会(MRC)评分,对安全性指标进行评价。治疗后6个月以呼吸衰竭、死亡等为终点事件进行随访。结果 ALSFRS-R评分:治疗前后总分比较差异无统计学意义(P>0.05);治疗后第14天穿衣和卫生评分明显高于治疗前(P=0.036);治疗后第28天,言语、穿衣和卫生功能评分明显高于治疗前(P分别为0.032、0.015),且言语功能评分明显高于治疗后第14天(P=0.040)。MRC评分:治疗后第14天上肢肌群肌力评分明显高于治疗前(P=0.050),治疗第28天上肢肌群肌力评分进一步增加(P=0.036)。随访至治疗后6个月,1例患者于治疗后第3个月因呼吸衰竭死亡,其余患者无严重不良事件。结论 UC-MSCs移植治疗ALS短期效果好且较为安全。
脐带间充质干细胞;肌萎缩侧索硬化症;ALSFRS-R评分;MRC评分;安全性
肌萎缩侧索硬化(ALS)是人类运动系统的一种特发性严重的神经变性病,其选择性累及脊髓前角细胞、脑干运动神经核以及锥体束,是成人运动神经元病的最常见类型[1]。近年来对ALS的发病机制虽已有初步认识。但自1996年美国FDA批准利鲁唑用于ALS的治疗以来,目前尚无新的有效治疗方法[2]。脐带间充质干细胞(UC-MSCs)具有修复受损组织[3]、利于造血重建[4]和调节免疫功能[5]的功效,其向神经细胞分化的能力为ALS的治疗带来新的希望[6]。本研究探讨UC-MSCs移植治疗ALS的短期疗效及安全性。
1 资料与方法
1.1 临床资料 选取2009年4月~2012年12月我院收治的29例ALS患者,男24例、女5例,就诊年龄38~73(55.86±9.35)岁,病程0.5~11(2.76±2.29)年。均符合中国ALS诊断和治疗指南[1]及世界神经病学联盟1994年EI Escorial会议上制定的ALS临床诊断标准[7]。纳入标准:①符合ALS诊断标准;②一般状况可,生命体征平稳;③本人或家属、委托人自愿接受干细胞治疗,并已经签署干细胞治疗知情同意书。排除标准:①休克、全身衰竭等危重情况及不能配合检查者;②晚期恶性肿瘤者;③存在全身严重感染疾患者;④合并严重脏器功能障碍者;⑤凝血功能障碍者;⑥血清病原学检查阳性者,如HIV抗体阳性,梅毒抗体RPR阳性;⑦严重精神障碍者。本研究通过广东省中医药局审批,具有干细胞治疗资质,本治疗方案经我院医学伦理委员会批准(伦理号:B2016-061-01)。
1.2 UC-MSCs分离与培养 UC-MSCs由深圳市北科细胞工程研究所提供。取足月顺产、无并发症的新生儿脐带,生理盐水冲洗,切割至乳糜状,接种于75 cm培养瓶中,每瓶含20 mL低糖细胞培养基(DMEM)完全培养液(含10%胎牛血清),置37 ℃、5% CO2饱和湿度培养箱培养。24~48 h后换液,去掉非贴壁细胞,之后每3天以低糖DMEM完全培养液换液1次。培养至贴壁细胞90%融合时,用0.25%胰蛋白酶消化,按1∶3的比例传代,扩增后的间充质干细胞(MSCs)计数并鉴定。检测艾滋病病毒抗体、梅毒抗体、肝炎标志物5项、TORCH 5项,检测合格后制备成UC-MSCs悬液,每份细胞数量为2×107~5×107个。
1.3 UC-MSCs移植 患者取侧卧位,成人取L3~L4椎间隙为穿刺点,局部麻醉后进针,在无菌操作下将UC-MSCs缓慢注入蛛网膜下腔,术后去枕平卧6 h,每个疗程进行4次移植治疗。具体方法参照《干细胞应用新技术》[8]。
1.4 相关指标观察 ①临床效果:治疗前及治疗后行修订的肌萎缩侧索硬化功能量表(ALSFRS-R)评分(总分48分;0分为严重受损,48分为正常)[9]、改良的医学研究委员会肌力评定量表(MRC)评分(满分为12分,评分越高说明肌力越好)[10]。②安全性观察:观察治疗过程中不良反应(发热、头痛、过敏)发生情况。观察实验室指标(血常规、肝肾功能、艾滋病病毒抗体、梅毒抗体、肝炎标志物、肿瘤标志物)及心电图变化。③随访:治疗后6个月以呼吸衰竭、死亡等为终点事件进行随访。

2 结果
本组29例ALS患者均完成治疗,进入结果分析,中途无脱落,其中1例血常规数据、3例肝功能数据、1例肾功能数据、4例肿瘤标志物数据缺失。
2.1 临床效果
2.1.1 ALSFRS-R评分 移植治疗后第14天,穿衣和卫生能力评分高于治疗前(P=0.036),总分及其余功能区评分均无明显变化(P均>0.05)。治疗后第28天,言语、穿衣和卫生能力评分明显高于治疗前(P分别为0.032、0.015),言语功能评分明显高于治疗后第14天(P=0.040),总分及其余功能区评分与治疗前及治疗后第14天比较均无统计学差异(P均>0.05)。详见表1。
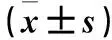
表1 29例ALS患者UC-MSCs移植治疗前后ALSFRS-R评分比较
注:与治疗前比较,△P<0.05;与治疗后第14天比较,*P<0.05。
2.1.2 MRC评分 UC-MSCs移植治疗后第14天,上肢肌群肌力评分明显高于治疗前(P=0.050),治疗第28天,上肢肌群肌力评分比治疗前进一步升高(P=0.036);颈部及下肢肌群肌力评分高于治疗前,但无统计学差异(P>0.05)。见表2。
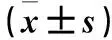
表2 29例ALS患者UC-MSCs移植治疗前后MRC评分比较
注:与治疗前比较,△P≤0.05。
2.2 安全性观察 本组2例出现自限性发热反应(体温<38.0 ℃),未经处理,分别持续6、8 h自行降至正常。1例出现头晕,腰穿脑脊液压力为70 mmH2O,经补液支持治疗后症状消失。4例出现局部疼痛,考虑与腰椎穿刺术操作有关,经对症治疗后疼痛均缓解。7例患者白细胞计数、13例患者甲胎蛋白(AFP)高于治疗前(P均<0.01),排除感染性及肿瘤性疾病,未处理,3个月后均降至正常范围。29例患者肝肾功能、艾滋病病毒抗体、梅毒抗体、肝炎标志物、心电图等指标治疗前后比较差异无统计学意义(P均>0.05)。
2.3 终点事件随访 随访6个月,1例于治疗后3个月死于呼吸衰竭,其余28例无严重不良事件发生。
3 讨论
ALS是由皮质、脑干及脊髓上下运动神经元受侵导致的一种渐进性神经退行性疾病,人群患病率高达7.4/100 000[11]。无论最初累及上或下运动神经元,最终均表现为肢体和延髓上、下运动神经元损害并存。过去的20年间超过50种药物被用于ALS的治疗,但只有利鲁唑被证实对ALS具有一定的治疗作用[12]。ALS呈进行性和致残性病程,患者最终多死于呼吸肌麻痹或并发的呼吸道感染,生存期限从数月到10余年,平均3~5年[1,11,13]。本研究纳入的29例ALS患者,病程(2.76±2.29)年,最长为11年。鉴于ALS的进展性和致命性,寻找新的有效疗法尤为重要,应用干细胞移植来阻止或延缓ALS的进展逐渐成为临床研究热点。脐带已成为除骨髓以外的重要干细胞来源,具有来源充足、免疫原性更弱、供者无痛苦、不涉及伦理问题、传播疾病的概率低、含有的干细胞丰富等优点[14]。
目前,已有学者报道采用干细胞治疗ALS[10,15~23]。部分研究结果显示,干细胞移植治疗后ALS患者的FVC、ALSFRS、Norris及MRC评分维持在稳定水平[10,15];另有研究结果显示,干细胞移植治疗可明显改善ALS患者的FVC、ALSFRS和Norris评分[17~19,21~23]。因而干细胞移植治疗ALS的疗效仍不确切。本研究以UC-MSCs作为干细胞主要来源,治疗前后ALSFRS-R总分比较差异无统计学意义,但治疗后ALS患者的言语、穿衣和卫生能力评分明显高于治疗前,说明VC-MSCs移植改善功能方面近期疗效明显。改良MRC评分反可反映ALS患者肌群的肌力情况及神经功能受损程度,对各功能区MRC评分的前后比较显示,治疗后第14天,上肢肌群肌力较治疗前显著改善;治疗第28天,上肢肌群肌力有进一步改善。通过治疗前后ALSFRS-R、MRC评分的比较,表明UC-MSCs移植对ALS患者的言语、肢体运动功能、生活能力有一定的改善作用。
UC-MSCs移植常见的不良反应包括轻度的发热、头晕、腰痛、臀部疼痛、肢痛等,分析原因可能与移植后轻度的免疫排斥反应、低颅压综合征、穿刺部位脊膜刺激征或穿刺点韧带损伤有关,这些不良反应症状轻微,经对症治疗多在3天内消失。
本研究7例患者白细胞计数治疗后第28天明显高于治疗前,但无发热及感染,后均降至正常范围;白细胞升高可能系干细胞移植后轻度的免疫反应引起。有研究者发现,干细胞移植过程中静推地塞米松防止变态反应也可导致一过性的白细胞计数升高[22]。AFP是在胚胎时期由胎儿肝细胞及卵黄囊产生的一种特异性球蛋白,在成人血清中含量极低,是肝癌的特异性标志。本研究所有患者治疗前已排除肿瘤病史,治疗后第28天AFP明显高于治疗前。其升高的原因可能是本研究所用干细胞来源于脐血,而脐血中可能含有较高的AFP[24,25]。CEA为临床常用的一个广谱肿瘤标志物,在胃癌、直肠癌、胰腺癌、甲状腺髓样癌、乳腺癌和肺癌等病程监测中有重要意义,本组患者治疗前后CEA改变无统计学差异。本研究肿瘤标志物检测结果提示,UC-MSCs移植治疗ALS短期内无明显致瘤性。其余安全性指标、如肝肾功能、艾滋病病毒抗体、梅毒抗体、肝炎标志物、心电图等,治疗前后比较差异无统计学意义,提示UC-MSCs移植治疗ALS在短期内安全性良好。
本研究随访结果显示,未发现任何严重的免疫排斥反应或者肿瘤。少数患者病情持续进展,大部分患者病情维持在治疗后水平。提示ALS病机复杂,UC-MSCs移植治疗ALS在短期内可明显改善患者的神经功能症状,但是长期疗效还有待进一步证实。
综上所述,UC-MSCs移植治疗ALS短期内安全有效,能显著改善患者的言语、肢体运动功能等生活能力,增强上肢肌群肌力,提高患者的生活质量,延缓病情发展,但不能逆转疾病进展。本研究存在周期较短、样本量较少、未设置病例对照研究等方面的不足,关于UC-MSCs移植治疗ALS的远期疗效及远期安全性还有待进一步探讨。
[1] 中华医学会神经病学分会肌电图与临床神经电生理学组,中华医学会神经病学分会神经肌肉病学组.中国肌萎缩侧索硬化诊断和治疗指南[J].中华神经科杂志,2012,45(7):531-533.
[2] Morren JA, Galvez-Jimenez N. Current and prospective disease-modifying therapies for amyotrophic lateral sclerosis[J]. Expert Opin Investig Drugs, 2012,21(3):297-320.
[3] Cabrera C, Carriquiry G, Pierinelli C, et al. The role of biologically active peptides in tissue repair using umbilical cord mesenchymal stem cells[J]. Ann N Y Acad Sci, 2012,1270:93-97.
[4] Wu Y, Cao Y, Li X, et al. Cotransplantation of haploidentical hematopoietic and umbilical cord mesenchymal stem cells for severe aplastic anemia: successful engraftment and mild GVHD[J]. Stem Cell Res, 2014,12(1):132-138.
[5] Damien P, Allan D S. Regenerative therapy and immune modulation using umbilical cord blood-derived cells[J]. Biol Blood Marrow Transplant, 2015,21(9):1545-1554.
[6] Farivar S, Mohamadzade Z, Shiari R, et al. Neural differentiation of human umbilical cord mesenchymal stem cells by cerebrospinal fluid[J]. Iran J Child Neurol, 2015,9(1):87-93.
[7] Brooks BR. El Escorial World Federation of Neurology criteria for the diagnosis of amyotrophic lateral sclerosis. Subcommittee on Motor Neuron Diseases/Amyotrophic Lateral Sclerosis of the World Federation of Neurology Research Group on Neuromuscular Diseases and the El Escorial "Clinical limits of amyotrophic lateral sclerosis" workshop contributors[J]. J Neurol Sci, 1994,124 Suppl:96-107.
[8] 杨晓凤.干细胞应用新技术[M].北京:军事医学科学出版社,2010:221.
[9] 王拥军.神经病学临床评定量表[M].北京:中国友谊出版公司,2005:476.
[10] Blanquer M, Moraleda JM, Iniesta F, et al. Neurotrophic bone marrow cellular nests prevent spinal motoneuron degeneration in amyotrophic lateral sclerosis patients: a pilot safety study[J]. Stem Cells, 2012,30(6):1277-1285.
[11] Haidet-Phillips AM, Maragakis NJ. Neural and glial progenitor transplantation as a neuroprotective strategy for Amyotrophic Lateral Sclerosis (ALS)[J]. Brain Res, 2015,1628(Pt B):343-350.
[12] Zoccolella S, Santamato A, Lamberti P. Current and emerging treatments for amyotrophic lateral sclerosis[J]. Neuropsychiatr Dis Treat, 2009,5:577-595.
[13] Martinez HR, Molina-Lopez JF, Cantu-Martinez L, et al. Survival and clinical features in Hispanic amyotrophic lateral sclerosis patients[J]. Amyotroph Lateral Scler, 2011,12(3):199-205.
[14] Watson N, Divers R, Kedar R, et al. Discarded Wharton jelly of the human umbilical cord: a viable source for mesenchymal stromal cells[J]. Cytotherapy, 2015,17(1):18-24.
[15] Karussis D, Karageorgiou C, Vaknin-Dembinsky A, et al. Safety and immunological effects of mesenchymal stem cell transplantation in patients with multiple sclerosis and amyotrophic lateral sclerosis[J]. Arch Neurol, 2010,67(10):1187-1194.
[16] Martinez HR, Molina-Lopez JF, Gonzalez-Garza MT, et al. Stem cell transplantation in amyotrophic lateral sclerosis patients: methodological approach, safety, and feasibility[J]. Cell Transplant, 2012,21(9):1899-1907.
[17] Rushkevich YN, Kosmacheva SM, Zabrodets GV, et al. The use of autologous mesenchymal stem cells for cell therapy of patients with amyotrophic lateral sclerosis in belarus[J]. Bull Exp Biol Med, 2015,159(4):576-581.
[18] 李敏,滑蓉蓉,于爱学,等.脐带间充质干细胞移植治疗肌萎缩侧索硬化症的疗效分析[J].中国医药导报,2012,9(12):52-54.
[19] 赖福生,卢少军,王一芳,等.脐带血有核细胞移植治疗肌萎缩侧索硬化的临床研究[J].东南国防医药,2010,12(6):515-518.
[20] 杨波,万鼎铭,曹勇,等.脐血间质干细胞移植对肌萎缩侧索硬化患者神经系统功能的影响[J].郑州大学学报(医学版),2006,41(2):239-241.
[21] 杨志刚,杨春水,李建英,等.脐血源间充质干细胞治疗肌萎缩侧索硬化的临床研究[J].中外医疗,2012,31(21):68-69.
[22] 杨万章,杨佳勇,梁豪文,等.脐血源神经干细胞治疗肌萎缩侧索硬化的免疫学改变及安全性评价[J].中西医结合心脑血管病杂志,2007,5(10):911-913.
[23] 孙大勇,韩杰,李雪娇,等.自体外周血干细胞移植治疗肌萎缩侧索硬化患者9例:短期效果分析[J].中国组织工程研究,2012,16(14):2645-2647.
[24] 郭秀筠,黄志清,陆健昌,等.正常孕妇血、羊水、脐血甲胎蛋白测定[J].广东医学,1984,5(4):38-39.
[25] 陈萍,王擎宇.脐血甲胎蛋白、癌胚抗原检测及其临床意义[J].河北医学,1998,4(4):84-85.
Short-term efficacy and safety of transplantation of umbilical cord mesenchymal stem cells in treatment of amyotrophic lateral sclerosis
QIAOLijun,LUAili,FENGMei,GAOHongxia,ZHAOYuanqi
(GuangdongProvincialHospitalofTraditionalChineseMedicine,Guangzhou510006,China)
Objective To evaluate the short-term clinical efficacy and safety of transplantation of umbilical cord mesenchymal stem cells (UC-MSCs) in treatment of amyotrophic lateral sclerosis (ALS). Methods Twenty-nine patients with ALS were treated with UC-MSCs transplantation for 4 times (lumbar puncture, 2×107to 5×107cells/time). Revised Amyotrophic Lateral Sclerosis Functional Rating Scale (ALSFRS-R) and Medical Research Council (MRC) scale for assessment of muscle power were assessed before and after the transplant. Safety indexes were evaluated at the same time. Results No significant difference of ALSFRS-R scale was observed (P>0.05). There was a significant improvement in the dressing and health abilities in ALS patients on the 14th day after treatment (P=0.036), and the scores of verbal, dressing and health abilities on the 28th day after treatment were significantly higher than those before treatment (P=0.032, 0.015). In addition, the speech function was further improved compared with that on the 14th day after treatment (P=0.040). The strength of upper limb muscles was enhanced with the extension of treatment (P=0.050, 0.036, on the 14th and 28th day after treatment ). Followed up for 6 months after treatment, only 1 patient died of respiratory failure at the 3th month, and the remaining patients had no serious adverse events. Conclusions UC-MSCs transplantation is safe and effective for ALS in the short-term.
umbilical cord mesenchymal stem cells; amyotrophic lateral sclerosis; ALSFRS-R; MRC scale; safety
广东省自然科学基金资助项目(2015A030310436);广东省中医药管理局科研资助项目(20151210)。
乔利军(1984-),男,博士后,研究方向为细胞治疗中医脑病的基础与临床研究。E-mail: qiaolijunwork@163.com
简介:招远祺(1978-),男,博士、副主任医师,研究方向为中医脑病的临床与基础研究。E-mail: tcm2008@126.com
10.3969/j.issn.1002-266X.2016.36.001
R744.8
A
1002-266X(2016)36-0001-04
2016-02-25)
——稳定身体的“磐石”

