鹭源新城疫病毒的生物学与遗传学特性研究
杨少华,许传田,黄艳艳,张 琳,黄庆华,张秀美
(山东省农业科学院 畜牧兽医研究所 山东省畜禽疫病防治与繁育重点实验室,济南 250100)
·研究论文·
鹭源新城疫病毒的生物学与遗传学特性研究
杨少华,许传田,黄艳艳,张 琳,黄庆华,张秀美
(山东省农业科学院 畜牧兽医研究所 山东省畜禽疫病防治与繁育重点实验室,济南 250100)
对2013年从健康野生鹭科候鸟中分离的新城疫病毒(Newcastle disease virus, NDV)蚀斑纯化后,选择5株病毒进行了生物学鉴定和遗传进化分析。致病指数和脑内接种指数测定结果显示5个分离株均为弱毒株;F蛋白裂解位点处氨基酸序列均为112ERQERL117,具有典型的弱毒株特征。交叉HI试验结果发现ClassⅠ分离株与LaSota的HI抗原同源性为0.56~0.57,与ClassⅡ强毒株的HI抗原同源性为0.44~0.51;遗传进化分析发现5个NDV毒株与目前流行的强毒株遗传关系较远,均属于ClassⅠ3c亚型,表明健康鹭携带I类新城疫病毒,在迁飞的过程可能传播给家养水禽,对其构成潜在威胁,提示加强野鸟NDV 的监控及流行病学研究具有紧迫性和重要性。
新城疫病毒;健康鹭;生物学特性
新城疫是严重危害养禽业的主要病毒性传染病之一,给许多国家的养禽业造成巨大的经济损失。其病原是新城疫病毒(Newcastle disease virus,NDV),又称为禽副粘病毒I型(Avian paramyxovirus serotype 1,APMV-1),属于单链负股RNA病毒目(Mononegavirales)、副黏病毒科(Paramyxoviridae)、副黏病毒亚科(Paramyxovirinae)的禽腮腺炎病毒属[1,2]。NDV为单股负链、不分节段RNA病毒,基因组长度约为15.2 kb,基因排列方式为 3′-NP-P-M-FHN-L-5′,分别编码6种主要结构蛋白[3]。NDV只有一个血清型,但基因型较多[4-7]。
NDV宿主非常广泛,可感染多种鸟类和野生水禽,而野生水禽是NDV的天然贮存宿主,一般感染后表现为带毒和排毒,不会引起临床疾病[7]。本研究对从野生鹭科候鸟分离的5株NDV进行了生物学和遗传学特性鉴定,以期为ND的防控提供科学的理论依据。
1 材料和方法
1.1 病毒与鸡胚 5株野生鹭源NDV由吉林大学畜牧兽医学院2013年从鄱阳湖鹭鸟泄殖腔棉拭子中分离;9~10日龄SPF鸡胚购自山东省农业科学院家禽研究所SPF场。
1.2 主要试剂 Trizol 购自Invitrogen 公司;反转录酶(M-MLV)Taq酶、胶回收试剂盒及pMD18-T Vector 购自大连宝生物公司;DH5α感受态细胞购自北京全氏金公司。
1.3 病毒的纯化 病毒接种于9~10日龄SPF鸡胚,每个胚0.2 mL,37℃孵化箱孵化,每天照胚,收集鸡胚的尿囊液,采用血凝(hemagglutination test, HA)和血凝抑制实验(hemagglutination inhibition, HI)对病毒进行血清学鉴定。阳性病毒接种鸡胚成纤维细胞(chicken embryo fibroblast, CEF),观察细胞病变情况,并以HA实验测定细胞培养液的病毒效价。挑选能在CEF上繁殖并产生病变的病毒,接种CEF并进行蚀斑纯化,蚀斑纯化3次后-20℃保存备用。
1.4 致病指数检测 检测分离病毒致鸡胚平均死亡时间(mean death times, MDT)和脑内接种指数(intracerebral pathogenicity indexes, ICPI),实验流程按照OIE 标准进行。
1.5 交叉血凝抑制试验 按照常规方法分别制备分离株SD21/13、SD24/13和疫苗株LaSota及基因Ⅶ型强毒株Duck/China/SD03/2009(GenBank登录号JN400895,简写为SD03)的单因子血清。将4种NDV病毒和阳性血清分别进行交叉HI实验,HI抗原同源性的计算按免疫学方法进行:R=(r1×r2)1/2×100%,r1=异源血清效价1/同源血清效价1,r2=异源血清效价2/同源血清效价2。
1.6 病毒F基因的扩增和克隆
1.6.1 病毒RNA的提取 取200 μL病毒的尿囊液,加入800 μL Trizol,按照TaKaRa公司Trizol试剂使用说明书步骤提取病毒全基因RNA,保存于-70℃备用。
1.6.2 F基因的RT-PCR扩增与克隆测序 ND-F:5′-ATGGGCTCCAAACCTTCTAC-3′,ND-R:5′-TCACATTTTTGTAGTGGCTC-3′,以上为所用引物序列。RT反应条件:42℃ 60 min,70℃ 15 min;PCR反应条件:95℃预变性2 min;94℃变性40 s,55℃退火45 s,72℃延伸2 min,30个循环;72℃再延伸10 min。
1.6.3 基因克隆 PCR产物在1%琼脂糖凝胶电泳观察结果,按凝胶回收试剂盒步骤回收PCR产物。将纯化后的产物按pMD18-T载体说明书进行连接,转化DH5α感受态细胞,筛选阳性克隆,常规方法提取质粒,用PCR进行初步鉴定,阳性质粒的菌液送上海生物工程有限公司进行测序。
1.7 F基因序列比对与遗传进化分析 应用分析软件Lasergene和MAGA 4.1软件对实验毒株与GenBank中收录的NDV代表毒株F基因序列进行比对分析,利用MAGA4.1软件对F基因变异区(nt47~420)进行系统进化分析。
2 结果
2.1 病毒鉴定 经血清学检测及蚀斑纯化,在鄱阳湖鹭鸟泄殖腔棉拭子中共鉴定5株NDV,这些毒株致死鸡胚时间较长,胚体有轻度出血,接种CEF细胞后约60 h产生细胞病变。
2.2分离株致病力测定结果 鹭源NDV分离株经鸡胚传代和蚀斑克隆纯化后,按照OIE规定的方法进行MDT和ICPI的测定。结果5个NDV分离株MDT均大于116 h,ICPI为0~0.2(见表1),根据国际兽疫局(OIE)推荐的毒力判定标准,5个分离株均为弱毒株。
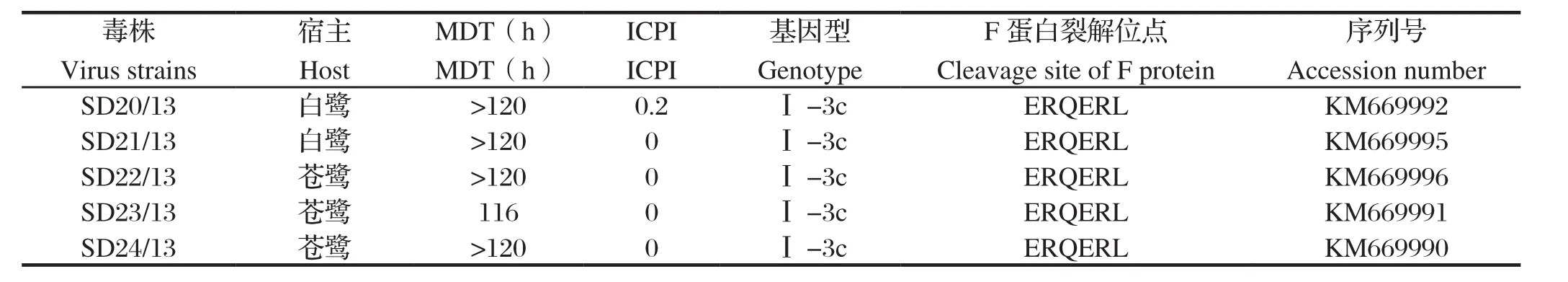
表1 本研究中NDV分离株的生物学及遗传学特征Table 1 Biological and genetic characterization of isolated NDV strains from wild waterfowl
2.3 交叉血凝抑制试验结果 分离株SD21/13,SD24/13与疫苗毒LaSota及基因Ⅶ型强毒的交叉HI结果显示,SD21/13与SD24/13之间的HI同源性为93%,两个ClassⅠ分离株与LaSota的同源性为56%~57%,与ClassⅡ强毒株的同源性为44%~51%(表2)。
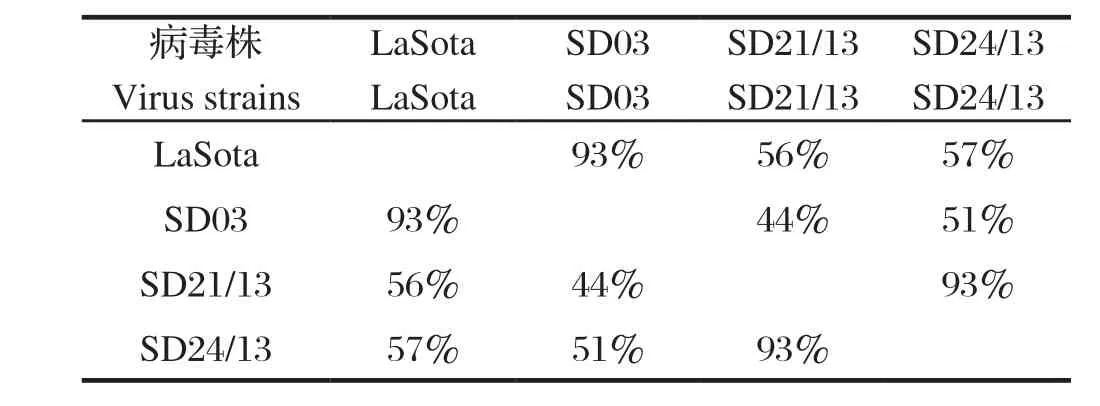
表2 不同NDV毒株间的HI同源性(%)Table 2 Correlations rate of HI among different NDV strains(%)
2.4 病毒F基因序列与遗传进化分析 利用MEGA4.1软件对5个鹭源分离株和26个参考毒株的F基因47~420 bp可变区进行系统进化分析(图1)。结果31个分离株被分为8个基因群,均属于classⅠ分支,5个分离株与7株2010~2014年分离的参考株聚于一簇,属于classⅠ目前主要流行的3c亚型,且具有典型的弱毒株F 蛋白裂解位点112ERQERL117。
3 讨论
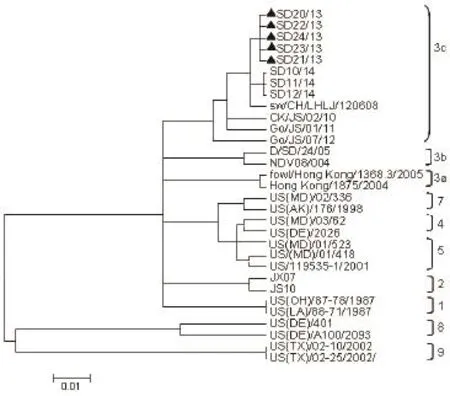
图1 5株鹭源NDV毒株F基因可变区(47~420 bp)系统进化分析Fig.1 Phylogenetic relationships of the nucleotide sequence of 5 NDV strains isolated from ardeid wildbird based on a variable portion (47~420 bp) of the F gene
野鸟在新城疫的流行病学中充当了一定的角色,国外报道过多次野鸟爆发ND的病例:1992年美国野鸟发生ND,死亡水鸟多达2万只;2002年荷兰野鸟暴发ND,海鸥、野鸭和猫头鹰均被感染[8]。调查发现,我国三江自然保护区、秦岭地区、上海的野鸟血清样品中均携带新城疫抗体[8-10],表明NDV在野鸟中广泛存在,但目前对野鸟中NDV的分离报道较少。本研究中鹭源NDV均分离于江西省都昌鄱阳湖区,该地区处于“东亚-澳大利亚”候鸟迁飞线路之中,每年立春后大批鹭鸟从东南亚等地迁徙至此度夏。5株鹭源NDV毒株与2010~2014年分离的CK/JS/02/10、Go/JS/01/11和SD10/14等毒株聚于一簇,属于3c亚型,目前从健康野鸟和家禽中分到的classⅠ毒株的基因型以3c亚型为主[11,12]。
classⅠ弱毒株与LaSota疫苗株的遗传距离较远,对野鸟无致病性。尽管classⅠ弱毒株无致病性,甚至还能提高禽群对新城疫的免疫保护[13,14],但这些弱毒株在健康野鸟中长期存在,相互影响,相互作用,存在基因重组和毒力返强的可能[15],并产生新的毒株和新的基因型,对家禽构成潜在的威胁。目前对野鸟NDV的流行病学调查较少,今后有必要针对野鸟NDV特别是弱毒株开展长期的流行病学监测,研究其毒力演化,以期对NDV的爆发和流行提前预警,减少经济损失。
[1] de Leeuw O, Peeters B. Complete nucleotide sequence of Newcastle disease virus: evidence for the existence of a new genus within the subfamily Paramyxovirinae[J]. J Gen Virol, 1999, 80 (pt 1): 131-136.
[2] Mayo M A. A summary of taxonomic changes recently approved by ICTV[J].Arch Virol, 2002, 147(8), 1655-1663.
[3] Ballagi-Pordany A, Wehmann E, Herczeg J, et al.Identification and grouping of Newcastle disease virus strains by restriction site analysis of a region from the F gene[J]. Arch Virol, 1996, 141(2): 243 - 261.
[4] Czegledl A, Ujvarl D, Somogyl E, et al. Third genome size category of avian paramyxovirus serotype 1 (Newcastal disease virus) and evolutionary implications[J].Virus Res, 2006, 12(2): 36-38.
[5] Briand F -X, Henry A, Brown P, et al. Complete genome sequence of a newcastle disease virus strain belonging to a recently identified genotype[J]. Genome Announc, 2013, 1(1): 100-112.
[6] Diel D G, da Silva L H, Liu H, et al. Genetic diversity of avian paramyxovirus type 1: proposal for a unified nomenclature and classification system of Newcastle disease virus genotypes[J]. Infect Genet Evol, 2012, 12(8): 1770-1179.
[7] Alexander D J, Saif J M, Barnes H J, et al. Newcastle disease, other avian paramyxoviruses and pneumovirus infections[M]. Diss Poultry, 2003: 63-99.
[8] 孙泉云, 薛 霞, 李凯航, 等. 上海地区野鸟中禽相关疫病的血清学调查[J]. 中国家禽, 2006, 28(11): 27-29.
[9] 曾祥伟, 华育平, 李晓冰, 等. 三江自然保护区野生迁徙水禽携带禽流感病毒和新城疫病毒状况的监测[J]. 微生物学报, 2008, 48(10): 1403-1407.
[10] 段旭基, 张鹏, 吴朋朋, 等. 秦岭北麓关中地区野鸟源基因Ⅸ型新城疫病毒病原学监测及分离株毒力测定[J]. 中国兽医学报, 2013, 33(8): 1163-1169.
[11] Liu X, Wang X, Wu S, et al. Surveillance for avirulent Newcastle disease viruses in domestic ducks (Anas platyrhynchos and Cairina moschata) at live bird markets in Eastern China and characterization of the viruses isolated[J]. Avian Pathol, 2009, 38(5): 377-391.
[12] Zhu J, Xu H X, Liu J J , et al. Surveillance of avirulent Newcastle disease viruses at live bird markets in Eastern China during 2008-2012 reveals a new subgenotype classⅠ virus[J]. Virol J, 2014, 11(211): 1-9.
[13] Kim L M, King D J, Suarez D L, et al. Characterization of class I Newcastle disease virus isolates from Hong Kong bird markets and detection using real-time reverse transcription PCR[J]. J Clin Microbiol, 2007, 45(4): 1310-1314.
[14] Kim L M, King D J, Curry P E, et al. Phylogenetic diversity among low-virulence newcastle disease viruses from waterfowl and shorebirds and comparison of genotype distributions to those of poultry-origin isolates [J]. J Virol, 2007, 81(22): 12641-12653.
[15] 于圣青, 丁铲, Kishida N, 等. 新城疫病毒某水禽分离株经鸡体传代后由非致病型转变为速发型的研究[J]. 中国预防兽医学报, 2003, 25(1): 59-64.
BIOLOGICAL CHARACTERISTICS AND GENETIC ANALYSIS OF NEWCASTLE DISEASE VIRUSES ISOLATED FROM ARDEID WILDBIRDS
YANG Shao-hua, XU Chuan-tian, HUANG Yan-yan, ZHANG Lin, HUANG Qing-hua, ZHANG Xiu-mei
(Shandong Key Lab of Animal Disease Control and Breeding, Institute of Animal Science and Veterinary Medicine, Shandong Academy of Agricultural Science, Jinan 250100, China)
In order to understand the biological characteristics and genetic evolution of fi ve class Ⅰ Newcastle disease viruses (NDV) isolated from ardeid wildbirds, these viruses were inoculated into one-day-old chicks. Results indicated that these five NDV isolates were all lentogenic according to the mean death time (MDT) and intracerebral pathogenicity index (ICPI). Cross HI test showed that HI homology was 0.56~0.57 between these isolates and LaSota and 0.44~0.51 between these isolates and Class Ⅱ isolates. Phylogenetic analysis of these isolates based on 47-470 bp of F genes revealed that all isolates were clustered into Class I group 3c clade. Class I NDV carried by healthy wild water fowls might have spread to domestic waterfowls through migration, posing a potential threat to domestic poultry. The results from the present study suggested the urgency and importance of strengthening the epidemiological studies of NDV in wild birds.
Newcastle disease virus; healthy wild water fowl; biological feature
S852.659.5
A
1674-6422(2016)05-0021-04
2016-03-01
公益性行业(农业)科研专项(201003012,201303033);现代农业产业技术体系建设专项(CARS-42-Z12)
杨少华,女,硕士,助理研究员,主要从事禽病综合防控技术研究
张秀美,E-mail: zxm820410@163.com

