不同ELISA试剂盒检测牛结核病效果比较
邵红霞,赵 巍,黄 健,钱 琨,叶建强,秦爱建
(1. 扬州大学兽医学院 禽类预防医学教育部重点实验室 江苏省动物预防医学重点实验室,扬州225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
不同ELISA试剂盒检测牛结核病效果比较
邵红霞1,2,赵 巍1,2,黄 健1,2,钱 琨1,2,叶建强1,2,秦爱建1,2
(1. 扬州大学兽医学院 禽类预防医学教育部重点实验室 江苏省动物预防医学重点实验室,扬州225009;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
本研究对自行研制的检测牛γ干扰素的双夹心ELISA试剂盒与商品化试剂盒进行了比较。用自行研制的双夹心ELISA试剂盒对1255份经牛PPD刺激的牛全血培养上清样品进行了检测,结果发现94份阳性样品,检测阳性率为7.5%。同时用进口的ELISA试剂盒对其中的472份样品进行了对比检测,两者阳性符合率为97.6%,阴性符合率为96.4%,总符合率为96.6%。比较检测结果证明,自行研制的检测牛γ干扰素的双夹心ELISA试剂盒有很好的应用前景。
检测牛γ干扰素;双夹心ELISA;比较
牛结核病(bovine tuberculosis)是由分支杆菌感染引起的一种慢性消耗性的人畜共患病,不仅对畜牧业可持续发展产生严重影响,而且还威胁人类的健康[1]。近年来,人结核病虽然处于有效控制中,但是仍然呈现一种缓慢上升趋势[2]。根据中国疾病预防控制中心数据统计,2011年我国感染肺结核的人数为953 275,死亡人数为2840。值得注意的是,人结核病中有10%左右是由牛结核分枝杆菌引起的。因此,牛结核病的有效诊断和防治,对控制人结核病具有十分重要的公共卫生意义。目前,我国牛结核病的检测方法主要有细菌学方法、PCR方法和免疫学方法等[9]。细菌学检测虽然能确诊牛结核,但是由于牛结核分枝杆菌生长缓慢,分离率低,且需要特定实验室,因此细菌学检测应用不广[10]。PCR目前未能有效应用于牛结核的检测与诊断中。免疫学方法主要有结核菌素皮内变态反应和γ干扰素-ELISA[5,6]。皮内变态反应由于其敏感性和特异性问题逐渐被淘汰。牛γ干扰素检测牛结核的商用ELISA 试剂盒已经在澳大利亚和欧美一些国家得到了广泛的应用[7],已被OIE列为牛结核病诊断方法之一。本研究应用两株特异性抗牛γ干扰素单克隆抗体3E1和6E5,建立了检测牛γ干扰素双夹心ELISA试剂盒,对临床样本进行了检测,并与商品化ELISA试剂盒进行了比较。
1 材料与方法
1.1材料 BPPD购自中国兽医药品监察所;酶标仪购自BioTek公司;检测牛γ干扰素双夹心ELISA试剂盒,为本实验室研制[3,4]和商品化的BOVIGAM采集试剂盒。
1.2 方法
1.2.1 牛全血培养
1.2.1.1 采血 无菌采集12头牛的抗凝血,每头5ml。采集好的血液(含有抗凝剂)轻轻颠倒几次充分混合。采血后30 h内进行培养(抗凝血不能贮存于冰箱中)。
1.2.1.2 血液培养 血液培养前轻轻颠倒,充分混匀。由于本试验需要活的淋巴细胞,因此需要将细胞损伤降至最低。将12头牛的血液样品依次,且每头牛的血液样品加入24孔培养板,加2孔,每孔1.5 mL。用一次性自动移液器或吸管在无菌条件下进行操作。
1.2.1.3 加入刺激原 每头牛的血液样品,一孔无菌加入100μL PBS(阴性抗原对照)和一孔无菌加入100μL 牛型提纯结核菌素(purified protein derivative from M·bovis,BPPD)。注:抗原必须与血液充分混匀,最好用一个微量振荡器高速振荡1
min。如果没有合适的仪器,将培养板及其盖紧紧固定在一起,在光滑的表面上顺时针和逆时针各旋转10次。小心操作不要引起交叉污染,也不要让血液附在盖上,避免血液起泡。只有刺激抗原与血液完全混合,试验才能达到最佳效果。
1.2.1.4 孵育 将含有血液和抗原的培养板放于37℃,CO2湿温培养箱中孵育24 h。
1.2.1.5 血浆样品的收获 用可调移液器小心吸取上层血浆,转入独立的1.5 mL离心管中。吸取血浆时应尽量避免吸入细胞,若吸入少量红细胞进行离心去除。
1.2.1.6 血浆的贮存 血浆可在2℃~8℃贮存7 d,在-20℃可贮存几个月。贮存前,每个贮存管必须用合适的盖子密封。检测前,样品需恢复至室温并充分混匀。
1.2.2 试剂盒检测 用自行研制的双夹心ELISA试剂盒对经BPPD刺激的1255份牛全血上清中牛γ干扰素进行检测,同时用进口的BOVIGAM试剂盒对其中的472份样本进行了同步对比检测与分析。
2 结果
2.1 自行研制试剂盒与进口试剂盒对牛γ-干扰素检测结果 用自行研制的双夹心ELISA试剂盒对1255份牛全血刺激上清中牛γ-干扰素进行了检测,结果发现94份阳性样品,检测阳性率为7.5%。同时用进口的ELISA试剂盒对其中的472份牛全血刺激上清进行了对比检测。在这472份样品中,进口的ELISA试剂盒检出82份阳性,自制ELISA试剂盒检出94份阳性样品,其中80份阴性样品与进口ELISA试剂盒检测结果相同,阳性符合率为 80/82=97.6%。自制ELISA试剂盒检出阴性样品376份,与进口ELISA试剂盒阴性符合率为376/390=96.4%,总符合率为(80+376)/(82+390)=96.6%。
2.2 不同奶牛场检测结果分析 对某地区奶牛场A奶牛采样875份牛血样,选取部分样本,用自制试剂盒进口试剂盒进行对比检测,结果在所比对的346份样本中,进口试剂盒检测阳性样本数为46份,自行研制的试剂盒阳性样本数为52份,共同阳性的样本数为45份,共同阴性的样本为293份,总符合率为97.7%。阳性样本的检测结果如图1所示。
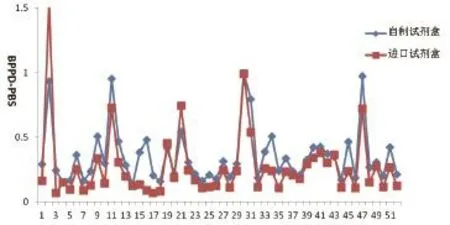
图1 自制试剂盒与进口试剂盒BPPD刺激与PBS刺激OD值差(阳性)Fig.1 Comparison of the sandwich ELISA with commercial ELISA kit for OD of BPPD-PBS
对某奶牛场B的奶牛采样22份,用自行研制试剂盒和进口试剂盒同时进行检测,结果自制试剂盒检测阳性样本为5份,进口试剂盒检测阳性样本为4份,共同检测出的阳性样本为4份,共同阴性样本为17份,符合率为95.5%。检测结果详见图2。
对某奶牛场C的奶牛采样92份牛血样,自制ELISA试剂盒检测出18份阳性样品,74份阴性样品。进口试剂盒检测出16份阳性样品,76份阴性样品。两者共同检测出的阳性样品15份,阴性样品73份,总符合率为95.7%,阴性样本检测结果见图3。
对某奶牛场D的奶牛,选取10份牛血样,用自制试剂盒与进口试剂盒方法检测结果均显示,阳性样品8份,阴性样品2份。符合率为100%,结果见图4。
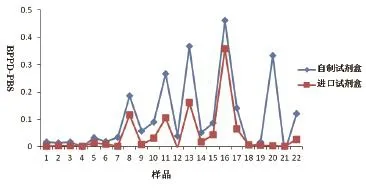
图2 自制试剂盒与进口试剂盒BPPD刺激与PBS刺激OD值差Fig.2 Comparison of the sandwich ELISA with commercial ELISA kit for OD of BPPD--PBS
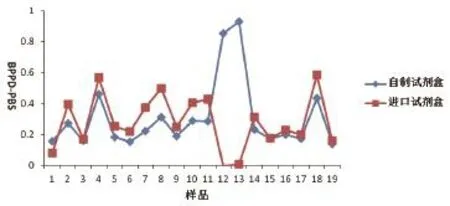
图3 自制试剂盒与进口试剂盒BPPD刺激与PBS刺激OD值差Fig.3 Comparison of the sandwich ELISA with commercial ELISA kit for OD of BPPD-PBS
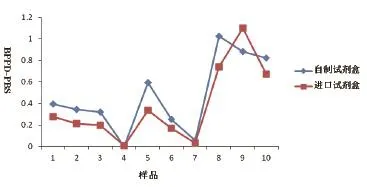
图4 自制试剂盒与进口试剂盒BPPD刺激与PBS刺激OD值差Fig.4 Comparison of the sandwich ELISA with commercial ELISA kit for OD of BPPD-PBS
3 讨论
牛结核是一种由牛分枝杆菌引起的临床症状不典型的慢性消耗性疾病。因此,早期临床检查与诊断比较困难。在免疫学检测方法中,结核菌素皮内变态反应被广泛使用,但其灵敏性和特异性不高,检测时间较长。1990年,Wood等[5]建立了通过检测经牛PPD刺激的牛全血释放出来的γ干扰素,从而诊断牛结核病的ELISA方法。牛结核病γ干扰素检测方法具有特异性好、灵敏度高等特点。目前,商品化的γ干扰素ELISA检测试剂盒已在澳大利亚和欧美的一些国家得到应用[8,10,11],在我国也有一定应用,但是价格十分昂贵。我国农业部已提出净化牛结核,并在十三五作为主要目标进行落实。因此,研制出高质量的具有自主知识产权的γ干扰素检测试剂盒具有重要意义。本研究应用自行研制的试剂盒能够有效用于经PPD刺激的牛全血培养中释放出的牛γ干扰素,从而对牛结核病进行快速诊断。与进口商品化ELISA试剂盒比较研究发现,阳性符合率为97.6%、阴性符合率为96.4%,总符合率达96.6%。这些结果证明,自行研制的双夹心ELISA试剂盒具有良好的特异性和灵敏性,可以应用于临床样本的检测,为我国牛结核病的检疫和根除提供了一种实用、快速、有效的检测工具,并展示了很好的应用价值。
[1] 刘思国, 于辉. 牛结核病研究进展[J]. 畜牧兽医科技信息,2003, 19(10): 10-14.
[2] Humblet M F, Boschiroli M L, Saegerman C.Classification of worldwide bovine tuberculosis risk factors in cattle: a stratified approach[J]. Vet Res, 2009, 40(5): 50.
[3] 黄大卢. BoIFN-γ 基因的原核表达及其单克隆抗体的研制[D]. 扬州: 扬州大学, 2012.
[4] 黄健. 牛结核病诊断方法的建立及初步应用[D]. 扬州:扬州大学, 2015.
[5] Wood P R, Corner L A, Placjett P. Development of a simple, rapid in vitro cellular assay for bovine tuberculosis based on the production of gamma interferon[J]. Res Vet cSi, 1990, 49(1): 46-49.
[6] 袁群芳. IFN-γ体外释放法检测牛结核病[J]. 中国动物保健, 2014, 16(7): 32-35.
[7] Denis Mi, Wedlock D N, McCarthy A R, et al.Enhancement of the sensitivity of the whole-blood gamma interferon assay for diagnosis of Mycobacterium bovis infections in cattle[J]. Clin Vaccine Immunol, 2007, 14(11): 1483-1489.
[8] de la Rua-Domenech R, Goodchild A T, Vordermeier H M, et al. Antemortem diagnosis of tuberculosis in cattle: a review of the tuberculin tests, gamma-interferon assay and other ancillary diagnostic techniques[J]. Res Vet Sci, 2006, 81(2): 190-210.
[9] Sarnaik R M, Sharma M, Kate S K, et al. Serodiagnosis of tuberculosis:assessment of kaolin agglutination test[J].Tuber Lung Dis, 1993, 74(6): 405-406.
[10] 陈祥. γ-干扰素试验和皮试变态反应对检测奶牛结核病的比较[J]. 中国人兽共患病学报, 2011, 27(2), 97-100.
[11] EmmerzaalA, Deleu S. Cattle tuberculosis: caused by Mycobacterium bovine is difficult to detect and to treat [J].Veehouderen Dierenarts, 2000, 14(2): 4-7.
COMPARISON OF DIFFERENT ELISA KITS FOR DETECTION OF BOVINE γ-IFN
SHAO Hong-xia1,2, ZHAO Wei1,2, HUANG Jian1,2, QIAN Kun1,2, YE Jian-qiang1,2, QIN Ai-jian1,2
(1. Ministry of Education Key Laboratory for Avian Preventive Medicine, Key Laboratory of Jiangsu Preventive Veterinary Medicine, Yangzhou University, Yangzhou 225009, China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
To select high quality diagnostic kit for bovine tuberculosis, the domestic sandwich ELISA developed in our laboratory and a commercial ELISA kit were compared for detection of bovine γ-IFN in whole blood stimulated with BPPD. The positive percentage was 7.5% (94/1,255) with the domestic sandwich ELISA. Furthermore, 472 of these 1,255 samples were tested in both ELISA kits. Our data showed that the positive, negative and total agreement between the two ELISAs were 97.6%, 96.4% and 96.6%, respectively. The direct comparison demonstrated that the domestic sandwich ELISA developed in our laboratory had promising application for detection of bovine γ-IFN.
Bovine γ-IFN; sandwich ELISA; comparison
S852.618
A
1674-6422(2016)05-0029-04
2016-01-06
江苏省科技支撑计划(BE2013391);江苏省优势学科项目
邵红霞,女,博士,讲师,主要从事动物病原学研究
秦爱建,E-mail : aijian@yzu.edu.cn

