不同方法对甜菜不同组织中总DNA的提取效果
王希,陈丽,赵春雷,丁广洲,贾海伦,徐杰
(1.黑龙江大学农作物研究院/中国农业科学院甜菜研究所,哈尔滨 150080;2.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;3.中国农业科学院北方糖料作物资源与利用重点开放实验室,黑龙江哈尔滨150080;4.黑龙江大学研究生学院,哈尔滨150080)
总DNA的提取是分子生物学技术中最基本、最重要的操作之一,也是决定后续试验结果的关键因素之一。高质量的DNA应当具备产量/得率理想、足够完整、无断裂无降解、杂质残留少等特点,同时,在提取过程中还应当尽可能节省时间、减少操作步骤、并尽量降低成本。然而DNA在生物体不同组织内分布不同,在不同物种中也有差异。因此,DNA提取方法的选择尤为重要,且针对不同植物、不同组织所采取的提取方法也应有所差别。目前常用的包括高盐低pH法、改良十二烷基硫酸钠(SDS)法、改良十六烷基三乙基溴化铵(CTAB)法及碱裂解法等多种方法[1-5]。
甜菜组织中富含酚类、糖类及其他次生代谢物,这些杂质均会影响到总DNA提取的质量与效率,且糖用甜菜为二年生作物,组织样品的获取方式与大部分一年生作物不同,往往需要从不同种组织中提取总DNA。因此对甜菜而言,针对不同研究目的、不同组织材料选择适宜的总DNA提取方法,对后续试验有着更为重要的意义,也是开展大部分甜菜分子生物学研究的前提。
本研究选取甜菜的叶片、花、种子、根4种不同组织,分别采用上述4种提取方法进行总DNA的提取,并比较提取产物的得率、纯度与PCR反应的扩增效果,探讨各组织最适合的总DNA提取方法。
1 材料与方法
1.1 试验材料
试验用甜菜材料为所在课题组保存的糖用甜菜种质M12,试验组织包括甜菜的幼嫩叶片、幼嫩花序、萌动种子及糖分积累期块根;PCR引物为课题组前期设计的简单序列重复标记(simple sequence repeat,SSR)引物,由上海生工生物公司合成,扩增产物约100bp;其它常规试剂与仪器略。
1.2 提取方法
改良CTAB法采用闫庆祥等[1]方法,改良SDS法采用单志等[2]方法,高盐低pH法采用伍艳芳等[3]方法,碱裂解法采用李筱婷和王茂芊等[4-5]方法。产物用RNA酶处理以减小质量检测时的误差。
1.3 总DNA产量与质量检测
测量DNA产物在260nm处的光密度值 (optical density,OD),计算产物浓度与DNA得率;根据比值OD260/OD280与OD260/OD230评价产物纯度。通过琼脂糖凝胶电泳检测DNA完整性。
DNA浓度与得率计算公式:样品浓度(μg/mL)=OD260×稀释倍数×50;样品得率(μg/mg)=样品浓度×样品体积(mL)/组织质量(mg)每种提取方法对不同组织均提取3份总DNA作为重复。
1.4 PCR扩增效果检测
应用特异性及扩增效率中等的SSR引物,使用上述4种方法所提取的总DNA组作为模板,进行PCR扩增,分析DNA产物质量对PCR效果是否有影响。
2 结果与分析
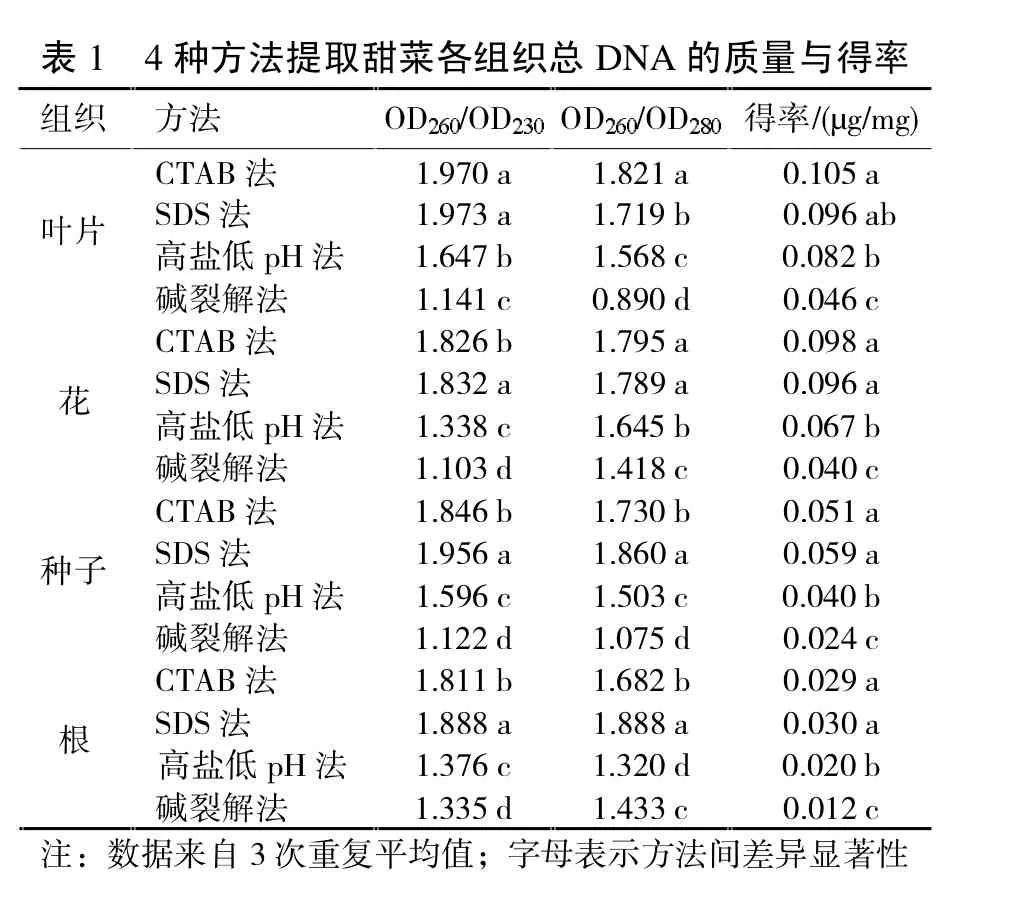
组织 方法 OD/OD OD/OD 得率/(µ叶片 碱裂解法 1.141 c 0.890 d 0.046 c cTAB 826 b 175 a 98 a SDS法 1.3 a .89 0.06高盐低pH法 1.338 c 1.645 b 0.067 b cTAB法 1.970 a 1.821 a 0.105 a SDS 3 79 b 96 b高盐低pH法 647 b 568 c 82 g/mg)种子 碱裂解法 122 d 075 d 24 c cTAB 1.81 b 1.682 b 0.09 a SDS法 1.888 a 1.888 a 0.030 a高盐低pH法 376 c 320 d 2 b花 碱裂解法 103 d 418 c 40 c cTAB法 1.846 b 1.730 b 0.051 a SDS 95 a 86 a 9高盐低pH法 1.596 c 1.503 c 0.040 b根 碱裂解法 1.335 d 1.433 c 0.012 c注:数据来自3次重复平均值;字母表示方法间差异显著性
2.1 不同方法提取DNA质量及得率比较
通常情况下,核酸及其衍生物紫外光吸收高峰为260nm,可据此估算核酸溶液浓度;蛋白质的吸收峰值为280nm;多糖、酚类及色素的吸收峰值则为230nm。纯净的DNA样品的OD260/OD230值约为2.0,过低表明小分子物质残留较多;OD260/OD280值约为1.8,若比值大于1.8表示存在RNA残留,若值小于1.8则可能存在蛋白质污染。本研究共采用了4种方法自各组织中提取总DNA,根据OD值分析产物纯度与得率,结果见表1。
就叶片而言,改良CTAB法的提取效果最为理想,得率较高,杂质去除也较彻底;SDS法次之,得率与CTAB法类似,但蛋白质残留略多;高盐低pH法与碱裂解法所得产物纯度远低于另外两种方法,产量也相对较低。对于花的提取,DNA产量与质量略低于叶片,其中CTAB法与SDS法均能得到较高得率,并能基本去除蛋白质杂质,但SDS法对其它小分子的去除效果优于CTAB法;另外两种方法的产率和质量均较低。对于种子和根,4种方法的得率均远低于叶片与花,SDS法在杂质去除上优于另外3种方法。
此外,比较来自不同组织的总DNA,使用叶片提取的DNA质量优于其他3种组织;得率方面,叶片和花相近,而根和种子的得率较低;其中改良CTAB法最适宜叶片的总DNA提取,改良SDS法适宜提取其它3种组织的DNA。
2.2 不同方法所得DNA的完整性检测
通过琼脂糖凝胶电泳,可直观地对比DNA产物的质量与完整性,结果见图1。由于不同方法、不同组织得率差异较大,因此调整上样量,避免条带亮度差异过大影响图像采集。其中,碱裂解法所得产物的上样量为其它3种方法产物的2倍;每种方法中,种子所得DNA的上样量为叶片与花的2倍,根的上样量为叶片与花的4倍。
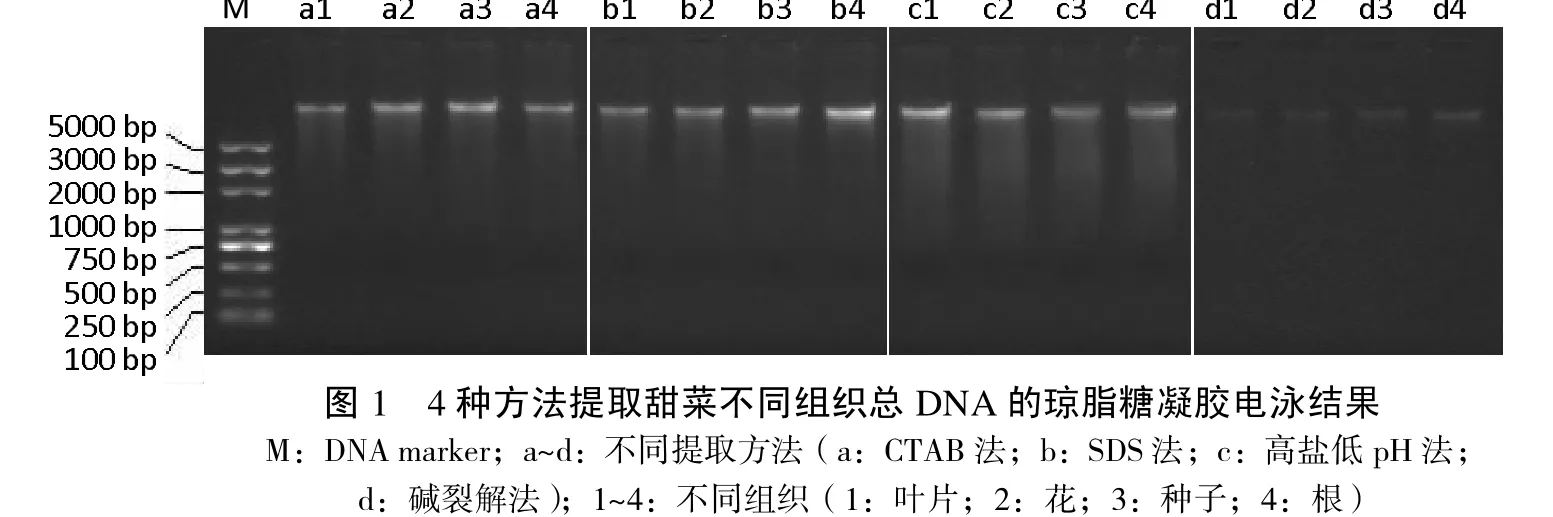
同一方法从不同组织中提取出的DNA电泳带型相似,表明DNA产物完整性基本不受组织类型的影响。比较不同方法所得DNA的完整性,可见CTAB法与SDS法的产物条带清晰明亮,几乎不拖尾,碱裂解法虽然条带较暗,但也可见无拖尾的产物条带,表明这些方法对DNA完整性的影响均较小;高盐低pH法则有较明显的拖尾现象,表明产物断裂或降解程度较大,或是由于杂质的存在,导致了DNA的陆续降解。
2.3 提取效果对PCR扩增的影响
将4种提取方法所取得的总DNA样品分别作为模板,采用SSR引物A1进行PCR扩增,根据扩增效率与特异性分析所得DNA对PCR反应的影响,结果见图2。
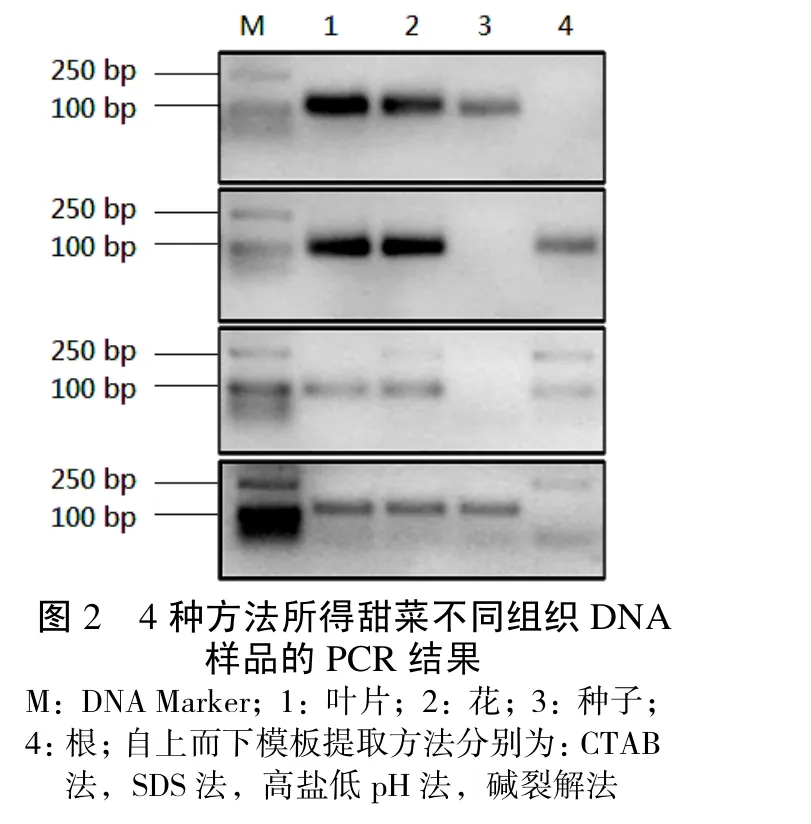
4种方法所提取的DNA大部分可得到扩增产物。其中,CTAB法与SDS法所得产物得到了单一的扩增条带,扩增特异性比较好,表明产物中干扰PCR反应的杂质较少;高盐低pH法和碱裂解法除目的条带外,还得到了一些非特异性条带,表明产物中残留的杂质有可能影响PCR反应的特异性。比较不同组织DNA的PCR结果,可见来自叶片与花的DNA均得到了扩增产物,而种子与根DNA条带较浅或几乎不可见,与DNA得率有类似的趋势,表明DNA得率过低时,会使PCR扩增效率随之降低。高盐低pH法与碱裂解法所得的种子和根的DNA作为模板时,PCR效率低,非特异产物条带明显,说明这4份DNA的纯度和浓度不足以进行高质量的PCR反应。
3 讨论
甜菜组织细胞中富含多糖、酚类及其他次生代谢物,一方面DNA容易被包埋在杂质之中而不能充分溶解,从而影响提取效率,另一方面这些物质的残留会影响DNA纯度,进而影响后续试验[5]。甜菜的不同组织由于自身特点不同,所能够提取到的总DNA的浓度及产量和得率也有所不同。
3.1 4种提取方法比较与适用性分析
3.1.1 CTAB法 CTAB是一种阳离子去污剂,既能够裂解细胞,又能够与DNA形成复合物,溶解于高盐溶液中,盐浓度降低时析出。CTAB能够有效地沉淀多糖,但对蛋白质、酚类以及多酚氧化产物等的去除效果一般[6]。改良CTAB法以氯仿为主要抽取试剂,可以在一定程度上避免向产物中引入更多酚类,但对蛋白质的抽提效果也有所下降。本研究结果表明,改良CTAB法更适宜于甜菜叶片的总DNA提取,但对于花、种子和根这些细胞偏老、成分相对复杂的组织,杂质去除效果则不如SDS法。
3.1.2 SDS法 SDS是一种阴离子去污剂,能够裂解细胞,释放核DNA。改良SDS法改进了细胞破碎及DNA纯化步骤,可避免常规SDS法常出现的褐化现象[2]。但甜菜组织细胞中的多糖、酚类及其他次生代谢物含量较多,可能干扰了DNA的溶解,从而使SDS法的提取效率略逊于改良CTAB法。本研究中,改良SDS法更适宜于花、种子及根的总DNA提取,可获得较纯净的DNA。
3.1.3 高盐低pH法 高盐低pH法的酸性环境能够避免组织细胞破碎时和大量材料沉淀时的电离化作用及酚类化合物的褐化现象,高盐则能够沉淀蛋白质,该方法操作较为经济,比较适用于多糖及次生代谢产物含量较低的提取材料[3]。本研究证明,对于成分较复杂的甜菜组织而言,使用高盐低pH法所提取的总DNA浓度及得率均较低。另外,此方法所得DNA的完整性也相对较差,可能是由于多步操作中机械剪切力所致,也有可能是残留杂质的影响。
3.1.4 碱裂解法 碱裂解法采用NaOH溶液裂解细胞,经简单的纯化步骤后,得到DNA的粗提物。其优点在于操作简单、耗时很短,但由于在提取总DNA的过程中缺乏有针对性的杂质抽提步骤,当某些杂质残留较多时,将对PCR扩增效果造成影响[7];另外该方法的产量及得率也较低,提取效果不够理想。碱裂解法的优势在于每个样品提取时间仅约30min,当样品提取难度不大、对DNA质量要求不高、待提取样品数目较多时,采用碱裂解法能够有效地提高工作效率。
3.2 不同组织提取效果比较
本文的结果表明,甜菜不同部位所提取的DNA量有较大差异,4种提取方法从叶片和花中提取的总DNA的产量及得率均优于种子和根。这与不同组织中细胞特征的差异有较大关系:幼嫩叶片中大部分细胞为未成熟细胞,细胞多且小,细胞壁较薄,代谢活动较为活跃,等质量组织中细胞数目较多,提取过程中细胞容易破碎,DNA释放量较大,因而提取量较多[8]。幼嫩花序中,有一部分成熟细胞,也存在相当大部分未成熟的细胞,因此得率也相对较高。而种子和根为成熟组织,且其中很大一部分是贮藏细胞,DNA含量较低、复制不旺盛,因此采用同样方法进行DNA提取,得率仅为叶片或花的一半左右。若使用叶片或花序作为材料,尽可能选取幼嫩部分,即可得到较高的得率,而使用种子或根作为材料时,建议根据需要增加浓缩步骤,否则很难得到充足的DNA。
从DNA产物纯度来看,叶片中除糖类与叶绿素以外,其它杂质均比较少,产物质量也相对优于其它3种组织。花、种子和根中另有一些色素、贮藏物质及多糖,与叶片相比成分比较复杂,因此经过同样的抽提步骤,残留的杂质多于叶片,并有可能由于杂质的干扰,降低DNA提取的效率。
杂质的残留对PCR反应的特异性有一定影响,DNA产物浓度则影响着PCR反应的扩增效率,当DNA纯度与浓度低于一定范围时,PCR的质量与重复性均会受到影响。根据本研究结果,若要保证PCR反应的准确性与重复性,DNA产物的浓度应不低于0.05μg/μL,当需要自根或种子中提取DNA时,建议将产物浓缩,以免浓度过低影响PCR效率,同时选择杂质去除效果较好的SDS法进行提取,适当增加纯化步骤,以尽量避免杂质对PCR特异性的影响。
4 结论
4.1 以甜菜幼嫩叶片、幼嫩花序、萌动种子与糖分积累期块根作为材料均可获得总DNA。其中,以叶片与花序作为材料,提取效果较好。种子与块根提取难度较大,产物得率低,需要提取时建议增加浓缩步骤。
4.2 改良CTAB法比较适合自甜菜幼嫩叶片中提取总DNA;SDS法比较适合花序、种子、根中的DNA提取;碱裂解法适用于DNA的快速提取;高盐低pH法未见优势。种子与块根由于总DNA得率低,不建议用碱裂解法提取。
[1]闫庆祥,黄东益,李开绵,叶剑秋.利用改良CTAB法提取木薯基因组DNA[J].中国农学通报,2010(4):30-32.
[2]单志,吴宏亮,李成磊,陈惠,吴琦.改良SDS法提取多种植物基因组DNA研究[J].广东农业科学,2011(8):113-115.
[3]伍艳芳,徐海宁,肖复明,等.陈山红心杉基因组DNA提取方法的比较与分析[J].江西农业大学学报,2012,34(3):517-521.
[4]李筱婷,陈卓君,许文涛,等.一种适于PCR扩增的植物基因组快速提取新方法[J].农业生物技术学报,2010,18(2):394-399.
[5]王茂芊,吴则东,王华忠.利用SRAP标记分析我国甜菜三大产区骨干材料的遗传多样性[J].作物学报,2011,31(5):811-819.
[6]刘巧红,程大友,杨林,等.甜菜品种(系)的ISSR标记数字指纹图谱构建及聚类分析(英文)[J].农业工程学报,2012,28(S2):280-284.
[7]Tae-Jin Kang,Moon-Sik Yang.Rapid and Reliable Extraction of Genomic DNA from Various Wild-type and Transgenic Plants[J]. BMC Biotechnology,2004,4(1):1-12.
[8]Li J,Schulz B,Stich B.Population structure and genetic diversity in elite sugar beet germplasm investigated with SSR markers[J]. Euphytica,2010,175(1):35-42.

