二甲基姜黄素对Fe3+的选择性识别研究
李正义,严金贝,殷 乐,徐德峰,孙小强*
(1.常州大学 石油化工学院,江苏 常州 213164;2.常州大学 制药与生命科学学院,江苏 常州 213164)
二甲基姜黄素对Fe3+的选择性识别研究
李正义1,严金贝1,殷 乐1,徐德峰2,孙小强1*
(1.常州大学 石油化工学院,江苏 常州 213164;2.常州大学 制药与生命科学学院,江苏 常州 213164)
以姜黄素和碘甲烷为原料,一步合成了二甲基姜黄素分子探针L,其结构经X-射线单晶衍射、1H NMR,13C NMR和ESI-MS等分析手段确证。该化合物晶体属单斜晶系,空间群C2/c,晶胞参数:a=22.317(6) nm,b=8.703 8(19) nm,c=23.039(5) nm,β=93.378(10)°,V=4 467.4(18) nm3,Z=4,Dc=1.206 g·cm-3,F(000)=1 720,μ(MoKα)=0.088 mm-1,R=0.080 9,ωR=0.216 3。探针L在甲醇-水溶液(体积比 9∶1,Tris-HCl缓冲溶液,pH 7.2)中对Fe3+具有选择性识别和较强的抗干扰能力。通过紫外滴定以及质谱确证探针L与Fe3+形成1∶1配合物,结合常数(K)为1.089×106L/mol。该识别体系在Fe3+浓度为5.5×10-6~3×10-5mol/L范围内具有较好的线性关系(r2=0.997 8),检出限为2.2×10-6mol/L。
二甲基姜黄素;分子探针;Fe3+;识别;紫外光谱
铁是自然界最常见的过渡金属之一,也是一种人体重要的微量元素,广泛存在于生物体细胞中,与人体的造血功能有着很大的关系[1]。但铁的过量或缺乏会对生命体的健康产生严重影响[2-3],人体摄入过多的铁会引起某些器官的功能紊乱,例如心脏病和老年痴呆症等[4]。因此,有关Fe3+检测方法的研究已成为热点问题。目前,检测Fe3+的方法繁多,其中原子吸收法、质谱法和伏安法操作较为繁琐耗时且实验成本相对较高[5-6],而荧光法和紫外检测法操作方便、快捷且准确度和灵敏度高。因此基于荧光和紫外检测的Fe3+分子探针的研究受到了广泛关注,如罗丹明类[7]、共轭聚合物[8]、苯并咪唑类衍生物[9]和香豆素[10]等功能分子对Fe3+具有较好的识别性能。但其中某些识别体系由于受其他金属离子的干扰限制了其在特定环境中的应用,且绝大多数探针分子具有一定的毒性,也限制了其在生物体内的应用。因此,设计、开发一种对Fe3+具有高选择性且无毒或低毒的探针分子具有重要的理论意义和应用价值。
β-二酮类化合物能通过酮-烯醇互变形成配位能力较强的O-鳌合双齿,与金属离子配位可形成稳定的六元螯合环,从而生成功能化的金属配合物[11-13]。姜黄素及其衍生物具有β-二羰基结构,同样也能与多种金属离子(如Cu2+,Pt2+,Hg2+,Re3+等)配位,形成稳定的配合物[14-19]。二甲基姜黄素[1,7-二(3,4-甲氧基苯基)-1,6-庚二烯-3,5-二酮]作为天然姜黄素重要的衍生物之一,具有抗炎、抗肿瘤、抗氧化、抗过敏等药理作用,特别是对前列腺癌有抑制作用[20-21],且具有较低的毒副作用。因此,本文基于二甲基姜黄素的配位性能及其低毒性,开发了新型的分子探针,并研究了其对各种金属离子的识别性能。实验结果表明该探针对Fe3+具有很好的选择性识别性能,且识别过程不受其它金属离子干扰。
1 实验部分
1.1 试剂与仪器
姜黄素(纯度≥97%,阿拉丁有限公司),碘甲烷(纯度≥99%,国药集团化学试剂有限公司),氘代试剂(上海凌峰化学试剂有限公司),其他试剂和所有的金属盐均为国产分析纯。
Brucker ARX-300MHz 核磁共振仪(300 MHz,瑞士布鲁克公司,TMS为内标);Shimadzu LCMS-2020 液相色谱-质谱联用仪、Shimadzu UV-1700 紫外分光光度计(日本岛津公司);Bruker ApexⅡ型X 射线单晶衍射仪(瑞士布鲁克公司)。
1.2 探针L的合成
探针L的合成路线如图1所示。称取200 mg (0.54 mmol)姜黄素溶于36 mL无水丙酮中,加入100 mg (0.72 mmol)无水K2CO3和342 mg (2.41 mmol)碘甲烷,回流搅拌反应6 h。反应结束后加入15 mL二氯甲烷,水洗(2×10 mL)后用无水Na2SO4干燥。减压蒸除溶剂后采用硅胶柱分离,二氯甲烷进行洗脱,产物进一步用干燥的乙腈结晶,得到黄色晶体。Yield:45%,m.p.129~131 ℃ (Lit.[22]129~130 ℃)。1H NMR (DMSO-d6,300 MHz)δ:3.81(s,6H),3.83(s,6H),6.12(s,1H),6.85(d,J=15.9 Hz,2H),7.01(d,J=8.4 Hz,2H),7.27(d,J=8.4 Hz,2H) 7.36(d,J=1.5 Hz,2H),7.59(d,J=15.9 Hz,2H),16.35(s,1H);13C NMR(DMSO-d6,75 MHz)δ:56.0,101.5,110.8,112.1,122.5,123.4,128.0,140.9,149.5,151.4,183.7。 ESI-MSm/z(%):397 [(M + H)+,100]。
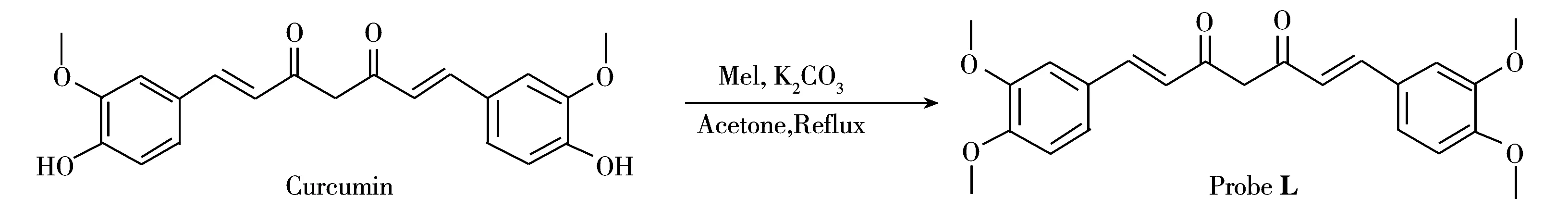
图1 探针L的合成路线Fig.1 The synthetic route to probe L
1.3 探针L晶体结构的测定
选取大小为0.22 mm×0.20 mm×0.18 mm的单晶,置于Bruker Smart Apex-Ⅱ型CCD单晶衍射仪,在297(2) K 下采用石墨单色器单色化的MoKα射线(λ= 0.071 073 nm),以ω-2θ扫描方式,在1.771°≤θ≤24.999°范围内共收集12 252个衍射点,其中独立衍射点3 947(Rint=0.070 2)个。所有计算均由SHELXTL-97晶体结构分析软件包完成。主要晶体学数据列于表1。

表1 探针L的晶体学数据
CCDC:1 433 145
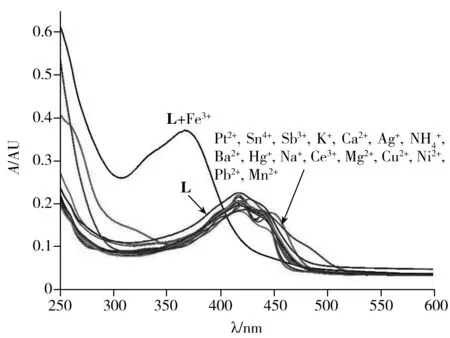
图2 探针L在不同金属离子存在下的紫外吸收光谱Fig.2 Ultraviolet spectrum of probe L in the presence of various metal ions
2 结果与讨论
2.1 探针L对金属离子的选择性识别及抗干扰性
进一步考察了常见的其他金属离子和Fe3+共存时对体系中Fe3+识别的干扰情况。在10 mL探针L的甲醇-水溶液(10 μmol/L)中分别加入4 μL浓度为0.5 mol/L的Fe3+和其他金属离子,观察不同共存金属离子对探针L识别Fe3+的影响。结果表明,当有不同的金属离子共存时,对探针L识别Fe3+的影响很小,说明探针L对Fe3+具有很好的选择性识别能力和较高的抗干扰能力。这可能是由于Fe3+的半径大小与探针L的空间结构更加匹配,探针L会优先与其结合。
2.2 pH值对探针L识别Fe3+的影响
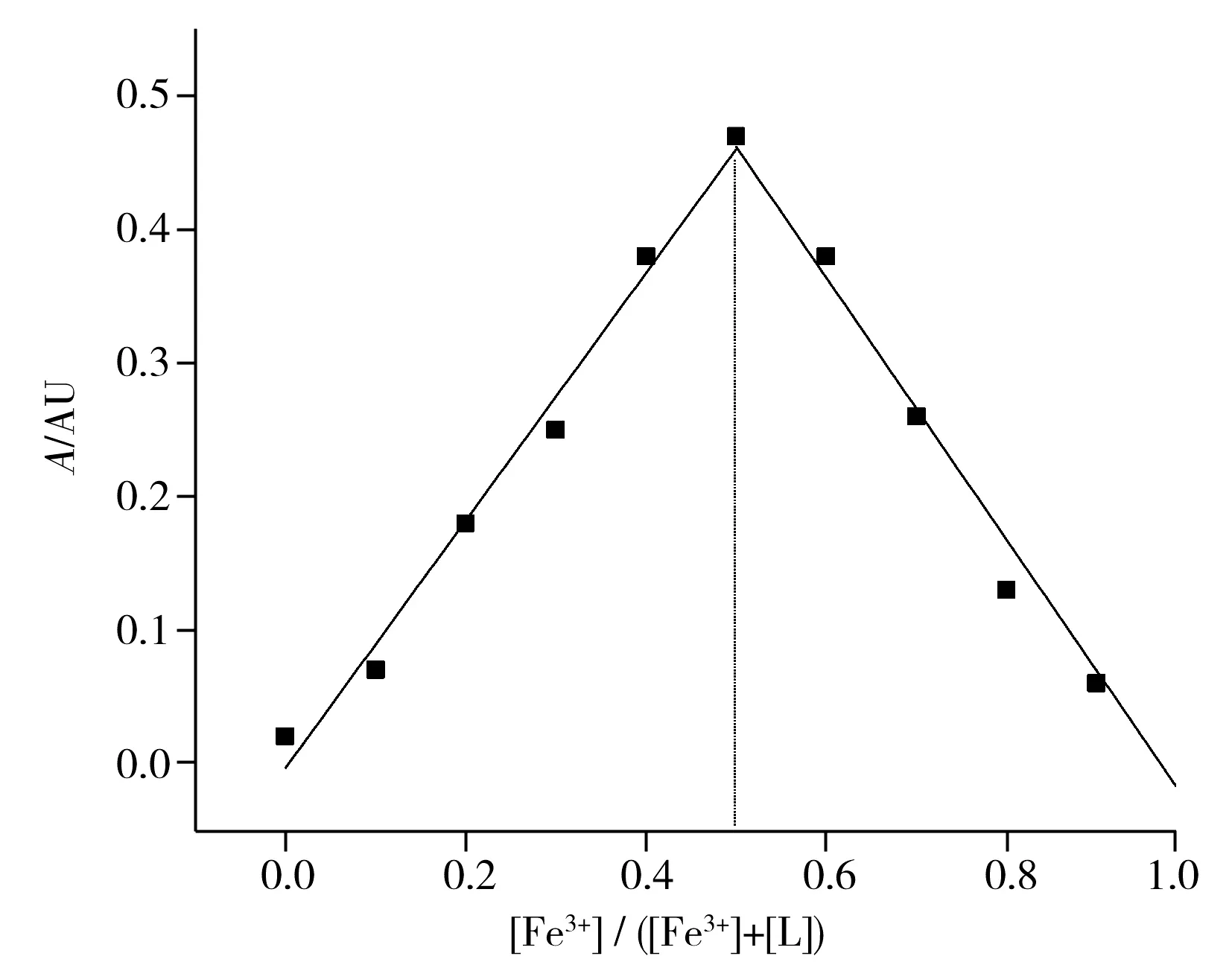
图3 探针L对Fe3+的Job曲线Fig.3 Job′s plot of probe L toward Fe3+[L]+[ Fe3+]=50 μmol/L
考察了pH 值对探针L与Fe3+作用的影响。结果显示,当Fe3+存在时,探针在pH 3.0~7.6之间的吸收强度基本保持不变。当pH 值高于7.6时,随着pH值增大,体系的吸收强度不断减弱。这是由于Fe3+在碱性条件下易沉淀,从而减少了其与探针L配位的数量。此外,探针L在碱性条件下结构不稳定,易分解成类似于香兰素和肉桂酸的系列化合物[25]。本实验选用Tris-HCl缓冲溶液将体系pH值调至7.2左右,以利于探针L用于生命体系中Fe3+的检测。
2.3 Job曲线及紫外滴定
等摩尔Job法是测定配合物络合比的常用方法[26]。本文固定金属离子与配体的总浓度不变,以紫外吸收强度对金属离子与配体比例作图。将探针L和Fe3+的总浓度保持为50 μmol/L,改变Fe3+的摩尔分数。结果显示,波长362 nm处的紫外吸收强度随探针L和Fe3+摩尔比的变化而变化(如图3)。当Fe3+的摩尔分数为0.5时,探针L和Fe3+的络合物在362 nm处出现最大的紫外吸收强度,表明探针L与Fe3+为1∶1络合。
紫外滴定实验结果显示,空白探针L(10 μmol/L)在423 nm处出现最大吸收峰,随着Fe3+的加入,在362 nm处出现1个新的吸收峰,且其吸收强度随着Fe3+浓度的增加而增大,直至 Fe3+的浓度达到10 μmol/L后,362 nm处的吸收强度不再变化,进一步证实了Fe3+与探针L的络合比为1∶1。
2.4 结合常数及检出限
确定探针L与Fe3+络合模式属于1∶1模型之后,按照Benesi-Hildebrand公式[27]:1/(A-Amin)=1/{K(Amax-Amin)[Fe3+]}+1/(Amax-Amin),计算得到探针L与Fe3+的结合常数,式中,K为探针L与Fe3+的结合常数,Amin代表空白探针L溶液的紫外吸收强度,Amax为在探针L溶液中加入过量Fe3+所产生的最大紫外吸收强度,A代表加入Fe3+后溶液的紫外吸收强度。以1/[Fe3+]为横坐标,1/(A-A0)为纵坐标作图,得到拟合曲线方程为y=1.831×10-5x-19.95,r2=0.992 9,其线性关系较好。根据该直线方程,并结合Benesi-Hildebrand公式,得到探针L与Fe3+的结合常数K=1.089×106L/mol,表明二甲基姜黄素对Fe3+有着较强的络合能力。
探针L对不同浓度Fe3+的响应结果显示,在5.5×10-6~3×10-5mol/L浓度范围内,探针L紫外吸收强度的增强(y)与Fe3+浓度(x,mol/L)呈良好的线性关系,线性方程为y=6 774.4x+ 0.145(r2=0.997 8)。以3σ(3倍空白的标准偏差)计算检出限[28],得到该探针L对Fe3+的LOD为2.2×10-6mol/L,表明探针L对Fe3+的识别作用具有较高的灵敏度。
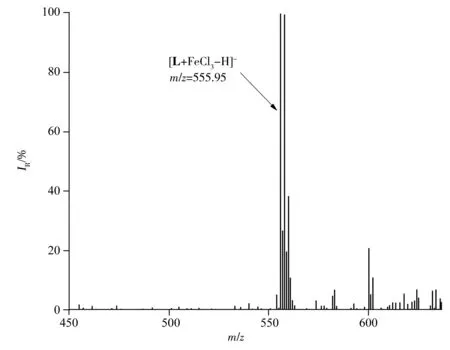
图4 探针L和Fe3+配合物的质谱图(ESI-MS,负离子扫描)Fig.4 MS spectrum of complex of probe L with Fe3+(ESI-MS,negative scan)
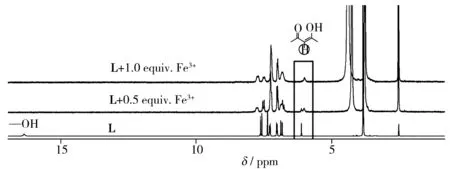
图5 核磁滴定图谱(DMSO-d6/D2O)Fig.5 1H NMR titration spectra in DMSO-d6/D2O
2.5 识别机理研究
由于探针L的晶体结构中所有的非氢原子位于同一平面上,且由于分子内氢键作用,L主要以烯醇式的结构存在,说明L在对Fe3+识别过程中以烯醇式与Fe3+相互作用;此外,L与Fe3+形成的配合物的质谱图中,基峰m/z=555.95(100%),对应[L+FeCl3-H]-的峰(图4),证实探针L失去烯醇结构中羟基上的质子后与FeCl3以1∶1的计量比形成稳定的络合物。
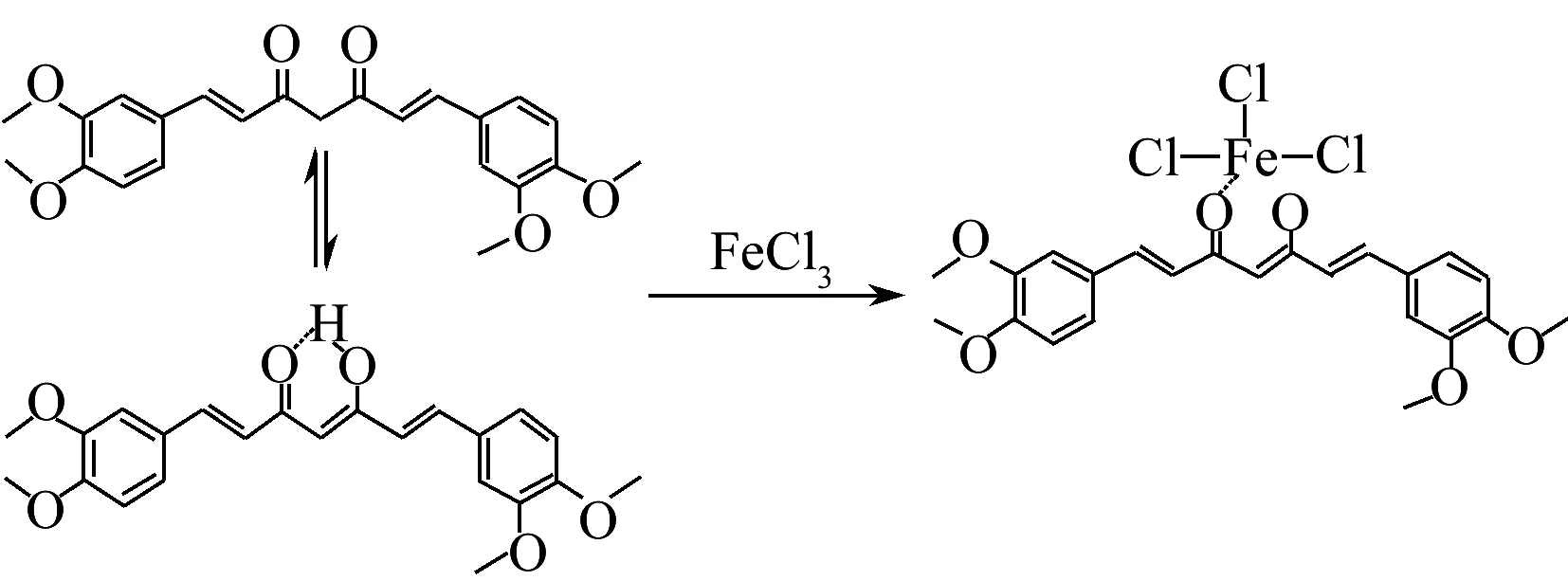
图6 探针L对Fe3+的识别过程与结合模型Fig.6 Recognition process and complex model for the probe L toward Fe3+
3 结 论
本文以姜黄素和碘甲烷为原料合成了低毒的药物分子二甲基姜黄素L,并以此作为Fe3+检测的分子探针。研究结果表明,L在甲醇-水溶液(9∶1,Tris-HCl缓冲溶液,pH 7.2)中对Fe3+具有较好的选择识别性能、抗干扰能力和灵敏度。紫外滴定和质谱分析结果确证探针L与Fe3+形成了1∶1配合物,结合常数为K=1.089×106L/ mol。在Fe3+浓度为5.5×10-6~3×10-5mol/L范围内,该识别体系具有较好的线性关系,可定量检出Fe3+的浓度。通过对探针L的晶体结构、配合物的质谱及核磁滴定研究,提出了探针L与Fe3+的结合模型和识别机理,为其在生物体内的潜在应用提供了参考依据。
[1] Theil E C.Curr.Opin.Chem.Biol.,2011,15:304-311.
[2] Weinstein D A,Roy C N,Fleming M D,Loda M F,Wolfsdorf J I,Andrews N C.Blood,2002,100:3776-3781.
[3] Huang X.Mutat.Res.,2003,533:153-171.
[4] Duvigneau J C,Piskernik C,Haindl S,Kloesch B,Hartl R T,Hüttemann M,Lee I,Ebel T,Moldzio R,Gemeiner M,Redl H,Kozlov A V.Lab.Invest.,2008,88:70-77.
[5] Huang L S,Lin K C.Spectrochim.ActaB,2001,56:123 - 128.
[6] Bobrowski A,Nowak K,Zarebski J.Anal.Bioanal.Chem.,2005,382:1691 - 1697.
[7] She M Y,Yang Z,Yin B,Zhang J,Gu J,Yin W T,Li J L,Zhao G F,Shi Z.DyesPigments,2012,92:1337-1343.
[8] Qin Y A,Zhang X,Liu S Y,Sun M M.J.Instrum.Anal.(秦元安,张献,刘叔尧,孙明明.分析测试学报),2015,34(10):1158-1162.
[9] Jung H J,Singh N,Jang D O.TetrahedronLett.,2008,49:2960-2964.
[10] Kaya E N,Yuksel F,Özpnar G A,Bulut M,Durmus M.Sens.ActuatorB,2014,194:377-388.
[11] Subhasri A,Anbuselvan C.Anal.Methods,2014,6:5596 - 5609.
[12] Shen X,Yan B.J.Mater.Chem.C,2015,3:7038 - 7044.
[13] Kim H M,Yang P R,Seo M S,Yi J S,Hong J H,Jeon S J,Ko Y G,Lee K J,Cho B R.J.Org.Chem.,2007,72:2088 - 2096.
[14] Jiang T,Wang L,Zhang S,Sun P C,Ding C F,Chu Y Q,Zhou P.J.Mol.Struct.,2011,1004:163 - 173.
[15] Zhou S S,Xue X,Jiang B,Lu C H,Tian Y P,Jiang M H.ActaChim.Sin.(周双生,薛璇,姜波,鲁传华,田玉鹏,蒋明华.化学学报),2011,69(19):2335 - 2340.
[16] Jiang B,Wei D,Fan J L,Wang J F,Zhou S S.Chin.J.Synth.Chem.(姜波,魏冬,范九良,汪佳凤,周双生.合成化学),2012,20(4):430 - 433.
[17] John V D,Krishnankutty K.Transit.MetalChem.,2005,30:229 - 233.
[18] Sagnou M,Benaki D,Triantis C,Tsotakos T,Psycharis V,Raptopoulou C P,Pirmettis I,Papadopoulos M,Pelecanou M.Inorg.Chem.,2011,50:1295 - 1303.
[19] Chittigori J,Kumar A,Li L,Thota S,Kokil A,Samuelson L A,Sandman D J,Kumar J.Tetrahedron,2014,70:991 - 995.
[20] Pfeiffer E,Hoehle S I,Walch S G,Riess A,Sólyom A M,Metzler M.J.Agric.FoodChem.,2007,55:538-554.
[21] Yamashita S,Lai K P,Chuang K L,Xu D F,Miyamoto H,Tochigi T,Pang S T,Li L,Arai Y,Kung H J,Yeh S,Chang C.Neoplasia,2012,14:74-83.
[22] Sagnoua M,Mitsopoulou K P,Koliopoulos G,Pelecanou M,Couladouros E A,Michaelakis A.ActaTrop.,2012,123:190-195.
[23] Zhang P,Zhang Y M,Lin Q,Yao H,Wei T B.Chin.J.Org.Chem.(张鹏,张有明,林奇,姚虹,魏太保.有机化学),2014,34:1300 - 1321.
[24] Dakhel A A,Cassidy S,Jasim K E,Henari F Z.Microelectron.Reliab.,2015,55:367 - 373.
[25] Wang Y J,Pan M H,Cheng A L,Lin L I,Ho Y S,Hsieh C Y,Lin J K.J.Pharm.Biomed.,1997,15:1867 - 1876.
[26] Yuan P,Xia Z N,Liu Y.J.Instrum.Anal.(袁佩,夏之宁,刘勇.分析测试学报),2001,20(1):80-83.
[27] Meng W F,Yang M P,Li B,Cheng Z,Yang B Q.Tetrahedron,2014,70:8577-8581.
[28] Luo D C,Luo Z.J.Instrum.Anal.(罗道成,罗铸.分析测试学报),2015,34(10):1191-1194.
Study on Selective Recognition of Di-O-methylcurcumin toward Fe3+Ion
LI Zheng-yi1,YAN Jin-bei1,YIN Yue1,XU De-feng2,SUN Xiao-qiang1*
(1.Institute of Petrochemical Engineering,Changzhou University,Changzhou 213164,China;2.School of Pharmaceutical Engineering & Life Science,Changzhou University,Changzhou 213164,China)
The di-O-methylcurcumin L as a molecular probe was directly synthesized by using curcumin and iodomethane.The title compound was characterized by X-ray single-crystal diffraction,1H NMR,13C NMR and ESI-MS.The crystal structure of the compound belongs to monoclinic system with a space group of C2/c.The cell parameters were as follows:a=22.317(6) nm,b=8.703 8(19) nm,c=23.039(5) nm,β=93.378(10) °,V=4 467.4(18) nm3,Z=4,Dc=1.206 g·cm-3,F(000)=1 720,μ(MoKα)=0.088 mm-1,R=0.080 9,ωR=0.216 3.The probe L exhibited a selective and sensitive absorption response toward Fe3+over a wide range of metal ions in ethanol-water solution(9∶1,Tris-HCl buffer,pH 7.2).The results of ultraviolet titration and mass spectrometry showed that the probe L and Fe3+formed a 1∶1 complex,and the association constantKwas determined to be 1.089×106L/mol.The mothod showed good linearity(r2= 0.997 8) for Fe3+concontration in the range of 5.5×10-6- 3×10-5mol/L with a limit of detection of 2.2×10-6mol/L.
di-O-methylcurcumin;molecular probe;Fe3+ion;recognition;ultraviolet spectra
2016-03-26;
2016-04-29
国家自然科学基金资助项目(21572026,21002009);江苏省高校自然科学研究重大项目(14KJA150002)
10.3969/j.issn.1004-4957.2016.10.015
O657.32;O614.81
A
1004-4957(2016)10-1306-05
*通讯作者:孙小强,博士,教授,研究方向:超分子化学,Tel:0519-86330257,E-mail:sunxiaoqiang@yahoo.com

