紫芝菌丝体多糖提取工艺的优化
张 婷,何平伟,闵 甜,吴 晖,赖富饶
(华南理工大学轻工与食品学院,广东广州 510640)
紫芝菌丝体多糖提取工艺的优化
张 婷,何平伟,闵 甜,吴 晖*,赖富饶*
(华南理工大学轻工与食品学院,广东广州 510640)
[目的]优化紫芝菌丝体多糖的提取工艺,提高紫芝菌丝体多糖的得率。[方法]以紫芝菌丝体为原料,以多糖得率为考察指标,首先对紫芝菌丝体多糖的提取温度、料液比、提取时间、pH、提取次数单因素进行优化,然后采用L9(34)正交试验探索最佳提取工艺。[结果]在料液比1∶30 g/mL,温度90 ℃,浸提时间4 h,溶液pH 7的条件下,紫芝菌丝体多糖得率最佳,为9.56%。[结论]该研究可为紫芝菌丝体多糖的工业生产提供有利的条件,为紫芝菌丝体多糖的进一步开发利用提供依据。
灵芝菌丝体;多糖;提取;工艺优化
灵芝(Ganodermalucidum)属担子菌纲多孔菌目多孔菌科灵芝属。我国灵芝属真菌多达75种,以赤芝、紫芝、黑芝、松杉灵芝等为常见。现代科学证明,灵芝作为我国传统的名贵菌类药材有广泛的药理作用和多种保健价值,目前从灵芝中分离出来的成分超过150种,其主要的生理活性物质为多糖类、三萜类、油脂类、蛋白类、生物碱类、甾醇类等[1-3]。
灵芝按其生长过程可分为菌丝体、子实体和孢子体3个阶段。作为灵芝的主要活性物质之一,灵芝多糖具有抗肿瘤[4-5]、免疫调节[3,6]、抗氧化、抗衰老[7-9]及降血糖血脂[10]等功效,因此灵芝多糖类产品备受人们青睐。目前的研究主要集中在灵芝子实体和孢子体提取物中,而对于灵芝菌丝体多糖的研究主要包括发酵优化、发酵液中提取物质、结构分析和活性检测等方面。为了高效地获取灵芝多糖,科研工作者们先后采用超声波、超声波酶法、脉冲超声法、微波法等对灵芝多糖的提取技术进行了探究[11-16]。虽然先进的技术大大提高了多糖的得率,具有能耗低、效率高的特点,但是有些多糖结构被破坏,其生理活性被降低。因此,笔者对传统经典热水浸提多糖的工艺进行进一步探究,寻找灵芝菌丝体最佳的热水提取工艺,从而为灵芝多糖的研究提供参考依据。
1 材料与方法
1.1 材料 原料及主要试剂:紫芝菌丝体,东莞市氏农业有限公司;氢氧化钠、乙醇、苯酚、硫酸、葡萄糖、蒸馏水,均为分析纯。主要仪器:UV2300紫外分光光度计,上海棱光技术有限公司;PHS-3C型精密pH计,上海雷磁技术有限公司;RE-2000A旋转蒸发器,上海亚荣生化仪器厂;JW-1016低速离心机,安徽嘉文仪器装备有限公司;JC101型不锈钢鼓风干燥箱,上海福玛实验设备有限公司;FA2204B电子天平,广州市授科仪器科技有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限责任公司;KQ-250DE型数控超声波清洗器,昆山市超声仪器有限公司。
1.2 方法
1.2.1 多糖提取的工艺流程。紫芝菌丝体→粉碎、过筛(80目)→80%乙醇预处理→抽滤干燥→热水浸提→离心取上清→定容测多糖得率。
1.2.2 多糖含量的测定。采用苯酚-硫酸法测定试样中总糖的含量[17],3,5-二硝基水杨酸比色法测还原糖含量[18]。
1.2.3 多糖含量和得率的计算。多糖百分含量(%)=(总糖-还原糖)×0.9,其中0.9是多糖的换算系数;菌丝体多糖得率(%)=灵芝多糖提取量/灵芝菌丝体质量×100%。
1.2.4 数据统计分析。所有试验重复3次,采用SPSS软件对数据进行统计分析。
2 结果与分析
2.1 提取温度对粗多糖得率的影响 分别取2 g处理过的紫芝菌丝体粉末,按料液比为1∶30 g/mL加入蒸馏水,调pH为7,分别在75、80、85、90、95 ℃提取3 h,提取1次,离心取上清液定容测定总糖的含量,计算出多糖得率。
图1表明,提取温度对多糖得率的影响比较明显,随着温度的升高,多糖得率呈先升高后降低的趋势,当提取温度为85 ℃时,多糖得率最高为9.04%,当提取温度再增加时,提取率下降。因为当温度过高时,造成部分多糖分解为低聚糖,导致得率下降,故选提取温度为85 ℃。

图1 提取温度对紫芝菌丝体多糖得率的影响Fig.1 Effects of extraction temperature on the extraction rate of mycelia polysaccharides from G. sinensis
2.2 料液比对粗多糖得率的影响 分别取2 g处理过的紫芝菌丝体粉末,按料液比1∶20、1∶25、1∶30、1∶35、1∶40 g/mL加入蒸馏水,调pH为7,在最佳提取温度85 ℃下提取3 h,提取1次,离心取上清液定容测定总糖的含量,计算出多糖得率。
图2表明,料液比对多糖得率的影响较小,只是随料液比的变化有轻微的变化,先呈升高趋势,后接近不变。考虑到随着溶剂的增加,提取过程及后续工艺中的提取液的浓缩等,成本会增加,故选取料液比为1∶30 g/mL。
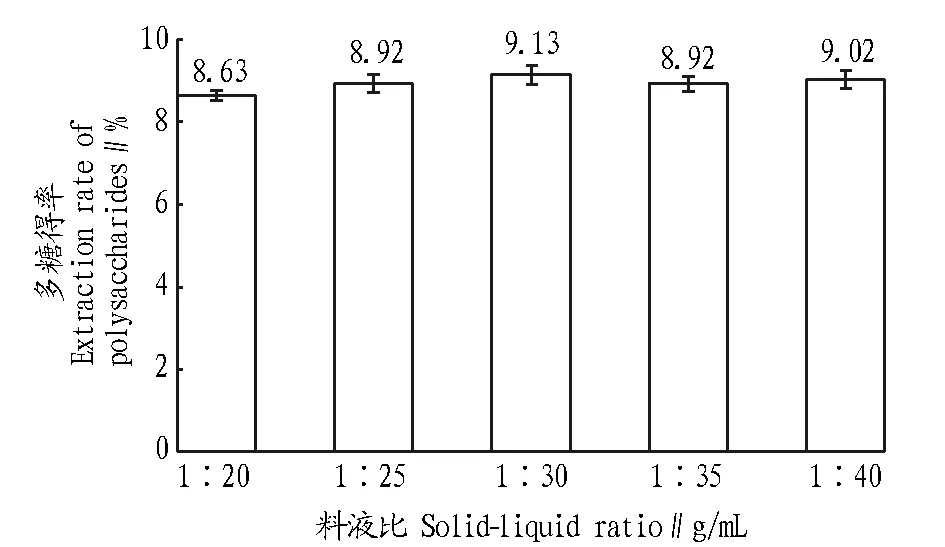
图2 料液比对紫芝菌丝体多糖得率的影响Fig.2 Effects of solid-liquid ratio on the extraction rate of mycelia polysaccharides from G. sinensis
2.3 提取时间对粗多糖得率的影响 分别取2 g处理过的紫芝菌丝体粉末,按最佳料液比为1∶30 g/mL加入蒸馏水,调pH为7,在最佳提取温度85 ℃下提取2.0、2.5、3.0、3.5、4.0 h提取1次,离心取上清液定容测定总糖的含量,计算出多糖得率。
图3表明,提取时间对多糖得率有较大的影响,提取时间越长越有利于多糖的溶出,3.0 h得率达到最大值,超过3.0 h得率有明显下降。说明多糖中有一部分的热稳性不佳,加热时间过长使其被破坏或降解,降低多糖的得率。故选用3.0 h为最佳提取时间。

图3 提取时间对紫芝菌丝体多糖得率的影响Fig.3 Effects of extraction time on the extraction rate of mycelia polysaccharides from G. sinensis
2.4 pH对粗多糖得率的影响 分别取2 g乙醇处理过的紫芝菌丝体粉末,按最佳料液比1∶30 g/mL加入蒸馏水,分别调pH为6、7、8、9、10在最佳提取温度85 ℃下提取3 h,提取1次,离心取上清液测定总糖的含量,计算出多糖得率。
图4表明,多糖得率随着pH的升高呈先升高后降低的趋势,在pH为7时多糖得率达到最高,为8.57%,当pH超过7时,多糖提取率逐渐下降。由此可知,该多糖大多为中性多糖,故提取pH选7。
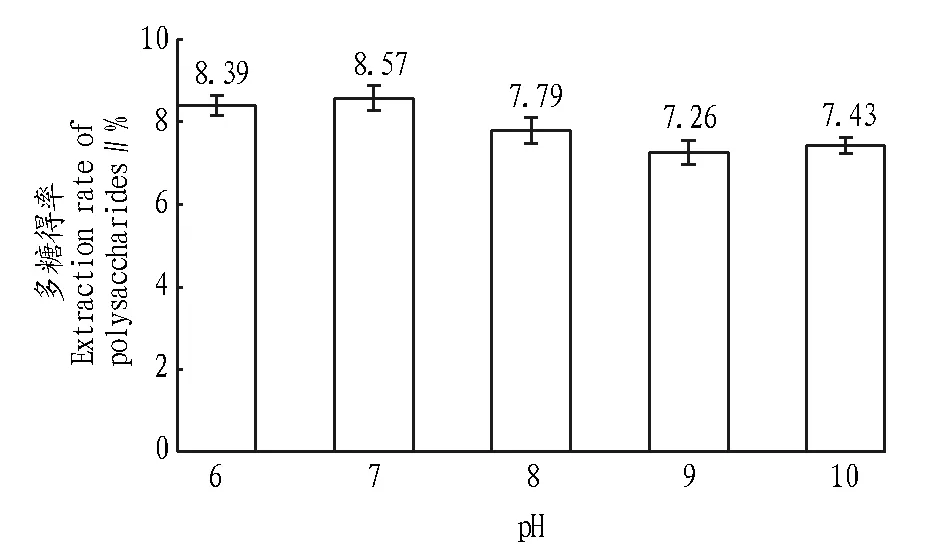
图4 pH对紫芝菌丝体多糖得率的影响Fig.4 Effects of pH on the extraction rate of mycelia polysaccharides from G. sinensis
2.5 提取次数对粗多糖得率的影响 分别取2 g乙醇处理过的紫芝菌丝体粉末,按最佳料液比1∶30 g/mL加入蒸馏水,调pH为7,最佳提取温度85 ℃下提取3.0 h,提取1次,离心取上清液定容测定总糖的含量,残渣按上述条件再次浸提,反复2次,计算出多糖得率。
图5表明,在第1次提取之后,残渣中的多糖含量明显下降。从减少能耗方面考虑,灵芝菌丝体多糖提取1次即可。
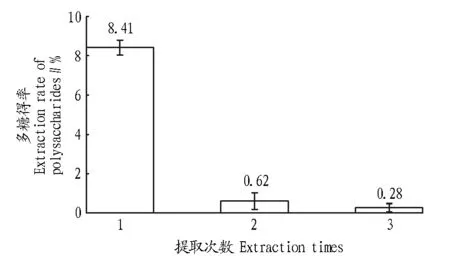
图5 提取次数对紫芝菌丝体多糖得率的影响Fig.5 Effects of extraction times on the on the extraction rate of mycelia polysaccharides from G. sinensis
2.6 最佳条件的确定 在单因素试验的基础上,对紫芝菌丝体多糖的提取工艺条件进行优化,选用L9(34)正交试验,选取提取时间(A)、料液比(B)、提取温度(C)和pH(D)4个因素,每个因素均选取3个水平,具体设计见表1,按照试验方法,测出总糖的含量,计算出多糖得率,结果见表2。
表2极差分析表明,对灵芝菌丝体多糖得率的影响因素从大到小依次为提取温度(C)、提取时间(A)、 pH(D)、料液比(B)。方差分析得出:F模型=40.886**,F截距=17 308.962**,FA=43.207**,FB=6.703**,FC=54.951**,FD=58.681**。表明提取时间(A)、料液比(B)、提取温度(C)、pH(D)4个因素对紫芝菌丝体多糖得率的影响均极显著。为了提高紫芝菌丝体多糖得率,最佳组合为A3B2C3D2,即提取温度90 ℃、提取对间4 h、料液比1∶30 g/mL、pH 7为最佳提取工艺条件。该组合没有出现在正交试验的9个组合中,验证试验表明,在该条件下紫芝菌丝体多糖得率为高达9.56%。
表1 热水提取多糖正交试验设计L9(34)
Table 1 The L9(34)orthogonal design for hot water extraction of polysaccharides

水平Level因素Factor提取时间(A)Extractiontime∥h料液比(B)Solid-liquidratio∥g/mL提取温度(C)Extractiontemperature∥℃pH(D)121∶20806231∶30857341∶40908
表2 不同提取因素对多糖提取率的影响
Table 2 Effects of different extraction factors on the extraction rate of polysaccharides

试验号Testcode因素FactorABCD多糖得率Extractionrateofpolysaccharides∥%1111121.382122223.553133323.324212316.255223124.006231223.657313227.918321322.009332122.48k17.587.287.457.54k27.107.736.927.69k38.047.728.366.84R2.831.334.322.55
3 结论与讨论
通过单因素试验,得出最佳的单因素条件分别为提取温度85 ℃,料液比1∶30 g/mL,浸提时间3 h,提取pH 7,提取次数1次。在最佳单因素的基础上,通过L9(34)正交试验,可知影响多糖得率的4个因素的主次序依次为提取温度(C)、提取时间(A)、pH(D)、料液比(B),确定了灵芝菌丝体多糖热水浸提的最佳工艺为提取温度90 ℃,提取对间4 h,料液比1∶30 g/mL,pH 7,按此工艺提取灵芝菌丝体多糖的得率较高,达到9.56%。该试验优化了紫芝菌丝体多糖的提取工艺,大大提高了多糖的得率,为其大规模工业生产和进一步开发利用提供了依据。
[1] 卢振,陈金和,王雨来,等.灵芝的研究及应用进展[J].时珍国医国药,2003,14(9):577-580.
[2] 志彬.灵芝研究与开发的历史、现状和未来[R].灵芝专题会,2004:2-3.
[3] 郝瑞芳,李荣春.灵芝多糖的药理和保健作用及应用前景[J].食用菌学报,2004,11(4):57-62.
[4] MA C W,FENG M Y,ZHAI X F,et al.Optimization for the extraction of polysaccharides fromGanodermalucidumand their antioxidant and antiproliferative activities[J].J Taiwan Inst Chem E,2013,44(6):886-894.
[5] PAN K,JIANG Q G,LIU G Q,et al.Optimization extraction ofGanodermalucidumpolysaccharides and its immunity and antioxidant activities[J].Int J Biol Macromol,2013,55(1):301-306.
[6] CHEN T Q,WU Y B,WU J G,et al.Efficient extraction technology of antioxidant crude polysaccharides fromGanodermalucidum(Lingzhi),ultrasonic-circulating extraction integrating with superfine-pulverization[J].J Taiwan Inst Chem E,2014,45(1):57-62.
[7] PAN K,JIANG Q G,LIU G Q,et al.Optimization extraction ofGanodermalucidumpolysaccharides and its immunity and antioxidant activities[J].International journal of biological macromolecules,2013,55(2):301-306.
[8] CHEN X,HU Z P,YANG X X,et a1.Monitoring ofimmune responsesto a herbal immuno-modulator in patients with advanced coloreetal cancer[J].Int Immunophamlacol,2006,6(3/4):499-508.
[9] 于海洋,弥春霞,吴薇,等.灵芝多糖提取方式比较及多糖应用研究进展[J].安徽农业科学,2014,42(8):2318-2319.
[10] ZHAO L Y,DONG Y H,CHEN G T,et al.Extraction,purification,characterization and antitumor activity of polysaccharides fromGanodermalucidum[J].Carbohydrate Polymers,2010,80:783-789.
[11] 王锋,罗丽兰,张秀清.灵芝多糖的超声辅助碱提工艺优化[J].中国酿造,2015,34(7):129-133.
[12] 林忠宁,何友建,陆烝,等.响应面分析法优选灵芝超声波提取工艺的研究[J].中国食品学报,2012,12(7):97-104.
[13] 陈乃东,陈琼,何健.正交试验优选灵芝多糖的提取工艺[J].安徽农业科学,2013,41(19):8146-8148.
[14] 游丽君,冯梦莹,刘钧发,等.不同提取方法对灵芝多糖性质的影响研究[J].现代食品科技,2013,29(6):1207-1212.
[15] 吕兴萍,杨薇红,马春娇.响应面优化酶法提取灵芝多糖工艺条件[J].江苏农业科学,2014,42(6):258-260.
[16] 黄生权.赤灵芝多糖的提取分离、结构分析与生物活性研究[D].广州:华南理工大学,2010.
[17] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances [J].Analytical chemistry,1956,28(3):350-356.
[18] REESE E T,MANDELS M.Methods in carbohydrate chemistry [M].New York:Academic Press,1963:139.
Optimization of Extraction Technique for Mycelia Polysaccharides fromGanodermasinensis
ZHANG Ting, HE Ping-wei, MIN Tian, WU Hui*, LAI Fu-rao*
(College of Food Science and Engineering, South China University of Technology, Guangzhou, Guangdong 510640)
[Objective] To optimize the extraction technology for mycelia polysaccharides fromGanodermasinensis, and to enhance the extraction rate of mycelia polysaccharides. [Method] WithG.sinensismycelia as the raw materials, we optimized the extraction temperature, solid-liquid ratio, time, pH and extraction times for the extraction of polysaccharides, with the extraction rate of polysaccharides as the investigation index. Then, the optimal extraction technology was researched by L9(34) orthogonal test. [Result] Under the conditions of 1∶30 g/mL solid-liquid ratio, 90 ℃ extraction temperature, 4 h extraction time pH 7 and adding NaOH, the extraction rate of polysaccharides fromG.sinensismycelia was the optimal, which was 9.56%. [Conclusion] This research provides favorable conditions for the industrial production of mycelia polysaccharides fromG.sinensis, and offers experimental basis for the further development and utilization of mycelia polysaccharides fromG.sinensis.
Ganodermalucidummycelia; Polysaccharides; Extraction; Technology optimization
广东省高等学校科技创新重点项目(2012CXZD0009);国家自然科学基金项目(31201330);广州市科技攻关项目(201300000202)。
张婷(1989- ),女,河南兰考人,硕士研究生,研究方向:食品质量与安全。*共同通讯作者:吴晖,教授,博士,从事天然产物提取研究;赖富饶,讲师,博士,从事天然产物提取研究。
2016-08-11
S 567.3
A
0517-6611(2016)29-0063-03

