纳米/微米一水草酸钙、二水草酸钙对牛血清白蛋白的吸附性能
温小玲 欧阳健明(暨南大学生物矿化与结石病防治研究所;暨南大学化学系,广州510632)
纳米/微米一水草酸钙、二水草酸钙对牛血清白蛋白的吸附性能
温小玲欧阳健明*
(暨南大学生物矿化与结石病防治研究所;暨南大学化学系,广州510632)
研究了牛血清白蛋白(BSA)在尺寸分别为100 nm、3 μm的一水草酸钙(COM)和二水草酸钙(COD)晶体上的吸附等温线及晶体ζ电位随BSA浓度(cBSA)的变化。结果表明,4种晶体对BSA的最大吸附量顺序为COD-100 nm>COM-100 nm≥COD-3 μm>COM-3 μm,即吸附量与晶体的比表面积成正相关。而比表面积归一化后,吸附量顺序为COD-3 μm>COM-3 μm>COM-100 nm>COD-100 nm,说明COM和COD晶体的结晶水数量和晶面电荷密度影响了BSA的吸附。吸附等温线都很好地拟合了Langmuir模型,表明BSA在纳米/微米COM、COD晶体上的吸附属于单分子层吸附。COM和COD等电点大小顺序为COM-100 nm(7.2)>COD-100 nm(6.7)≥COM-3 μm(4.7)>COD-3μm(4.3),因此在病生理条件下(pH≈6.3)纳米级晶体的团聚比微米级晶体的更严重。纳米级和微米级晶体对BSA的最大吸附量都在BSA等电点附近(pH=4.8)。BSA在纳米/微米COM和COD晶体上的吸附与晶体的比表面积、晶面电荷、团聚、结晶水数量和pH值有关。本文结果有助于阐明尿液中不同性质微晶与尿蛋白质对草酸钙结石形成的影响。
纳米;微米;草酸钙;牛血清白蛋白;吸附等温线;等电点;pH值
0 前言
尿液中存在许多结石抑制因子,如蛋白质和葡胺聚糖等,这些物质可以吸附到草酸钙晶体表面,封闭晶体表面的生长、聚集位点,从而发挥其抑制作用。白蛋白是尿液中最丰富的蛋白之一,能降低草酸钙的饱和程度,抑制大尺寸晶体形成和聚集;同时,白蛋白能够促进二水草酸钙(COD)晶体形成,并抑制一水草酸钙(COM)的生长,这有利于抑制CaOx结石的形成[1]。Liu等[2]发现牛血清白蛋白不仅能促进COD的形成,还能抑制COM的成核。白蛋白还可以通过吸附到COM表面螺旋位错的台阶,从而抑制晶体的生长[3]。Grohe等[4]发现带负电的弱亲水白蛋白可以吸附到尿微晶上,并通过静电斥力抑制尿微晶的团聚和吸附到肾上皮细胞,这种情况使得晶体更容易被冲出肾小管。可见白蛋白对抑制尿结石的形成有很重要的作用。
之前的报道注重研究白蛋白对草酸钙晶体聚集、成核和生长的影响以及蛋白对草酸钙晶体不同晶面的选择性吸附差异。例如,Farmanesh等[3]通过荧光标记硫酸软骨素、白蛋白和转铁蛋白,发现这些大分子结合在COM的不同的结晶面,导致晶体的形态改变。Grohe等[5]利用共聚焦显微镜研究了磷酸化多肽与COM晶体的吸附,发现荧光主要出现在COM的(100)晶面,说明这些多肽优先吸附在COM的(100)晶面。Taller等[6]将骨桥蛋白(OPN)先用荧光染料标记,再用激光扫描共聚焦显微镜研究这些OPN对COM的特异性吸附,发现OPN主要吸附在(100)和(121)晶面的边缘,原因之一是这些边缘的吸附位点有较高表面能。
虽然这些文献报道了尿液蛋白对草酸钙晶体形貌、晶相的影响以及对晶面的选择性吸附,但尿液中的蛋白质在不同尺寸、不同晶相的草酸钙晶体的吸附性质的差异至今未有研究。我们前期的研究表明尿液中存在纳米和微米尺寸的COM和COD晶体[7-9],这些尺寸和晶相不同的草酸钙晶体具有不同的比表面积、不同的ζ电位和不同的聚集状态。基于此,本文研究了尿蛋白在纳米、微米COM和COD晶体上的吸附差异,研究了这些晶体的性质(如晶体尺寸、聚集程度、ζ电位、比表面积、晶相等)对蛋白吸附的影响,这有助于阐明尿液中存在的蛋白质和尿微晶性质差异对草酸钙结石形成的影响。
1实验材料与方法
1.1试剂与仪器
PBS磷酸盐缓冲溶液(北京索莱宝科技有限公司),牛血清白蛋白(BSA,Roche,Shanghai,China)。
Varian Cary 500型紫外可见分光光度计(美国Varian公司)。Zetasizer Nano-ZS型纳米粒度仪-Zeta电位分析仪(英国Malvem公司)。数字酸度计(PHS-3C,郑州宝晶电子科技有限公司)。
1.2纳米/微米COM、COD晶体的合成方法
参照前文[10]合成尺寸分别约为100 nm和3 μm的COM、COD晶体,并分别用COM-100nm、COD-100nm、COM-3μm、COD-3μm表示。XRD和FTIR表明合成的晶体为纯的目标产物。各晶体的比表面(SBET)和孔容通过全自动比表面积及孔隙度分析仪(Tristar 3000,Micromeritics,USA)得到。以He作为载气,N2为被吸附气体。仪器对记录数据分别采用BET方程(Brunauer-Emmett-Teller)和BJH(Barrett-Joyner-Halenda)方法处理,得到晶体的比表面积和孔容值。
1.3ζ电位测定方法
参照文献[11]的方法测量不同pH值下BSA和草酸钙的ζ电位,通过不同pH值下的ζ电位得到晶体和BSA的等电点。
(1)取12个小烧杯,分别加入50 mg COM或COD晶体,加入20 mL的蒸馏水溶解,用10 μL微量注射器滴加浓度为0.25 mol·L-1的HCl或NaOH调节pH值分别至3.5、4、4.5、5、5.5、6、6.5、7、7.5、8和9,摇匀后,取约1 mL悬浮液加入电位池中,测量对应的ζ电位;
(2)同上面方法,将晶体替换为0.5 mg·mL-1BSA溶液,测量不同pH值下BSA的ζ电位。
ζ电位的测量是通过测定体系的电泳迁移率,运用Smoluchowski方程计算出ζ电位,Smoluchowski方程如下其中UE是电泳迁移率,ε是介电常数,η是粘度。
1.4BSA标准曲线测定
准确称取100 mg BSA固体,用PBS磷酸盐缓冲溶液(pH=7.3±0.1)定容至100 mL,配置成浓度为1 mg·mL-1的BSA标准溶液。于10 mL具塞管中加入不同体积的1 mg·mL-1标准BSA溶液,用PBS定容至10 mL。以PBS溶液为参比,采用分光光度计于280 nm处测定蛋白质溶液的吸光值(A)。以浓度为横坐标,A为纵坐标,获得BSA浓度标准曲线,其线性方程为:y=0.717 1x-0.002 1;R2=0.999 2。
1.5BSA吸附试验方法
准确称取不同质量的BSA固体,用PBS定容至100 mL,配置成浓度(C0)分别为0、2、4、6、8、10、12、15、20、25 mg·mL-1的BSA标准溶液。分别称取10份50 mg草酸钙晶体于25 mL烧杯中,分别加入预先配置好的BSA标准溶液10 mL。超声10 min完全分散后,放入37℃恒温干燥箱中,吸附24 h后取出离心,取上清液适量测定剩余BSA浓度(Ceq),同时测量悬浮液的ζ电位。根据公式计算出晶体对BSA的吸附量(Qads)。以Ceq为横坐标,Qads为纵坐标绘制吸附等温线。
1.6pH值对吸附的影响
分别称取10份50 mg草酸钙晶体于25 mL烧杯中,分别加入初始浓度(C0)为1.0 mg·mL-1的BSA标准溶液15 mL。超声10 min完全分散后,用10 μL微量注射器滴加浓度为0.25 mol·L-1的HCl或NaOH调节pH值分别至3.5、4、4.5、5、5.5、6、6.5、7、7.5和8。放入37℃恒温干燥箱中,吸附24 h后,取出离心,取上清液适量测定剩余BSA浓度(Ceq)。根据公式计算出晶体对BSA的吸附量(Qads)。以pH值为横坐标,Qads为纵坐标绘制吸附曲线。
2 结果与讨论
2.1纳米/微米COM和COD晶体对BSA的吸附
2.1.1吸附等温线
纳米/微米COM和COD晶体对BSA的吸附等温线如图1A所示,BSA的最大吸附量顺序为COD-100 nm>COM-100 nm≥COD-3 μm>COM-3 μm,即:纳米级晶体的吸附量远大于微米级的晶体。这是因为纳米级晶体的比表面积大于微米级晶体,说明BSA的吸附量与晶体的比表面积成正相关。
2.1.2表面积归一化后的吸附等温线
为了排除比表面积的影响,比较相同面积时纳米/微米COM和COD晶体对BSA的吸附量,对平衡吸附量进行晶体的比表面积归一化,得到比表面积归一化的吸附量Qe′(即每平方米晶体面积吸附的BSA质量,Qe′=Qe/SBET),如图1B所示。可以看出,比表面积归一化后,BSA的最大吸附量的顺序为COD-3 μm>COM-3 μm>COM-100 nm>COD-100 nm,即微米级晶体的吸附量大于纳米级的晶体。这与图1A中结果相反,这归因于COM和COD晶体在水溶液中会存在聚集现象。用Dratio代表水溶液中的粒径和单个粒子的直径之比,Dratio值越大代表粒子聚集越严重。在聚合过程中,单个粒子先形成小聚集体,再形成大聚集体。粒子的聚集会导致粒子的间隙关闭(BSA分子无法进入聚集体内部的间隙),因此减少了纳米粒子用来吸附的暴露表面[12]。由表1可知,纳米级晶体的Dratio比微米级的高很多,说明纳米晶体比微米晶体聚集更严重。由于BSA分子无法进入聚集体中的间隙,减少了它们用来吸附的暴露表面,因此比表面积归一化后,纳米级晶体吸附量小于微米级晶体。这种差异说明晶体聚集越严重,吸附量越小。
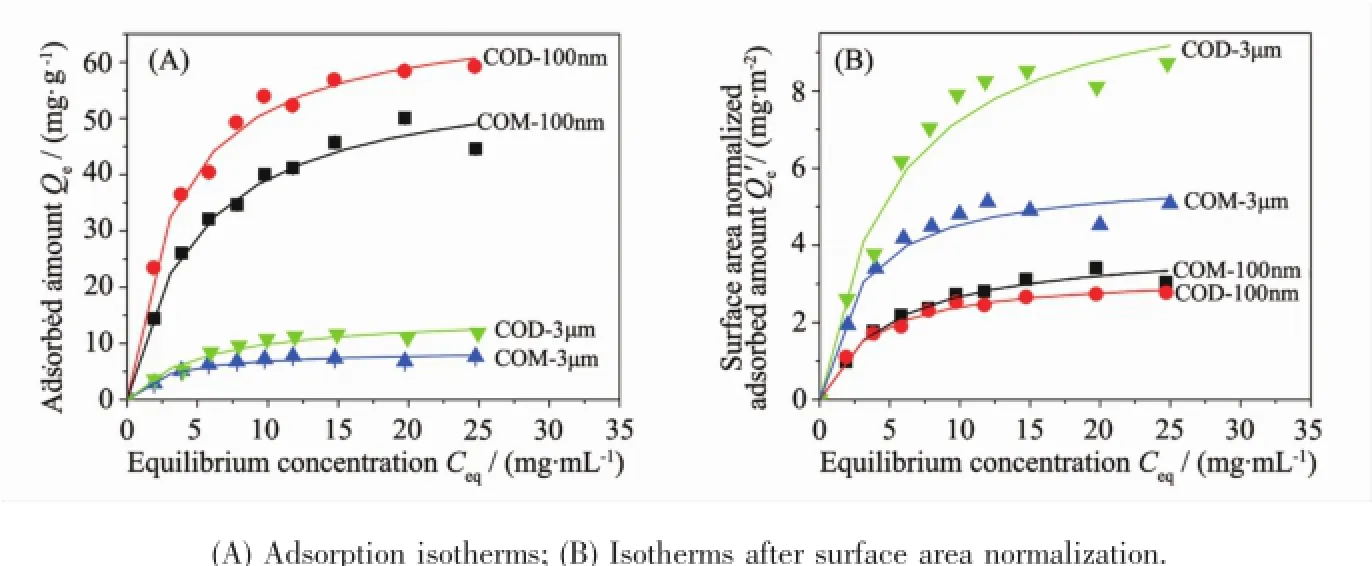
图1 BSA在纳米/微米COM和COD晶体上的吸附等温线Fig.1 Adsorption isotherms of BSA on micron/nano COM and COD

表1纳米/微米COM、COD的性质Table 1 The properties of m icron/nano COM and COD
2.1.3COM与COD吸附量的比较
如图1A所示,对于相同尺寸的晶体,COD的吸附量大于COM,说明晶体的亲水性影响了BSA的吸附。COD比COM多含一个结晶水,水化程度比COM高[13],所以BSA与COD会形成更多的氢键。Walton等[14]报道白蛋白在COD的吸附量大于COM是因为白蛋白对COM晶体的面选择性吸附,主要吸附在COM带正电荷的(101)晶面。而COD是一个对称的双锥体,白蛋白对COD所有的面都有类似的亲和力,这导致COD晶体上用于蛋白吸附的位点比COM晶体多。这说明吸附量不仅与晶体的比表面积有关,还与吸附是否存在氢键作用有极大的关系。
比表面积归一化后,微米级COD的吸附量仍大于COM,但纳米级COM的吸附量会稍高于COD晶体。这是因为COM-100nm的ζ电位接近中性(0.17 mV),导致覆盖在粒子表面的蛋白层密度更高。所以比表面积归一化后,COM的吸附量会稍高于COD晶体。这与Rezwan等[15]的结果一致,BSA分子与氧化物粒子带相同或相反电荷时,都会减小覆盖在粒子表面的BSA密度(即单位面积吸附的BSA质量);只有纳米Al2O3粒子电荷接近中性(-0.114 mV),与BSA所带电荷既不相反也不相同,会增大覆盖在粒子表面的BSA密度。以上结果表明吸附量与晶面电荷有关。
COD对BSA的吸附量大于COM,这一结果与表面活性剂的吸附结果相反,因为不同表面活性剂在COM的吸附量常常大于COD[13,16]。这是因为在pH=7时,BSA与晶体的吸附力主要是氢键作用,COD晶体的水化程度大于COM晶体,因此,BSA与COD会形成更多的氢键,导致COD的吸附量增加。而表面活性剂分子尺寸较小,其与晶体的吸附主要由静电力主导,表面活性剂吸附在晶体表面带电荷的位点(如钙位点和草酸根位点),由于COM表面的这些位点数比COD多[16],所以不同表面活性剂在COM的吸附量大于COD。
2.1.4吸附等温线的拟合结果
吸附模型最常用的是Langmuir模型和Freundlich模型[17]。Langmuir模型假设溶剂吸附可以忽略,吸附质分子(如BSA)以单分子层吸附在吸附剂(如COM、COD)表面的吸附位点,形成凸型吸附等温线。Freundlich模型表示在低浓度下已被吸附的分子(如BSA)又能吸附在液相中的分子(如BSA,其他分子),形成多分子层吸附,为凹型吸附等温线。Langmuir模型的线性方程为[12]为平衡时的吸附量,Ce为平衡时的溶液浓度,Q0为吸附剂饱和吸附量,b是Langmuir等温吸附方程式常数。
图2a和图2c给出了100 nm和3 μm的COM和COD晶体吸附等温线按照Langmuir模型线性拟合的结果,其相关系数在0.982 3~0.996 4范围内。
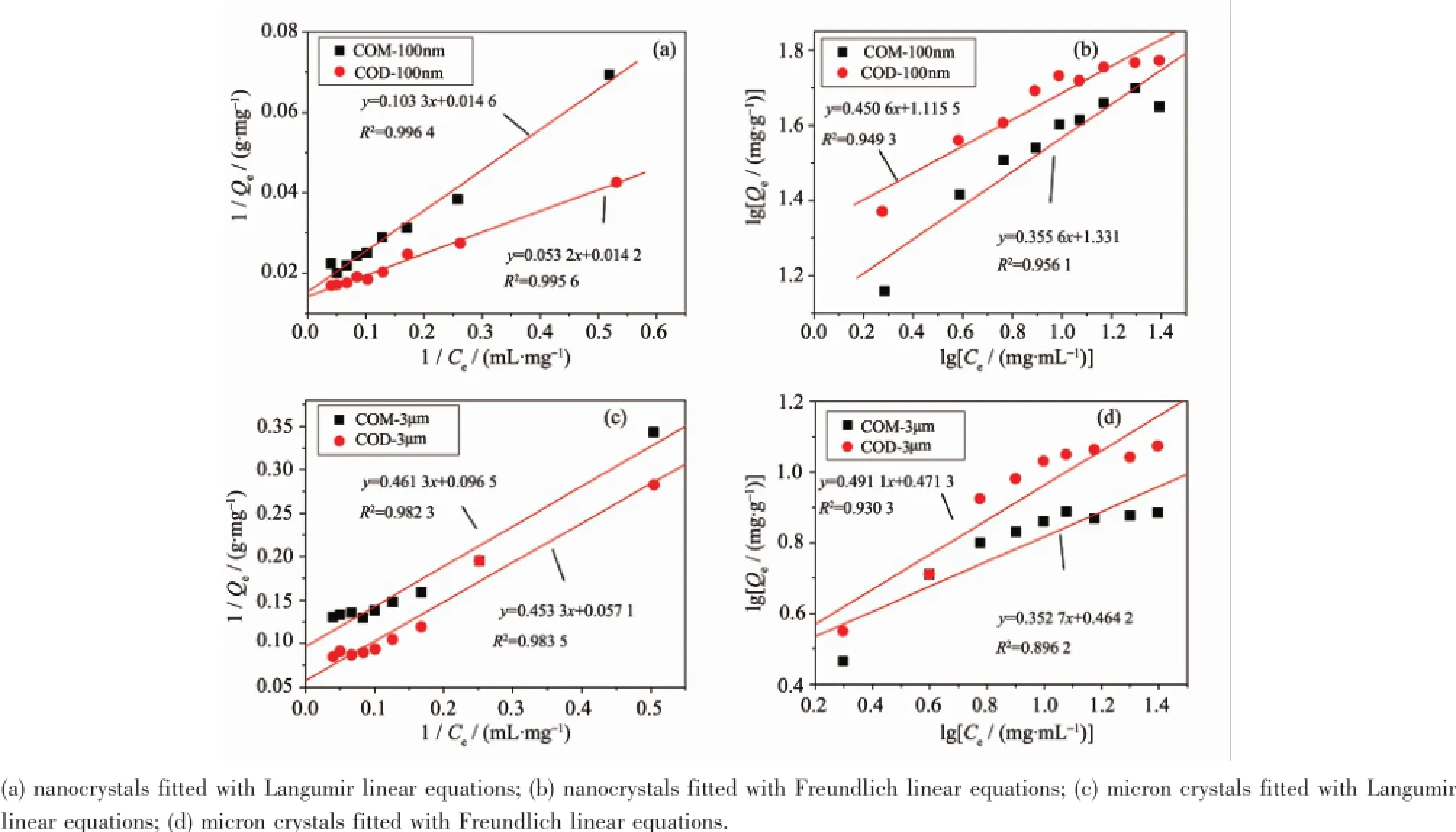
图2纳米/微米COM和COD对BSA吸附等温线的拟合结果Fig.2 Fitting results of adsorption isotherms of BSA on micron/nano COM and COD
可以看出,这4种晶体均很好的拟合了Langmuir模型(图2a,2c),而与Freundlich模型(图2b,2d)差异较大,说明BSA在COM和COD晶体上的吸附属于单分子层吸附。
2.2吸附BSA后的ζ电位
为了将吸附行为和ζ电位联系起来,在测量吸附等温线的相同条件下测量了体系的ζ电位(图3)。随BSA浓度的增加,纳米/微米COM和COD的吸附量增加后(图1),对应的ζ电位变得更负。
BSA含607个氨基酸残基,其等电点为pH= 4.7~4.8[15,19],所以在实验pH=7.3时BSA带负电荷,吸附BSA后会使ζ电位变得更负。图3也进一步验证了晶体对BSA的吸附。
纳米级晶体对BSA的吸附量大于微米级晶体(图1),吸附BSA后纳米级晶体的ζ本应比微米晶体更负。但是从图3可知,吸附后纳米级晶体和微米级晶体的ζ电位相差不大。这与晶体原始的ζ电位和晶体的孔容有关(表1)。微米级COM和COD晶体的原始ζ电位(分别为-6.95和-15.5 mV)比纳米级COM和COD晶体的原始ζ电位(0.17和-2.22 mV)更负,加上纳米级晶体的孔容比微米级晶体的大,所以BSA进入纳米级晶体孔结构的分子数比微米级晶体的多,导致吸附在表面的BSA分子减少。而ζ电位反映的是晶体的表面电荷[20],当晶体表面的BSA分子减少时,其表面电荷也会随着降低。所以吸附后,纳米级晶体和微米级晶体的ζ电位相差不大。

图3纳米/微米COM和COD吸附BSA后的ζ电位Fig.3ζ potential of m icron/nano COM and COD after BSA adsorption
2.3pH值对吸附的影响
2.3.1不同pH值下晶体的荷电情况和对应的吸附量
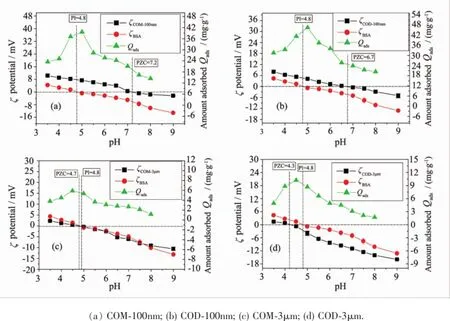
图4 BSA在纳米/微米COM、COD的吸附随平衡pH的变化及晶体和BSA在不同pH值下ζ电位Fig.4 Change of BSA adsorption quantity and Zeta potential of micron/nano COM and COD crystals with equilibrium pH
图4为纳米/微米COM、COD和BSA的ζ电位随pH值的变化及对应4种晶体的BSA吸附量变化,晶体的零ζ电位点(PZCCaOx)和BSA零ζ电位点(PIBSA)如表1所示。COM和COD等电点大小顺序为COM-100 nm(7.2)>COD-100 nm(6.7)≥COM-3 μm (4.7)>COD-3 μm(4.3),纳米级晶体的等电点远大于微米级晶体。草酸钙结石患者的尿液pH值约为6.3[21-22],接近COM-100 nm和COD-100 nm晶体的等电点(分别为7.2和6.7)。在晶体的等电点附近,晶体间的斥力最小,聚集最为严重,因此纳米晶体的聚集较微米晶体严重。研究表明尿微晶通过肾脏的时间只有5~10 min。在滞留时间内,晶体不足以通过成核生长到足够大的尺寸造成肾脏堵塞。晶体的聚集才是导致尿微晶尺寸迅速增大最为重要的一步[23-24],人体尿液pH值升高时会加重纳米级晶体聚集,导致形成结石的几率增加。
2.3.2不同pH值下BSA与晶体的相互作用
蛋白质分子可通过静电作用与荷电表面结合,通过氢键作用与亲水表面结合[25]。COM-100 nm和COD-100 nm的最大吸附量在pH=5,而COM-3 μm和COD-3 μm的最大吸附量在pH=4.5,都在实验测得的BSA的等电点(pH=4.8)附近。Zhang等[26]研究了BSA在4种聚吡咯类吸附剂上的吸附,其最大吸附量在pH=5或4.5处;Alkan等[27]研究了BSA在不同氧化物表面的吸附,其最大吸附量也在约pH为5处。最大吸附量在BSA等电点附近,是因为此时BSA分子显中性,吸附在晶体表面的BSA分子之间的静电斥力最小,吸附层最紧凑,所以吸附量最大。
pH值变化使晶体和BSA荷电性质的改变,影响晶体与BSA分子之间的相互作用,从而影响BSA的吸附量。以COM-100 nm为例,BSA与COM-100nm在不同pH下的荷电情况及相互作用如图5所示。BSA与其它3个晶体的相互作用与COM-100 nm相似。
(1)在pH 在pH>PZCCaOx(COM晶体的零电荷点)时,随pH值的升高,晶体和BSA的ζ电位不断变负(图5c)。 上述两种情况均使得BSA分子之间的静电排斥和BSA分子与晶体之间的静电斥力增大,导致吸附量下降。但晶体对BSA分子仍然有明显的吸附,说明BSA与晶体之间还有其他的作用,如氢键和表面配位[26],这些作用力可以部分弥补因静电斥力增加导致的BSA吸附量减少。 (2)在PIBSA 图5 BSA与纳米COM在不同pH下的荷电情况及其相互作用Fig.5 Charged situation of BSA and nano COM and their interaction under different pH 对于3 μm的COM和COD晶体,晶体的零电荷点就在BSA等电点附近,所以最大吸附量都在pH=4.5处。 在pH>4.5时,随着pH值增大,吸附量逐渐下降。这是因为BSA分子带负电荷,晶体也带负电荷,晶体与BSA分子的静电斥力以及BSA分子间的静电斥力共同导致BSA吸附量下降。 而在pH<4.5时,随着pH值减小,吸附量也逐渐下降。这是因为此时BSA分子带正电荷,晶体也带正电荷,晶体与BSA分子的静电斥力以及BSA分子间的静电斥力共同导致BSA吸附量下降。 纳米、微米COM和COD晶体对BSA的最大吸附量都在实验测得的BSA的等电点(pH=4.8)附近。在等电点附近,BSA分子显中性,吸附在晶体表面的BSA分子之间静电斥力最小,吸附层最紧凑,此时吸附量最大。pH>4.8时,BSA的吸附量随pH值增大而减小。 在草酸钙结石患者尿液环境下(pH≈6.3),BSA的吸附量小,晶体聚集严重,成石风险提高。在pH= 6.3时,BSA分子间静电斥力和晶体与BSA分子间的静电斥力,共同作用导致BSA吸附量的下降(图5b,5c)。 尺寸分别为100 nm和3 μm的COM和COD晶体对BSA的吸附等温线很好的拟合了Langmuir模型,表明BSA在纳米/微米COM和COD晶体上的吸附属于单分子层吸附。上述4种晶体对BSA的最大吸附量都在BSA等电点(4.8)附近。吸附BSA后,这些晶体的ζ电位绝对值增加,这有利于抑制晶体的聚集。由于COM和COD等电点(PI)大小顺序为COM-100nm(7.2)>COD-100nm(6.7)≥COM-3μm(4.7)>COD-3μm(4.3),表明在草酸钙结石尿液中(pH≈6.3)纳米级晶体团聚较严重。BSA的吸附与晶体的比表面积、晶面电荷、团聚以及结晶水的数量密切相关。晶体的比表面积越大、团聚越小,晶面的结晶水数量越多,吸附量越大。当晶面电荷接近中性时,吸附量也会增大。 [1]Cerini C,Geider S,Dussol B,et al.Kidney Int.,1999,55(5): 1776-1786 [2]Liu J F,Jiang H D,Liu X Y.J.Phys.Chem.B,2006,110: 9085-9089 [3]Farmanesh S,Ramamoorthy S,Chung J,et al.J.Am.Chem. Soc.,2013,136(1):367-376 [4]Grohe B,Taller A,Vincent P L,et al.Langmuir,2009,25 (19):11635-11646 [5]Grohe B,O′Young J,Ionescu D A,et al.J.Am.Chem.Soc., 2007,129:14946-14951 [6]Taller A,Grohe B,Rogers K A,et al.Biophys.J.,2007,93 (5):1768-1777 [7]LIU Yi-Ming(柳一鸣),XIA Zhi-Yue(夏志月),OUYANG Jing-Ming(欧阳健明),et al.Chinese J.Inorg.Chem.(无机化学学报),2013,29(5):903-909 [8]Ouyang J M,Xia Z Y,Zhang G N,et al.Rev.Inorg.Chem., 2012,32(2/3/4):101-110 [9]He J Y,Deng S P,Ouyang J M.IEEE Trans.Nanobiosci., 2010,9(2):156-163 [10]Sun X Y,Ouyang J M,Liu A J,et al.Mater.Sci.Eng.C, 2015,57:147-156 [11]Oliva F Y,Avalle L B,Cámara O R,et al.J.Colloid Interface Sci.,2003,261(2):299-311 [12]Song L,Yang K,Jiang W,et al.Colloids Surf.B,2012,94: 341-346 [13]Tunik L,Fueredi-Milhofer H,Garti N.Langmuir,1998,14 (12):3351-3355 [14]Walton R C,Kavanagh J P,Heywood B R,et al.BBA-Gen. Subjects,2005,1723(1/2/3):175-183 [15]Rezwan K,Meier L P,Rezwan M,et al.Langmuir,2004,20 (23):10055-10061 [16]Sikiri M D,Füredi-Milhofer H.Adv.Colloid Interface Sci., 2006,128:135-158 [17]Mohsen-Nia M,Bidgoli M M,Behrashi M,et al.Protein J., 2012,31(2):150-157 [18]Puskas J E,Dahman Y,Margaritis A.Biomacromolecules, 2004,5(4):1412-1421 [19]Kandori K,Oda S,Tsuyama S.J.Phys.Chem.B,2008,112 (8):2542-2547 [20]Thielbeer F,Donaldson K,Bradley M.Bioconjugate Chem., 2011,22(2):144-150 [21]Srinivasan S,Kalaiselvi P,Sakthivel R,et al.Clin.Chim. Acta,2005,353(1):45-51 [22]Gao J,Xue J F,Xu M,et al.Int.J.Nanomed.,2014,9: 4399 [23]Finlayson B,Reid S.Invest.Urol.,1978,15:442-448 [24]Kok D J,Khan S R.Kidney Int.,1994,46:847 [25]Shemetov A A,Nabiev I,Sukhanova A.ACS Nano,2012,6 (6):4585-4602 [26]Zhang X,Bai R,Tong Y W.Sep.Purif.Technol.,2006,52 (1):161-169 [27]Alkan M,Demirba Doan M,et al.Microporous Mesoporous Mater.,2006,96(1):331-340 Adsorption Properties of Bovine Serum Album in on M icron/Nano Calcium Oxalate Monohydrate and Dihydrate Crystals WEN Xiao-Ling OUYANG Jian-Ming* The adsorption isotherms of bovine serum albumin(BSA)on calcium oxalate monohydrate(COM)and calcium oxalate dehydrate(COD)crystals with a size of 100 nm and 3 μm were detected,and Zeta potential of the crystals after adsorption of various concentration of BSA was measured.Adsorption quality change of BSA at different pH value were also measured.Results showed that the adsorption quality of BSA were positively related to the specific surface area of crystals,that was,following the order:COD-100nm>COM-100 nm≥COD-3 μm>COM-3 μm.However,after surface area normalization,the adsorption order was COD-3 μm>COM-3 μm>COM-100 nm>COD-100 nm.It indicated that the crystal water and charge density on crystal surface of COM and COD also affected BSA adsorption.These adsorption isotherms were fitted better with Langmuir model,indicating a monolayer adsorption of BSA on micron/nano COD and COM surface.The isoelectric point of the four crystals followed an order: COM-100 nm(7.2)>COD-100 nm(6.7)≥COM-3 μm(4.7)>COD-3 μm(4.3),which indicated more serious aggregation of nanocrystals under pathophysiological conditions(pH≈6.3).The maximum BSA adsorption occurred at around isoelectric point of BSA(pH=4.8).The adsorption of BSA on micron/nano COM is related to the specific surface area of crystals,its surface charge,crystal aggregation,crystal water number,and the pH value of system.These results can help to clarify the effect of various urine microcrystalline and urine proteins on the formation of CaOxstones. nano;micron;calcium oxalate;bovine serum albumin;adsorption isotherms;isoelectric point;pH value O614.23+1 A 1001-4861(2016)01-0103-08 10.11862/CJIC.2016.011 2015-08-10。收修改稿日期:2015-09-27。国家自然科学基金(No.21371077)资助项目。 *通信联系人。E-mail:toyjm@jnu.edu.cn
3 结论
(Institute of Biomineralization and Lithiasis Research,Jinan University,Guangzhou 510632,China)