磁性聚合物微球的制备及在痕量磺胺类药物分析中的应用
张仟春,卢汉文,谢思琪,杨燕群,苏 姚,张仁凤
(兴义民族师范学院 生物与化学学院,贵州 兴义 562400)
磁性聚合物微球的制备及在痕量磺胺类药物分析中的应用
张仟春,卢汉文,谢思琪,杨燕群,苏 姚,张仁凤
(兴义民族师范学院 生物与化学学院,贵州 兴义 562400)
通过采用微波辐射悬浮聚合法制备了磁性微球,并研究了磁性聚合物微球的结构性能和萃取性能。建立了磁性聚合物微球萃取富集-高效液相色谱-紫外联用测定5种磺胺类药物的分析方法,方法检出限在35~65ng/L范围内。将该方法用于测定猪肉和鸡肉样品中的磺胺类物质,样品中未检出,采用加标浓度为5.0μg/kg和30μg/kg考察,加标回收率分别为78.8%~97.6%和89.8%~108%,RSD为小于8.5%,实现了复杂样品中痕量磺胺类多组分的灵敏和简便分析。
磁固相萃取;磺胺类药物;高效液相色谱;猪肉样;鸡肉样
0 引言
磺胺是广谱抗菌类药物,广泛用于畜牧业和水产养殖中预防和治疗细菌等感染性疾病,以提高动物的抗病能力。但其在动物体内的代谢时间长,造成可食性组织药物残留,人食后在体内蓄积,危及人体健康。中国、欧盟、美国等,规定食品和饲料中的磺胺类药物总量不得超过100μg/kg[1-3]。食品类复杂样品需经过前处理,以浓缩痕量待测组分,除去样品中基体与其它干扰物。
磺胺类药物的前处理方法有传统的溶剂提取法[4]、基质固相分散法[5,6]、固相萃取[3,7,8]和固相微萃取[9,10]等。检测方法主要有高效液相色谱-紫外光谱法[9-11]、液相色谱-荧光检测法[4]、毛细管电泳法[12]、毛细管电色谱法[12]、气相色谱-质谱法[13,14]、液相色谱-质谱法[8,15,16]等。其中液相色谱-质谱联用技术虽然具有较高的灵敏度,但仪器及分析成本高,难以普及。高效液相色谱-紫外分析法,具有无需衍生化过程,能实现多组分的同时分析,得到广泛应用。生物样品中,因基质的复杂性及残留量低,迫切需要合适的样品前处理方法,从而获得良好的灵敏度和准确度,磁固相萃取(Magnetic solid-phase extraction,MSPE)技术因具有分离速度快、操作简便快速、吸附性能好等突出优势,为痕量分析物的预富集打开了一扇新的窗口,深受广大分析工作者的青睐。
实验通过采用微波辐射法制备磁性聚合物微球,研究其结构性能和萃取性能。建立了磁性聚合物微球萃取,MSPE-HPLC-UV同时测定5种磺胺类药物的分离分析方法,并将该方法应用于猪肉和鸡肉样品中5种磺胺类药物的同时分析检测,结果准确可靠。
1 实验部分
1.1 仪器和试剂
Agilent1220高效液相色谱仪(美国安捷伦科技有限公司),VWD紫外检测器,MAS-I微波合成仪(上海新仪微波化学科技公司);机械搅拌器(上海新荣仪器公司);GZX-9140MBE电热鼓风干燥箱(上海博迅实业有限公司);KQ-300DE型超声波清洗器(中国昆山市超声仪器有限公司);HGC-12氮吹仪(天津恒奥科技发展有限公司)。XL-30扫描电子显微镜(SEM)(荷兰飞利浦公司);IR-prespige-21傅立叶红外光谱仪(FT-IR)(日本岛津公司);磁学性质测量系统(SQUID)(美国QUANTUM DESIGN公司)。
磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺对甲氧嘧啶、磺胺甲噁唑标准品购自德国Dr. Ehrenstorfer公司;双(三甲基硅烷基)三氟乙酰胺(Bis(trimethylsilyl) trifluoroacetamide, BSTFA)、FeCl3·6H2O、FeSO4·7H2O、Na2SO3、Na2SO4、Zn(CH3COO)2、CH2Cl2、K6Fe(CN)4、聚乙二醇6000(PEG-6000)、苯乙烯购自上海阿拉丁试剂公司;甲基丙烯酸甲酯(methyl methacrylate,MMA)、偶氮二异丁腈(azo(bis)-isobutyronitrile,AIBN)、甲苯、三氯甲烷、正己烷、乙酸乙酯、甲醇、丙酮、二甲基亚砜(dimethyl sulfoxide,DMSO)购自天津大茂化学试剂厂;乙二醇二甲基丙烯酸酯(ethylene glycol dimethacrylate,EGDMA)购自广州市千湖贸易有限公司;色谱级乙腈和色谱级甲醇购自中国迪马(dikma)公司;实验用水均为超纯水。未提纯度的试剂均为分析纯。
1.2 磁性聚合物微球的制备
PEG-Fe3O4磁流体制备参考文献[17],即采用90.0g FeCl3·6H2O和46.4g FeSO4·7H2O(摩尔比为2.0∶1.0),用超纯水定容。取160mL溶液于1 000mL单颈圆底烧瓶中,加入0.10g Na2SO3和200mL超纯水,通入N2保护,搅拌速度调节为700r/min,15min后快速加入浓氨水至出现大量黑色小颗粒沉淀,调节溶液的pH约为12~13。在45℃下微波加热3min,后升温至80℃下,老化60min。用磁铁进行磁分离,并用超纯水多次清洗至中性,得到水合磁流体。在100mL烧杯中加入4.5g水合磁流体和20.0g PEG-6000,溶于60mL超纯水中,搅拌混合均匀后,将此混合物放入超声水浴中超声分散30min,得到PEG-Fe3O4磁流体。磁性聚合物微球的制备参考文献[18],并作适当修改,具体过程:将200mL超纯水、3.0mL EGDMA、6.0mL苯乙烯、PEG-Fe3O4磁流体、10.0mL MMA10.0mL甲苯和200mg AIBN置于三颈圆底烧瓶,摇匀后,将其置于微波合成仪中,持续通入N2保护,搅拌速度600r/min,程序升温(室温下3min升温至40℃,随后3min升温至60℃,再3min升温至70℃,并保持60min)。聚合结束30min后停止通入氮气,外加磁场分离反应混合物,采用50~200目的分子筛进行筛分,即得到磁性聚合物微球。采用超纯水、乙酸/甲醇(v/v,1∶9)、甲醇溶液依次超声清洗筛分后的磁性聚合物微球,直至洗脱液中用HPLC-UV检测不到存在任何杂质峰。将微球置于真空干燥箱120℃下老化8h,得到的磁性聚合物微球置于干燥器中保存备用。
1.3 磁性聚合物微球结构性能研究
将制备得到的磁性聚合物微球进行红外FT-IR,微球形貌SEM及磁性能SQUID表征。
1.4 富集条件研究
以乙腈为溶剂配制20mg/L的磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺对甲氧嘧啶、磺胺甲噁唑标准工作溶液,优化磁性聚合物微球分离富集磺胺药物的萃取条件。分别研究萃取溶剂、萃取时间、解吸溶剂、解吸时间,磁性聚合物微球对磺胺药物的最优富集分离条件,其中萃取溶剂和解吸溶剂的体积分别为25.0mL和1.00mL,重溶体积为200μL。
1.5 实际样品的制备
实验样品为兴义当地农贸市场的猪肉和鸡肉。称取匀浆的样品5.00g(精确至0.02g),放置在50mL离心管中,加25mL乙腈和加入5.0g无水Na2SO4,超声萃取10min,重复萃取2次,合并萃取液,采用8 000r/min离心10min,清液置于50mL鸡心瓶旋干。加入2.50mL乙腈于鸡心瓶内进行萃取,重复两次,合并于15mL离心管内,加入50μL质量分数为10.3%亚铁氰化钾和50μL质量分数为21.9%乙酸锌振荡5min,以10 000r/min离心10min。转移上清液于15mL玻璃离心管中,加入1.00mL二氯甲烷,2.50mL1%的氯化钠水溶液,6.00mL正己烷,振荡,静置分层,取出中间有机相(乙腈-二氯甲烷),再加入4.00mL乙腈,1.00mL二氯甲烷对水相再次萃取两次,合并有机相,置于50mL鸡心瓶旋干,加入25.0mL甲苯重新溶解,备以MSPE萃取,并进行加标验证方法,加标浓度为5.0μg/kg和30μg/kg。
1.6 色谱条件
检测磺胺类化合物的色谱条件:色谱柱为Diamonsil(TM)C18(250mm×4.60mm,I.D:5μm),流动相乙腈/0.5%(v/v)醋酸水溶液的梯度洗脱程序为(0.00~10.00min为20∶80,10.01~22.00min,乙腈线性升至32%),流速1.000mL/min,柱温为35.0℃,进样量为20.00μL,紫外检测波长270nm。
2 结果与讨论
2.1 磁性聚合物微球结构性质研究
采用傅里叶变换红外吸收光谱研究Fe3O4和磁性聚合物微球的特征功能基团。磁性Fe3O4粒子在569cm-1有Fe-O特征吸收峰,微波辐射法制备的磁性聚合物微球在558cm-1有吸收峰,表明磁性聚合物微球均存在Fe3O4磁性粒子。聚合物微球在3 431cm-1吸收峰对应于MMA的O-H伸缩振动,2 930cm-1吸收峰对应于苯乙烯上芳香族和MMA的C-H的伸缩振动,1 728cm-1吸收峰对应于MMA羰基基团上C=O键的伸缩振动,1 448cm-1和1 384cm-1吸收峰对应于MMA和EGDMA甲基上C-H键的弯曲振动。
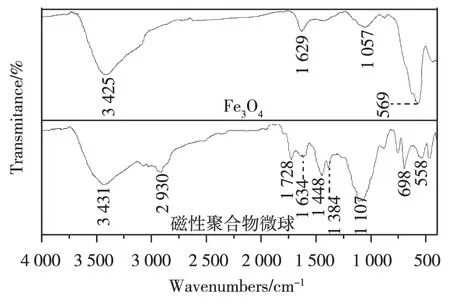
图1 Fe3O4和磁性聚合物微球红外吸收光谱图Fig.1 Infrared spectra for the Fe3O4 and magnetic polymer microspheres
研究微波辐射法制备磁性聚合物微球在室温下的饱和磁化曲线。从图2中可以看出磁性聚合物微球的磁滞回线均无顽磁和剩磁,表明Fe3O4磁性粒子在聚合物微球内部依然显示出超顺磁性,在磁场下能被磁化,去掉磁场后能重新分散,因此可以反复使用。磁性聚合物微球和Fe3O4磁性粒子的饱和磁化强度分别为0.48emu/g和0.59emu/g,经过聚合物包覆后磁性有所下降,但是能满足磁分离的需要。
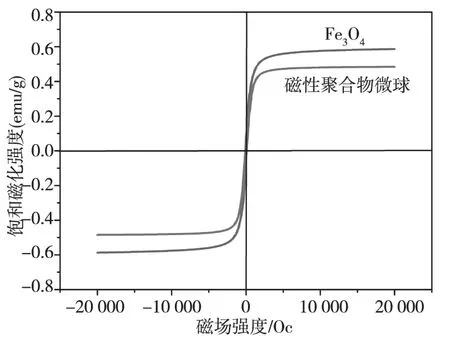
图2 磁性聚合物微球和Fe3O4微球的磁滞回线Fig.2 Magnetization curve of magnetic polymer microballoon and Fe3O4 microspheres
通过SEM研究磁性聚合物微球的表面形貌及结构,如图3所示(A)和(B)的放大倍率分别为200和10 000。由图3(A)可知,磁性聚合物微球粒径范围(约为40~120μm),形状为球型。图3(B)可以更清楚地观察到磁性聚合物微球具有疏松多孔的结构,这有利于增加微球比表面积,增加萃取量,加快萃取过程的传质速率。

图3 磁性聚合物微球SEM图。放大倍率:(A) 200X;(B) 10 000XFig.3 Scanning electron micrographs of magnetic polymer microballoon. Magnifications: (A). 200X; (B). 10 000X
2.2 富条件研究
磁性聚合物微球用量是40.0mg,磺胺标准溶液萃取浓度50.0μg/L,通过优化磁性聚合物微球的萃取溶剂、萃取时间、解吸溶剂和解吸时间对磺胺药物的富集条件进行优化。
2.2.1 萃取溶剂
选择常见的正己烷、甲苯、氯仿、乙酸乙酯、丙酮、乙腈、甲醇和水考察萃取溶剂的影响,磁性聚合物微球的萃取量与溶剂极性之间存在着一定的关系,微球萃取量基本随着萃取溶剂极性的增大而降低,这是由于磺胺与微球的结合力是非共价作用力,极性溶剂会减弱或破坏磁性聚合物微球的氢键作用。结果如图4A所示,聚合物磁性微球在正己烷中的萃取量最大,但是重现性不好,而在甲苯中能得到较好的萃取量和良好的重现性,磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺对甲氧嘧啶、磺胺甲噁唑的萃取量分别为252ng、185ng、194ng、151ng和184ng,因此选择甲苯为萃取溶剂。
2.2.2 萃取时间
实验结果如图4B所示。在40min之内,随着萃取时间的增加,磺胺的萃取量急剧增大,40min后,萃取量随萃取时间增加而减缓,萃取时间到达50min时,磺胺嘧啶萃取达到平衡,而其它4种磺胺物质则需要60min达到动力学平衡,选择60min作为萃取时间。
2.2.3 解吸溶剂
分别选择甲醇、乙腈以及甲醇-乙酸(99∶1,v/v)、乙腈-乙酸(99∶1,v/v)作为解吸溶剂进行解吸溶剂的优化,解吸溶液体积为1.0mL。解吸过程需要破坏或减弱两者萃取介质与富集对象之间的氢键作用,故选择极性较强的甲醇和乙腈为解吸溶剂考察其对解吸过程的影响,为了增强解吸效果,还会在甲醇和乙腈中加入不同量的乙酸。结果如图4C所示,在相同条件下,甲醇解吸体系对磺胺的解吸效果明显高于乙腈解吸体系,且甲醇效果最好,故选择甲醇为解吸溶剂。
2.2.4 解吸时间
由于磁性聚合物微球具有较薄的厚度及疏松多孔结构,对分析物扩散具有促进作用。实验结果如图4D所示,故当解吸时间达到30min时,磺胺嘧啶解吸完全,而其它4种磺胺分析物需要40min基本才能从磁性聚合物微球解吸平衡,因此,选择40min为最佳解吸时间。
2.3 萃取容量研究
配制一系列浓度20.00~2 100μg/L磺胺标准溶液,研究磁性聚合物微球的饱和萃取容量,磁性聚合物微球用量均为40.0mg,萃取条件采用最优条件,实验结果如图5所示。随着磺胺标准溶液萃取溶液浓度的增加,磁性聚合物微球萃取量增加。当磺胺标准溶液浓度增加至1 200μg/L,磁性聚合物微球萃取达到平衡,磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺对甲氧嘧啶、磺胺甲噁唑的萃取量分别为2 149ng、1 549ng、1 686ng、1 411ng和1 532ng。
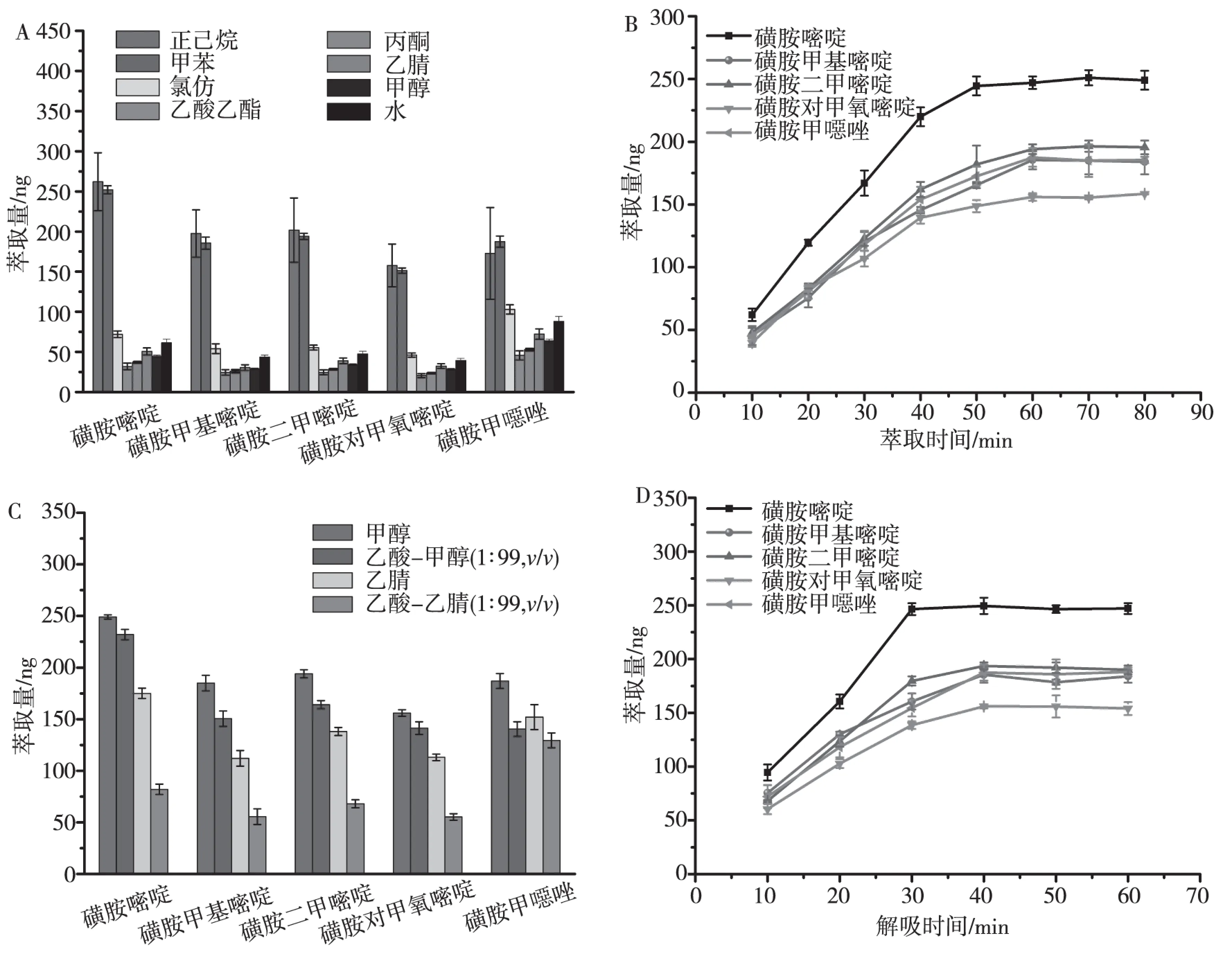
A:萃取溶剂;B:萃取时间;C:解吸溶剂;D:解吸时间图4 富集条件优化Fig.4 Enrichment conditions
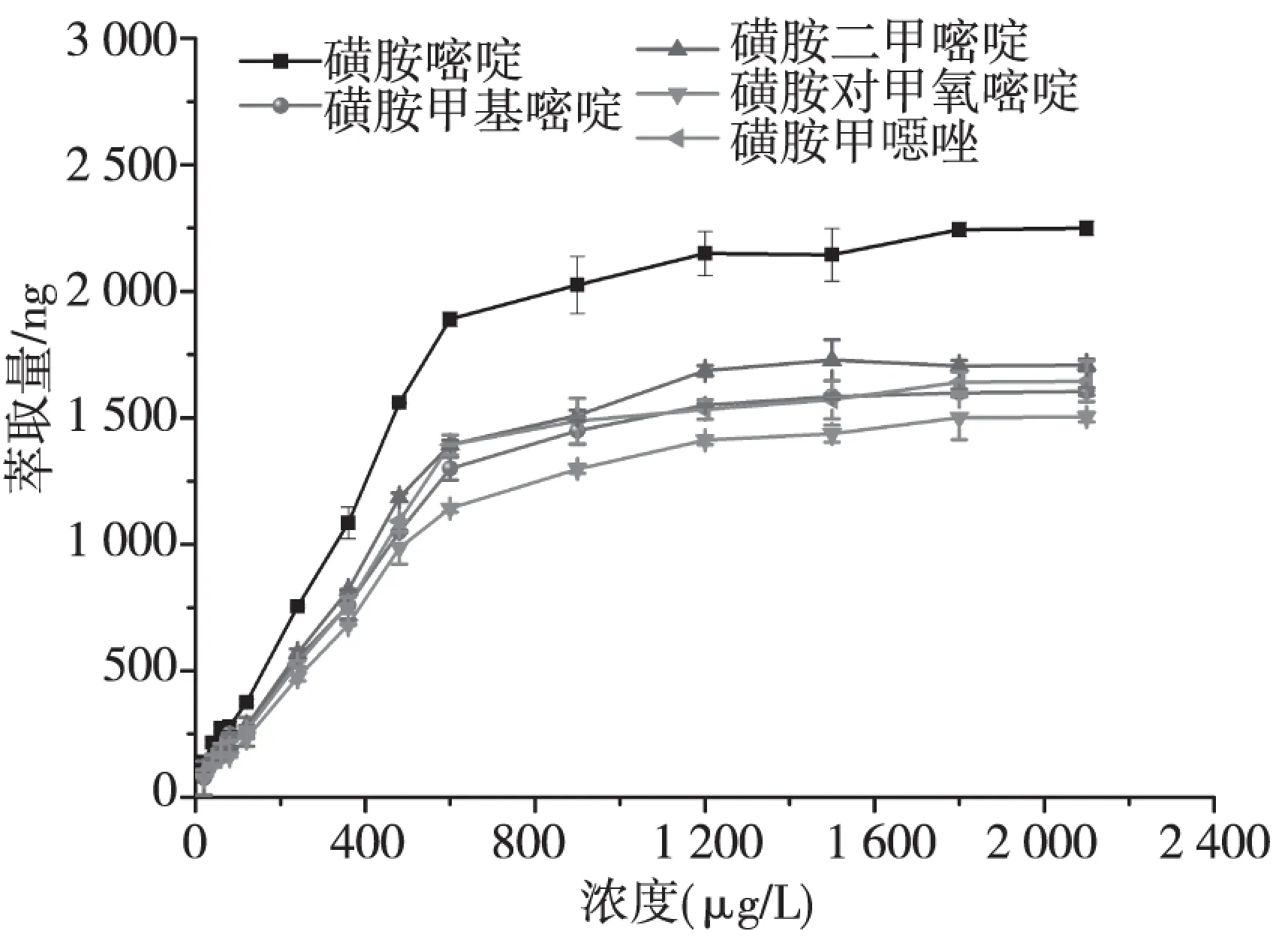
图5 磁性聚合物微球萃取磺胺标准溶液萃取量曲线Fig.5 Extraction amount curve by magnetic polymer microspheres extraction for sulfanilamides
2.4 分析方法建立与应用
2.4.1 分析方法建立
采用不同浓度磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺对甲氧嘧啶、磺胺甲噁唑混合标准溶液考察MSPE-HPLC-UV联用分析方法,同时测定这5种磺胺类物质的线性方程、相关系数及线性范围,结果如表1所示。
磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺对甲氧嘧啶、磺胺甲噁唑在0.30~50.0μg/L浓度范围内具有良好的线性关系,相关系数大于0.995 5,5种磺胺的检出限为35~65ng/L。以10.0μg/L混合标准溶液考察方法的精密度为3.1%~6.4%。与文献[9]报道的高效液相色谱-紫外检测分析方法比较可知,该MSPE-HPLC-UV联用分析方法具有更高的灵敏度。
2.4.2 样品分析
采用MSPE-HPLC-UV联用方法测定猪肉和鸡肉中5种磺胺类药物,因为在样品中未检出,采用加标对其方法验证,5种磺胺的加标浓度分别为5.0μg/kg、30.0μg/kg。如图6所示,图a、b和c分别为25.0μg/L混合标准溶液,样品和加标5.0μg/kg猪肉和鸡肉样品分析的色谱图,加标样品中回收率如表2所示,磺胺嘧啶、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺对甲氧嘧啶、磺胺甲噁唑在猪肉和鸡肉样品中的加标回收率分别为78.8%~97.6%和89.8%~108%之间,RSD为4.2%~8.5%,该方法能很好的满足复杂样品中痕量磺胺类药物的分析。
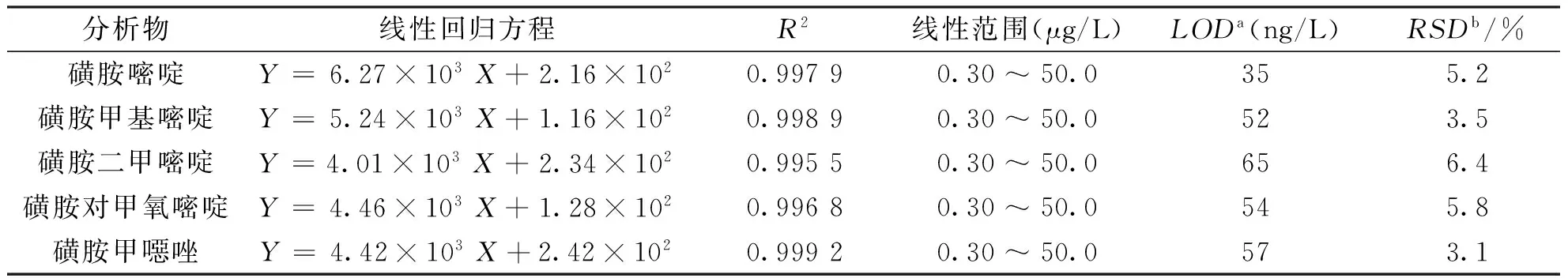
表1 MSPE-HPLC-UV联用测定磺胺方法的线性范围、检出限及精密度(n=7)Tab.1 The calibration curves, linear range, detection limit and precision of MSPE-HPLC-UV method for the determination of sulfanilamides (n=7)
a检出限按信噪比3∶1估算
b采用10.0μg/L磺胺类混合标准溶液考察方法精密度(n=7)
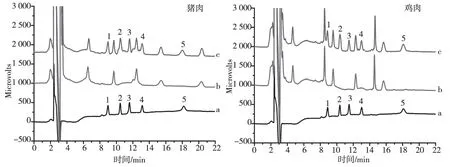
25.0μg/L混合标准溶液;(b)空白样品;(c)空白样品加标5.0μg/kg。1:磺胺嘧啶,2:磺胺甲基嘧啶,3:磺胺二甲嘧啶,4:磺胺对甲氧嘧啶,5:磺胺甲噁唑图6 猪肉和鸡肉样品分析色谱图Fig.6 Chromatograms of pork and chicken samples表2 MSPE-HPLC-UV分析猪肉和鸡肉样品中5种磺胺药物(n=5)Tab.2 The analysis of sulfonamides in spiked pork and chicken samples by MSPE-HPLC-UV (n=5)
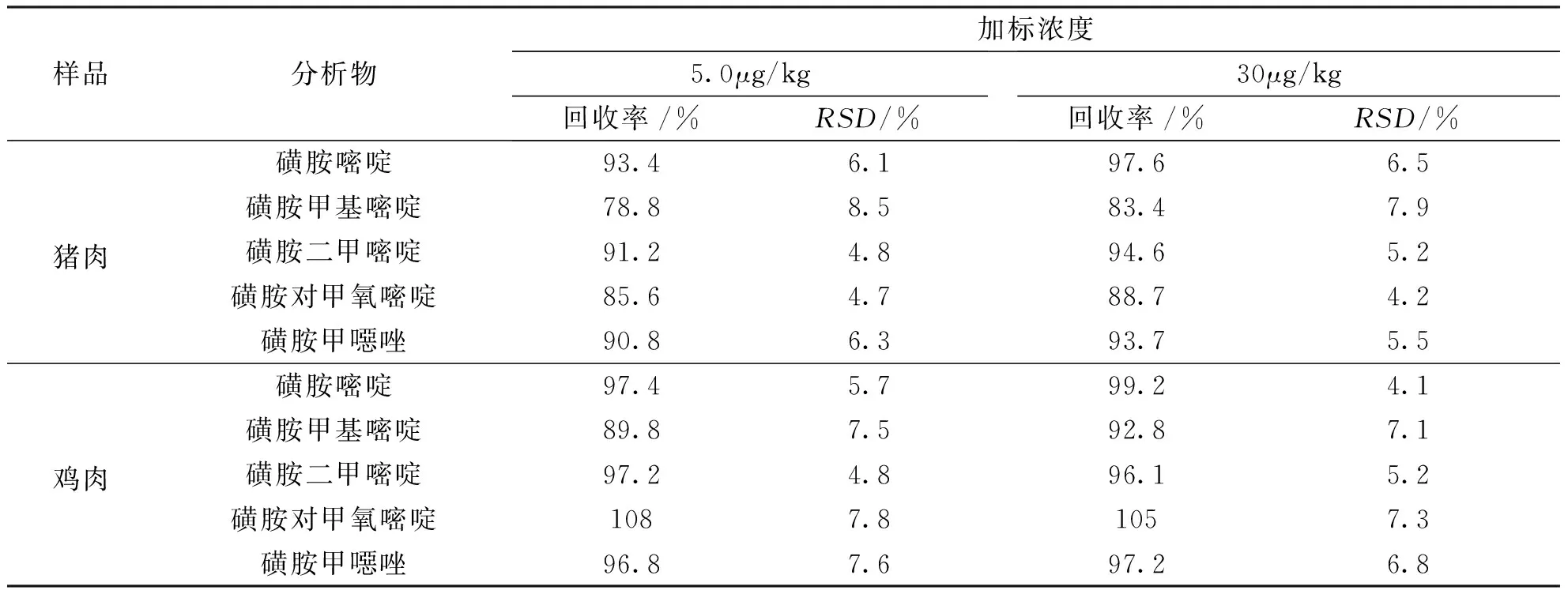
样品分析物加标浓度5.0μg/kg回收率/%RSD/%30μg/kg回收率/%RSD/%猪肉磺胺嘧啶93.46.197.66.5磺胺甲基嘧啶78.88.583.47.9磺胺二甲嘧啶91.24.894.65.2磺胺对甲氧嘧啶85.64.788.74.2磺胺甲噁唑90.86.393.75.5鸡肉磺胺嘧啶97.45.799.24.1磺胺甲基嘧啶89.87.592.87.1磺胺二甲嘧啶97.24.896.15.2磺胺对甲氧嘧啶1087.81057.3磺胺甲噁唑96.87.697.26.8
3 小结
采用微波辐射悬浮聚合法制备了磁性聚合物微球,研究了磁性聚合物微球的结构性能和萃取性能。微球表面具有疏松多孔结构,粒径分布在40~120μm,微球具有良好的磁响应性,能满足磁分离和重复多次使用的要求。建立了MSPE-HPLC-UV联用分析5种痕量磺胺类的方法,方法检出限在35~65ng/L范围内。将该方法用于测定猪肉和鸡肉样品中的磺胺类物质,样品中未检出,采用加标验证,加标浓度分别为5.0μg/kg和30μg/kg,猪肉和鸡肉样品中的加标回收率分别为78.8%~97.6%和89.8%~108%之间,RSD为4.2%~8.5%,实现了复杂样品中痕量磺胺类多组分的同时分析测定,方法具有较高的灵敏度和准确度。
[1] FURUSAWA N.Rapid high-performance liquid chromatographic determining technique of sulfamonomethoxine,sulfadimethoxine, and sulfaquinoxaline in eggs without use of organic solvents[J].Anal Chim Acta,2003,481(2):255-259.
[2] HARTIG C,STORM T,JEKEL M.Detection and identification of sulphonamide drugs in municipal waste water by liquid chromatography coupled with electrospray ionisation tandem mass spectrometry[J].Journal of Chromatography A,1999,854(1-2):163-173.
[3] STUBBINGS G,TARBIN J,COOPER A,et al.A multi-residue cation-exchange clean up procedure for basic drugs in produce of animal origin[J].Anal Chim Acta,2005,547(2):262-268.
[4] 陈万勤,黄丽英,陈小珍,等.高效液相色谱光化学在线衍生技术在11种磺胺药物残留检测中的应用[J].分析化学,2014,2(4):573-578.
[5] KISHIDA K,FURUSAWA N.Matrix solid-phase dispersion extraction and high-performance liquid chromatographic determination of residual sulfonamides in chicken[J].Journal of Chromatography A,2001,37(1-2):9-55.
[6] BOGIALLI S,CURINI R,CORCIA A D,et al.Rapid confirmatory assay for determining 12 sulfonamide antimicrobials in milk and eggs by matrix solid-phase dispersion and liquid chromatography-mass spectrometry[J].Journal of Agricultural and Food Chemistry,2003,51(15):4225-4232.
[7] FANG G Z,HE J X,WANG S.Multiwalled carbon nanotubes as sorbent for on-line coupling of solid-phase extraction to high-performance liquid chromatography for simultaneous determination of 10 sulfonamides in eggs and pork[J].Journal of Chromatography A,2006,1127(1-2):12-17.
[8] 欣顾,吴剑平,张 鑫,等.阳离子交换在线固相萃取/液相色谱-串联质谱法检测牛奶中14种磺胺药物残留[J].分析化学,2014,42(12):1759-1766.
[9] XU Z, SONG C,HU Y,et al.Molecularly imprinted stir bar sorptive extraction coupled with high performance liquid chromatography for trace analysis of sulfa drugs in complex samples[J].Talanta,2011,85:97-103.
[10]ZHANG Q C,XIAO X H,LI G K.Porous molecularly imprinted monolithic capillary column for on-line extraction coupled to high-performance liquid chromatography for trace analysis of antimicrobials in food samples [J].Talanta,2014,123(6):63-70.
[11]PREECHAWORAPUN A,CHUANUWATANAKUL S,CHAILAPAKUL O,et al.Electroanalysis of sulfonamides by flow injection system/high-performance liquid chromatography coupled with amperometric detection using boron-doped diamond electrode [J].Talanta,2006,68(5):1726-1731.
[12]FONT G,JUAN-GARCíA A,PICó Y.Pressurized liquid extraction combined with capillary electrophoresis-mass spectrometry as an improved methodology for the determination of sulfonamide residues in meat[J].Journal of Chromatography A,2007,1159(1-2):233-241.
[13]TARBIN J A,CLARKE P,SHEARER G.Screening of sulphonamides in egg using gas chromatography-mass-selective detection and liquid chromatography-mass spectrometry.Journal of Chromatography B,1999,729(1-2):127-138.
[14]REEVES V B.Confirmation of multiple sulfonamide residues in bovine milk by gas chromatography-positive chemical ionization mass spectrometry.Journal of Chromatography B,1999,723(1):127-137.
[15]LINDSEY M E,MEYER M,THURMAN E M.Analysis of Trace levels of sulfonamide and tetracycline antimicrobials in groundwater and surface water using solid-phase extraction and liquid chromatography/mass spectrometry[J].Analytical Chemistry,2001,73(19):4640-4646.
[16]VERZEGNASSI L,SAVOY-PERROUD M C,STADLER,R H.A pplication of liquid chromatography-electrospray ionization tandem mass spectrometry to the detection of 10 sulfonamides in honey[J].Journal of Chromatography A,2002,977(1):77-87.
[17]ZHANG Y,LIU R J,LI G K,et al.Microwave heating in preparation of magnetic molecularly imprinted polymer beads for trace triazines analysis in complicated samples[J].Analytical Chemistry,2009,81(3):967-976.
[18]ZHANG Z M,TAN W,LI G K,et al.Simultaneous determination of trace sterols in complicated biological samples by gas chromatography-mass spectrometry coupled with extraction using β-sitosterol magnetic molecularly imprinted polymer beads[J].Journal of Chromatography A,2011,1218(28):4275-4283.
Preparation and application of polymer magnetic microsphere for trace analysis of sulfanilamides
ZHANG Qianchun,LU Hanwen,XIE Siqi,YANG Yanqun,SU Yao,ZHANG Renfeng
(School of Biology and Chemistry, Xingyi Normal University for Nationalities, Xingyi,Guizhou 562400, China)
Magnetic polymer microspheres were prepared by suspension polymerization. The structural characteristics and extraction performance of resultant microspheres were studied. A method was developed for the determination of five sulfanilamides by the magnetic microspheres extraction coupled with HPLC-UV. The detection limit of the method was 35~65 ng/L. The proposal method was applied to simultaneous determination of trace sulfanilamides in pork and chicken samples with the amount was not detected. The concentrations of each sulfanilamide for the spiked sample solutions were 5.0 and 50.0 μg/kg, respectively. The recoveries obtained from pork and chicken samples ranged 78.8%~97.6%, and 89.8%~108%, respectively. And the relative standard deviation (RSDs) were less than 8.5%. The proposal method based on magnetic solid-phase extraction was sensitive and convenient for trace determination of sulfanilamides in complex samples.
magnetic solid-phase extraction; sulfanilamides; high performance liquid chromatography; pork samples; chicken samples
1004—5570(2016)05-0060-07
2016-07-03
国家自然科学基金(No. 21505115);贵州省科学技术基金(黔科合LH字[2014]:No.7406);黔西南州科技局项目(No. 2014-30)
张仟春(1981-),男,博士,副教授,研究方向:功能材料在色谱与光谱中的应用,E-mail: qianchunzhang@qq.com.
O656.9
A

