应用酶联免疫分析方法检测镇江市内水域水样和底泥中的邻苯二甲酸二乙酯
曾 昆,周 军,邵 杰,张 祯*
(1.江苏大学环境与安全工程学院,江苏 镇江 212013;2.江苏大学环境生态研究所,江苏 镇江 212013)
应用酶联免疫分析方法检测镇江市内水域水样和底泥中的邻苯二甲酸二乙酯
曾 昆1,2,周 军1,邵 杰1,张 祯1*
(1.江苏大学环境与安全工程学院,江苏 镇江 212013;2.江苏大学环境生态研究所,江苏 镇江 212013)
应用邻苯二甲酸二乙酯(Diethyl phthalate,DEP)抗体,建立了间接竞争性ELISA方法,并对反应条件进行优化,进而测定了镇江市内水域中DEP含量。结果显示优化后的ELISA方法检测范围为20~320 ng·mL-1,最低检测限为8.2 ng·mL-1。方法特异性高,与其他邻苯二甲酸酯类似物几乎无交叉反应。ELISA方法批内差在3.38%~9.09%,批间差在3.76%~12.78%。检测方法检测水样和底泥样本中DEP含量,添加回收率在90.46%~122.75%。镇江市内古运河和运粮河水样和底泥样本中DEP的检出率分别为62.5%和87.5%,其中水样中DEP含量最高可为6.61 ng·mL-1,底泥样本中DEP含量最高为86.9 ng·g-1。
塑化剂;DEP;抗体
目前DEP的检测方法主要有气相色谱法、高效液相色谱法以及色谱-质谱联用技术等[15-18],这些仪器方法对环境样本的前处理方法要求严苛,操作流程繁琐,并不适用于大量环境样本的筛查。以抗原-抗体特异性结合为基础的免疫分析方法,因其灵敏度高、特异性强、操作简便等优势,近年来在环境分析领域被广泛应用。因此,本研究利用自主制备的DEP抗体,建立了灵敏、快速的ELISA方法,优化了反应条件,并以此对镇江地区部分市内河流中DEP的污染状况进行调查。
1 材料与方法
1.1 材料和试剂
抗DEP多克隆抗体和包被抗原OVA-DEP为本实验室自制,明胶、Tween-20、四甲基联苯胺(Tetramethylbenzidine,TMB)购自Sigma-Aldrich公司,辣根过氧化酶标记羊抗兔(IgG-HRP)购自北京博奥森生物技术有限公司,DEP、邻苯二甲酸二丁酯(Dibutyl phthalate,DBP)、邻苯二甲酸丁酯本甲酯(Butyl benzyl phthalate,BBP)、邻苯二甲酸二正辛酯(n-Dioctyl ph thalate,DnOP)、邻苯二甲酸二(2-甲氧基)乙酯(Dimethoxyethyl phthalate,MEP)、邻苯二甲酸单-2-乙基己酯(Monoethylhexyl phthalate,MEHP)、邻苯二甲酸二异辛酯(Diisooctyl(o-)phthalate,DiOP)、邻苯二甲酸单丁酯(Monobutyl phthalate,MBP)标准品购自北京北纳创联研究院,正己烷及其余常规试剂均来自国药集团化学试剂有限公司(分析纯)。96孔酶标板购自上海生工生物工程技术有限公司。所用酶标仪为Multiskan MK3型酶标仪;氮吹仪为MD200-2型,购自上海睿玥实验器材有限公司。
1.2 竞争性ELISA方法检测流程
96 孔板中加入一定浓度的OVA-DEP,每孔100 μL,4℃过夜。倒掉孔内液体,用洗涤液(含0.05% Tween-20的0.01 mol·L-1PBS,pH 7.4)洗涤1次,拍干。每孔加封闭液(含1%明胶的0.01 mol·L-1PBS,pH 7.4)200 μL,37℃孵育2 h,倒掉孔内液体,拍干。用抗体稀释液(含0.1%明胶的0.01 mol·L-1PBS,pH 7.4)将DEP标准品配成系列浓度(1、10、20、40、80、 160、320 ng·mL-1),每孔加入50 μL标准品,再加入50 μL适量浓度的DEP抗体,37℃孵育后洗涤液洗涤3次,拍干。每孔加入适量浓度的IgG-HRP 100 μL,37℃孵育1 h后洗涤液洗涤3次,拍干。每孔加新鲜配制的TMB底物溶液(0.1 mg·mL-1)100 μL,显色10 min。每孔加终止液(2 mol·L-1H2SO4)50 μL,检测吸光度OD450nm~OD630nm。
1.3 条件优化
1.3.1 包被抗原及一抗最佳反应浓度
采用棋盘法摸索抗原抗体最佳反应浓度。96孔酶标板每行包被不同浓度的OVA-DEP(浓度分别1∶1000、1∶2000、1∶4000、1∶8000、1∶16 000),每孔100 μL,4℃过夜。洗涤及封闭同1.2节。将DEP抗体用抗体稀释液从1∶2500开始倍比稀释到1∶40 000,并依次加入不同浓度包被的孔板中,每孔100 μL,37℃孵育1 h后洗涤液洗涤3次,拍干。加入酶标记物、显色、读值,流程同前。以阳性对照/阴性对照(Positive/ Negative,P/N)≥2.1、吸光度在1.0左右时的抗原及一抗浓度为最佳反应浓度[P/N=(OD标本-OD空白对照)/(OD阴性对照-OD空白对照)]。
1.3.2 最佳竞争反应时间的优化
在DEP抗体与DEP标准品反应时,采用不同的反应时间(5、15、30、45、60 min),按1.2节方法进行检测,每组3个平行,建立标准曲线并计算半数抑制率(50%Inhibitory Concentration,IC50)。选择最大吸光度(B0值)较高且IC50值较小时的反应时间为最佳竞争反应时间。
1.3.3 最佳酶标二抗浓度的优化
采用不同浓度(1∶250、1∶500、1∶1000、1∶2000)的酶标二抗,按1.2节方法进行检测,每组3个平行,建立标准曲线并计算IC50。选择B0值较高且IC50值较小时的酶标二抗浓度为最佳使用浓度。
1.3.4 最佳反应pH值的优化
分别配制pH值为6.0、6.5、7.0、7.4、8.0的PBS缓冲液,用该缓冲液将DEP标准储备液稀释为一系列浓度的DEP标准溶液,按1.2节方法进行检测,每组3个平行,建立标准曲线并计算IC50。选择B0值较高且IC50值较小时的pH值为最佳反应pH值。
1.3.5 最佳离子强度的优化
分别配制离子强度为0.01、0.05、0.1、0.15、0.2 mol·L-1的PBS缓冲液,用该缓冲液将DEP标准储备液稀释为一系列浓度的DEP标准溶液,按1.2节方法进行检测,每组3个平行,建立标准曲线并计算IC50。选择B0值较高且IC50值较小时的离子强度值为最佳离子强度。
1.4 环境水样中DEP测定
采集镇江市内水体(古运河和运粮河)中的水样和底泥样本。水样采集于水面以下0.5 m处,放入棕色玻璃瓶4℃保存,一周内检测。在各个水样采集点周围布设3个底泥采样点,利用抓斗式采样器采集表层底泥,然后混合均匀组成一个底泥样本,放入棕色玻璃瓶4℃保存,一周内检测。
1.4.1 ELISA方法检测DEP
取5 mL水样,加入5 mL正己烷,上下颠倒振荡30 min,6000 r·min-1离心10 min,取2.5 mL上清,用氮吹仪吹干。最终样品用0.5 mL PBS复溶,用于DEP含量测定。底泥样本在50℃下彻底干燥。取5 g底泥样本,加入5 mL正己烷,上下颠倒振荡30 min,6000 r·min-1离心10 min,取1 mL上清,用氮吹仪吹干。最终样品用0.5 mL PBS复溶,用于DEP含量测定。
1.4.2 GC-MS方法检测DEP
1.5 竞争性ELISA方法的性能评估
1.5.1 标准曲线和分析方法的灵敏度
基于1.3节中优化后的条件,按照1.2节中的操作流程,DEP标准品浓度为10、20、40、80、160、320 ng·mL-1,建立标准曲线,每组实验设3组平行。以DEP标准品浓度的对数为横坐标,B/B0为纵坐标绘制标准曲线,其中B为不同浓度标准品对应的OD值,B0为标准品浓度为0时对应的OD值,即最大OD值。B/B0值与标准品的对数呈线性回归关系,可以得出回归曲线的方程,从而计算IC50和最低检测限,其中最低检测限为抑制率在90%时的标准品浓度,检测范围为抑制率在20%~80%的标准品浓度区间[20]。
1.5.2 交叉反应
选取DEP结构类似物(DBP、MEP、BBP、MEHP、DiOP、MBP、DnOP)进行交叉反应测定,评价本实验方法的特异性。
交叉反应的计算公式为:交叉反应(CR%)=IC50(DEP)/IC50(类似物)×100%
1.5.3 精密度
DEP标准曲线重复测定10次,隔日再次检测,计算批内和批间变异系数(Coefficient of Variation,CV)。CV=SD/mean×100%,其中SD为标准差(Standard Deviation)。
式中:j为第i项制约因素的第j项制约子因素,j=0,1,2,…n,; k1为第i层制约因素包含的制约子因素个数,k1=1,2, …,n;
1.5.4 添加回收实验
阴性水样选择全玻璃双蒸水并储存在玻璃瓶中,阴性底泥样本则是在远离居民区的河流区域采集,并且经GC-MS方法检测,未检测到DEP。
取1 mL水样或1 g底泥样本,添加DEP标准品,使其终浓度为20、50、100 ng·mL-1或ng·g-1,充分混合均匀,4℃放置12 h。按照1.4.1节方法处理样本后用于ELISA检测。
2 结果与分析
2.1 ELISA反应条件的优化
基于抗原抗体特异性反应的ELISA方法受到多种因素的影响,包括使用的抗原抗体的浓度、竞争性反应的时间、竞争结合时的pH以及离子强度等。
采用棋盘法筛选包被抗原OVA-DEP与特异性抗DEP抗体反应的最佳使用浓度,结果见表1。吸光度在1.0左右的值有3组,分别为抗原1∶1000/抗体1∶20 000、抗原1∶2000/抗体1∶10 000、抗原1∶4000/抗体1∶2500,其中第一组和第三组的空白值较高(>0.1),故采用抗原1∶2000/抗体1∶10 000作为最佳使用浓度。
酶标二抗的使用浓度直接影响ELISA的读值的高低,也会影响方法的灵敏度。使用的酶标二抗浓度过高不仅浪费试剂,而且过高的OD值会掩盖掉竞争性反应的趋势,降低方法的灵敏度。从实验结果上看(图1a),随着酶标物稀释度的增加,B0值逐渐减小;在酶标物浓度较高(1∶250)时,IC50值较高(209 ng· mL-1),随着稀释度的增加,IC50值在一定范围内波动。其中当酶标物浓度为1∶500时,B0值较高而IC50值最低,因此我们认为该条件为最佳酶标二抗浓度。
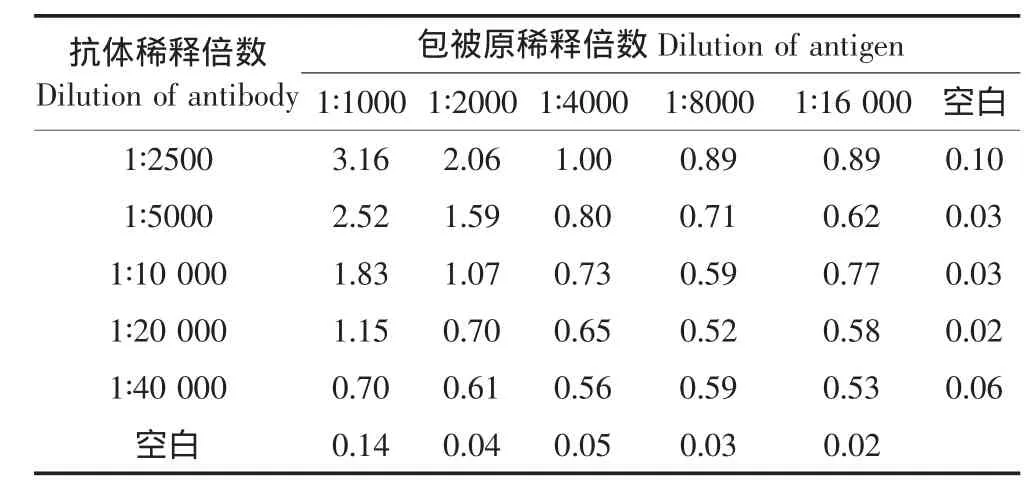
表1 棋盘法筛选最佳包被抗原及一抗反应浓度Table 1 Optimal concentration of coating antigen and antibody by checkerboard method
抗原抗体的结合是非共价键的作用,因此抗原抗体复合物始终处在结合-解离-结合的动态平衡过程中。选择合适的时间节点,使得特异性抗体更多的与游离DEP而非板上固化的OVA-DEP结合,对于所建立的方法的灵敏度有显著影响。从实验结果来看(图1b),在一定的孵育时间(5~45 min)内,随着时间延长,B0不断增加,IC50也呈下降的趋势,但是当孵育时间达到60 min时,IC50却呈现出升高的趋势。当竞争反应时间为45 min时,B0值较高而IC50值最低,因此我们认为该条件为最佳反应时间。
从图1c可以看出,pH对B0值的影响并不大,IC50值出现了先降低后又升高的态势,当pH为7.4时,IC50值最低。溶液的离子强度对B0值影响较大(图1d),离子强度越高,B0值越小,而IC50值整体呈上升的趋势。当离子强度为0.01 mol·L-1时,B0值最高而IC50值最低。
2.2 DEP标准曲线的建立
基于以上优化后的反应条件,建立了DEP检测的标准曲线,见图2。该方法的线性范围为20~320 ng·mL-1,IC50为72 ng·mL-1,检测限为8.2 ng·mL-1。

图1 不同反应条件的优化Figure 1 Influence of parameters on ELISA
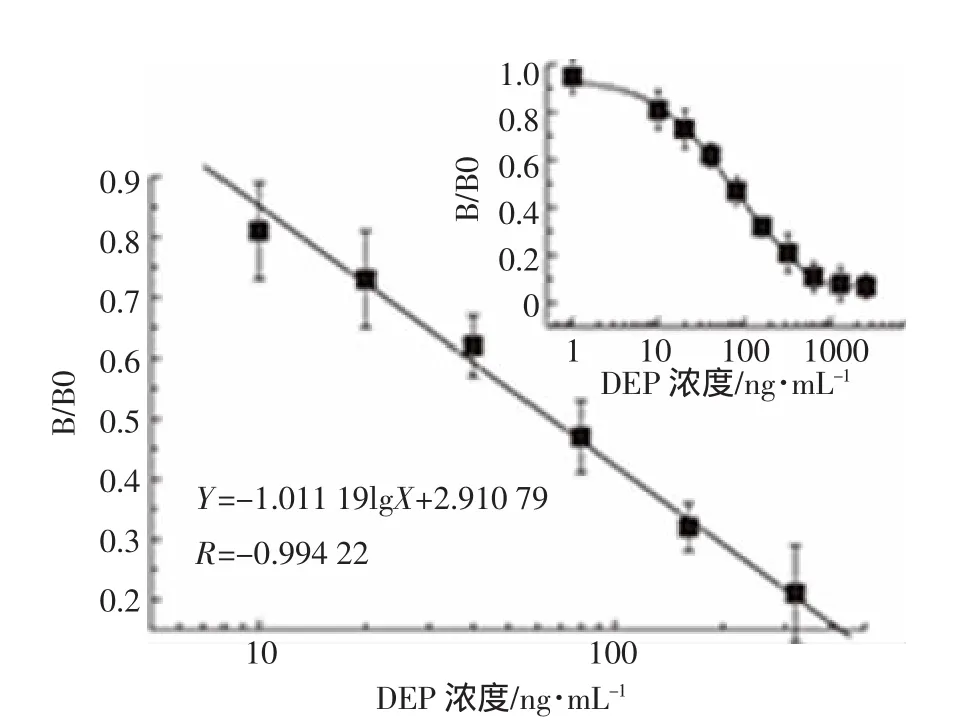
图2 ELISA方法检测DEP的标准曲线Figure 2 Calibration curve for detection of DEP by ELISA
2.3 ELISA方法的特异性
抗体制备过程中,将抗原特有的抗原决定簇暴露于机体的免疫系统而获得相应的抗体。如果目标化合物与其类似物具有相同的分子结构或者官能团,则所得的抗体就会同时识别目标物及其类似物,那么所建立的分析方法测得的物质浓度为具有类似官能团的化合物的总浓度,不能实现目标物质的特异性检测。本研究旨在建立特异性的DEP检测方法,因此所用抗体与DEP类似物的结合能力越低,则该方法的特异性就越强。从交叉反应的实验结果(表2)可以看出,DEP抗体仅与DBP、MEP、BBP有较弱的交叉反应,分别为4.29%、2.03%、0.035%,与MEHP、DiOP、MBP、DnOP没有明显的交叉反应(CR<0.1%),显示了本方法具有较好的特异性。
2.4 ELISA方法的精密度
以同一块板上的孔间平均变异系数来表示批内差异,以不同时间检测的孔间平均变异系数来表示批间差异,结果见表3。本方法的批内差在3.38%~9.09%,平均值为7.15%;批间差在3.76%~12.78%,平均值为8.14%。批内差小于10%,批间差小于20%,该方法具有较高的精密度。
2.5 ELISA检测DEP方法的准确性
为评估所建立的ELISA方法的准确性,我们进行了添加回收实验。由于DEP污染的广泛性,难以获得有效的空白样本,因此添加回收实验是采用由GCMS方法验证的阴性样本进行的,其中水样来自古运河严家桥采样点,底泥样本来自玉带河。进行添加回收实验的同时测定未添加时的本底浓度,如有本底浓度测出,则在计算回收率时扣除本底再行计算。结果显示(表4),所采用的水样和泥样中并没有DEP检出,检测的回收率在90.46%~122.75%,平均回收率110.88%,说明该方法的准确性较高。
2.6 环境样本中DEP的测定
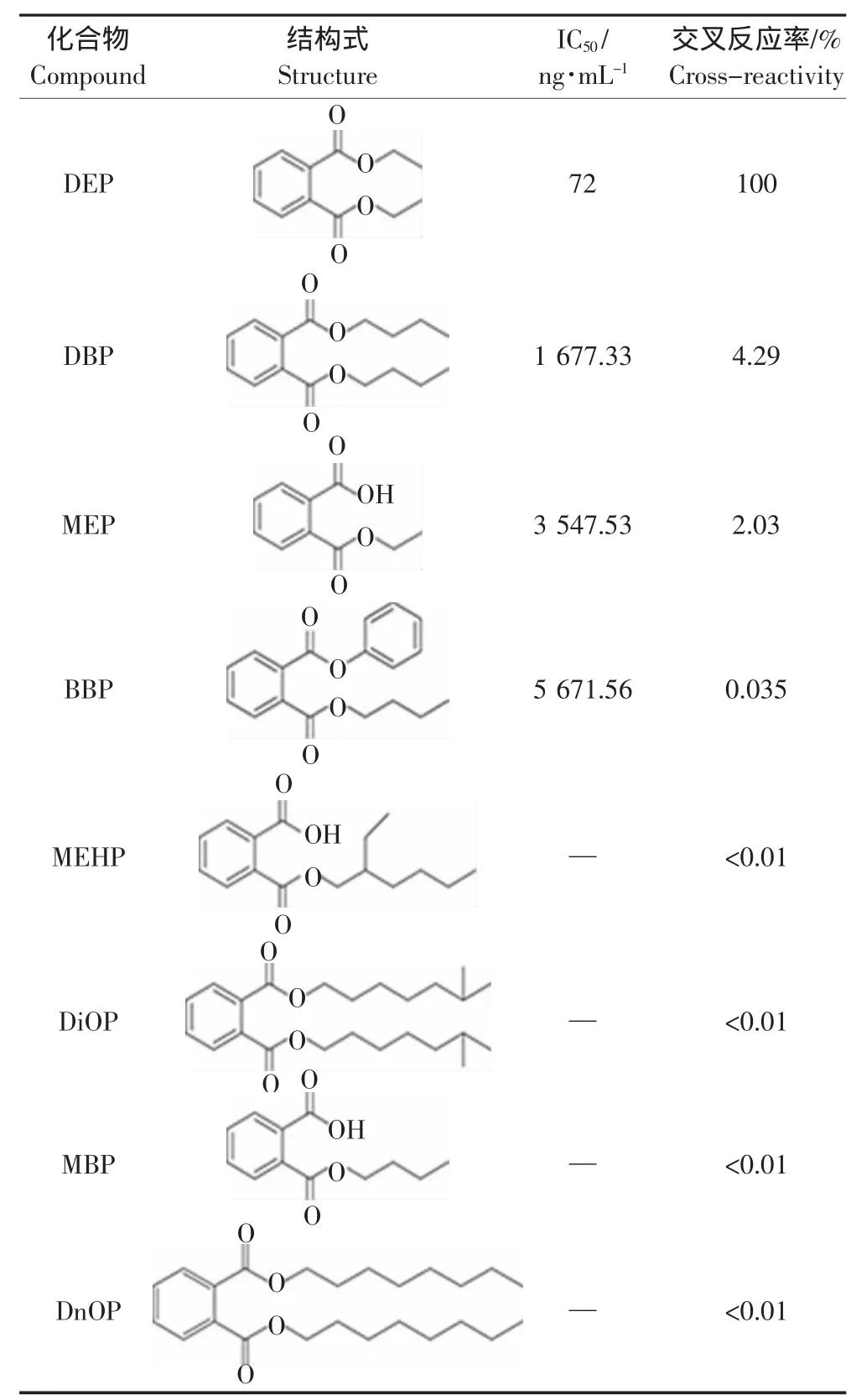
表2 ELISA方法与DEP类似物的交叉反应Table 2 Cross-reactivity of DEP structural compounds
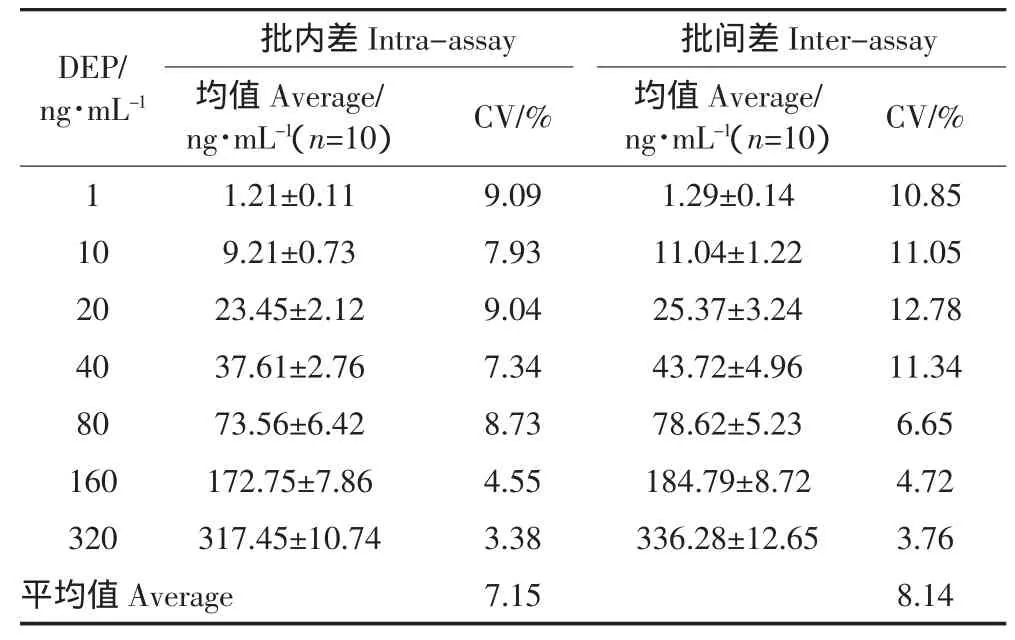
表3 ELISA方法的批内和批间差异Table 3 Intra-assay and inter-assay variance of ELISA
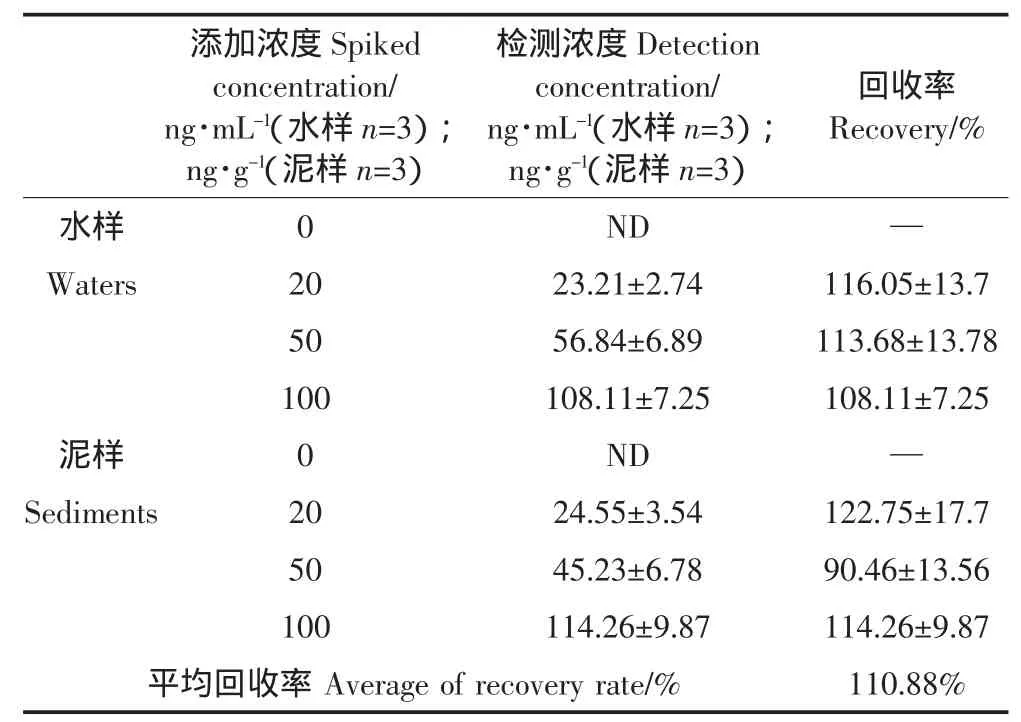
表4 添加回收实验Table 4 Recovery of DEP from spiking waters and sediments samples
由于塑化剂广泛存在于塑料制品中,为避免采样工具对样本的污染,造成检测结果不准确,采用棕色玻璃瓶作为采样和储存工具。并且玻璃瓶在使用前,先用丙酮浸润1 h,后用正己烷洗涤3次,最大限度地避免了来自采样工具的污染。由于水样中DEP含量相对较低,我们对水样进行了浓缩前处理。采用正己烷提取的前处理方法,应用ELISA方法检测水样的检测限为1.19 ng·mL-1,底泥样本的检测限为5.95 ng·g-1。
应用建立的ELISA方法以及GC-MS方法对镇江市内古运河以及运粮河水样及底泥样本中的DEP进行检测。结果显示(表5),在18个样本中,15个样本的ELISA和GC-MS检测结果一致,具有较好的相关性。实验室的自来水样中并未检测到DEP,但是采集的其他8个样本中,5个水样和7个底泥样本中有DEP检出,检出率分别为62.5%和87.5%。水样中DEP含量在ND~6.51ng·mL-1,底泥样本中DEP含量在ND~86.92ng·g-1。同时对ELISA结果和GC-MS结果进行相关性分析,发现两者具有较好的一致性(图3)。
3 讨论
随着塑料制品的生产、使用和废弃,PAEs越来越多地渗透到环境中。由于PAEs是亲脂性化合物,正辛醇-水分配系数(Kow)值较高,因而在水中的挥发损失小,进入水环境的PAEs很难向大气环境迁移转化,易于从水中吸附到沉积物以及土壤等有机物中。表6汇总了DEP在水样和底泥样本中的分布情况,可以看出DEP分布广泛,在水样中的含量可达数十ng·mL-1水平,而底泥样本中DEP含量显著高于水样,最高达上千ng·g-1水平。
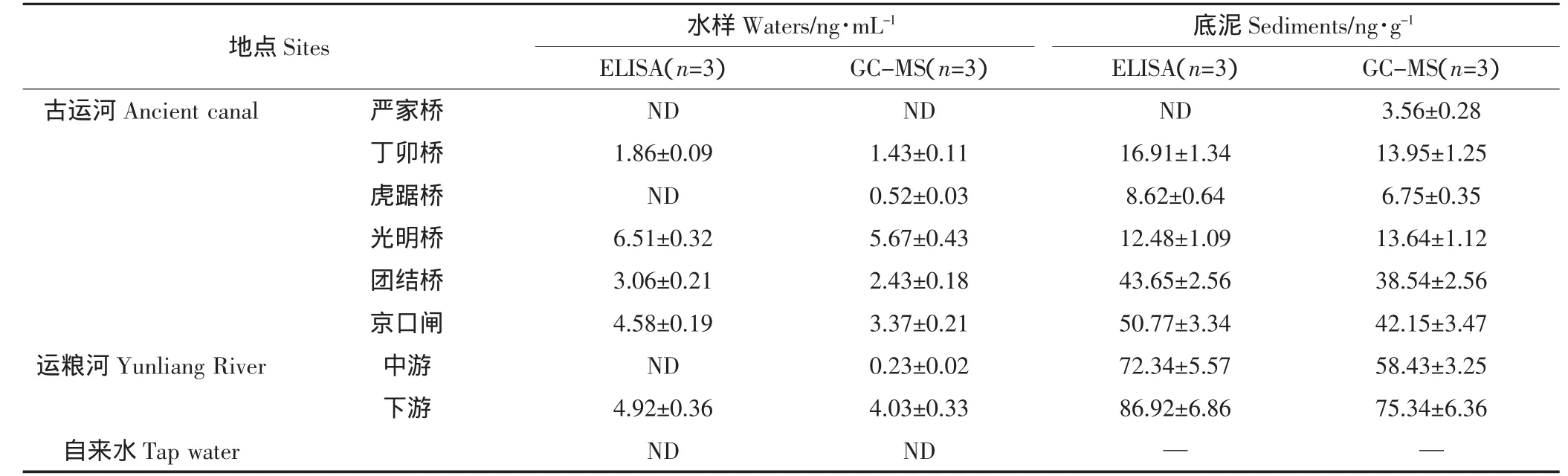
表5 镇江市内水样和底泥样本中的DEP含量Table 5 Analysis DEP in real waters and sediments samples
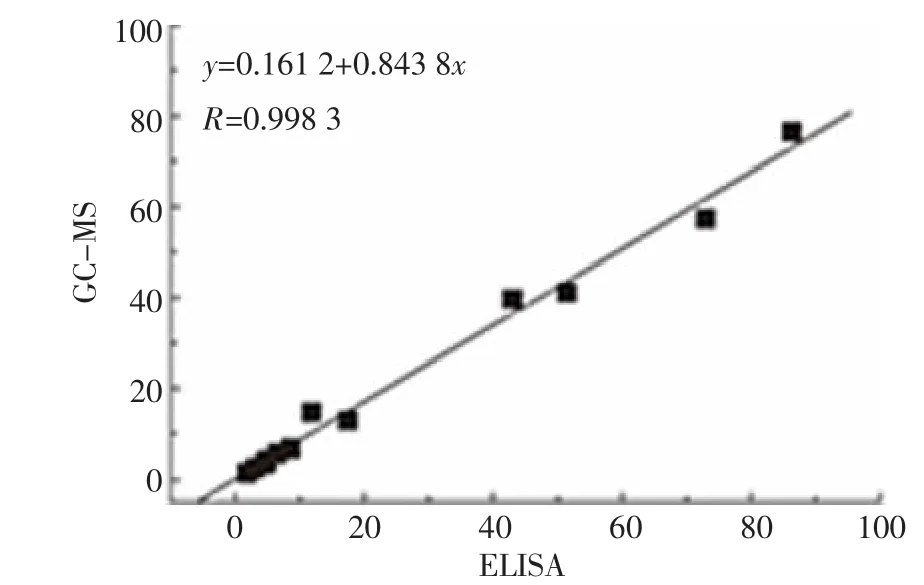
图3 ELISA结果和GC-MS结果相关性分析Figure 3 Correlation analysis of the results of ELISA and GC-MS
建立快速、灵敏的分析方法监测环境样本中DEP的分布状况,是评价DEP生态风险的重要手段。常规仪器分析方法因设备昂贵、需要专业人员等缺陷,不适用于大量环境样本的快速筛选与分析。ELISA方法以抗原-抗体特异性结合为基础,通过酶促反应放大信号,从而实现痕量物质的快速检测。其中特异性抗体是ELISA方法建立的关键因素,其灵敏度、特异性等直接影响方法的检测性能。DEP分子量较小,不能诱导动物机体产生免疫反应,因此需将其与大分子载体蛋白(如牛血清白蛋白、卵清白蛋白等)偶联,免疫动物才能获得相应的抗体。因此,DEP抗体的获得较为困难,目前基于DEP抗体的免疫分析方法报道较少。Zhang等[29]建立了直接竞争ELISA方法,检测范围在0.1~3500 ng·mL-1,并用于环境水样的检测;随后,Zhang等[30]又建立了间接竞争ELISA方法,检测范围缩小到0.005~18.6 ng·mL-1。相对于文献报道,本研究所建立的方法灵敏度有一定的差距,主要原因可能与所使用的抗体灵敏度不高有关。由于环境样本,尤其是水样中污染物浓度偏低,许多分析方法(包括LC-MS/MS等仪器分析方法)的固有灵敏度并不足以分析环境样本中的痕量污染物。因此,样品前处理时进行相应的富集,富集倍数因其前处理方法差异而不同,通常可达数十乃至数百倍。在本研究中,ELISA方法固有灵敏度为8.2 ng·mL-1,但经过前处理的10倍富集后检测限可达到1.19 ng·mL-1,完全可以满足水样中痕量DEP的分析要求。
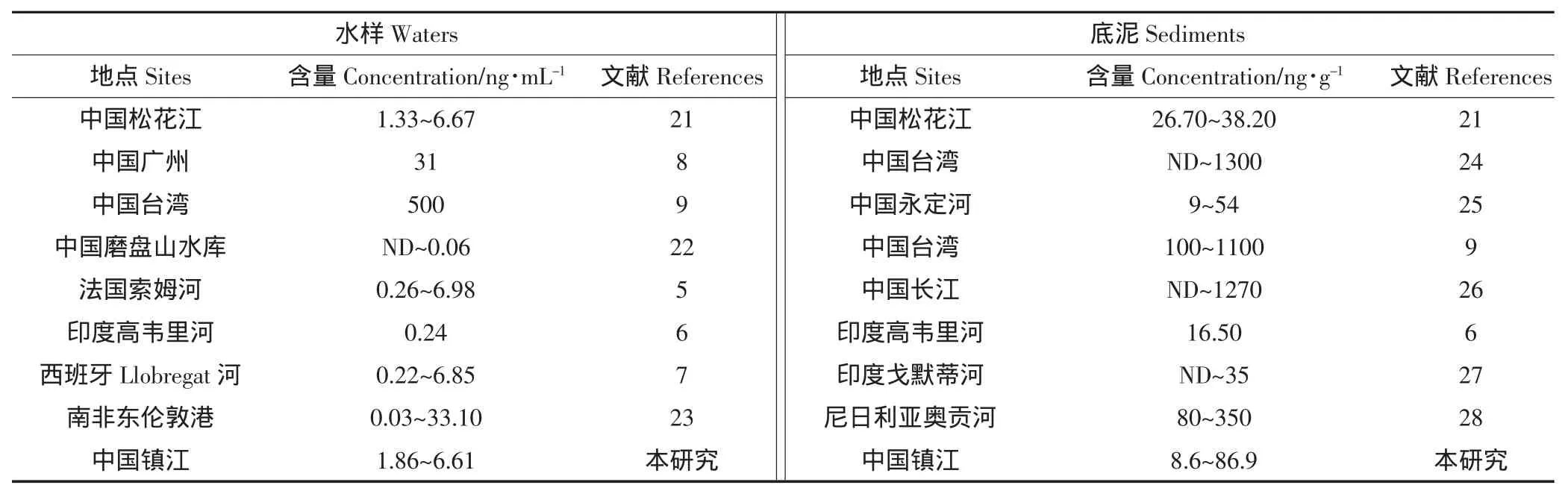
表6 DEP在水样和底泥样本中的分布情况Table 6 Occurrence of DEP in waters and sediments samples
对镇江市内古运河以及运粮河水样及底泥样本的检测结果可以看出,DEP污染较为严重,检出率分别为62.5%(水样)和87.5%(底泥),原因可能是由于河流周边人口密集,加剧了污染的发生。与其他各地水体中的DEP浓度相比,镇江水体中的DEP浓度与中国松花江、法国索姆河以及西班牙Llobregat河等接近。虽然我国目前未出台针对地表水中DEP的限量标准,但水体中DEP的严重污染也应引起我们的足够重视。底泥中的DEP的检出率高于水体,并且其含量也高于同一采样点水体中DEP的浓度,这一结果可能是由于DEP易于从水中吸附到沉积物中。底泥沉积于河底,随着时间延长,DEP等污染物不断积累、吸附,容易造成新的生态环境隐患。
4 结论
采用DEP多克隆抗体建立的间接竞争ELISA法,优化反应条件后,方法的检测范围为20~320 ng· mL-1,IC50为72 ng·mL-1,最低检测限为8.2 ng·mL-1。该方法具有较高的特异性,与其他邻苯二甲酸酯类似物几乎无交叉反应。ELISA方法准确性高,与仪器方法比对具有较好的一致性。以建立的方法检测了镇江市内水体中水样和底泥样本中DEP,发现环境样本中DEP有较高的检出率。酶联免疫分析方法的建立可为环境中塑化剂分布研究,进而评估其生态风险提供有效的技术手段。
[1]张军伟.食品中塑化剂分析方法研究综述[J].中国科技信息,2014(8):77-78.
ZHANG Jun-wei.Review of analysis methods for plasticizer in food analysis[J].China Science and Technology Information,2014(8):77-78.
[2]雷艳虹.常见塑化剂简介[J].化学教学,2013(4):71-73.
LEI Yan-hong.Brief introduction for plasticizers[J].Education in Chemistry,2013(4):71-73.
[3]陈海婷,魏丹毅,郭智勇.邻苯二甲酸酯类增塑剂的分析方法研究进展[J].塑料助剂,2008,67(1):17-21.
CHEN Hai-ting,WEI Dan-yi,GUO Zhi-yong.Progress in the analysis of phthalic acid esters[J].Plastics Additives,2008,67(1):17-21.
[4]Jobling S,Reynolds T,White R,et al.A variety of environmentally persistent chemicals,including some phthalate plasticizers,are weakly estrogenic[J].Environmental Health Perspectives,1995,103(6):582-587.
[5]Net S,Dumoulin D,El-Osmani R,et al.Case study of PAHs,Me-PAHs, PCBs,phthalates and pesticides contamination in the Somme River water,France[J].International Journal of Environmental Research,2014,8(4):1159-1170.
[6]Selvaraj K K,Sundaramoorthy G,Ravichandran P K,et al.Phthalate esters in water and sediments of the Kaveri River,India:Environmental levels and ecotoxicological evaluations[J].Environmental Geochemistry and Health,2015,37(1):83-96.
[7]Céspedes R,Lacorte S,Raldúa D,et al.Distribution of endocrine disruptors in the Llobregat River basin(Catalonia,NE Spain)[J].Chemosphere,2005,61(11):1710-1719.
[8]Zeng F,Cui K,Xie Z,et al.Occurrence of phthalate esters in water and sediment of urban lakes in a subtropical city,Ghangzhou,South China [J].Environment International,2008,34(3):372-380.
[9]Yuan S Y,Liu C,Liao C S,et al.Occurrence and microbial degradation of phthalate esters in Taiwan river sediments[J].Chemosphere,2002,49(10):1295-1299.
[10]周开胜,吕超田,杨刚,等.水体中酞酸酯类环境激素污染及生物降解研究进展[J].环境科技,2009,22(4):56-59.
ZHOU Kai-sheng,LÜ Chao-tian,YANG Gang,et al.Research progress on pollution and biodegradation of environmental hormone-phthalate esters in water[J].Environmental Science and Technology,2009,22(4):56-59.
[11]Call D J,Markee T P,Geiger D L,et al.An assessment of the toxicity ofphthalate esters to freshwater benthos.1.Aqueous exposures[J].Environmental Toxicology and Chemistry,2001,20(8):1798-1804.
[12]Yang J,Hauser R,Goldman R H.Taiwan food scandal:The illegal use of phthalates as a clouding agent and their contribution to maternal exposure[J].Food and Chemical Toxicology,2013,58:362-368.
[13]Crinnion W J.Toxic effects of the easily avoidable phthalates and parabens[J].Alternative Medicine Review,2010,15(3):190-197.
[14]Ventrice P,Ventrice D,Russo E,et al.Phthalates:European regulation,chemistry,pharmacokinetic and related toxicity[J].Environmental Toxicology and Pharmacology,2013,36(1):88-96.
[15]Schecter A,Lorber M,Guo Y,et al.Phthalate concentrations and dietary exposure from food purchased in New York State[J].Environmental Health Perspectives(Online),2013,121(4):473.
[16]Batlle R,Nerín C.Application of single-drop microextraction to the determination of dialkyl phthalate esters in food simulants[J].Journal of Chromatography A,2004,1045(1):29-35.
[17]Fierens T,Servaes K,Van Holderbeke M,et al.Analysis of phthalates in food products and packaging materials sold on the Belgian market[J]. Food and Chemical Toxicology,2012,50(7):2575-2583.
[18]Holadová K,Proku°pková G,Hajšlová J,et al.Headspace solid-phase microextraction of phthalic acid esters from vegetable oil employing solvent based matrix modification[J].Analytica Chimica Acta,2007, 582(1):24-33.
[19]Khosravi K,Price G W.Determination of phthalates in soils and biosolids using accelerated solvent extraction coupled with SPE cleanup and GC-MS quantification[J].Microchemical Journal,2015, 121:205-212.
[20]刘艳梅,钟辉,黄建芳,等.直接竞争ELISA检测大米样品中的重金属镉[J].免疫学杂志,2015,31(6):528-532.
LIU Yan-mei,ZHONG Hui,HUANG Jian-fang,et al.Amplification of direct competition ELISA in cadmium ions detection of rice samples[J]. Immunological Journal,2015,31(6):528-532.
[21]Gao D,Li Z,Wen Z,et al.Occurrence and fate of phthalate esters in full-scale domestic wastewater treatment plants and their impact on receiving waters along the Songhua River in China[J].Chemosphere, 2014,95:24-32.
[22]Liu Y,Chen Z,Shen J.Occurrence and removal characteristics of phthalate esters from typical water sources in Northeast China[J].Journal of analytical methods in chemistry,2013,2013(2):606-612.
[23]Fatoki O S,Noma A.Solid phase extraction method for selective determination of phthalate esters in the aquatic environment[J].Water,Air, and Soil Pollution,2002,140(1/2/3/4):85-98.
[24]Huang P C,Tien C J,Sun Y M,et al.Occurrence of phthalates in sediment and biota:Relationship to aquatic factors and the biota-sediment accumulation factor[J].Chemosphere,2008,73(4):539-544.
[25]Wang X T,Ma L L,Sun Y Z,et al.Phthalate esters in sediments from guanting reservoir and the Yongding River,Beijing,People′s Republic of China[J].Bulletin of Environmental Contamination and Toxicology, 2006,76(5):799-806.
[26]Wang F,Xia X,Sha Y.Distribution of phthalic acid esters in Wuhan section of the Yangtze River,China[J].Journal of Hazardous Materials,2008,154(1):317-324.
[27]Srivastava A,Sharma V P,Tripathi R,et al.Occurrence of phthalic acid esters in Gomti River Sediment,India[J].Environmental Monitoring and Assessment,2010,169(1-4):397-406.
[28]Adeniyi A A,Okedeyi O O,Yusuf K A.Flame ionization gas chromatographic determination of phthalate esters in water,surface sediments and fish species in the Ogun river catchments,Ketu,Lagos,Nigeria[J]. Environmental Monitoring and Assessment,2011,172(1/2/3/4):561-569.
[29]Zhang M,Cong Y,Sheng Y,et al.A direct competitive enzyme-linked immunosorbent assay by antibody coated for diethyl phthalate analysis [J].Analytical Biochemistry,2010,406(1):24-28.
[30]Zhang M,Yu X,Wang Y,et al.A highly sensitive indirect competitive enzyme-linked immunosorbent assay(ic-ELISA)by antigen coating for diethyl phthalate analysis in foods[J].Food Analytical Methods, 2013,6(4):1223-1228.
Development of a enzyme-linked immunosorbent assay for diethyl phthalate analysis in water and sediment samples from rivers in Zhenjiang City
ZENG Kun1,2,ZHOU Jun1,SHAO Jie1,ZHANG Zhen1*
(1.College of Environmental and Safety Engineering,Jiangsu University,Zhenjiang 212013,China;2.Institute of Environment and Ecology, Jiangsu University,Zhenjiang 212013,China)
Based on a polyclonal antibody targeting diethyl phthalate(DEP),a sensitive indirect competitive enzyme-linked immunosorbent assay(ELISA)was proposed and several parameters were investigated.Under the optimized conditions,the developed method showed high sensitivity to DEP(the limit of detection,8.2 ng·mL-1)and high selectivity with cross-reactivities less than 4.29%to seven structurally related phthalate esters.The linear range was from 20 ng·mL-1to 320 ng·mL-1.The recoveries(90.46%~122.75%)and reproducibility(CV of intra-assay,3.38%~9.09%;CV of inter-assay,3.76%~12.78%)were satisfactory.Our proposed ELISA indicated that it had good agreement with those given by GC-MS,which was applied to detect DEP in waters and sediments from ancient canal and Yunliang River.And DEP was found in most of target areas(the detection rate,62.5%in waters and 87.5%in sediments),the concentration was up to 6.61 ng·mL-1and 86.9 ng·g-1in water and sediments,respectively.
plasticizer;DEP;antibody
X78
A
1672-2043(2016)11-2237-08
10.11654/jaes.2016-0303
2016-03-10
国家自然科学基金项目(31502118,21577051);江苏省自然科学基金项目(BK20130507);中国博士后基金项目(2013M541606)
曾昆(1980—),女,湖北襄阳人,博士,讲师,从事污染物快速分析研究。E-mail:kjj80116@163.com
*通信作者:张祯E-mail:zhzhenok@163.com
曾昆,周军,邵杰,等.应用酶联免疫分析方法检测镇江市内水域水样和底泥中的邻苯二甲酸二乙酯[J].农业环境科学学报,2016,35(11):2237-2244.
ZENG Kun,ZHOU Jun,SHAO Jie,et al.Development of a enzyme-linked immunosorbent assay for diethyl phthalate analysis in water and sediment samples from rivers in Zhenjiang City[J].Journal of Agro-Environment Science,2016,35(11):2237-2244.
邻苯二甲酸酯(Phthalate esters,PAEs)类塑化剂广泛应用于塑料及一次性塑料消费品,还可以作为原料用于香味剂、化妆品和冷凝剂[1-3]。随着工业生产的发展及塑料制品的大量使用,PAEs已经成为全球性最普遍的一类污染物[4]。其中邻苯二甲酸二乙酯(Diethyl phthalate,DEP)是PAEs中的重要成员,近年来被越来越多地用作增塑剂和食品添加剂[11],在法国[5]、印度[6]、西班牙[7]以及我国广州[8]、台湾[9]等地区的水体和底泥中均有检出。研究表明DEP是一类影响严重的环境激素,易造成生物体内分泌失调,引起生殖功能障碍,甚至还会诱发恶性肿瘤[10-14]。我国生活饮用水卫生标准(GB 5749—2006)中规定DEP的限值为0.003 mg·L-1。因此,建立简单、快速、高通量的分析方法,对环境水体和底泥中此类污染物进行分析尤为必要。

