白洋淀沉水植物腐解释放溶解性有机物光谱特性
洪志强,熊 瑛,李 艳,崔 骏,刘钰钦,何江伟,王京刚,袁冬海,*
1 北京化工大学环境系, 北京 100029 2 北京建筑大学,北京应对气候变化研究与人才培养基地,北京市可持续城市水系统构建与风险控制工程技术研究中心,北京 100044 3 鞍钢集团工程技术有限公司能源环保事业部,鞍山 114002 4 北京师范大学环境学院,北京 100875
白洋淀沉水植物腐解释放溶解性有机物光谱特性
洪志强1,2,熊 瑛2,李 艳3,崔 骏4,刘钰钦1,何江伟2,王京刚1,袁冬海2,*
1 北京化工大学环境系, 北京 100029 2 北京建筑大学,北京应对气候变化研究与人才培养基地,北京市可持续城市水系统构建与风险控制工程技术研究中心,北京 100044 3 鞍钢集团工程技术有限公司能源环保事业部,鞍山 114002 4 北京师范大学环境学院,北京 100875
利用水生植物修复受污染水体中,水生植物在秋冬季节腐烂分解会释放大量溶解性有机物(DOM),DOM可影响水环境中污染物的迁移转化,对水体中的化学和生物过程产生一定影响。因此利用紫外可见光光谱(UV-vis)结合平行因子分析法(PARAFAC)和主成分分析法(PCA)来表征和分析水生植物腐解产物中DOM的组分及其特点。UV-vis的研究表明随着腐解时间的增加,样品中DOM的腐殖化程度逐渐升高,当腐殖化程度达到最高值时,腐解进入矿化阶段,此时腐殖化程度逐渐降低。通过PARAFAC分析可以分离出3种类蛋白组分(C1、C2和C5)和2种类腐殖酸组分(C3和C4)。由PCA可以得出在腐解初期,类蛋白组分占据主导地位;随着腐解时间的增加,类蛋白组分含量逐渐降低,而类腐殖酸组分含量逐渐升高。
水生植物腐解;溶解性有机物(DOM);平行因子(PARAFAC);主成分分析(PCA);光谱特性
白洋淀是我国北方地区最大的草型湖泊之一,具有调节小气候和提供饮用水源的功能,同时可发展旅游和水产养殖业等。随着周边及上游地区经济的快速发展,大量污水排入白洋淀上游河道中,导致白洋淀水体污染严重,如重金属和有机污染物含量超标。白洋淀作为典型的草型湖泊,可以考虑使用大量现存的水生植物对水体进行修复。利用水生植物修复技术可以有效地吸收氮、磷和重金属等污染物[1],修复污染水体,改善水体水质,促进有机物的矿化作用,达到控制富营养化和恢复并重建水体生态环境的目的[2]。
由于水生植物在秋冬季节腐烂分解,会释放出大量的营养盐类物质,致使水体遭受二次污染的风险。潘慧云等[3]研究发现,苦草、金鱼藻衰亡后,其有机质分解造成水体处于厌氧状态,促进了沉积物中磷的释放。李文朝[4]的研究表明,一些浅水湖泊中茭草的腐烂分解造成了水质的恶化,形成“茭黄水”现象。此外水生植物腐解还会释放出大量溶解性有机物(DOM),这是秋冬季节DOM的主要来源之一[5]。DOM是一类由植物和微生物降解所产生的、普遍存在于自然水体中的有机物,它的存在影响自然水体中的化学和生物过程[6-7]。DOM可与水体中污染物质发生相互作用,影响水体中污染物的迁移转化和生物有效性。张璐璐等[8]采用Hakanson潜在生态风险指数法对白洋淀的重金属现状进行综合评价。结果表明,表层沉积物中重金属处于低风险水平,重金属含量的顺序为Zn>Cr>Cu>Pb>As>Cd>Hg。Chen等[9]对白洋淀鱼体中重金属含量进行分析并根据美国环保署标准发现鱼体中As和Hg的含量严重超标。而Plaze等[10]利用荧光技术研究污泥中的腐殖酸与Cu、Zn、Pb、Cd的淬灭效果,研究结果表明不同重金属与腐殖酸的络合常数和结合容量不同,Pb和Cu的络合效果较好。
鉴于水生植物腐解过程释放的溶解性有机质分子结构复杂,且在一定程度上影响水体环境,因此需要综合利用多种分析技术表征不同腐解阶段释放有机质的特点,为科学评价水生植物腐解对水环境的影响提供基础。本研究成果可加深对水生植物腐解有机质释放对其周边环境效应的认识,有助于更好的利用水生植物对受损水体进行生态修复。
1 材料与方法
1.1 样品的采集
试验所使用的水生植物均为多年生沉水植物,包括轮藻、金鱼藻、马来眼子菜和蓖齿眼子菜,其质量比设定为1∶1∶1∶1。多年生草本植物地上部分容易腐解,而地下部分存活时间较长。由于其地上部分和地下部分的分解节律不同,这里仅选用水生植物地上部分(茎、叶)作为实验材料。通过对白洋淀单位面积生物量的多次调查发现其生物量密度在0—5 kg/m2范围之间波动。因此,本实验设置6个不同的生物量梯度:0、0.5、1、3、5、8 kg/m2。将采集的沉水植物用水反复冲洗,再用蒸馏水进行漂洗,去除其表面杂质后进行风干,将风干后的植物放置于烘箱中烘干至恒量,保存在干燥处待用。
实验设置6个高为90 cm,直径为70 cm的圆柱形塑料桶。桶底统一铺设20 cm厚的白洋淀底泥,向6个桶中分别添加烘干的水生植物残体,使其生物量密度分别为0、0.5、1、3、5、8 kg/m2,分别记为U0、U1、U2、U3、U4和U5,然后注入约40 cm高的湖水。为了保证实验条件在最大程度上贴近白洋淀的自然环境,将6个塑料桶放置于白洋淀岸边,并且每周向桶内补充一定量相同体积的湖水,来弥补由于蒸发导致的水分丧失。静置3d后,以2012年9月20日作为腐解实验的第一次采样时间。实验共采集4次样本,分别为2012年9月,2012年12月,2013年3月和2013年6月,分别记为T1、T2、T3和T4批,每批采集6个样品。DOM样品采集于沉积物与上覆水交界处的上覆水样,所取样品保存在低温(≤4℃)条件下送回实验室。以7000 r/min的转速离心10 min后,将上清液通过0.45 μm滤膜,最终所得滤液保存在4℃下待用。
1.2 紫外吸收光谱测定
紫外吸收光谱是由装有紫外探针软件的电脑控制的双束光谱测定仪进行测定的。测定波长范围为200—700 nm,测定时使用1 cm的石英器皿在室温(20 ℃)下进行测定,每组实验都使用超纯水作为空白样进行校正。
1.3 溶解性有机碳(DOC)的测定
采用TOC-VCPN总有机碳分析仪对样品的有机碳含量进行测定,DOC的浓度可以近似用来表示DOM的浓度。在800℃的高温催化氧化条件下,将待测样品放入样品槽中,使用8%的HCl酸化,选用Non-Purgeable Organic Carbon(NPOC)的非挥发性有机碳模式测定。分别配置5、20、40、80、100 mg/L的邻苯二甲酸氢钾,采用标准曲线法得出待测样品的DOC值。本实验DOC的测定值为3次测定所得的平均值。
1.4 荧光光谱的测定
为了降低内过滤效应的影响,同时使样本具有可比性,在测定荧光光谱前,所有样本的DOC浓度统一使用超纯水稀释至小于等于10 mg/L[11]。使用Hitachi F- 4600荧光光谱测定仪进行荧光光谱的测量。光源为150 W的疝气灯,PMT电压为700 V。激发波长Ex的扫描范围为200—450 nm,发射波长Em的扫描范围为280—550 nm,扫描速度为2400 nm/min,响应时间为0.5 s。激发和发射光的带通均为5 nm。同步荧光光谱扫描范围Ex=250—600 nm,Δλ=Em-Ex= 55 nm。样品均在室温下测定,为了消除瑞利散射峰,所有光谱在使用前,需减去由超纯水测定的空白光谱[12-13]。样品所有参数的测定均在同一天内完成。
1.5 平行因子分析法
由于使用传统的激发发射光谱(EEMs)难以将DOM样品中重叠的荧光峰分离出来,因此使用平行因子法(PARAFAC)结合EEMs分析DOM样品已被广泛使用[14-15]。PARAFAC结合EEMs不仅可以分离出荧光峰的种类,还可以确定荧光峰的强弱[16],为DOM的定性和定量研究提供了科学依据。
PARAFAC是一种运用数学计算方法的研究手段,具体的是运用交替最小二乘法程序将N种组分分解成n种载荷矩阵。简而言之,三维荧光光谱数据组成一个三维的数据集I×J×K,I表示样品数量,J表示发射光谱数目,K表示激发光谱数目。PARAFAC将三维的数据集分解成3个矩阵标记为A(得分矩阵)、B和C(载荷矩阵),及元素aif、bjf和ckf。公式如下:

(1)
式中,f为某个荧光组分,F为荧光组分的总数目,本实验中,使用带有DOMFlour工具包的Matlab7.0软件进行PARAFAC分析[17-18]。分析步骤如下:(1)将每个研究样品的EEM减去纯净水的EEM图谱;(2)将所有扣除空白样的EEMs及标准化后的数据导入DOMFlour工具包中;(3)将EEMs图整理成三维的数据图,在PARAFAC分析中,运用各种分析方法再结合交替最小二乘法对PARAFAC模型求解;(4)计算出2到8个组分,由残差、平方误差和置信度等综合指标,得出最优组分和荧光强度。
1.6 主成分分析方法
使用科学的数据统计软件SPSS 16.0进行主成分分析(Principle component analysis;PCA)。PCA用于确定主要成分,它可以解释光谱“类型”,定义包含DOM中大量荧光光谱变化的复合物。潜在的非独立性的数据可以影响PCA的结果,因此应用Kaiser-Meyer-Olkin (KMO)和Bartlett的实验测试各个组分的相关性和独立性。同时,所有的光谱数据使用Varimax Raw运算法则进行旋转以获得主成分数据矩阵中最大的光谱变化和负荷。
2 结果与分析
2.1 紫外吸收光谱特性
通过对DOM样品进行紫外吸收光谱的全波长扫描,可以分析出DOM分子结构中部分官能团的性质。由于DOM分子结构中存在大量的且相互干扰的官能团,因此紫外可见光谱通常没有明显的特征峰(图1)。上覆水DOM样品的紫外吸收光谱具有相似的趋势,在200 nm到400 nm处,紫外吸收值随着波长的增加而迅速降低,在400 nm到700 nm处曲线趋于稳定。随着水生植物腐解时间的增加,上覆水DOM的紫外吸收值呈现出升高的趋势(图1A)。同样,随着生物量的增加,紫外吸收值逐渐上升,在达到最大值后,随着生物量的增加呈现降低的趋势。但仍高于未添加生物量时的紫外吸收值(图1B)。
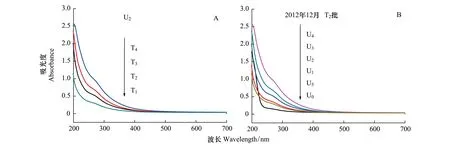
图1 上覆水DOM样品紫外吸收曲线Fig.1 The UV-Vis absorption curves of DOM samples in overlying water(A)样品U2在不同采样时间段的紫外吸收光谱变化;(B)T2批次不同样品的紫外吸收光谱比较
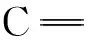
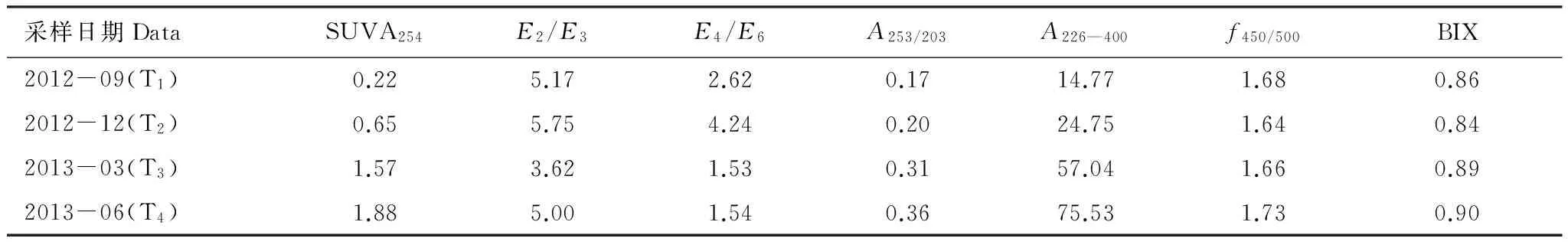
表1 DOM紫外吸收参数随时间的变化(U3样品)
通常将激发波长固定在370 nm处,所得到的在450 nm和500 nm处的发射波长比值称为荧光指数FI(Fluorescence Index,f450/500),f450/500可用于表征DOM的来源[23]。当f450/500在1.4左右时,认为DOM主要受陆源影响;当f450/500在1.9左右时,认为DOM主要受微生物源影响。T4批样品的f450/500变化范围为1.62—1.74(表2),表明上覆水DOM受陆源和微生物源共同作用。不同采样批次的f450/500值在1.64—1.73之间变化(表1),其中T4的f450/500较高,表明这个时段微生物活动相对强烈。
生物指数(Biological Index)BIX通常用来评价样品中由微生物活动所产生的新鲜DOM。BIX<0.6表示样品受微生物影响较弱[24]。T4批样品的BIX的变化范围为0.85—1.02之间(表2),其中U0具有较大的BIX值,表明U0中由微生物产生的新鲜的DOM较多,这是由于U0中未添加生物量,有机质含量较少,DOM主要来源于微生物的活动,因此造成样品中微生物来源相对贡献较大。在不同批次的样品中,T4的BIX较大,T2的BIX较小(表1),这是由于夏季微生物活动频繁,冬季微生物活动较少,从而使得不同阶段的BIX存在一定差异。
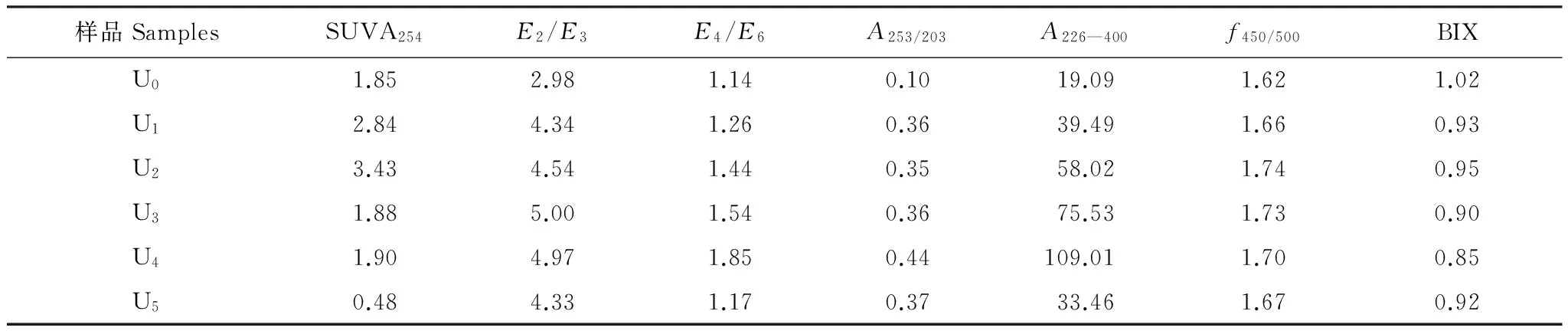
表2 T4批样品的紫外吸收参数(6月份)
E2/E3为吸光度在250 nm与365 nm处的比值,其常用来区分不同来源的DOM吸收特性[25],当E2/E3小于3.5时,主要反映DOM中胡敏酸的吸收特性,当比值大于3.5时,主要反映DOM中富里酸的吸收特性[23]。植物腐解样品中的E2/E3均大于3.5(表1和表2),说明上覆水DOM样品中以富里酸为主。而未添加生物量的样品U0,其比值小于3.5,表明其DOM主要以胡敏酸为主。E4/E6通常为465 nm处的吸光度值与665 nm吸光度值的比值,通常反应的是胡敏酸的腐殖化程度及芳香化合物的缩合程度[26]。样品U3在不同阶段中,E4/E6的变化范围为1.53—4.24(表1)。其中T2批次的平均值最大,表明在此阶段胡敏酸的缩合度和腐殖化程度比较高。在6月份的不同样品中,E4/E6的比值在1.14—1.85之间(表2),差异较小,并且与添加量成正比,到U4后开始降低。表明胡敏酸的芳香化程度随着植物量的增多而呈现缓慢的上升趋势,而到达最大值后迅速降低,表明过量的生物量会导致腐殖化程度降低。
A253/203主要用来反映芳香环上取代基的种类及取代程度的高低。一般情况下,当芳香环上取代基中的脂肪链所占比例升高时,A253/203值降低,而当芳香环上的羟基、羧基、羰基和酯类等取代基的比例升高时,A253/203值升高[27]。表1显示出A253/203与腐解时间的长短有着明显的变化规律,A253/203的数值随着腐解时间的增加而升高,表明取代基由简单的链状结构向更为复杂的羧基、羟基等转变。U1—U5的A253/203值在0.35—0.44之间(表2)。U0的A253/203值为0.10,表明芳香环取代基的脂肪链含量较多,同时表明植物量的加入使上覆水DOM中芳香环取代基羧基、羰基、酯类的含量增多。
A226—400指紫外吸收光谱在226 nm至400 nm之间的积分面积,通常反映的是有机质的吸收光谱特征。其值越高,表示具有苯环结构的化合物所占比例较高。按照时间顺序,A226—400值逐渐升高(表1),表明随着腐解时间增长,DOM分子中苯环结构所占比例升高,越难分解。此外,样品U4的A226—400值最高,说明样品U4中具有苯环结构的化合物含量最高。
2.2 平行因子荧光组分分析
通过对不同阶段白洋淀水生植物腐解样品的EEMs进行平行因子分析,共有5种组分被分离出来(图2)。根据激发区间和发射区间的不同对其进行分类,可以得出组分C1(275 nm/300 nm)、C2(280 nm/350 nm)和C5(215(280) nm/325 nm)属于类蛋白组分,而组分C3(220(305) nm/400 nm)和C4(270 nm/455 nm)属于类腐殖酸组分。
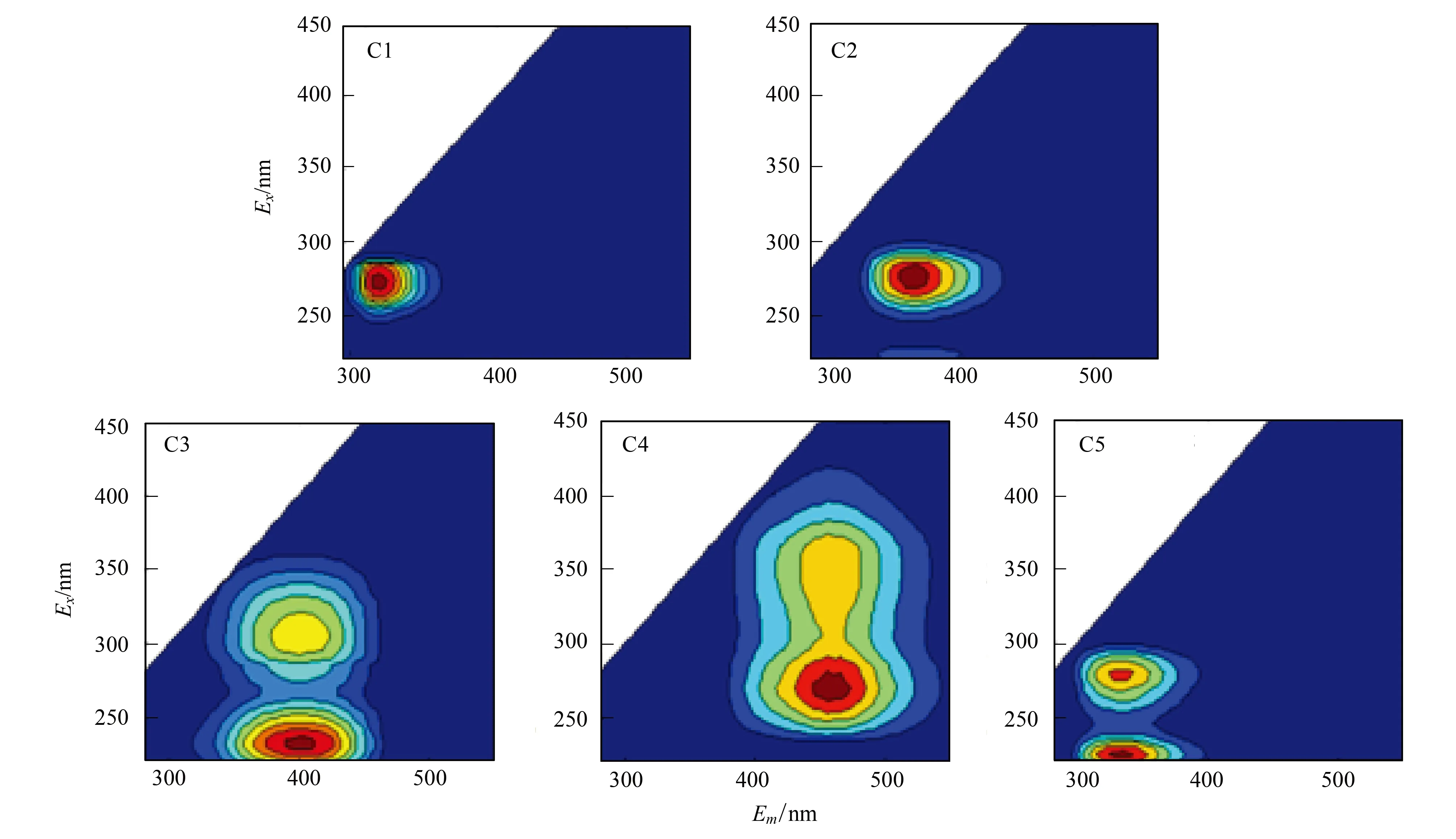
图2 平行因子组分荧光光谱图Fig.2 Fluorescence components identified by the PARAFAC model
表3指出水生植物腐解DOM组分的荧光峰位置和与先前研究结果的对比。其中C1在Ex/Em=275 nm/300 nm处出现单一峰,与Fellman等[28]研究得到的类酪氨酸组分(Ex/Em=270—275 nm/304—312 nm)在同一区间内,被认为是类酪氨酸组分。C2在Ex/Em=280 nm/350 nm出现的单峰与Coble等[29]发现的T峰(Ex/Em=275 nm /340 nm)相似,此峰被Coble认为是结合或游离态的类色氨酸峰。C3出现了双峰,与Williams等[30]研究得出的C1(Ex/Em=<260(305) nm/428 nm)相比,稍有蓝移,被认为是陆源及海洋类腐殖酸的混合组分。C4与先前研究相比也发生了蓝移,属于陆源类腐殖酸,此外,C4的Ex范围较大,介于225—415 nm之间,说明在C4中含有高芳香性或是大分子的荧光基团。C5在Ex/Em=215(280) nm/325 nm处出现双峰,然而之前并没有研究显示在215 nm/325 nm处的峰类型及特点。从C5的位置分布来看,C5为类色氨酸组分。

表3 水生植物腐解DOM五种组分的荧光峰位置及描述
2.3 DOM荧光组分主成分分析
为了进一步评价荧光组分的变化规律,使用由PARAFAC分析得出的荧光组分得分值进行PCA解析。在进行主成分分析前,对两个参数:KMO和P进行测试检验可以用来评估PCA的可行性。PCA显示参数KMO=0.93,P<0.001,通常KMO大于0.9,P值小于0.001就可以被视为适合PCA[35]。
对所有PARAFAC得出的荧光组分进行主成分分析后得出第一主成分和第二主成分分别占据荧光组分变化的48.31%和40.16%,两个主成分共占据了88.47%的变化。
F1=0.471C1+0.517C2+0.073C3+0.012C4+0.481C5
F2=0.052C1+0.069C2+0.610C3+0.681C4+0.004C5
通过主成分得分图3A可得出,5种组分均与主成分1和主成分2正相关。其中3个类蛋白组分C1、C2、C5具有高的F1负荷,更接近于PC1轴,同时主成分2的得分接近于0,表示主成分1中类蛋白物质占主导地位。陆源和海洋源的类腐殖酸组分C3和C4显示出高的F2负荷,更接近于PC2轴,表明主成分2中以腐植酸物质为主。本研究中将PCA与PARAFAC分析相结合可以分离DOM中不同特征的荧光组分,从而可以分辨不同样点荧光物质的特点及贡献率。

图3 PCA分析结合PARAFAC分离的四种组分Fig.3 PCA combined with PARAFACA: 主成分分析各组分因子负荷图The loading for the fluorescent components;B: 不同腐解时间所有样点PCA因子得分图The score of all the samples;C: 时间序列主成分因子得分图The score order by time;D. 不同时间样品主成分得分图The score of different time
将所有样品PCA的得分绘制于一张图中(图3B)。从图中可以看出部分点位主成分1的得分较高,其他点位的主成分2得分较高,大多数样品相对分散,表明水泥交界面处的样品中DOM组分会随着时间的变化而发生变化。图3C中显示出不同时间条件下表层水植物腐解样品的主成分分析图,T4时间段的样本主成分得分较为集中,其它月份较为分散,且主成分1得分明显低于主成分2得分,PC1从-0.98到-0.58,均为负值,PC2得分从0.87到1.72。表明2013年6月DOM的行为主要受主成分2的影响,类腐植酸物质的贡献较大。
为了进一步分析样品的特征,按照采样时间和采样点对各个点位进行绘制主成分得分图(图3D)。结果表明,不同样本的主成分未呈现明显的差异,分析原因可能是因为其来源相同。按照时间序列对其进行分析时发现,各个样点随时间的变化规律一致,腐解初期,主成分1的比例高于主成分2,DOM中以类蛋白物质为主,随着腐解的进行,主成分1与主成分2比例相似,表明DOM来源于类蛋白物质和类腐殖酸物质的共同作用,腐解后期呈现出主成分2的比例明显高于主成分1,说明此时DOM主要受类腐殖酸组分的影响。分析结果表明,水生植物的消亡过程会导致水体的蛋白质含量的变化,随着腐解时间的增加,类蛋白物质含量逐渐降低,类腐殖酸物质含量逐渐升高,腐烂分解后期主要受沉积物的内源释放和剧烈的生物矿化作用的影响[36]。
2.4 相关性分析
为了更清晰地分析DOM各个参数之间的相互关系,采用相关性分析对紫外和荧光指数进行相关系数的计算。SUVA254、E2/E3、E4/E6、A253/203和A226—400值能够用于表征DOM腐殖化程度、芳香化程度或缩合度和分子量的大小等。在紫外参数之间,E2/E3与A253/203存在显著地相关性(r=0.937,P<0.01)(表4),E4/E6与A226—400之间也表现为显著正相关关系(r=0.993,P<0.01)(表4),然而芳香腐殖化指数SUVA254与其它参数的相关关系并不明显,其它的文献中也并未说明SUVA254与其他参数的相关性。
生物指数(Biotic Index)BIX与腐殖化指数E2/E3、A253/203和A226—400均存在显著负相关关系(相关系数分别为r=-0.906,-0.920,-0.856)。E2/E3与f450/500的结果表明,两者之间存在着显著正相关关系(r=0.826,P<0.05),Wang等[37]的研究发现,E2/E3与腐殖化程度和分子量大小存在负相关性,E2/E3的值越小,表明腐殖化程度越高,DOM分子量越大。因此可以推断荧光指数f450/500与腐殖化程度之间存在着负相关性,这个结论与郭旭晶[38]对乌梁素海水体进行相关性分析的结论一致。
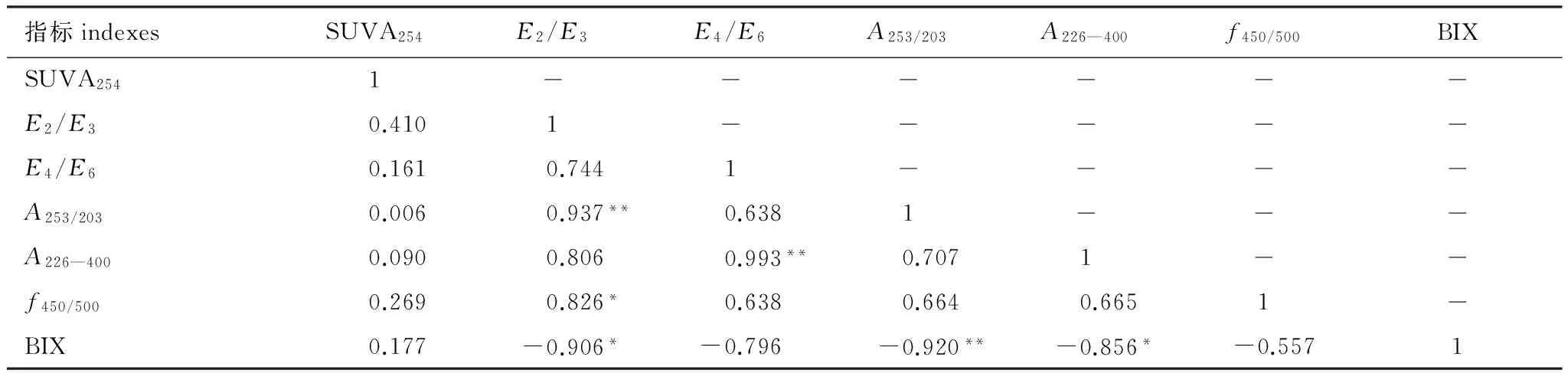
表4 紫外光谱参数与荧光指数的相关性
*P<0.05;**P<0.01
通过对平行因子各个组分之间的相关性进行研究,发现C3与C4具有较高的显著性水平(r=0.932,P<0.01)(表5)。同时C1、C2和C5之间也存在较高的显著性水平。进一步证明了两种腐殖酸组分和三种类蛋白质组分分别具有相同的来源与组分特征。
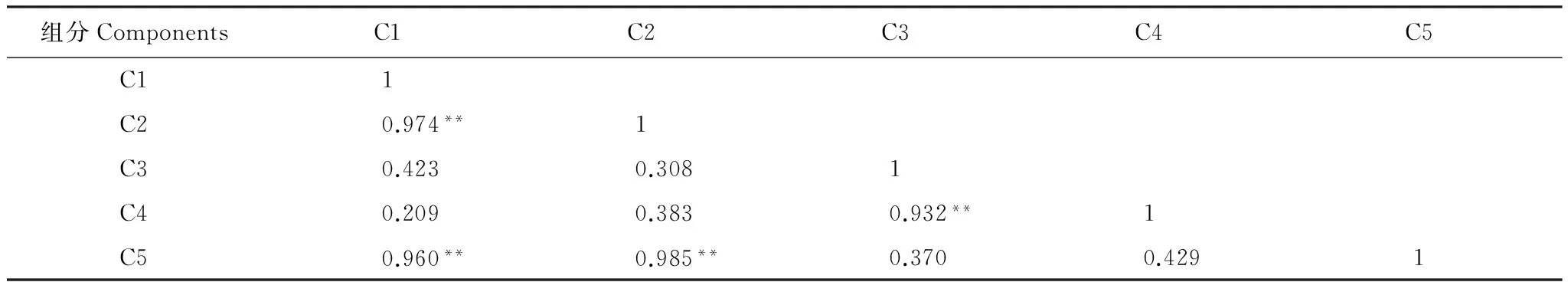
表5 平行因子各组分之间相关性
*P<0.05; **P<0.01
3 结论
本实验运用UV-vis和EEM结合PARAFAC和PCA等分析方法对白洋淀不同水生植物腐解量及不同腐解时间的上覆水DOM进行了研究。其结果表明:
(1)UV-vis能够有效的评估DOM的宏观结构和来源。腐殖化指数显示出样品的芳香化程度呈现出先增大后减小的趋势,未添加任何植物量的U0样品腐殖化程度最低。对紫外指数SUVA254、A253/203和A226—400的研究表明,随着腐解时间的增长,DOM分子结构越来越复杂,缩合度和腐殖化程度越来越高,更难于被微生物所降解利用。
(2)通过PARAFAC共分离出5种荧光组分,3种为类蛋白组分(C1、C2、C5),两种为类腐植酸组分(C3、C4)。利用PCA对PARAFAC的结果进一步判断得出C1、C2、C5与主成分1明显正相关,C3、C4与主成分2明显正相关。按照腐解时间顺序,腐解初期类蛋白组分在DOM样品中占据主导地位;腐解中期DOM样品受类蛋白与类腐殖酸组分共同作用,腐解后期腐殖酸物质占主导地位,并随着腐解时间的增加逐渐进入矿化阶段。
[1] Sooknah R D, Wilkie A C. Nutrient removal by floating aquatic macrophytes cultured in anaerobically digested flushed dairy manure wastewater. Ecological Engineering, 2004, 22(1): 27- 42.
[2] 秦伯强. 湖泊生态恢复的基本原理与实现. 生态学报, 2007, 27(11): 4848- 4858.
[3] 潘慧云, 徐小花, 高士祥. 沉水植物衰亡过程中营养盐的释放过程及规律. 环境科学研究, 2008, 21(1): 64- 68.
[4] 李文朝. 东太湖茭黄水发生原因与防治对策探讨. 湖泊科学, 1997, 9(4): 364- 368.
[5] Zhang Y L, Liu X H, Wang M Z, Qin B Q. Compositional differences of chromophoric dissolved organic matter derived from phytoplankton and macrophytes. Organic Geochemistry, 2013, 55: 26- 37.
[6] Kwon B, Lee S, Cho J, Ahn H, Lee D, Shin H S. Biodegradability, DBP formation, and membrane fouling potential of natural organic matter: characterization and controllability. Environmental Science & Technology, 2005, 39(3): 732- 739.
[7] Bonnie A L, Rose M C, Howard S W. Changes in dissolved organic matter fluorescence and disinfection byproduct formation from UV and subsequent chlorination/chloramination. Journal of Hazardous Materials, 2014, 264: 411- 419.
[8] 张璐璐, 刘静玲, 李毅. 白洋淀底栖动物群落特征与重金属潜在生态风险的相关性研究. 农业环境科学学报, 2013, 32(3): 612- 621.
[9] Chen C Y, Pickhardt P C, Xu M Q, Folt C L. Mercury and arsenic bioaccumulation and eutrophication in Baiyangdian Lake, China. Water, Air, and Soil Pollutant, 2008, 190(1/4): 115- 127.
[10] Plaza C, Brunetti G, Senesi N, Polo A. Molecular and quantitative analysis of metal ion binding to humic acids from sewage sludge and sludge-amended soils by fluorescence spectroscopy. Environmental Science & Technology, 2006, 40(3): 917- 923.
[11] Ohno T. Fluorescence inner-filtering correction for determining the humification index of dissolved organic matter. Environmental Science & Technology, 2002, 36(4): 742- 746.
[12] Baker A, Curry M. Fluorescence of leachates from three contrasting landfills. Water Research, 2004, 38(10): 2605- 2613.
[13] Hudson N, Baker A, Reynolds D. Fluorescence analysis of dissolved organic matter in natural, waste and polluted waters - a review. River Research and Applications, 2007, 23(6): 631- 649.
[14] Stedmon C A, Markager S. Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis. Limnology and Oceanography, 2005, 50(2): 686- 697.
[15] Stedmon C A, Markager S. Tracing the production and degradation of autochthonous fractions of dissolved organic matter by fluorescence analysis. Limnology and Oceanography, 2005, 50(5): 1415- 1426.
[16] Yao X, Zhang Y L, Zhu G W, Qin B Q, Feng L Q, Cai L L, Gao G. Resolving the variability of CDOM fluorescence to differentiate the sources and fate of DOM in Lake Taihu and its tributaries. Chemosphere, 2011, 82(2): 145- 155.
[17] Smilde A, Bro R, Geladi P. Multi-Way Analysis: Applications in the Chemical Sciences. Chichester: Wiley, 2004.
[18] Lyes L, Victor A, Thierry A. PARAFAC analysis of front-face fluorescence data: Absorption and scattering effects assessed by means of Monte Carlo simulations. Chemometrics and Intelligent Laboratory Systems, 2012, 116: 112- 122.
[19] Shao Z H, He P J, Zhang D Q, Shao L M. Characterization of water-extractable organic matter during the biostabilization of municipal solid waste. Journal of Hazardous Materials, 2009, 164(2- 3): 1191- 1197.
[20] He X S, Xi B D, Wei Z M, Guo X J, Li M X, An D, Liu H L. Spectroscopic characterization of water extractable organic matter during composting of municipal solid waste. Chemosphere, 2011, 82(4): 541- 548.
[21] Nishijima W, Speitel G E Jr. Fate of biodegradable dissolved organic carbon produced by ozonation on biological activated carbon. Chemosphere, 2004, 56(2): 113- 119.
[22] 李翠兰, 张晋京, 窦森, 任志成. 玉米秸秆分解期间土壤腐殖质数量动态变化的研究. 吉林农业大学学报, 2009, 31(6): 729- 732.
[23] Yuan D H, He L S, Xi B D, Yan C L, Zhang L Y, Huo S L, Liu H L. Characterization of Natural Organic Matter (NOM) in waters and sediment pore waters from Lake Baiyangdian, China. Fresenius Environmental Bulletin, 2011, 20(4A): 1027- 1035.
[24] Huguet A, Vacher L, Relexans S, Froidefond J M, Parlanti E. Properties of fluorescent dissolved organic matter in the Gironde Estuary. Organic Geochemistry, 2009, 40(6): 706- 719.
[25] Fialho L L, da Silva W T L, Milori D M B P, Simões M L, Martin-Neto L. Characterization of organic matter from composting of different residues by physicochemical and spectroscopic methods. Bioresource Technology, 2010, 101(6): 1927- 1934.
[26] Kang K H, Shin H S, Park H. Characterization of humic substances present in landfill leachates with different landfill ages and its implications. Water Research, 2002, 36(16): 4023- 4032.
[27] Kumke M U, Specht C H, Brinkmann T, Frimmel F H. Alkaline hydrolysis of humic substances—spectroscopic and chromatographic investigations. Chemosphere, 2001, 45(6/7): 1023- 1031.
[28] Fellman J B, Hood E, Spencer R G M. Fluorescence spectroscopy opens new windows into dissolved organic matter dynamics in freshwater ecosystems: A review. Limnology and Oceanography, 2010, 55(6): 2452- 2462.
[29] Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy. Marine Chemistry, 1996, 51(4): 325- 346.
[30] Williams C J, Yamashita Y, Wilson H F, Jaffé R, Xenopoulos M A. Unraveling the role of land use and microbial activity in shaping dissolved organic matter characteristics in stream ecosystems. Limnology and Oceanography, 2010, 55(3): 1159- 1171.
[31] Cory R M, McKnight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter. Environmental Science & Technology, 2005, 39(21): 8142- 8149.
[32] Stedmon C A, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial. Limnology and Oceanography: Methods, 2008, 6(11): 572- 579.
[33] Stedmon C A, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy. Marine Chemistry, 2003, 82(3/4): 239- 254.
[34] Guo W D, Yang L Y, Hong H S, Stedmon C A, Wang F L, Xu J, Xie Y Y. Assessing the dynamics of chromophoric dissolved organic matter in a subtropical estuary using parallel factor analysis. Marine Chemistry, 2011, 124(1/4): 125- 133.
[35] Guo X J, Yuan D H, Jiang J Y, Zhang H, Deng Y. Detection of dissolved organic matter in saline-alkali soils using synchronous fluorescence spectroscopy and principal component analysis. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2013, 104: 280- 286.
[36] Burdige D J, Kline S W, Chen W H. Fluorescent dissolved organic matter in marine sediment pore waters. Marine Chemistry, 2004, 89(1/4): 289- 311.
[37] Wang L Y, Wu F C, Zhang R Y, Li W, Liao H Q. Characterization of dissolved organic matter fractions from Lake Hongfeng, Southwestern China Plateau. Journal of Environmental Sciences, 2009, 21(5): 581- 588.
[38] 郭旭晶. 乌梁素海DOM光谱特性及其与金属离子相互作用的研究. 北京师范大学, 2010.
The spectra characterization on dissolved organic matter of submerged plant decomposition in Lake Baiyangdian
HONG Zhiqiang1,2,XIONG Ying2,LI Yan3,CUI Jun4,LIU Yuqin1,HE Jiangwei2,WANG Jinggang1,YUAN Donghai2,*
1BeijingUniversityofChemicalTechnology,Beijing100029,China2BeijingClimateChangeResponseResearchandEducationCenter,BeijingEngineeringResearchCenterofSustainableUrbanWaterSystemConstructionandRiskControl,BeijingUniversityofCivilEngineeringandArchitecture,Beijing100044,China3EnergyandEnvironmentDepartment,AngangSteelEngineeringandTechnologyCo.,Ltd.,Anshan114002,China4SchoolofEnvironment,BeijingNormalUniversity,Beijing100875,China
Urban polluted landscape water was purified by macrophytes that absorb nutrients and degrade pollutants. However, macrophytes are decomposed in autumn and winter, affecting water quality since they release the absorbed nutrients and pollutants back into the environment. Meanwhile, dissolved organic matter (DOM) released by decomposing macrophytes sharply increases organic pollutants. Previous studies focused on the macrophyte-purified water, biodiversity maintenance of landscape water, and eco-culture lineage, but just a few of them studied the negative effects of urban polluted landscape water purified by macrophytes. DOM is a complex mixture of compounds, most of which remain unknown, because it is hard to separate and characterize them. These compounds affect the distribution of pollutants, such as heavy metals and organic pollutants that react with DOM to form an even more complex mixture. Lake Baiyangdian is one of the largest lakes in north China that serves as an aquaculture and aquatic natural reserve, and contributes to the adjustment of the surrounding climate and carbon cycling. In this study, we investigated the effect of DOM released by macrophyte decomposition during the winter in Lake Baiyangdian, where mounts of phytoplankton, emergent aquatic plants, and submerged plants are grown. We used UV-vis and fluorescence spectra combined with Parallel Factor (PARAFAC) and Principal Component Analysis (PCA) to study DOM released by macrophyte decomposition and reveal its humification degree, aromatic degree, and molecular weight. UV-vis results indicated that the number of plants positively affected the number of carboxyl, carbonyl, and esters groups in DOM molecular composition. The humification degree increased with increasing decomposition time, but it decreased after reaching the peak value, probably because decomposition process entered into the mineralization phase. PARAFAC provided more detailed information on the components in DOM samples that hardly detected by traditional peak picking. Five components were identified by PARAFAC, including 3 protein-like components (C1, C2, and C5) and 2 humic-like acid components (C3 and C4). C1 was classified as tyrosine-like group, C2 and C5 were classified as tryptophan-like groups, C4 was dominated by humic-like acid, and C3 was a combination of marine and terrestrial humic-like acids. Correlation analysis showed that C3 was significant positive correlated with C4, as well as C1, C2 with C5, results that indicated the close relationship of protein-like substances with humic-like acids. PCA provided information on the contribution of components in DOM samples. The results showed a relatively high factor 1 score in the beginning of decomposition, indicating that the protein-like substances were dominant. During the process of decomposition, the proportion of protein-like substances decreased and the humic-like substances increased. At the end of decomposition, the humic-like acids had a relative high proportion and were dominant in DOM samples
macrophyte decomposition; dissolved organic matter (DOM); parallel factor analysis (PARAFAC); principle component analysis (PCA); spectra characterization
国家自然科学基金资助项目(51578037,51209003)
2014- 07- 11;
日期:2016- 03- 18
10.5846/stxb201407111412
*通讯作者Corresponding author.E-mail: yuandongha@aliyun.com
洪志强,熊瑛,李艳,崔骏,刘钰钦,何江伟,王京刚,袁冬海.白洋淀沉水植物腐解释放溶解性有机物光谱特性.生态学报,2016,36(19):6308- 6317.
Hong Z Q,Xiong Y,Li Y,Cui J,Liu Y Q,He J W,Wang J G,Yuan D H.The spectra characterization on dissolved organic matter of submerged plant decomposition in Lake Baiyangdian.Acta Ecologica Sinica,2016,36(19):6308- 6317.

