季节性冻融期间土壤动物对高山草甸两种凋落叶失重的贡献
彭 艳,杨万勤,2,薛 樵,李 俊,王 滨,谭 波,2,吴福忠,2,*
1 四川农业大学生态林业研究所,高山森林生态系统定位研究站, 成都 611130 2 长江上游生态安全协同创新中心, 成都 611130 3 理县林业局, 理县 623100
季节性冻融期间土壤动物对高山草甸两种凋落叶失重的贡献
彭 艳1,杨万勤1,2,薛 樵3,李 俊1,王 滨1,谭 波1,2,吴福忠1,2,*
1 四川农业大学生态林业研究所,高山森林生态系统定位研究站, 成都 611130 2 长江上游生态安全协同创新中心, 成都 611130 3 理县林业局, 理县 623100
季节性冻融期间高山草甸凋落叶的分解可为生长季节植物生长提供必要的养分,对于维持生态系统物质循环和养分平衡具有重要作用。然而,土壤动物对凋落叶分解是否具有明显的贡献仍然缺乏一致认识。因此,以高山草甸代表性植物黄花亚菊(Ajanianubigena)和黑褐苔草(Carexatrofusca)凋落叶为研究对象,采用不同孔径凋落叶袋排除土壤动物的方法,研究冬季不同冻融时期(冻结前期、冻结期和融化期)土壤动物对凋落叶失重的贡献。整个季节性冻融期间土壤动物对黄花亚菊和黑褐苔草两种凋落叶失重率的作用分别为12.07%和4.03%,总贡献率分别为46.39%和24.14%。土壤动物对两种凋落叶失重率的作用均在融化期最大,而土壤动物对黄花亚菊凋落叶失重率的作用在冻结初期最小,土壤动物对黑褐苔草凋落叶失重率的作用在冻结期最小。整个季节性冻融期,土壤动物对凋落叶失重率的作用和贡献率与正积温和凋落叶初始C、N浓度和C/N比均呈显著的正相关关系。因此,季节性冻融期间土壤动物对高山草甸凋落叶分解具有明显的贡献,但这些过程受冻融格局和凋落叶初始质量的调控。
高山草甸;凋落叶质量损失;季节性冻融时期;土壤动物
高寒生态系统季节性冻融期间凋落叶分解不仅是物质循环和能量流动的关键阶段[1- 3],而且可为随后的生长季节植物生长提供必要的养分来源[4]。传统的观点认为冬季冻结环境下土壤动物处于休眠状态甚至被直接杀死,其活动可以忽略不计[5]。近年来越来越多的研究表明,在冬季冻结环境下,高山/亚高山森林土壤动物仍然保持了相对较高的活性[6- 7],对凋落叶分解等关键生态系统过程具有明显作用,且其活动受控于温度驱使下的冻融循环格局[5]。相对于森林生态系统,处于海拔更高的高山草甸生态系统结构更为单一[8],缺乏乔木冠层庇护,土壤表层环境必须面对更严酷的低温和冻融环境,土壤动物等生物活动及其驱动的凋落叶分解等物质循环过程更加敏感于环境变化[9]。同时,高山草甸季节性冻融时间相对更长,而植物生长季节相对较短,季节性冻融期间凋落物分解对植物生长以及生态系统净生产力更为重要。然而,尽管气候变化正在改变高山草甸季节性冻融格局,进而影响土壤动物等生物活动对凋落物分解及其相关生态系统过程的作用,但缺乏必要的关注。
川西高山草甸位于青藏高原东缘和长江上游,这里不仅是全球气候变化的敏感区域[10],对维持区域生态环境具有极其重要的作用[11],同时也是代表性的典型高寒生态系统。该区冬季冻融期长达6—7个月,具有明显的季节性冻融特征。基于前期的研究,假设高山草甸土壤动物在季节冻融期间对凋落叶的分解过程具有明显的贡献。为此,本研究选取高山草甸代表性植物黄花亚菊(Ajanianubigena)和黑褐苔草(Carexatrofusca)凋落叶为研究对象。采用不同孔径凋落叶袋排除土壤动物的方法,研究冬季不同冻融时期(冻结初期、冻结期和融化期)土壤动物对凋落叶失重的贡献,以期为认识高山草甸生态系统中凋落叶分解等物质循环过程提供一定的基础数据。
1 材料与方法
1.1 研究区域与样地概况
研究样地位于四川省阿坝藏、羌族自治州,理县鹧鸪山(31°85′ N,102°68′ E,3989 m),为大渡河与岷江的分水岭,是重要的江河源区。冬季雪被期明显,从10月到次年4月,长达6—7个月[12]。高山草甸相对于相邻的高山灌丛和暗针叶林,光照最强,蒸发量最大,地被物的厚度最低[12-13],样地坡向为东偏南14°,土壤类型为高山草甸土,地表石砾含量较高,草本优势种主要有禾本科、菊科和龙胆科植物;主要植物:黄花亚菊(Ajanianubigena)、黑褐苔草(Carexatrofusca)、细芒羊茅(Festucastapfii)、珠芽蓼(Polygonumviviparum)、圆穗蓼(Polygonummacrophyllum)、垂穗披碱草(Elymusnutans)、异针茅(Stipaaliena)、短葶飞蓬(Erigeronbreviscapus)、短毛紫菀(Asterbrachytrichus)、长稃早熟禾(Poadolichachyra)等。此外,经调查后我们发现黄花亚菊和黑褐苔草的植被盖度分别约占样地内植被盖度的30%和20%,因此将其作为研究对象。
1.2 试验设计与样品处理
于2013年10月,在所选取的研究样地内收集新鲜的黄花亚菊和黑褐苔草凋落叶,并将新鲜的凋落叶样品带回室内自然风干,然后准确称取样品10 g,分别封装于不同孔径的凋落叶袋中(20 cm×20 cm)。凋落叶袋是由两层尼龙网缝合而成。尽管5.00 mm孔径的凋落叶袋可允许所用土壤动物进入[9],但前期的研究发现几乎很少的土壤动物大于3.00 mm[5],而且2.00 mm孔径的凋落叶袋可允许大型土壤动物的进入,0.04 mm孔径的凋落叶袋可排除所有的土壤动物进入,除非常微小型的土壤动物[9]。因此,考虑到运输过程中凋落叶会遗漏出凋落叶袋(如黄花亚菊凋落叶),本研究决定采用表面层分别采用0.04 mm(小孔径)和3.00 mm(大孔径)的尼龙网,贴地面层均采用0.04 mm的尼龙网。另外,两个物种分别取相同质量(10 g)的风干叶各3袋,在65 ℃下烘干至恒重,进行凋落叶初始质量的测定(表1)。凋落物有机碳含量采用重铬酸钾氧化-外加热法(林业行业标准(LY/T 1237—1999))测定,全氮含量采用半微量凯氏定氮法(林业行业标准(LY/T1269—1999))测定,全磷含量采用钼锑钪比色法(林业行业标准(LY/T 1270—1999))。
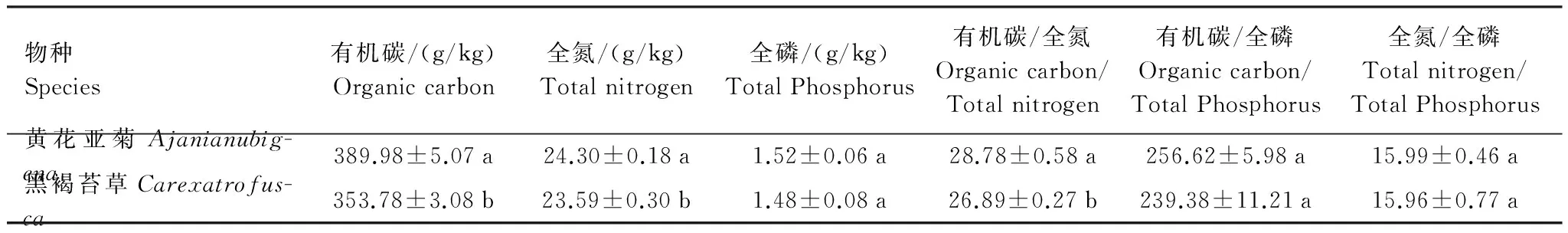
表1 黄花亚菊与黑褐苔草凋落叶初始质量(平均值±标准差,n=3)
不同的小写字母表示物种间的差异显著(独立样本t检验,P<0.05)
于2013年11月12日土壤冻结前(无雪被覆盖),在样地内随机选取3个5 m×5 m的均质样方,每个样方相隔约100 m,去除样方内土壤表面的植物和凋落叶,将凋落叶分解袋平铺于地表,凋落叶袋用麻绳固定以防被风吹走。研究样地中每个样方埋设两个物种,每个物种有两个孔径的凋落叶袋,即每个样方总共放置凋落叶袋36个(1样方×2物种×2孔径×3重复×3次采集),样地内总共放置108个凋落叶袋。分别在2013年12月22日、2014年3月9日、2014年4月22日进行3次样品的采集。每次样品的采集是从样地的一个样方中采集12个凋落叶袋(2物种×2孔径×3重复),总共采集36个凋落叶袋。将收集的凋落叶袋装入密封透气的土壤动物收集袋中低温保存,迅速带回室内,将袋内凋落叶全部取出放置与解剖盘中,拣去其中的大型土壤动物,然后采用干漏斗法收集中小型土壤动物[14]。最后去除凋落叶上的泥土和其他杂质,装入信封,于65 ℃烘干至恒重,计算其失重率。
据已有的研究[12]以及当地历年气象数据显示,研究区每年10月至次年4月为季节性冻融期。2013年11月12日,在特定的凋落叶袋内,15 cm深的土壤中,以及高约0.5 m的柱子上(注:用捆绑方法将温度计固定于柱子上,使其暴露于空气中,并防止遗失)分别放置一个纽扣式温度计(Button DS1923-F5, Maxim Com. USA),并自动记录(设定为每2h记录1次数据)冻结初期(2013-11-22—2013-12-22)、冻结期(2013-12-23—2014-03-09)、融化期(2014-03-10—2014-04-22)凋落叶袋内、土壤及空气的温度动态(图1)。考虑到温度计的丢失,我们在样地中放置了备份的温度计。为了解温度的整体动态变化,计算不同关键时期的平均温(AT)、正积温(PAT)、负积温(NAT)(表2)。不同关键时期的平均温为各关键时期内逐日日均温的平均值,正积温为各关键时期内高于0℃的逐日日均温的总和,负积温为各关键时期内低于0℃的逐日日均温的总和[15-16]。
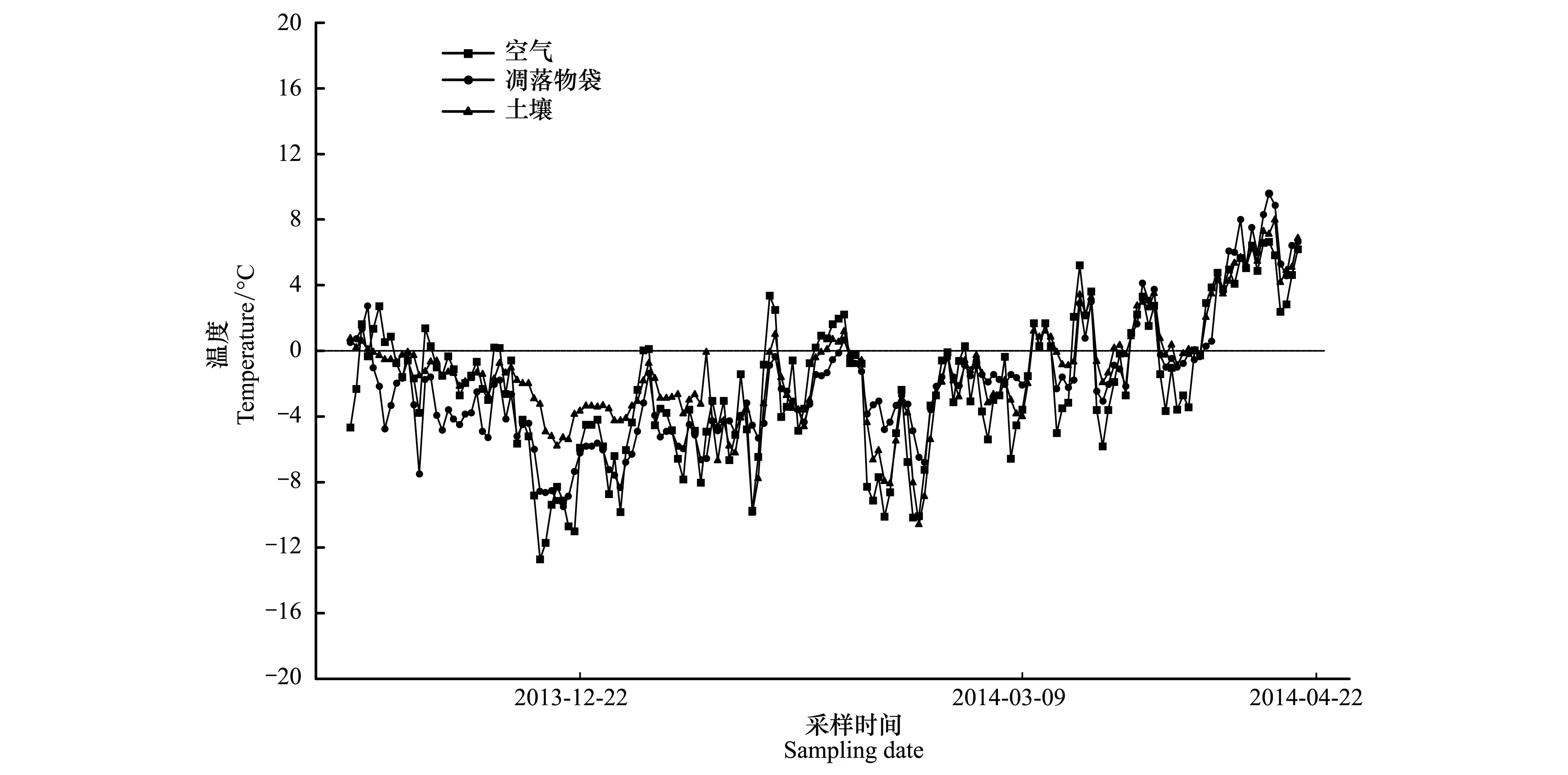
图1 季节性冻融期样地空气、凋落叶袋以及土壤温度的动态变化Fig.1 Dynamics of air, litterbag and soil temperature in the sampling sites during the season withfreeze-thaw cycles
Table 2 Average temperature (AT), positive accumulated temperature (PAT), negative accumulated temperature (NAT) in each decomposition stage during the season withfreeze-thaw cycles
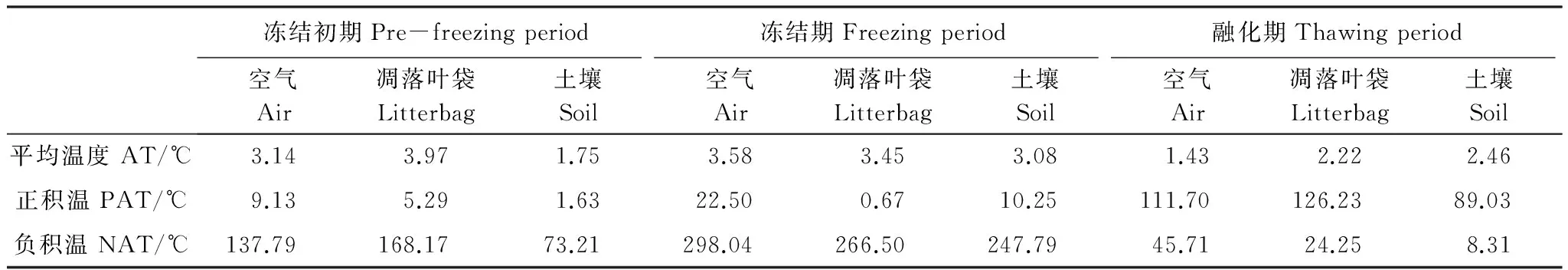
冻结初期Pre-freezingperiod冻结期Freezingperiod融化期Thawingperiod空气Air凋落叶袋Litterbag土壤Soil空气Air凋落叶袋Litterbag土壤Soil空气Air凋落叶袋Litterbag土壤Soil平均温度AT/℃3.143.971.753.583.453.081.432.222.46正积温PAT/℃9.135.291.6322.500.6710.25111.70126.2389.03负积温NAT/℃137.79168.1773.21298.04266.50247.7945.7124.258.31
1.3 计算与统计分析
各孔径内凋落叶的失重率(Lt)、土壤动物对凋落叶失重率的作用(Cfau)、及季节性冻融期间土壤动物对凋落叶失重的总贡献率(Ptotal)计算公式[17-18]如下:
式中,M0为凋落叶袋埋置前的烘干凋落叶质量;Mt为各孔径分解袋内干凋落叶残留量;(Llt-Lst)为最近一次采样大小孔径凋落叶袋内失重率之差;(Ll0-Ls0)为上一次采样大小孔径凋落叶袋内失重率之差;Ll为最后一次采样大孔径凋落叶袋内失重率;Ls为最后一次采样小孔径凋落叶袋内失重率。
采用独立样本t检验法(independent samplest-test)比较两物种之间凋落叶的初始质量和土壤动物对凋落叶失重率的作用和贡献率,同一物种不同孔径凋落叶袋内凋落叶的失重率和土壤动物对凋落叶失重率的作用及贡献率。单因素方差分析(one-way ANOVA)比较两物种凋落叶的不同孔径各个时期凋落叶的失重率、土壤动物对凋落叶失重率的作用和贡献率。双因素(two-way ANOVA)方差分析凋落叶分解时期和凋落叶袋孔径及其相互作用对凋落叶失重率的影响。采用Person相关分析法分析整个季节性冻融每个时期土壤动物对凋落叶失重率的作用和贡献率与凋落叶初始质量和温度因子之间的相关性(P<0.05)。数据统计使用SPSS 20.0的软件完成。
2 结果与分析
2.1 黄花亚菊与黑褐苔草凋落叶的失重率
整个季节性冻融期,大孔径凋落叶袋内黄花亚菊和黑褐苔草凋落叶的失重率分别为26.09%和16.35%;而小孔径凋落叶袋内两种凋落叶的失重率分别为14.02%和12.31%(图2)。相对于其他时期,大孔径内两种凋落叶的失重率在融化期最多,在冻结初期最少。然而,小孔径内两种凋落叶的失重率在冻结初期最多,在冻结期却最少。土壤动物改变了高山草甸凋落叶在整个季节性冻融期的失重模式,即两种凋落叶大孔径的失重率随冻融格局的变化呈逐渐增加的趋势。此外,两种凋落叶大小孔径之间的失重率均具有显著的差异,且在冻结初期两种凋落叶大孔径的失重率均显著小于小孔径的失重率(P<0.05)。
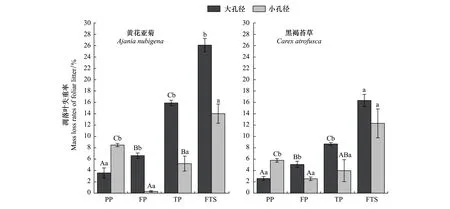
图2 季节性冻融期黄花亚菊和黑褐苔草凋落叶的失重率(平均值±标准差,n=3)Fig.2 Mass loss rates of Ajania nubigena and Carex atrofusca foliar litters in litterbags with different periods during the season with freeze-thaw cycles (mean ± SD, n=3)PP:冻结初期 Pre-freezing period;FP:冻结期 Thawing period;TP:融化期;FTS:季节性冻融期 Seasonal freeze-thaw period;不同大写字母表示同一物种同一孔径在不同冻融时期的差异显著(P<0.05);不同小写字母表示同一物种不同孔径之间在同一分解时期的差异显著(P<0.05)
2.2 土壤动物对凋落叶失重率的作用和贡献率
整个季节性冻融期,土壤动物对凋落叶的失重具有明显的贡献。且土壤动物对黄花亚菊和黑褐苔草两种凋落叶失重率的作用(Cfau)分别为:12.07%和4.03%(图3)。相对于其他冻融时期,土壤动物对凋落叶失重率的作用在融化期最大,分别为:10.68%(黄花亚菊凋落叶)>4.71%(黑褐苔草凋落叶)。然而,土壤动物对黄花亚菊凋落叶失重率的作用在冻结初期最小,土壤动物对黑褐苔草凋落叶失重率的作用在冻结期最小。整个季节性冻融期,土壤动物对黄花亚菊凋落叶失重的贡献(Pfau)为46.39%,显著大于对黑褐苔草凋落叶失重的贡献25.14%(图4)。同样,在融化期土壤动物的贡献最大,而在冻结初期土壤动物对黄花亚菊凋落叶失重的贡献最小,在冻结期对黑褐苔草凋落叶失重的贡献最小。在各个冻融时期,土壤动物对凋落叶失重率的作用在两个物种之间均具有显著的差异(P<0.05)。此外,土壤动物在冻结期和融化期对两种凋落叶失重率的作用为正值(正效应),而在冻结初期却为负值(副效应)。
2.3 土壤动物对凋落叶失重率的作用和贡献率与初始质量和温度的关系
整个季节性冻融期,土壤动物对凋落叶失重率的作用(Cfau)和贡献率(Pfau)与凋落叶初始质量C、N的浓度,以及C/N比呈显著正相关关系(P<0.05)(表3)。土壤动物对凋落叶失重率的作用(Cfau)和贡献率(Pfau)与正积温和凋落叶袋的平均温度均呈显著的正相关关系(P<0.05)(表4)。
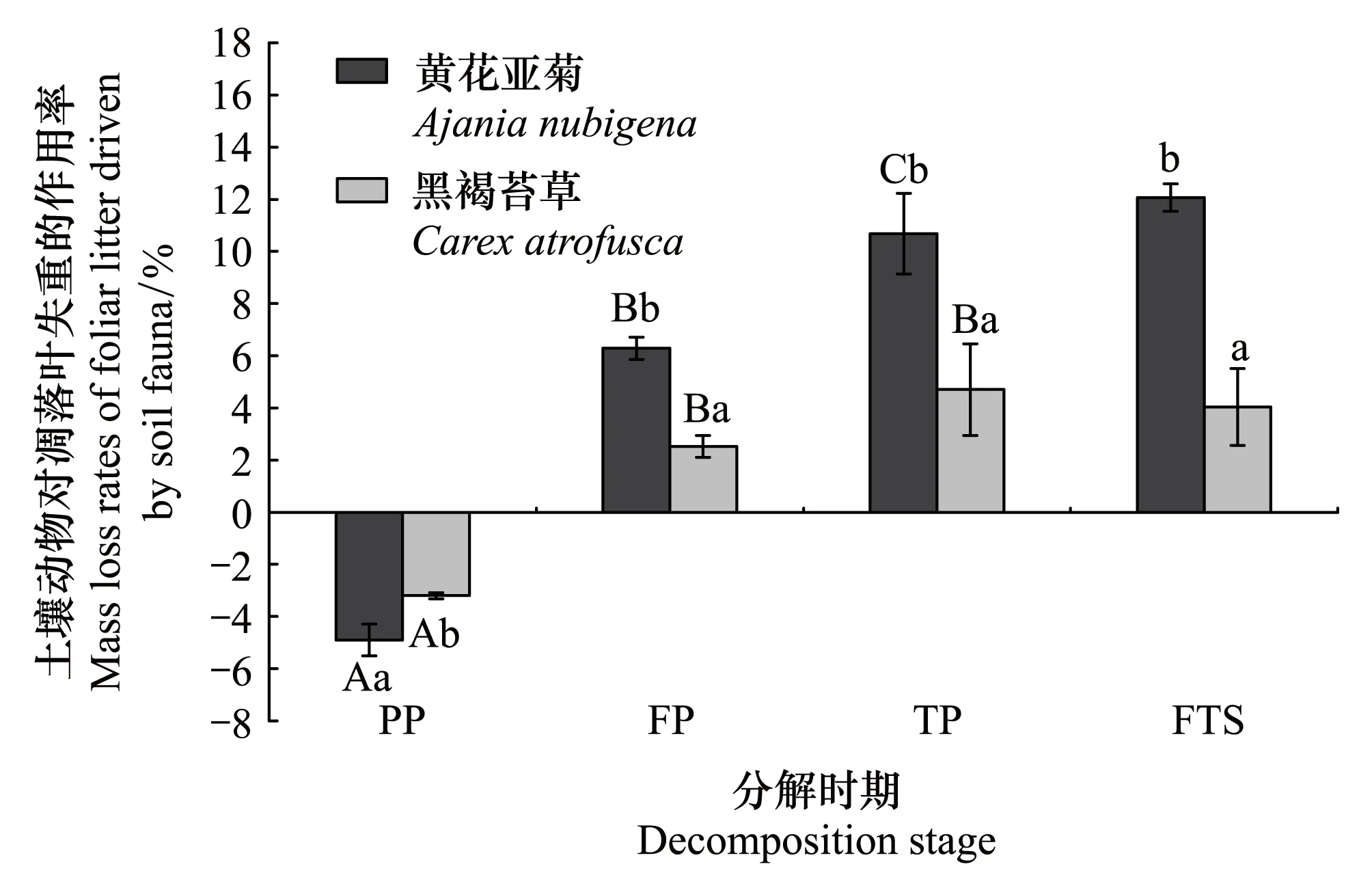
图3 季节性冻融期土壤动物作用于凋落叶的失重率(平均值±标准差,n=3)Fig.3 Foliar litter mass loss rates driven by soil fauna during the season withfreeze-thaw cycles (mean ± SD, n=3)不同大写字母表示同一物种不同冻融时期的差异显著(P<0.05);不同小写字母表示两个物种在季节冻融期的差异显著(P<0.05)
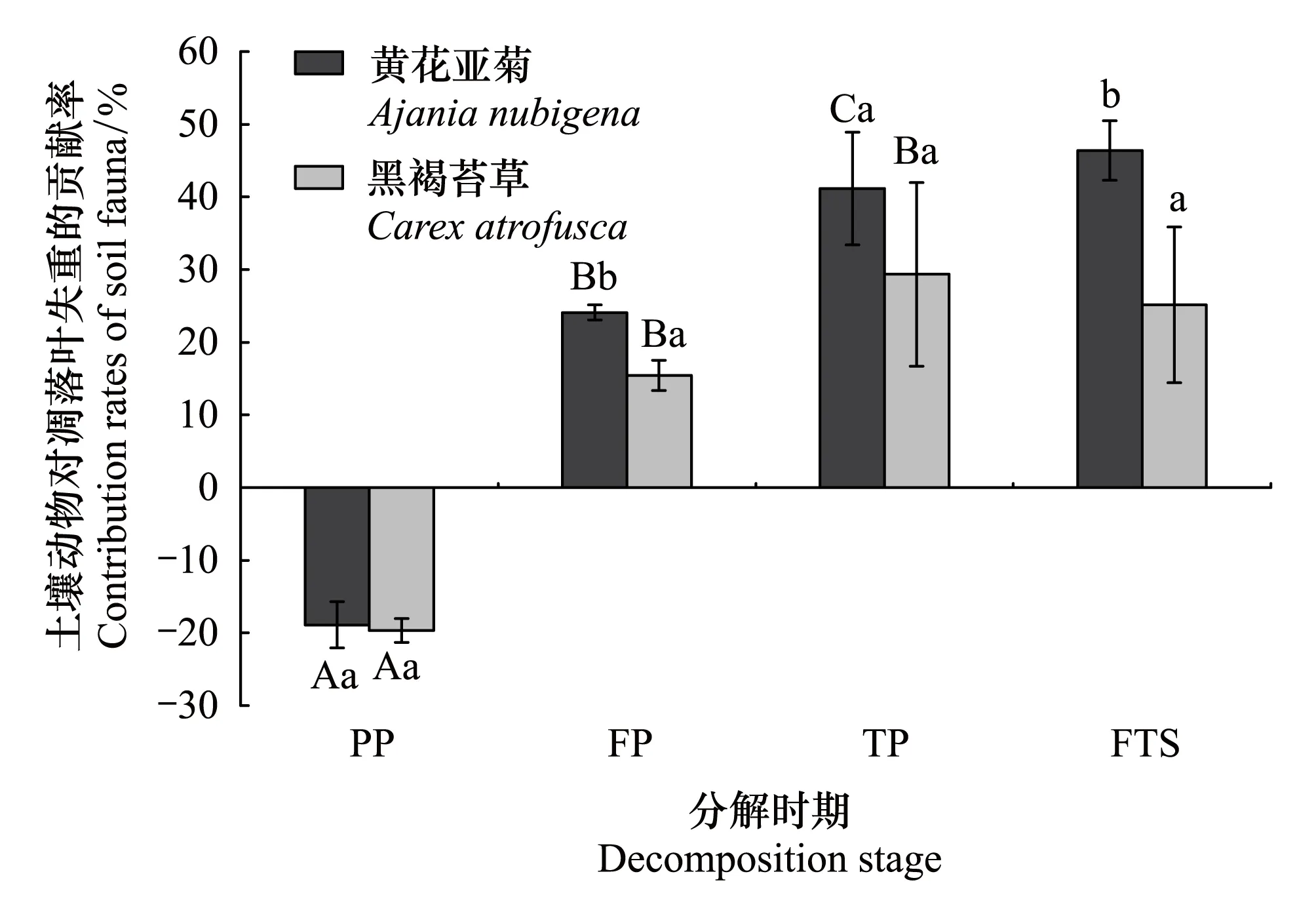
图4 季节性冻融期土壤动物作用于凋落叶失重的贡献率(平均值±标准差,n=3)Fig.4 Contribution rates of soil fauna to foliar litter mass loss during the season withfreeze-thaw cycles (mean ± SD, n=3)不同大写字母表示同一物种不同冻融时期的差异显著(P<0.05);不同小写字母表示两个物种在季节冻融期的差异显著(P<0.05)
Table 3 Pearson′s correlations between litter mass loss rates driven by soil fauna (Cfau) and contribution of soil fauna (Pfau) and initial quality of foliar litter (n=6)
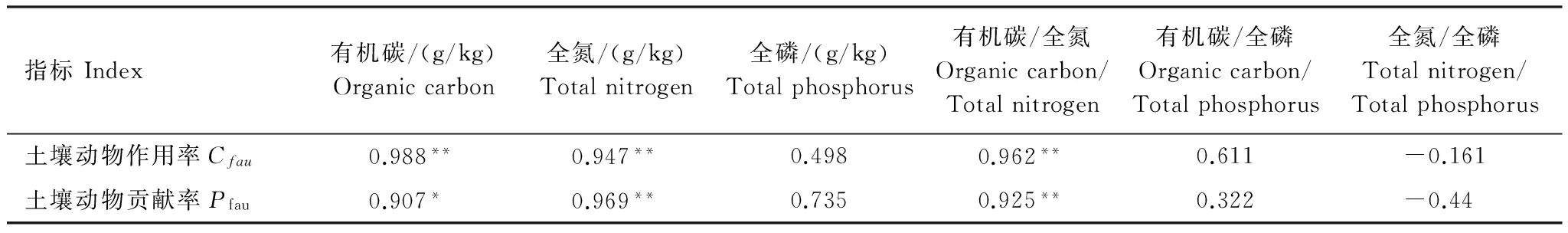
指标Index有机碳/(g/kg)Organiccarbon全氮/(g/kg)Totalnitrogen全磷/(g/kg)Totalphosphorus有机碳/全氮Organiccarbon/Totalnitrogen有机碳/全磷Organiccarbon/Totalphosphorus全氮/全磷Totalnitrogen/Totalphosphorus土壤动物作用率Cfau0.988**0.947**0.4980.962**0.611-0.161土壤动物贡献率Pfau0.907*0.969**0.7350.925**0.322-0.44
**P< 0.01,*P< 0.05
表4 土壤动物对凋落叶失重率的作用(Cfau)和贡献率(Pfau)与温度因子的相关分析
Table 4 Pearson′s correlations between mass loss driven by soil fauna (Cfau) and contribution of soil fauna (Pfau) and temperature (n=9)
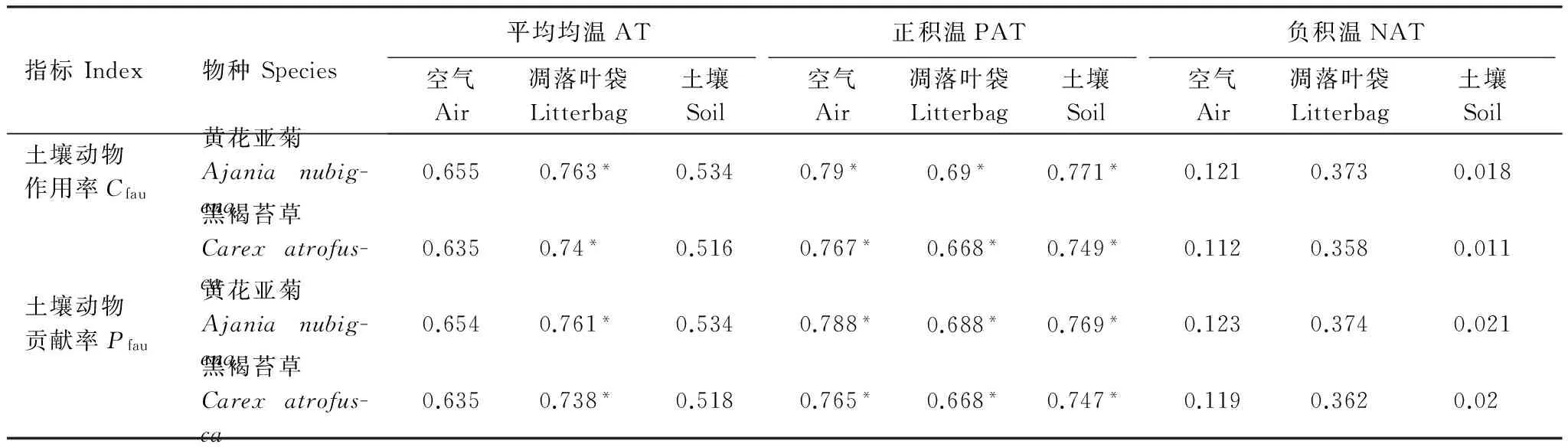
指标Index物种Species平均均温AT正积温PAT负积温NAT空气Air凋落叶袋Litterbag土壤Soil空气Air凋落叶袋Litterbag土壤Soil空气Air凋落叶袋Litterbag土壤Soil土壤动物作用率Cfau黄花亚菊Ajanianubig-ena0.6550.763*0.5340.79*0.69*0.771*0.1210.3730.018黑褐苔草Carexatrofus-ca0.6350.74*0.5160.767*0.668*0.749*0.1120.3580.011土壤动物贡献率Pfau黄花亚菊Ajanianubig-ena0.6540.761*0.5340.788*0.688*0.769*0.1230.3740.021黑褐苔草Carexatrofus-ca0.6350.738*0.5180.765*0.668*0.747*0.1190.3620.02
*P< 0.05; AT: 平均均温 Average temperature; PAT: 正积温 positive accumulated temperature; NAT: 负积温 negative accumulated temperature
3 讨论
凋落叶分解作为高寒生态系统物质循环和能量流动的重要环节之一[19],其过程受到土壤动物等生物活动的影响[20-21]。本研究发现,高山草甸土壤动物在季节性冻融期对两种凋落叶的分解均具有明显的贡献,这与所提出的科学假设相吻合。另外,从整个季节性冻融期来看,土壤动物显著的促进了凋落叶的分解(P<0.05)。在冻结期和融化期土壤动物显著的促进了两种凋落叶的分解(P<0.05),而在冻结初期土壤动物的参与对两种凋落叶的分解具有一定副作用。然而,这些过程还受冻融格局和凋落叶初始质量的调控。
普遍认为随海拔梯度不断的升高,气温逐渐降低[22],土壤动物的活性也会随之降低,进而土壤动物对凋落叶分解的作用也会随之减小。然而,本项研究结果却发现在高山草甸生态系统中,土壤动物对凋落叶分解的作用并没减少。其原因可能是:(1)尽管高山草甸位于岷江流域最高海拔处,雪被覆盖期长,但仍存在一部分耐寒冷环境的土壤动物群落[5],且微生物生物量也较多[23-24];(2)土壤动物除了对凋落叶进行直接地破碎、取食外,还能刺激微生物的活性[9],从而增强了土壤动物与微生物或其他非生物因素的交互作用[25],进而增加对凋落叶失重的作用;(3)随海拔的升高土壤表面温度并不是逐渐降低的趋势,如高山草甸与相邻的生态系统相比,温度并不是最低[23]。已有研究也发现在高山草甸雪被末期中小型土壤动物(562只)多于生长季节末期(309只),其中以矮蒲螨科和美绥螨科为优势类群[26]。此外,整个季节性冻融期,土壤动物对凋落叶失重率的作用为4.03%—12.07%(图3),明显高于山地森林土壤动物的作用,但低于交错带土壤动物的作用[27]。同样,土壤动物对高山草甸凋落叶失重的贡献高达25.14%—46.39%(图4),高于高山和亚高山森林土壤动物的贡献[7],低于交错带土壤动物的贡献[27],且略大于武夷山高山草甸及矮生林生态系统土壤动物的贡献[28]。此外,土壤动物专一化的功能较强[29],且在本研究中整个季节性冻融期间土壤动物对凋落叶绝对失重的作用(0.36—1.06 g)和凋落叶总的失重(1.51—2.41 g)均相对较低。因此,高山草甸中土壤动物对凋落叶失重的贡献是合理的。然而,这还有可能与高寒生态系统样地的海拔、植被类型等地理环境和气候以及特殊的冻融格局特征有关,使得土壤动物等土壤生物群落结构的不同[28, 30- 31],从而导致土壤动物对凋落叶失重的作用在不同生态系统之间的差异性。
本研究还发现,整个季节性冻融期,土壤动物对高山草甸凋落叶失重率的作用在各个冻融时期均具有显著的差异(P<0.05)。不同营养类群的土壤动物常常出现在凋落叶分解的不同阶段[32-33]。而且不同的冻融时期具有不同的冻融特征;从冻结初期到冻结期,温度相对较低,冻结作用逐渐加强[16],从而抑制了土壤动物的活动,随着融化期温度的回升,土壤动物的活动也逐渐地增加。多因素方差分析结果也表明,孔径和凋落叶分解时期均显著的影响了两种凋落叶的失重率(表5)。另外,土壤冻融、冻结和融化均会显著影响土壤动物群落的结构和多样性[34-35]。并有研究发现土壤动物群落的个体密度、类群数量和多样性指数随冻融格局变化表现出先降低后升高的趋势,且冬季土壤动物主要以腐食性类群为主,捕食性和植食性功能类群在融化末期显著增加[36]。尽管新鲜凋落叶为土壤动物提供了相对丰富的底物[11],但土壤动物在进入凋落物还需要一段时间,且冻结初期,某些土壤动物类群可能会缺失[29],因此在冻结初期土壤动物对凋落叶失重率的作用相对较小。然而,在冻结期,较强的冻结作用会极大地限制大多数土壤动物的活性[37],冻结期存在的小部分土壤动物活动[38-39]对凋落叶失重的作用就相对于融化期土壤动物的作用较小。然而,由于冻结初期土壤动物通过对大孔径中凋落叶的直接作用后,所释放的营养元素可能会刺激微生物的活性[9],同时可能增强土壤动物与微生物的竞争,进而增强了对凋落叶失重的作用。因此,冻结期土壤动物对凋落叶失重的作用仍显著(P<0.05)。融化期,不仅温度逐渐回升,而且雪被的融化对凋落叶淋溶过程中所释放的营养元素会刺激分解群落,使得土壤动物、微生物的活性也随之增强[5],进而增加了对凋落叶的失重。因此,在融化期土壤动物的贡献最大。相关分析表明,土壤动物对凋落叶失重率的作用和贡献率与凋落叶袋内正积温和平均温度均呈显著的正相关关系(P<0.05)(表4)。这些结果充分的表明,土壤动物不仅促进了凋落叶的分解(P<0.05),而且还受冻融循环过程中温度动态变化的影响。
然而,由于土壤动物不仅能取食和破碎凋落叶[9],还具有对凋落叶迁移的作用,使得在冻结初期大孔径凋落叶袋内的质量多于小孔径凋落叶袋内的质量(图2),这可能是土壤动物带入凋落叶袋的外源物质(凋落叶)大于土壤动物取食和破碎凋落叶的量,并将此视为土壤动物的副效应(图3)。然而,还有可能的原因是:(1)在冻结初期,土壤微生物的活动可能先于土壤动物的作用,且其群落结构会影响土壤动物的作用。然而,有研究发现凋落叶的分解并不仅仅基于凋落叶分解层[40],在凋落叶衰老、掉落之前就已有微生物存在[41];(2)在冻结初期雪被的覆盖会改变凋落叶袋的微环境,且大孔径相对于小孔径更易接触到雪被,然而土壤动物对环境的变化也十分敏感[9],导致在冻结初期土壤动物更多的可能是出于自我防御寒冷的活动,而较少地取食或破碎凋落叶。此外,本研究还发现在冻结初期,凋落叶袋中有12只土壤动物,而冻结期有35只土壤动物,融化期16只土壤动物。冻结期凋落叶冻结,耐寒的土壤动物也更易取食微生物;在融化期,雪被的融化会增强对凋落叶的淋溶作用,进而使得大孔径凋落叶失重在融化期最大,小孔径凋落叶失重率在冻结初期最大。
表 5 多因素方差分析凋落叶分解时期和凋落叶袋孔径对黄花亚菊和黑褐苔草凋落叶失重率的作用
Table 5 Results of analyzing the effects of litter decomposition period (time) and mesh size of litterbags on the mass loss ofAjanianubigenaandCarexatrofuscafoliar litters (n=18)
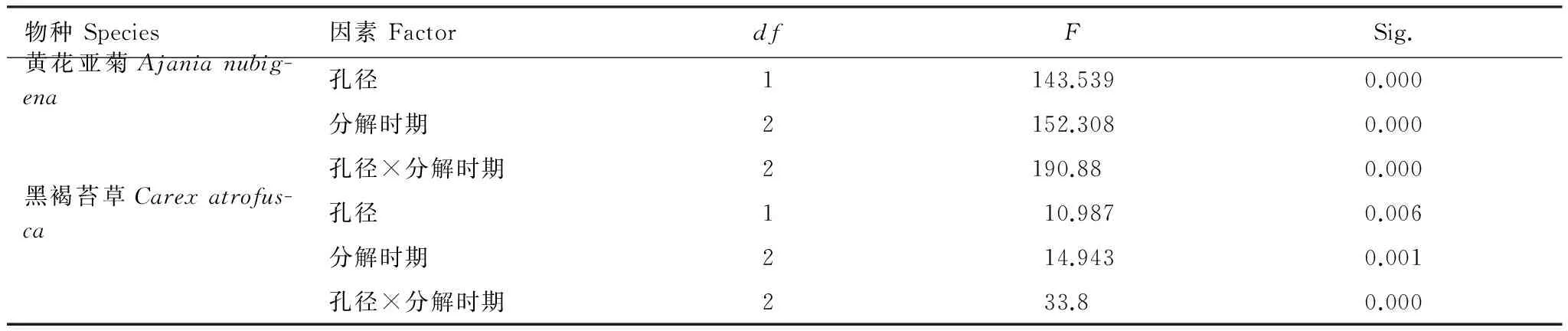
物种Species因素FactordfFSig.黄花亚菊Ajanianubig-ena孔径1143.5390.000分解时期2152.3080.000孔径×分解时期2190.880.000黑褐苔草Carexatrofus-ca孔径110.9870.006分解时期214.9430.001孔径×分解时期233.80.000
采用凋落叶袋排除土壤动物的方法,探讨不同土壤动物群落与凋落叶分解的相互关系已被广泛应用于不同尺度生态系统的研究中[6-7,27,42-43],其研究结果却饱受质疑[44-46]。然而,最近已有研究证明了凋落叶袋排除土壤动物的方法是合理的[47]。我们前期的研究结果也发现,不同气候区域分解袋中凋落叶温度与大气温度有相似的季节变化动态,且两种孔径凋落叶袋中的温度和湿度无显著差异[43],对分解过程中微环境的影响较小。因此,在本研究中孔径间的显著差异性是可以解释土壤动物对凋落叶失重的作用和贡献的,但这个过程受冻融格局的调控。
凋落叶的可食性常常会影响土壤动物类群的变化[48-49],进而影响土壤动物对凋落叶分解的过程。土壤动物对凋落叶失重率的作用和贡献率与凋落叶初始质量C和N浓度,以及C/N比均显著相关(表3),并且两种凋落叶的初始C、N浓度,以及C/N比具有显著差异(P<0.05)(表1)。本研究还发现,在高山草甸的各个冻融时期,土壤动物对黄花亚菊凋落叶失重率的作用均显著高于对黑褐苔草的作用(P<0.05)。因此,说明了土壤动物更易作用于黄花亚菊凋落叶(图3)。另外,黄花亚菊凋落叶较黑褐苔草凋落叶的比表面积大,在冻结期更易受到冻结作用的破碎,从而导致两个物种的土壤动物贡献在冻结期具有显著差异(图4)。这些结果充分的表明,土壤动物对凋落叶失重的作用和贡献的过程还受凋落叶初始质量的调控。
4 结论
综上所述,在整个季节性冻融时期土壤动物对高山草甸两种凋落叶的分解具有明显的贡献。然而,这些过程受冻融格局和凋落叶初始质量的调控。雪被覆盖期的缩短和雪被厚度的降低可能会影响土壤动物或土壤动物与微生物的相互作用,从而影响凋落物分解及其相关的生态过程。因此,高山草甸季节性冻融期土壤动物对凋落物分解的贡献不仅能为生长季节植物生长提供必要的养分来源,而且对于全球气候变化具有重要的指示作用[50]。本研究结果为深入认识气候变化情景下高山草甸物质循环和能量流动等关键过程提供了一定的基础数据和新的思路。
[1] Currie W S. Relationships between carbon turnover and bioavailable energy fluxes in two temperate forest soils. Global Change Biology, 2003, 9(6): 919- 929.
[2] Gholz H L, Wedin D A, Smitherman S M, Harmon M E, Parton W J. Long-term dynamics of pine and hardwood litter in contrasting environments: toward a global model of decomposition. Global Change Biology, 2000, 6(7): 751- 765.
[3] Parton W, Silver W L, Burke I C, Grassens L, Harmon M E, Currie W S, King J Y, Adair E C, Brandt L A, Hart S C, Fasth B. Global-scale similarities in nitrogen release patterns during long-term decomposition. Science, 2007, 315(5810): 361- 364.
[4] 王文君, 杨万勤, 谭波, 刘瑞龙, 吴福忠. 四川盆地亚热带常绿阔叶林土壤动物对几种典型凋落物分解的影响. 生态环境学报, 2013, 22(9): 1488- 1495.
[5] Tan B, Wu F Z, Yang W Q, Liu L, Yu S. Characteristics of soil animal community in the subalpine/alpine forests of western Sichuan during onset of freezing. ActaEcologicaSinica, 2010, 30(2): 93- 99.
[6] 刘瑞龙, 李维民, 杨万勤, 谭波, 王文君, 徐振锋, 吴福忠. 土壤动物对川西高山/亚高山森林凋落物分解的贡献. 应用生态学报, 2013, 24(12): 3354- 3360.
[7] 夏磊, 吴福忠, 杨万勤. 季节性冻融期间土壤动物对岷江冷杉凋落叶质量损失的贡献. 植物生态学报, 2011, 35(11): 1127- 1135.
[8] 黄旭, 文维全, 张健, 杨万勤, 刘洋, 闫帮国, 黄玉梅. 川西高山典型自然植被土壤动物多样性. 应用生态学报, 2010, 21(1): 181- 190.
[9] Swift M J, Heal O W, Anderson JM. Decomposition in Terrestrial Ecosystems. Berkley,California,USA: University of California Press, 1979.
[10] Baker W L, Honaker J J, Weisberg P J. Using aerial photography and GIS to map the forest-tundra ecotone in Rocky Mountain National Park, Colorado, for global change research. Photogrammetric Engineering and Remote Sensing, 1995, 61(3): 313- 320.
[11] 杨万勤, 王开运, Kellomaki S. 生物多样性与针叶林生态系统过程的关系. 世界科技研究与发展, 2003, 25(5): 47- 55.
[12] 陈亚梅, 和润莲, 邓长春, 刘洋, 杨万勤, 张健. 川西高山林线交错带凋落物纤维素分解酶活性研究. 植物生态学报, 2014, 38(4): 334- 342.
[13] 刘洋, 张健, 杨万勤, 吴福忠, 黄旭, 闫帮国, 文维全, 胡开波. 川西高山树线群落交错带地被物及土壤的水文效应. 林业科学, 2011, 47(3): 1- 6.
[14] 尹文英, 胡圣豪, 沈韫芬. 中国土壤动物检索图鉴. 北京: 科学出版社, 1998.
[15] Zhu JX, He XH, Wu FZ, Yang WQ, Tan B. Decomposition ofAbiesfaxonianalitter varies with freeze-thaw stages and altitudes in subalpine/alpine forests of southwest China. Scandinavian Journal of Forest Research, 2012, 27(6): 586- 596.
[16] 何伟, 吴福忠, 杨万勤, 武启骞, 何敏, 赵野逸. 雪被斑块对高山森林两种灌木凋落叶质量损失的影响. 植物生态学报, 2013, 37(4): 306- 316.
[17] Yang X D, Chen J. Plant litter quality influences the contribution of soil fauna to litter decomposition in humid tropical forests, southwestern China. Soil Biology and Biochemistry, 2009, 41(5): 910- 918.
[18] Xin W D, Yin X Q, Song B. Contribution of soil fauna to litter decomposition in Songnen sandy lands in northeastern China. Journal of Arid Environments, 2012, 77: 90- 95.
[19] 李强, 周道玮, 陈笑莹. 地上枯落物的累积、分解及其在陆地生态系统中的作用. 生态学报, 2014, 34(14): 3807- 3819.
[20] Anderson J M. Succession, diversity and trophic relationships of some soil animals in decomposing leaf litter. Journal of Animal Ecology, 1975, 44(2): 475- 495.
[21] Liu C J, Ilvesniemi H, Berg B, Kutsch W, Yang Y S, Ma X Q, Westman C J. Aboveground litterfall in Eurasian forests. Journal of Forestry Research, 2003, 14(1): 27- 34.
[22] Vitousek P M, Turner D R, Parton W J, Sanford R L. Litter decomposition on the Mauna Loa environmental matrix, Hawai′i: patterns, mechanisms, and models. Ecology, 1994, 75(2): 418- 429.
[23] 刘洋, 张健, 闫帮国, 黄旭, 徐振锋, 吴福忠. 青藏高原东缘高山森林-苔原交错带土壤微生物生物量碳、氮和可培养微生物数量的季节动态. 植物生态学报, 2012, 36(5): 382- 392.
[24] Lipson D A, Schadt C W, Schmidt S K. Changes in soil microbial community structure and function in an alpine dry meadow following spring snow melt. Microbial Ecology, 2002, 43(3): 307- 314.
[25] Reddy M V,Venkataiah B. Influence of microarthropod abundance and climatic factors on weight loss and mineral nutrient contents of Eucalyptus leaf litter during decomposition. Biology and Fertility of Soils, 1989, 8(4): 319- 324.
[26] 和润莲, 陈亚梅, 邓长春, 杨万勤, 张健, 刘洋. 中小型土壤动物对川西高山草甸枯落物分解的季节响应. 应用与环境生物学报, 2015, 21(2): 350- 357.
[27] Peng Y, Yang W Q, Li J, Wang B, Zhang C, Yue K, Wu F Z. Contribution of soil fauna to foliar litter-mass loss in winter in an ecotone between dry valley and montane forest in the upper reaches of the Minjiang River. Plos One, 2015, 10(4): e0124605.
[28] Wang S J, Ruan H H, Wang B. Effects of soil microarthropods on plant litter decomposition across an elevation gradient in the Wuyi Mountains. Soil Biology and Biochemistry, 2009, 41(5): 891- 897.
[29] Heemsbergen D A, Berg M P, Loreau M, van Hal J R, Faber J H, Verhoef H A. Biodiversity effects on soil processes explained by interspecific functional dissimilarity. Science, 2004, 306(5698): 1019- 1020.
[30] Heneghan L, Coleman D, Zou X, Crossley D A Jr, Haines B L. Soil microarthropod community structure and litter decomposition dynamics: a study of tropical and temperate sites. Applied Soil Ecology, 1998, 9(1/3): 33- 38.
[31] Facelli J M, Pickett S T A. Plant litter: Its dynamics and effects on plant community structure. The Botanical Review, 1991, 57(1): 1- 32.
[32] Berg M P, Kniese J R, Verhoef H A. Dynamics and stratification of bacteria and fungi in the organic layers of a scots pine forest soil. Biology and Fertility of Soils, 1998, 26(4): 313- 322.
[33] Hunter M D, Adl S, Pringle C M, Coleman D C. Relative effects of macroinvertebrates and habitat on the chemistry of litter during decomposition. Pedobiologia, 2003, 47(2): 101- 115.
[34] Wu F Z, Yang W Q, Zhang J, Deng R J. Litter decomposition in two subalpine forests during the freeze-thaw season. ActaOecologica, 2010, 36(1): 135- 140.
[35] Hentschel K, Borken W, Matzner E. Repeated freeze-thaw events affect leaching losses of nitrogen and dissolved organic matter in a forest soil. Journal of Plant Nutrition and Soil Science, 2008, 171(5): 699- 706.
[36] 谭波, 吴福忠, 杨万勤, 夏磊, 杨玉莲, 王奥. 川西亚高山/高山森林大型土壤动物群落多样性及其对季节性冻融的响应. 生物多样性, 2012, 20(2): 215- 223.
[37] Bokhorst S, Bjerke J W, Melillo J, Callaghan T V, Phoenix G K. Impacts of extreme winter warming events on litter decomposition in a sub-Arctic heathland. Soil Biology and Biochemistry, 2010, 42(4): 611- 617.
[38] Saccone P, Morin S, Baptist F, Bonneville J M, Colace M P, Domine F, Faure M, Geremia R, Lochet J, Poly F, Lavorel S, Clément J C. The effects of snowpack properties and plant strategies on litter decomposition during winter in subalpine meadows. Plant and Soil, 2013, 363(1/2): 215- 229.
[39] 胡霞, 吴宁, 吴彦, 左万庆, 郭海霞, 王金牛. 川西高原季节性雪被覆盖对窄叶鲜卑花凋落物分解和养分动态的影响. 应用生态学报, 2012, 23(5): 1226- 1232.
[40] Stone J K. Initiation and development of latent infections byRhabdoclineparkerion Douglas-fir. Canadian Journal of Botany, 1987, 65(12): 2614- 2621.
[42] Wang S J, Ruan H H, Han Y. Effects of microclimate, litter type, and mesh size on leaf litter decomposition along an elevation gradient in the Wuyi Mountains, China. Ecological Research, 2010, 25(6): 1113- 1120.
[43] 谭波. 长江上游不同海拔代表性森林土壤动物对凋落叶分解的影响[D]. 成都: 四川农业大学, 2013.
[44] Bradford M A, Tordoff G M, Eggers T, Jones T H, Newington J E. Microbiota, fauna, and mesh size interactions in litter decomposition. Oikos, 2002, 99(2): 317- 323.
[45] Prescott C E. Do rates of litter decomposition tell us anything we really need to know? Forest Ecology and Management, 2005, 220(1/3): 66- 74.
[46] Vossbrinck C R, Coleman D C, Woolley T A. Abiotic and biotic factors in litter decomposition in a sermiarid grassland. Ecology, 1979, 60(2): 265- 271.
[47] Bokhorst S, Wardle D A. Microclimate within litter bags of different mesh size: Implications for the ‘arthropod effect’ on litter decomposition. Soil Biology and Biochemistry, 2013, 58: 147- 152.
[48] Meyer W M III, Ostertag R, Cowie R H. Macro-invertebrates accelerate litter decomposition and nutrient release in a Hawaiian rainforest. Soil Biology and Biochemistry, 2011, 43(1): 206- 211.
[49] Bocock K L. Changes in the amounts of dry matter, nitrogen, carbon and energy in decomposing woodland leaf litter in relation to the activities of the soil fauna. Journal of Ecology, 1964, 52(2): 273- 284.
[50] 宋飘, 张乃莉, 马克平, 郭继勋. 全球气候变暖对凋落物分解的影响. 生态学报, 2014, 34(6): 1327- 1339.
Contribution of soil fauna to the decomposition of foliar litter of two alpine meadow plants during the season with freeze-thaw cycles
PENG Yan1, YANG Wanqin1,2, XUE Qiao3, LI Jun1, WANG Bin1, TAN Bo1,2, WU Fuzhong1,2,*
1Long-termResearchStationofAlpineForestEcosystems,InstituteofEcologyandForest,SichuanAgriculturalUniversity,Chengdu611130,China2CollaborativeInnovationCenterofEcologicalSecurityintheUpperReachesoftheYangtzeRiver,Chengdu611130,China3LixianForestryBureau,Lixian623100,China
Foliar litter decomposition during the season with freeze-thaw cycles helps to replenish the store of nutrients necessary for ecosystem productivity for the subsequent growing season in alpine meadow ecosystems, and as such is an important process for the maintenance of materials cycling and nutrient balance in alpine meadows. However, little information is currently available about what effect soil fauna may have on foliar litter decomposition in cold-biome alpine meadow ecosystems, given that the severity of the environment during the season with freeze-thaw cycles might restrict soil fauna activity. To examine the possible influence of soil fauna, we conducted a field experiment in an alpine meadow in southwestern Sichuan, China, using litterbags of different mesh sizes to exclude or include soil fauna. The contribution of soil fauna to the foliar litter mass loss of two common plants,AjanianubigenaandCarexatrofusca, was examined during three distinct periods: the pre-freeze period, the freeze period, and the thaw period. Over the entirety of the season with freeze-thaw cycles,A.nubigenaandC.atrofuscafoliar litters lost 26.09% and 16.35% of their initial mass, respectively, in large-mesh litterbags, but lost only 14.02% and 12.31% of their initial mass, respectively, in small-mesh litterbags. However, the contribution of soil fauna to the foliar litter mass loss of two common plants,A.nubigenaandC.atrofusca,were 46.39% and 25.14%, respectively, and the mass loss rates driven by soil fauna were 12.07% and 4.03%, respectively, during the season with freeze-thaw cycles. Compared with other periods, rates of foliar litter mass loss driven by soil fauna were highest in the thaw period for bothA.nubigenaandC.atrofusca. On the other hand, the lowest rates of mass loss driven by soil fauna occurred in the pre-freeze period forA.nubigenafoliar litter but during the freeze period forC.atrofuscafoliar litter. Moreover, it is notable that soil fauna negatively affected foliar litter mass loss in the pre-freeze period but positively impacted foliar litter in both the freeze and thaw periods. In addition, the rate of mass loss attributable to soil fauna was significantly (P< 0.05) correlated with temperature and initial foliar litter quality, such as initial carbon (C) and nitrogen (N) concentrations and the C/N ratio during the season with freeze-thaw cycles. Loss of foliar litter mass was also significantly (P< 0.05) influenced by the interactions between litterbag mesh size and litter decomposition period. Soil fauna also seemed to play a more active role inA.nubigenafoliar litter decomposition than inC.atrofuscafoliar litter decomposition. These results indicated that although soil fauna play a large role in the decomposition of foliar litter during the season with freeze-thaw cycles in alpine meadow ecosystems, this process is modulated by the dynamics of the freeze-thaw cycle and the initial quality of the foliar litter. A shorter period of snow cover or reduction in snow depth resulting from climate change could affect soil fauna activity and thus the rates of foliar litter decomposition in these alpine environments.
alpine meadow; foliar litter mass loss; seasonal freeze-thaw period; soil fauna
国家自然科学基金资助项目(31270498, 31170423);高等学校博士学科点专项科研基金资助项目(20135103110002);中国博士后科学基金特别资助项目(2012T50782);四川省青年基金资助项目(2012JQ0008, JQ0059)
2015- 05- 27;
日期:2016- 01- 15
10.5846/stxb201505271058
*通讯作者Corresponding author.E-mail: wufzchina@163.com
彭艳,杨万勤,薛樵,李俊,王滨,谭波,吴福忠.季节性冻融期间土壤动物对高山草甸两种凋落叶失重的贡献.生态学报,2016,36(19):6149- 6158.
Peng Y, Yang W Q, Xue Q, Li J, Wang B, Tan B, Wu F Z.Contribution of soil fauna to the decomposition of foliar litter of two alpine meadow plants during the season with freeze-thaw cycles.Acta Ecologica Sinica,2016,36(19):6149- 6158.

