血清HBsAg、HBcrAg和HBV DNA预测慢性乙型肝炎肝组织病理状态的性能评价
张占卿 陆伟 丁荣蓉 翁齐铖 张智勇 王雁冰 周新兰 黄丹 李秀芬
·论 著·
血清HBsAg、HBcrAg和HBV DNA预测慢性乙型肝炎肝组织病理状态的性能评价
张占卿 陆伟 丁荣蓉 翁齐铖 张智勇 王雁冰 周新兰 黄丹 李秀芬
目的 评价血清HBsAg、HBcrAg、HBV DNA预测慢性乙型肝炎肝组织病理状态的性能。方法 将324例HBeAg阳性和255例HBeAg阴性慢性乙型肝炎患者随机分为3组匹配的训练集和验证集。血清HBsAg和HBcrAg分别采用Abbott Architect I2000和Fujirebio Lumipulse G1200全自动化学发光免疫系统检测,血清HBV DNA采用Bio-Rad Icycler荧光定量PCR仪检测。肝组织病理学诊断采用Scheuer评分系统,其中病理学分级包括G0~G4五级,分期包括S0~S4五期。结果 无论HBeAg阳性或阴性患者,3个训练集与3个匹配的验证集性别比例和平均年龄、病理学分级和分期构成比之间的差异均无统计学意义(P>0.05)。HBeAg阳性患者,血清HBsAg、HBcrAg、HBV DNA预测全集病理学分级≥G3和分期≥S4的ROC曲线下面积最大;参照预测3个训练集病理学分级≥G3和分期≥S4的最佳截断值,血清HBsAg、HBcrAg、HBV DNA预测3个匹配的验证集病理学分级≥G3和分期≥S4的灵敏度极差分别为37%和9%、30%和16%、17%和14%,特异度极差分别为12%和5%、13%和3%、15%和6%。HBeAg阴性患者,血清HBcrAg、HBV DNA预测全集病理学分级≥G2和分期≥S2的ROC曲线下面积最大;参照预测3个训练集病理学分级≥G2和分期≥S2的最佳截断值,血清HBcrAg、HBV DNA预测3个匹配的验证集病理学分级≥G2和分期≥S2的灵敏度极差分别为11%和20%、46%和19%,特异度极差分别为15%和2%、38%和16%。结论 HBeAg阳性患者,血清HBsAg、HBcrAg、HBV DNA可预测的最佳病理状态为病理学分级≥G3和分期≥S4,其预测理学分期≥S4的稳定性高于预测病理学分级≥G3;HBeAg阴性患者,血清HBcrAg和HBV DNA可预测的最佳病理状态为病理学分级≥G2和分期≥S2,血清HBcrAg预测病理学分级≥G2和分期≥S2的稳定性高于HBV DNA。
乙型肝炎表面抗原;乙型肝炎核心相关抗原;乙型肝炎病毒DNA;肝组织;病理学;无创诊断
10余年来,虽然慢性乙型肝炎(chronic hepatitis B, CHB)肝组织病理状态的无创指标和模型研究已取得许多进展[1-5],但仍不能满足让患者避免有创检查的需求[6-9]。CHB肝组织病理状态是机体针对乙型肝炎病毒(hepatitis B virus, HBV)免疫应答效应的集中表现,因此,血清免疫学指标和病毒学标记物的数量变化在一定程度上能够反映CHB患者肝组织病理状态。近年来,血清HBsAg、乙型肝炎核心相关抗原(hepatitis B core-related antigen, HBcrAg)和HBV DNA预测CHB肝组织病理状态的价值已经被探讨[10-18],但其预测肝组织病理状态的性能很少被评价。本研究根据324例HBeAg阳性和255例HBeAg阴性CHB患者血清HBsAg、HBcrAg和HBV DNA定量检测的结果,采用K-折交叉验证法,评价其预测肝组织病理状态的性能。
资料和方法
一、研究对象
2012年8月至2015年7月上海市(复旦大学附属)公共卫生临床中心初治CHB患者579例,诊断符合2015年中华医学会肝病学分会、感染病学分会联合修订的《慢性乙型肝炎防治指南(2015更新版)》中的标准[6]。HBeAg阳性患者中,男204例,女120例,年龄14~72岁,平均(34.9±10.5)岁;HBeAg阴性患者中,男164例,女91例,年龄17~78岁,平均(43.0±12.0)岁。排除合并其他病毒性肝炎、药物性肝病、遗传性肝病、血吸虫性肝病以及自身免疫性疾病、内分泌与代谢疾病、血液系统疾病,接受干扰素-α、核苷(酸)类、甾体激素类和甘草酸类药物治疗的患者。HBeAg阳性和阴性患者均被随机划分为A、B、C三个样本集;其中,A+B+C谓之全集,A+B、B+C、A+C分别谓之训练集ⅠT、ⅡT、ⅢT,C、A、B分别谓之验证集ⅠV、ⅡV、ⅢV。本研究得到了上海市(复旦大学附属)公共卫生临床中心伦理委员会的批准,研究过程遵循赫尔辛基宣言。
二、病理学诊断
所有患者在接受肝活检前常规签署知情同意书。肝组织活检采用1秒钟经皮肝穿刺法。标本采集后立即冰冻送检。肝组织置塑料包埋盒中,中性甲醛固定、梯度乙醇脱水、二甲苯透明、石蜡浸入和包埋、切片,苏木素-伊红染色和网状纤维染色。肝组织标本的质量评价和肝组织病理学诊断由1名有经验的病理学医师独立完成。肝组织病理学诊断采用Scheuer评分系统[19],其中肝组织病理学分级包括G0、G1、G2、G3、G4五级,分期包括S0、S1、S2、S3、S4五期。
三、血清HBsAg、HBcrAg和HBV DNA检测
所有患者于肝穿刺前后1周内早晨空腹采集静脉血,分离血清。血清HBsAg和HBeAg采用化学发光微粒子免疫法和Abbott Architect I2000全自动化学发光免疫系统及其配套试剂检测,正常参考值分别为<0.05 IU/mL和<1.0 S/CO;其中HBsAg检测上限为250 IU/mL,如超过检测上限,则血清作500倍稀释后重新检测。血清HBcrAg采用化学发光酶免疫法和Fujirebio Lumipulse G1200全自动化学发光免疫系统检测,试剂由Fujirebio株式会社提供,批准文号:SAX5031(日本),正常参考值为<1.000 kU/mL;检测上限为10 000 kU/mL,如超过检测上限,则血清作50倍稀释后重新检测。血清HBV DNA采用Bio-Rad Icycler荧光定量PCR仪检测,试剂购自深圳匹基生物工程有限公司,检测范围5×102~5×107IU/mL。
四、统计学方法
数据处理和统计分析采用Medcalc 15.1软件。训练集与验证集患者性别比例、肝组织病理学分级和分期构成比之间的差异比较采用χ2检验,平均年龄之间的差异比较采用两独立样本t检验;血清HBsAg、HBcrAg和HBV DNA与肝组织病理学分级和分期的相关性采用Spearman相关分析;全集血清HBsAg与HBcrAg、HBcrAg与HBV DNA、HBV DNA与HBsAg预测肝组织相同病理状态ROC曲线下面积之间的比较采用两配对样本Delong非参数检验;血清HBsAg、HBcrAg和HBV DNA预测肝组织不同病理状态的性能评价采用K-折交叉验证法。P<0.05为差异有统计学意义。
结 果
一、训练集与验证集患者性别比例和平均年龄、肝组织病理学分级和分期构成比之间的差异
无论HBeAg阳性或阴性患者,训练集ⅠT、ⅡT、ⅢT分别与验证集ⅠV、ⅡV、ⅢV性别比例和平均年龄之间的差异均无统计学意义(P>0.05),肝组织病理学分级和分期构成比之间的差异均无统计学意义(P>0.05)。见表1~2。
二、血清HBsAg、HBcrAg和HBV DNA与肝组织病理学分级和分期的相关性
HBeAg阳性患者,血清HBsAg与病理学分级和分期均呈显著负相关(rs=-0.346,P=0.000和rs=-0.403,P=0.000);HBcrAg与病理学分级和分期均呈显著负相关(rs=-0.244,P=0.000和rs=-0.316,P=0.000);HBV DNA与病理学分级和分期均呈显著负相关(rs=-0.177,P=0.001和rs=-0.281,P=0.001)。见图1A~B。其中,训练集ⅠT、ⅡT、ⅢT和验证集ⅠV、ⅡV、ⅢV HBsAg与病理学分级和分期均呈显著负相关(P<0.01);训练集ⅠT、ⅡT、ⅢT和验证集ⅠV、ⅡV、ⅢV HBcrAg与病理学分级和分期均呈显著负相关(P<0.05);训练集ⅠT、ⅡT、ⅢT HBV DNA与病理学分级和分期均呈显著负相关(P均<0.01),验证集ⅠV、ⅡV、ⅢV HBV DNA分别与病理学分级和分期无显著相关性(P>0.05)和呈著负相关(P<0.01)。见表3。

表1 HBeAg阳性患者训练集与验证集性别比例和平均年龄、病理学分级和分期构成比之间的比较(例)

表2 HBeAg阴性患者训练集与验证集性别比例和平均年龄、病理学分级和分期构成比之间的比较

注:血清HBsAg、HBcrAg和HBV DNA测量单位分别为log10 IU/mL、log10 kU/mL和log10 IU/mL

样本集例数HBsAg病理学分级rsP值病理学分期rsP值HBcrAg病理学分级rsP值病理学分期rsP值HBVDNA病理学分级rsP值病理学分期rsP值ⅠT208-0.3040.000-0.3750.000-0.2770.000-0.3650.000-0.1800.009-0.2910.000ⅠV116-0.4170.000-0.4550.000-0.1930.038-0.2310.013-0.1780.056-0.2720.003ⅡT220-0.3310.000-0.3740.000-0.2170.001-0.2600.000-0.1750.009-0.2750.000ⅡV104-0.3700.000-0.4720.000-0.2990.002-0.4310.000-0.1830.062-0.2950.002ⅢT220-0.3980.000-0.4580.000-0.2430.000-0.3280.000-0.1780.008-0.2800.000ⅢV104-0.2350.016-0.2740.005-0.2600.008-0.3100.001-0.1770.073-0.2890.003
HBeAg阴性患者,血清HBsAg与病理学分级和分期均无显著相关性(rs=-0.078,P=0.216和rs=-0.033,P=0.604);HBcrAg与病理学分级和分期均呈显著正相关(rs=0.383,P=0.000和rs=0.400,P=0.000);HBV DNA与病理学分级和分期均呈显著正相关(rs=0.320,P=0.000和rs=0.288,P=0.000)。见图1C~D。其中,训练集ⅠT、ⅡT和验证集ⅠV、ⅡV、ⅢV HBsAg与病理学分级和分期均无显著相关性(均P>0.05),训练集ⅢT HBsAg分别与病理学分级和分期呈显著负相关(P<0.05)和无显著相关性(P>0.05);训练集ⅠT、ⅡT、ⅢT和验证集ⅠV、ⅡV、ⅢV HBcrAg与病理学分级和分期均呈显著正相关(均P<0.05);训练集ⅠT、ⅡT、ⅢT和验证集ⅠV、ⅢV HBV DNA与病理学分级和分期均呈显著正相关(均P<0.05),验证集ⅡV HBV DNA分别与病理学分级和分期呈显著正相关(P<0.05)和无显著相关性(P>0.05)。见表4。
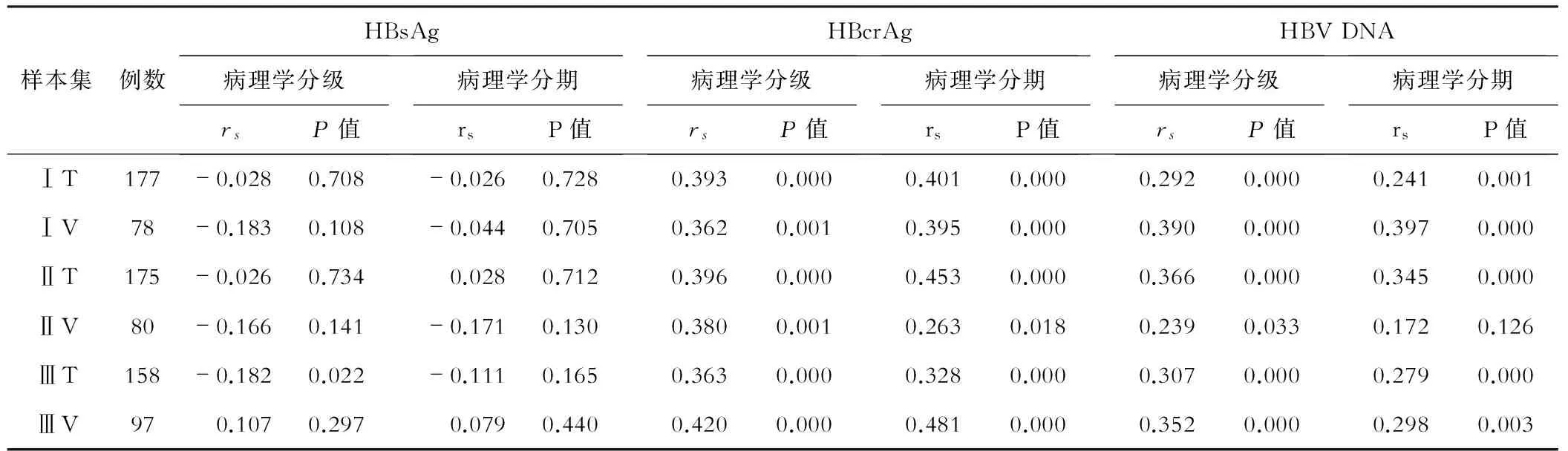
表4 HBeAg阴性患者训练集和验证集血清HBsAg、HBcrAg和HBV DNA与病理学分级和分期的Spearman相关系数
三、血清HBsAg、HBcrAg和HBV DNA预测肝组织不同病理状态的ROC曲线下面积
HBeAg阳性患者,血清HBsAg、HBcrAg和HBV DNA预测病理学分级≥G2、≥G3和分期≥S2、≥S3、≥S4的ROC曲线下面积均显著大于对角参考线下面积(P<0.01);其中,血清HBsAg预测病理学分级≥G3和分期≥S3、≥S4及HBcrAg和HBV DNA预测病理学分期≥S4的ROC曲线下面积大于0.70。血清HBsAg与HBV DNA预测病理学分级≥G3和分期≥S3、≥S4的ROC曲线下面积之间的差异有统计学意义(P<0.05)。见表5,图2A~B。
HBeAg阴性患者,血清HBsAg预测病理学≥S3,HBcrAg预测病理学分级≥G2、≥G3和分期≥S2、≥S3、≥S4,HBV DNA预测病理学分级≥G2、≥G3和分期≥S2、≥S3的ROC曲线下面积显著大于对角参考线下面积(P<0.05);其中,血清HBcrAg预测病理学分级≥G2、≥G3和分期≥S2的ROC曲线下面积大于0.70。血清HBcrAg与HBV DNA预测病理学分级≥G3和分期≥S3的ROC曲线下面积之间的差异有统计学意义(P<0.05)。见表5,图2C~D。
四、血清HBsAg、HBcrAg和HBV DNA预测优选肝组织病理状态的性能评价
HBeAg阳性患者,血清HBsAg、HBcrAg、HBV DNA预测训练集ⅠT、ⅡT、ⅢT病理学分级≥G3的

表5 血清HBsAg、HBcrAg和HBV DNA预测不同和相同病理状态ROC曲线下面积之间的差异
注:AUC为ROC曲线下面积;SE为标准误。a:Z=2.180,P=0.029; b:Z=3.617,P=0.000; c:Z=3.619,P=0.000; d:Z=2.405,P=0.016; e:Z=2.632,P=0.009; f:Z=2.352,P=0.019; g:Z=3.098,P=0.002; h:Z=2.555,P=0.011; i:Z=2.100,P=0.036; j:Z=5.371,P=0.000; k:Z=3.968,P=0.000; l:Z=2.370,P=0.018; m:Z=2.298,P=0.022

图2 血清HBsAg、HBcrAg和HBV DNA预测HBeAg阳性患者病理学分级≥G3(A)和分期≥S4(B)
中位最佳截断值上限与预测全集病理学分级≥G3的最佳截断值上限之差分别为0.050 log10IU/mL、0.318 log10kU/mL和0.241 log10IU/mL;血清HBsAg、HBcrAg、HBV DNA预测训练集ⅠT、ⅡT、ⅢT的最佳截断值上限极差分别为0.423 log10IU/mL、0.371 log10kU/mL和0.241 log10IU/mL;以预测训练集ⅠT、ⅡT、ⅢT病理学分级≥G3的最佳截断值为标准,血清HBsAg、HBcrAg、HBV DNA预测验证集ⅠV、ⅡV、ⅢV病理学分级≥G3的灵敏度和特异度极差分别为37%和12%、30%和13%、17%和15%。血清HBsAg、HBcrAg、HBV DNA预测训练集ⅠT、ⅡT、ⅢT病理学分期≥S4的中位最佳截断值上限与预测全集病理学分期≥S4的最佳截断值上限之差分别为0.105 log10IU/mL、0.000 kU/mL、0.475 log10IU/mL;血清HBsAg、HBcrAg、HBV DNA预测训练集ⅠT、ⅡT、ⅢT的最佳截断值上限极差分别为0.105 log10IU/mL、0.270 log10kU/mL、0.475 log10IU/mL;以预测训练集ⅠT、ⅡT、ⅢT病理学分期≥S4的最佳截断值为标准,血清HBsAg、HBcrAg、HBV DNA预测验证集ⅠV、ⅡV、ⅢV病理学分期≥S4的灵敏度和特异度极差分别为9%和5%、16%和3%、14%和6%。见表6。
HBeAg阴性患者,血清HBcrAg、HBV DNA预测训练集ⅠT、ⅡT、ⅢT病理学分级≥G2的中位最佳截断值下限与预测全集病理学分级≥G2的最佳截断值下限之差均为0;血清HBcrAg、HBV DNA预测训练集ⅠT、ⅡT、ⅢT的最佳截断值下限极差分别为0.017 log10kU/mL和1.817 log10IU/mL;以预测训练集ⅠT、ⅡT、ⅢT病理学分级≥G2的最佳截断值为标准,血清HBcrAg、HBV DNA预测验证集ⅠV、ⅡV、ⅢV病理学分级≥G2的灵敏度和特异度极差分别为11%和15%、46%和38%。血清HBcrAg、HBV DNA预测训练集ⅠT、ⅡT、ⅢT病理学分期≥S2的中位最佳截断值下限与预测全集病理学分期≥S2的最佳截断值下限之差分别为0.020 log10kU/mL和0.082 log10IU/mL;血清HBcrAg、HBV DNA预测训练集ⅠT、ⅡT、ⅢT的最佳截断值下限极差分别为0.020 log10kU/mL和0.371 log10IU/mL;以预测训练集ⅠT、ⅡT、ⅢT病理学分期≥S2的最佳截断值为标准,血清HBcrAg、HBV DNA预测验证集ⅠV、ⅡV、ⅢV病理学分期≥S2的灵敏度和特异度极差分别为20%和2%、19%和16%。见表7。

表6 HBeAg阳性患者血清HBsAg、HBcrAg和HBV DNA预测优选病理状态的最佳截断值及其性能验证[M(全距)]
注:Sen为灵敏度;Spe为特异度;+PV为阳性预测值;-PV为阴性预测值

表7 HBeAg阴性患者血清HBcrAg和HBV DNA预测优选病理状态的最佳截断值及其性能验证[M(全距)
注:Sen为灵敏度;Spe为特异度;+PV为阳性预测值;-PV为阴性预测值
讨 论
预测CHB肝组织病理状态的无创指标可分为两大类:疾病特异性和病因特异性指标。其中,疾病特异性指标和基于疾病特异性指标构建的数学模型已被广泛研究,其部分成果已被推广应用[6-9];近年来,随着商业化血清HBsAg、HBcrAg和HBV DNA定量检测的逐步应用,病因特异性指标预测肝组织病理状态的价值也逐步被研究[10-18]。但是,病因特异性指标预测肝组织病理状态的性能尚未被广泛验证,整合病因特异性和疾病特异性指标构建的数学模型也未被充分开发[20]。
本研究结果显示,HBeAg阳性患者,全集血清HBsAg、HBcrAg和HBV DNA与病理学分级和分期均呈显著负相关;三组匹配的训练集和验证集中,仅验证集ⅠV、ⅡV、ⅢV 血清HBV DNA与病理学分级无显著相关性。HBeAg阴性患者,全集血清HBsAg与病理学分级和分期均无显著相关性,血清HBcrAg和HBV DNA与病理学分级和分期均呈显著正相关;三组匹配的训练集和验证集中,仅训练集ⅢT HBsAg与病理学分级呈显著负相关,验证集ⅡV HBV DNA与病理学分期无显著相关性。前期的研究[10-14]也有相似的结果。提示血清HBsAg、HBcrAg和HBV DNA对HBeAg阳性患者,血清HBcrAg和HBV DNA对HBeAg阴性患者病理学分级和分期有潜在的预测价值。
无创指标或模型可预测的最佳病理状态,就炎症活动度而言,或为显著炎症(Knodell HAI ≥5,METAVIR炎症分级≥A2,Scheuer病理学分级≥G2),或为严重炎症(Knodell HAI ≥7,METAVIR炎症分级≥A3,Scheuer病理学分级≥G3);就纤维化程度来说,或为显著纤维化(Ishak 纤维化评分≥2,METAVIR纤维化分级≥F2,Scheuer病理学分期≥S2),或为严重纤维化(Ishak 纤维化评分≥3,METAVIR纤维化分级≥F3,Scheuer病理学分期≥S3),或为进展期纤维化(Ishak 纤维化评分≥4,METAVIR纤维化分级≥F4,Scheuer病理学分期≥S4)。根据已发表文献,血清HBsAg对HBeAg阳性患者肝组织病理状态有一定的预测意义,但其可预测的最佳病理状态存在分歧[11-14, 20-23];血清HBV DNA对HBeAg阴性患者的肝组织病理状态有一定的预测价值,其可预测的最佳病理状态为显著炎症或显著纤维化[11-12, 14, 18, 24-28];血清HBcrAg对HBeAg阳性和阴性患者均有一定的预测价值,其可预测的最佳病理状态分别相似于HBeAg阳性患者的血清HBsAg和HBeAg阴性患者的血清HBV DNA[14]。
本研究结果显示,HBeAg阳性患者,只有血清HBsAg预测病理学分级≥G3和分期≥S3、≥S4及HBcrAg和HBV DNA预测病理学分期≥S4的ROC曲线下面积大于0.70;与预测病理学分级≥G2和分期≥S2、≥S3相比,血清HBsAg、HBcrAg和HBV DNA预测病理学分级≥G3和分期≥S4的ROC曲线下面积最大。HBeAg阴性患者,只有血清HBcrAg预测病理学分级≥G2、≥G3和分期≥S2的ROC曲线下面积大于0.70;与预测病理学分级≥G3和分期≥S3、≥S4相比,血清HBcrAg和HBV DNA预测病理学分级≥G2和分期≥S2的ROC曲线下面积最大。本结果与文献[11-14,16,23]报道相似。因此,HBeAg阳性患者,血清HBsAg、HBcrAg和HBV DNA可预测的最佳病理状态为病理学分级≥G3和分期≥S4;HBeAg阴性患者,血清HBcrAg和HBV DNA可预测的最佳病理状态为病理学分级≥G2和分期≥S2。
将肝组织病理状态根据双维度(炎症活动度和纤维化程度)进行二分类,采用ROC曲线法确定无创指标和模型的最佳截断值并计算相应的诊断参数,是目前评价无创指标和模型对肝组织病理状态是否有预测意义的最常用方法。采用ROC曲线法的研究已证实,血清HBsAg、HBcrAg和HBV DNA对肝组织病理状态有一定的预测意义[11-12, 14-18, 20-28]。但是,迄今为止,很少有文献进一步采用交叉验证法来评价血清HBsAg、HBcrAg和HBV DNA预测其可预测的最佳病理状态的性能[20]。
本研究结果显示,HBeAg阳性患者,血清HBsAg、HBcrAg、HBV DNA预测三个训练集病理学分级≥G3和分期≥S4的最佳截断值上限极差分别<1.000 log10IU/mL和<1.000 log10IU/mL、<1.000 log10kU/mL和<1.000 log10kU/mL、<1.000 log10IU/mL和<1.000 log10IU/mL;以预测三个训练集病理学分级≥G3和分期≥S4的最佳截断值为标准,血清HBsAg、HBcrAg、HBV DNA预测三个匹配的验证集病理学分级≥G3的灵敏度和特异度极差分别为37%和12%、30%和13%、17%和15%,预测三个匹配的验证集病理学分期≥S4的灵敏度和特异度极差分别为9%和5%、16%和3%、14%和6%;提示血清HBsAg、HBcrAg、HBV DNA预测HBeAg阳性患者病理学分期≥S4的稳定性高于预测病理学分级≥G3,其中血清HBsAg预测理学分期≥S4的稳定性最高。HBeAg阴性患者,血清HBcrAg、HBV DNA预测三个训练集病理学分级≥G2和分期≥S2的最佳截断值下限极差分别<1.000 log10kU/mL和>1.000 log10kU/mL、<1.000 log10IU/mL和<1.000 log10IU/mL;以预测三个训练集病理学分级≥G2和分期≥S2的最佳截断值为标准,血清HBcrAg、HBV DNA预测三个匹配的验证集病理学分级≥G2的灵敏度和特异度极差分别为11%和15%、46%和38%,预测三个匹配的验证集病理学分期≥S2的灵敏度和特异度极差分别为20%和2%、19%和16%;提示血清HBcrAg预测HBeAg阴性患者病理学分级≥G2和分期≥S2的稳定性高于HBV DNA,但是,血清HBcrAg预测病理学分级≥G2和分期≥S2的稳定性也不能令人满意。
本研究采用ROC曲线探讨了血清HBsAg、HBcrAg和HBV DNA预测CHB肝组织病理状态的价值,并采用K-折交叉验证法初步评价了其可预测的最佳病理状态的性能。结果显示,HBeAg阳性患者,血清HBsAg、HBcrAg和HBV DNA可预测的最佳病理状态为病理学分级≥G3和分期≥S4,预测病理学分期≥S4的稳定性高于预测病理学分级≥G3;HBeAg阴性患者,血清HBcrAg和HBV DNA可预测的最佳病理状态为病理学分级≥G2和分期≥S2,血清HBcrAg预测病理学分级≥G2和分期≥S2的稳定性高于HBV DNA。
[1] Shoaei SD, Sali S, Karamipour M, et al. Non-invasive histologic markers of liver disease in patients with chronic hepatitis B. Hepat Mon, 2014, 14: e14228.
[2] Zeng X, Xu C, He D, et al. Performance of several simple, noninvasive models for assessing significant liver fibrosis in patients with chronic hepatitis B. Croat Med J, 2015, 56: 272-279.
[3] Wan R, Liu H, Wang X, et al. Noninvasive predictive models of liver fibrosis in patients with chronic hepatitis B. Int J Clin Exp Med, 2015, 8: 961-971.
[4] Cheng J, Hou J, Ding H, et al. Validation of ten noninvasive diagnostic models for prediction of liver fibrosis in patients with chronic hepatitis B. PLoS ONE, 2015, 10: e0144425.
[5] Motola DL, Caravan P, Chung RT, et al. Noninvasive biomarkers of liver fibrosis: clinical applications and future directions. Curr Pathobiol Rep, 2014, 2: 245-256.
[6] 中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015更新版). 肝脏,2015,20: 915-932.
[7] Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Hepatol Int, 2016, 10: 1-98.
[8] European Association for the Study of the Liver, Asociacion Latinoamericana para el Estudio del Higado. EASL-ALEH Clinical practice guidelines: Non-invasive tests for evaluation of liver disease severity and prognosis. J Hepatol, 2015, 63: 237-264.
[9] World Health Organization. Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection. Geneva: WHO Press, 2015: 25-35.
[10] 张占卿,陆伟,王雁冰,等. 血清HBsAg和HBV DNA对慢性乙型肝炎肝组织病理状态的判别评价. 中华临床医师杂志(电子版), 2013, 7: 6841-6847.
[11] 张占卿, 陆伟, 王雁冰, 等. 年龄和血清 HBsAg、HBV DNA预测慢性乙型肝炎肝组织病理状态的研究. 同济大学学报(医学版), 2015, 36: 50-57.
[12] 张占卿,陆伟,王雁冰,等.血清HBsAg和HBV DNA预测慢性乙型肝炎肝组织病理状态的评价.胃肠病学和肝病学杂志,2013, 23: 5541-559.
[13] 张占卿, 陆伟,翁齐铖, 等. 血清病毒学标记物预测慢性乙型肝炎肝组织病理状态的评价. 同济大学学报(医学版), 2015, 36: 57-63.
[14] 张占卿, 陆伟,翁齐铖, 等. 血清乙型肝炎核心相关抗原预测慢性乙型肝炎肝组织病理状态的评价. 肝脏, 2015, 20: 576-582.
[15] Zeng DW, Zhang JM, Liu YR, et al. A retrospective study on the significance of liver biopsy and hepatitis B surface antigen in chronic hepatitis B infection. Medicine, 2016, 95: e2503.
[16] Jia W, Qi X, Ji YY, et al. Low serum hepatitis B surface antigen level predicts compensated cirrhosis caused by chronic hepatitis B in HBeAg positive patients in east China. Hepat Mon, 2015, 15:e29183.
[17] Alam S, Ahmad N, Mustafa G, et al. Evaluation of normal or minimally elevated alanine transaminase, age and DNA level in predicting liver histological changes in chronic hepatitis B. Liver Int, 2011, 31:824-830.
[18] Croagh CMN, Bell SJ, Slavin J, et al. Increasing hepatitis B viral load is associated with risk of significant liver fibrosis in HBeAg-negative but not HBeAg-positive chronic hepatitis B. Liver Int, 2010, 30: 1115 -1122.
[19] Brunt EM. Grading and staging the histopathological lesions of chronic hepatitis: The Knodell histology activity index and beyond. Hepatology, 2000, 31: 241-246.
[20] Xun YH, Zang GQ, Guo JH, et al. Serum hepatitis B surface antigen quantification as a useful assessment for significant fibrosis in hepatitis B e antigen-positive hepatitis B virus carriers. J Gastroeterol Hepatol, 2013, 28: 1746-1755.
[21] Martinot-Peignoux M, Carvalho-Filho R, Lapalus M, et al. Hepatitis B surface antigen serum level is associated with fibrosis severity in treatment-naive, e antigen-positive patients. J Hepatol, 2013, 58: 1089-1095.
[22] Seto WK, Wong DKH, Fung J, et al. High hepatitis B surface antigen levels predict insignificant fibrosis in hepatitis B e antigen positive chronic hepatitis B. PLoS One, 2012, 7: e43087.
[23] Cheng PN, Tsai HW, Chiu YC, et al. Clinical significance of serum HBsAg levels and association with liver histology in HBeAg positive chronic hepatitis B. J Clin Virol, 2013, 57: 323-330.
[24] Alam S, Ahmad N, Mustafa G, et al. Evaluation of normal or minimally elevated alanine transaminase, age and DNA level in predicting liver histological changes in chronic hepatitis B. Liver Int, 2011, 31: 824-830.
[25] McMahon BJ, Bulkow L, Simons B, et al. Relationship between level of HBV DNA and liver disease - a population-based study of hepatitits B e antigen-negative persons with hepatitis B. Clin Gastroenterol Hepatol, 2014, 12: 701-706.
[26] Praneenararat S, Chamroonkul N, Sripongpun P, et al. HBV DNA level could predict significant liver fibrosis in HBeAg negative chronic hepatitis B patients with biopsy indication. BMC Gastroenterology, 2014, 14: 218.
[27] Croagh CMN, Bell SJ, Slavin J, et al. Increasing hepatitis B viral load is associated with risk of signi?cant liver fibrosis in HBeAg-negative but not HBeAg-positive chronic hepatitis B. Liver Int, 2010, 30: 1115-1122.
[28] Sanai FM, Helmy A, Bzeizi KI, et al. Discriminant value of serum HBV DNA levels as predictors of liver fibrosis in chronic hepatitis B. J Viral Hepat, 2011, 18: e217- e225.
(本文编辑:钱燕)
Evaluation on predictive value of serum HBsAg, HBcrAg and HBV DNA for liver pathology in chronic hepatitis B patients
ZHANGZhan-qing,LUWei,DINGRong-rong,WENGQi-cheng,ZHANGZhi-yong,WANGYan-bing,ZHOUXin-lan,HUANGDan,LIXiu-fen.
DivisionTwoofHepatitisDepartment,ShanghaiPublicHealthClinicalCenter,Shanghai201508,ChinaCorrespondingauthor:ZHANGZhan-Qing,Email:doctorzzqsphc@163.com
Objective To evaluate the predictive value of serum hepatitis B surface antigen (HBsAg), hepatitis B core-related antigen (HBcrAg) and hepatitis B virus (HBV) DNA for liver pathology in chronic hepatitis B (CHB) patients. Methods CHB patients, containing 324 HBeAg-positive and 255 HBeAg-negative cases, were randomly divided into 3 paired train and validation sets. Serum HBsAg and HBcrAg were measured by Lumipulse G1200 and Abbott Architect I2000 automatic chemiluminescence immunoassay analyzers, respectively. Serum HBV DNA was detected by Bio-Rad Icycler fluorescence quantitative PCR system. Scheuer scoring system was applied for pathological evaluation of liver tissues, containing 5 grades from G0 to G4 and 5 stages from S0 to S4. Results Gender ratio, average age and proportion of pathological grades and stages in 3 paired train and validation sets showed no statistically significant differences (P>0.05) in both HBeAg positive and negative cases. In HBeAg-positive patients, the areas under receiver operating characteristic curve (ROC) of serum HBsAg, HBcrAg and HBV DNA for predicting ≥ G3 and ≥ S4 in complete set were the largest. Referring to the optimal cutoffs for predicting ≥ G3 and ≥ S4 in 3 train sets, the ranges of sensitivities of serum HBsAg, HBcrAg and HBV DNA for predicting ≥ G3 and ≥ S4 in the 3 matched validation sets were 37%, 30%, 17% and 9%, 16%, 14%, respectively. Meanwhile, the ranges of specificity were 12%, 13%, 15% and 5%, 3%, 6%, respectively. In HBeAg-negative patients, the areas under ROC of serum HBcrAg and HBV DNA for predicting ≥ G2 and ≥ S2 in complete set were the largest. Based on the optimal cutoffs in 3 train sets, the ranges of sensitivity of serum HBcrAg and HBV DNA for predicting ≥ G2 and ≥ S2 in the 3 matched validation sets were 11%, 46% and 19%, 20%, respectively, and the ranges of specificities were 15%, 38% and 2%, 16%, respectively. Conclusion In HBeAg-positive patients, serum HBsAg, HBcrAg and HBV DNA were suitable for predicting pathologic states of ≥ G3 and ≥ S4, and the stabilities for predicting ≥ S4 were better than those for predicting ≥ G3. In HBeAg-negative patients with pathologic states of ≥ G2 and ≥ S2, serum HBcrAg and HBV DNA were the best predictable indicators, and serum HBcrAg showed better stabilities than serum HBV DNA.
Hepatitis B surface antigen; Hepatitis B core-related antigen; Hepatitis B virus DNA; Liver tissue; Pathology; Noninvasive diagnosis
上海市卫生和计划生育委员会重点科研项目(20134032);国家“十二五”科技重大专项(2013ZX10002005)
201508 上海市公共卫生临床中心肝炎二科(张占卿,陆伟,丁荣蓉,王雁冰,周新兰,黄丹,李秀芬);日本富士瑞必欧株式会社(翁齐铖,张智勇)
张占卿,Email:doctorzzqsphc@163.com
2016-05-05)

