利奈唑胺治疗高龄院内获得性肺炎患者的疗效及安全性
刘文兵 方 强 丁学军
(浙江大学医学院附属第一医院ICU,浙江 杭州 310003)
利奈唑胺治疗高龄院内获得性肺炎患者的疗效及安全性
刘文兵1方 强 丁学军1
(浙江大学医学院附属第一医院ICU,浙江 杭州 310003)
目的 观察利奈唑胺(LZD)治疗耐甲氧西林金黄色葡萄球菌(MRSA)所致的老年院内获得性肺炎(HAP)的临床疗效和安全性。方法 通过回顾性分析,评价LZD在确诊或高度怀疑由MRSA感染的老年HAP患者中的疗效及安全性。结果 48例不同程度肺炎的患者接受LZD治疗,在重症患者中的临床缓解率是66.7%,细菌清除率是33.3%,在轻中度患者中的临床缓解率是88.9%,细菌清除率是44.4%。实验室检查提示,LZD治疗后患者的白细胞总数,中性粒细胞百分数和绝对值、C反应蛋白(CRP)均较治疗前显著下降(P<0.05),同时肝肾功能、血红蛋白、血小板计数治疗前后比较差异无统计学意义。结论 LZD治疗不同严重程度的MRSA感染引起的HAP均有较好的疗效,且安全性好,不良反应少。
利奈唑胺;院内获得性肺炎;安全性
院内获得性肺炎(HAP)的发病率和病死率有逐年增高的趋势,是导致患者死亡的重要原因〔1〕。甲氧西林金黄色葡萄球菌(MRSA)是医院相关性感染最重要的革兰阳性球菌,MRSA多发生在一些机体抵抗力低下、患有多种疾病和长期住院的病人中,如果这些病人能够得到及时有效的抗生素治疗,结果将会得到极大地改善〔2〕。选用合适的抗生素是控制感染,提高患者生存率的重要环节〔3〕。本研究评价利奈唑胺(LZD)治疗高龄HAP患者的疗效和安全性。
1 资料与方法
1.1 研究对象 选择2010年5月至2013年4月浙江中医药大学附属第三医院急诊科和呼吸科的48例,确诊或高度怀疑是医院获得性MRSA肺炎患者。入选标准:①符合医院获得性肺炎的诊断标准;②通过痰培养或血培养病原学确诊或高度怀疑是MRSA引起的;③年龄≥75岁;④受试者或其法定授权人签署知情同意书。HAP排除标准:①同时合用有其他抗革兰阳性细菌的抗生素;②每天使用激素用量大于10 mg;③混合病毒感染或真菌感染;④存在有影响肺炎疗效的一些其他呼吸系统疾病(支气管哮喘、肺结核、慢性支气管炎、脓胸);⑤其他一些感染性疾病(如心内膜炎、骨髓炎、脑膜炎等);⑥免疫缺陷。48例入组,年龄78~93〔平均(85.75±4.2)〕岁,男33例,女15例;重症肺炎12例,中度28例,轻度8例。入选患者均伴有不同数量的慢性疾病,合并疾病种类平均为(3.8±1.2)种。在48例患者中,40例患者在应用LZD之前使用过包括万古霉素在内的抗生素,因无效而换用LZD。所有患者一开始采用的均为静脉滴注(600 mg,1次/12 h),其中有20例患者在LZD针剂后改为片剂(600 mg,1次/12 h)。LZD的平均静脉用药时间(9.3±1.4)d,持续7~12 d,平均口服用药时间(9.4±1.5)d,持续8~12 d。总的LZD的疗程是(13.25±5.36)d,持续8~24 d。
1.2 治疗方式 LZD有静脉注射液和片剂两种剂型,两种剂量均为600 mg。作为治疗的准则,一般首先以静滴的方式给药,静脉注射:600 mg,1次/12 h,30 min至2 h之内滴完。口服片剂每天给药1 200 mg,1次/12 h。
1.3 疗效评估
1.3.1 临床评估 依据卫生部发布的《抗感染药物临床研究指导原则》进行评价,分为治愈、显效、进步和无效。①痊愈:症状、体征、实验室及病原学检查均恢复正常。②显效:病情明显好转,但以上4 项中1 项未恢复正常。③进步:用药后病情有好转,但不够明显。④无效:用药后72 h病情无明显好转或加重。痊愈与显效两项合计为临床缓解,据此计算临床缓解率。
1.3.2 细菌清除率 ①清除:在治疗结束后的72 h之内痰或血培养细菌提示阴性;②减少:治疗后提示存在MRSA,菌株数量较前减少;③可疑阳性:培养结果不明确;④持续存在:细菌培养提示MRSA阳性,较前无变化。
1.3.3 实验室指标评价 LZD治疗前和停止治疗72 h之内肝肾功能、白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)、C反应蛋白(CRP)的比较。
1.3.4 预后 若有数据支持,在LZD治疗结束后的14 d内再次进行疗效判断(基于临床表现和实验室检查),包括治愈、改善、没有变化、恶化或死亡。
1.4 统计学方法 采用SPSS16.0软件进行Wilcoxon秩和检验及χ2检验。
2 结 果
2.1 临床反应 48例患者中,20例痊愈,20例显效,4例进步,4例无效,治愈率41.6%(20/48),临床缓解率83.3%(40/48);其中在重症患者中复查痰培养有4例被清除,治愈率为33.3%(4/12),临床缓解率66.7%(8/12);在中度及轻度患者中的治愈率是44.4%(16/36),临床缓解率是88.9%(32/36)。在40例确定预后的患者中,24例治愈,12例改善,4例死亡。
2.2 微生物学反应 48例患者中,20例清除,12例细菌减少,4例可疑阳性,12例持续存在。LZD总的细菌清除率是41.6%(20/48),如果包括了细菌减少的例数,细菌清除率是58.3%(28/48);其中在重症患者中的细菌清除率是33.3%(4/12),在轻度和中度患者中的细菌清除率是44.4%(16/36)。在临床缓解的40例患者中,微生物学清除占了20例,细菌减少占了12例,可疑阳性占了4例,持续存在4例。
2.3 安全性评价 患者的WBC、中性粒细胞百分比及计数、CRP治疗后较治疗前显著下降(P<0.05);同时肌酐(Cr)、尿素氮(BUN)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、WBC、红细胞计数(RBC)、Hb及PLT治疗前后相比无差异。见表1。
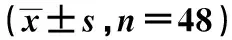
表1 治疗前后实验室指标观察
与治疗前比较:1)P<0.05
3 讨 论
高龄患者身体抵抗力低,往往合并有糖尿病、脑梗死等多种慢性基础疾病,且住院时间长,有侵入性操作等问题,是继发HAP的高危人群〔4〕。MRSA是引起医院相关性感染的重要致病菌之一〔5〕,自1961年首次发现以来〔6〕,其分离率不断增加,CHINET研究结果显示,临床分离出的4 452株金黄色葡萄球菌中MRSA比例高达51.7%〔7〕,占革兰阳性球菌的第一位〔8〕。
LZD是一种新型的人工合成的噁唑烷酮类抗生素,2007年在中国被批准用于MRSA的治疗。它是一种广谱的抗革兰阳性细菌的安全有效的抗生素,在肾功能不全的患者中也可以使用,且具有较高的组织渗透性。在国外已经被广泛应用,并且显示出它在治疗MRSA感染肺炎中的临床有效性。近年来革兰阳性球菌的耐药日趋严重,虽然糖肽类抗菌药物如万古霉素、替考拉宁等一直是治疗革兰阳性菌感染的有效药物,但对其耐药菌株的感染有增多趋势〔9〕。而LZD肺组织浓度高,虽然国外已经有对其耐药MRSA菌株出现,但敏感度仍高达99%以上,我国尚未发现耐利奈唑胺的MRSA菌株〔10〕。
MRSA肺炎的抗感染疗程需根据感染的严重程度决定,通常为7~21 d,但一般不推荐短疗程,尤其是中重度肺炎疗程通常需要2~3 w,最长可用至28 d。本研究与指南推荐的疗程基本一致,可以发现,一般重症肺炎的疗程较轻中度肺炎的长。
上海华山医院应用LZD治疗革兰阳性菌感染的研究显示,在治疗终点,临床缓解率为86.9%,在随访期,临床缓解率为83.1%,细菌清除率79.2%〔11〕。本研究虽然在总的临床缓解率上与既往研究类似,但是细菌清除率较低,临床缓解的患者中一部分细菌培养持续存在,成为隐性带菌者,可能与入选患者年龄大、病情重、合并多种基础疾病、一些长期住院的有呼吸系统疾病的患者长期应用机械通气、机体免疫力低下有关。同时与既往大多数研究不同的是,入选患者仅仅是MRSA肺炎,而MRSA只是众多革兰阳性菌中的其中一种,从另一角度也提示了MRSA较其他革兰阳性菌的顽固性。除此之外,有10例患者在使用LZD之前接受过其他抗菌药物的治疗,未见效果,再一次提示了LZD不但在治疗MRSA引起的轻中度肺炎患者,而且在重症肺炎及多种药物抵抗的病例中依然有较好的临床及微生物学反应,特别是在一些中等严重程度的病例中,提示在疾病恶化之前及时对患者进行有效治疗对预后非常有效。
既往有研究提示LZD耐受性良好〔12〕,常见恶心、呕吐等胃肠道反应;严重不良反应如总胆红素、BUN等可逆性升高者少见,最严重的不良反应是骨髓抑制,包括贫血、WBC下降、PLT减少。本次研究的患者多为高龄,经LZD治疗以后,在WBC、N%及N、CRP较治疗前显著下降的同时,肝肾功能、PLT均未发生显著变化,未发现LZD治疗导致严重肝肾功能损害及骨髓抑制,说明其对老年患者是安全的。虽然既往研究提示血小板减少是其主要的不良反应,多在治疗10 d左右发生,国外报道使用LZD的患者中,PLT减少症发生率为13.0%〔13〕。对于血小板减低发生机制仍不清楚,一般认为是骨髓抑制,有人认为可能与免疫介导有关,也有在对LZD治疗不同年龄段球菌感染患者的研究中发现,LZD致PLT减少与高龄、肝肾功能不全等因素相关〔14〕。但是本实验结果提示LZD在老年患者中有较高的安全性。但也可能由于病例数量有限引起,因此仍建议临床使用LZD的患者,特别是疗程>2 w的,仍应当严密监测血液系统不良反应,至少一周一次监测血小板计数,同时注意治疗剂量个体化。本次研究通过治疗结束后14 d内的随访发现,患者最后预后较好,只有1例患者死亡,原因可能与合并多种严重基础疾病有关,并不是LZD治疗引起的有直接因果关系的不良事件。其余患者不论是否与LZD治疗有因果关系,均没有发生死亡、重大的身体功能障碍以及其他一些生命受到威胁的严重事件。综上,可见LZD在医院获得性MRSA肺炎中有较好的疗效及安全性,并建议在疾病早期及时使用,以达到较好的临床缓解率及细菌清除率。
1 王文玉,叶 芳.老年糖尿病患者并发医院感染的危险因素调查分析〔J〕.中华医院感染学杂志,2011;21(3):2937-9.
2 Catherine Liu,Bayer A,Cosgrove SE,etal.Clinical practice guidelines by the infectious diseases society of America for the treatment of methicillin-resistant staphylococcus aureus infections in adults and children:executive summary〔J〕.Clin Infect Dis,2011;52(5):285-92.
3 Migliori GB,Eker B,Richardson MD,etal.A retrospective TBN ET assessment of linezolid safety,tolerability and efficacy in multidrug resistant,tuberculosis〔J〕.Eur Respir J,2009;34(2):387-93.
4 梁 蓉,陈协群,白庆咸,等.利奈唑胺治疗恶性白血病并发革兰阳性球菌感染16例临床分析〔J〕.中国实用内科杂志,2010;30(12):1155-7.
5 陈启文,张丽娜,吴星恒,等.利奈唑胺治疗儿童白血病化疗后重症感染12例效果观察〔J〕.山东医药,2011;51(11):675-80.
6 Matouskova I,Janout V.Current knowledge of methicillin-resistant Staphylococcusaureus and community-associated methicillin-resistant Staphylococcusaureus〔J〕.Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2008;152(2):191-202.
7 朱德妹,汪 复,胡付品,等.2010年中国CHINET细菌耐药性监测〔J〕.中国感染与化疗杂志,2011;8(5):325-33.
8 Vonder Lippe B,Sandven P,Brubakk O.Efficacy and safety of linezolid in multidrug resistant tuberculos is (MDR-TB) a report of ten cases〔J〕.J Infect,2006;52(2):92-6.
9 唐神结,肖和平.利奈唑胺抗结核作用的研究及其最新进展〔J〕.中华临床医师杂志(电子版),2010;4(1):63-6.
10 肖永红,王 进,赵彩云,等.2006-2007年Mohnarin 细菌耐药监测〔J〕.中华医院感染学杂志,2008;18(6):1051-6.
11 Ramirez P,Laia Fernandez-Baratb,Torres A.New therapy options for MRSA with respiratory infection/pneumonia〔J〕.Curr Opin Infect Dis,2012;25(7):159-65.
12 Lin DF,Zhang YY,Wu JF.Linezolid for the treatment of infections caused by Gram-positive pathogens in China〔J〕.Int J Antimicrob Agents,2008;32(2):2412-49.
13 Garazzino S,De Rosa FG,Bargiaechi O,etal.Haematological safety of long-term therapy with linezolid〔J〕.Int J Antimicrob Agents,2007;29(4):480-3.
14 王海燕,崔 杰,候 莉,等.静脉注射利奈唑胺致血小板减少的相关因素分析〔J〕.中国药物应用与监测,2010;75(5):266-8.
〔2015-01-26修回〕
(编辑 安冉冉/曹梦园)
浙江中医药大学校级基金(2011ZY18);浙江中医药大学附属第三医院院级基金(ZS11CA11)
刘文兵(1981-),男,在读硕士,主治医师,主要从事呼吸系统疾病防治的研究。
R563.1
A
1005-9202(2016)20-5077-03;
10.3969/j.issn.1005-9202.2016.20.066
1 浙江中医药大学附属第三医院ICU

