运动性失语患者不同疗效的功能MRI研究
王 鑫 施 伟 孙彩花 戚悦雅 杨 敏 杨 阳
扬州大学医学院附属江苏扬州五台山医院神经康复科 扬州 225000
·论著·
运动性失语患者不同疗效的功能MRI研究
王 鑫 施 伟 孙彩花 戚悦雅 杨 敏 杨 阳
扬州大学医学院附属江苏扬州五台山医院神经康复科 扬州 225000
目的 探讨运动性失语患者不同疗效的脑区激活特点。方法 选取处于同一基线水平的运动性失语患者,均进行1个月常规失语症康复训练。根据评价结果分为疗效较好组和疗效较差组,与正常人分别进行图片命名任务的fMRI检查,分析各组激活脑区的差异:结果 正常人组双侧岛叶(BA13)、左侧Broca区及其右侧镜像区(BA45)等区域有明显激活,激活区域以左侧半球为多,有明显左侧偏侧性;疗效较差组整体激活较正常人组明显下降,右侧大脑脑区有过多激活,左右间差距较正常人组缩小;疗效较好组则激活区域左侧偏侧性明显,左右间差距较疗效较差组增大,无右侧大脑脑区过多激活。结论 语言功能有明显左侧偏侧性,运动性失语症患者语言功能恢复与左侧半球未受损的功能相关。
运动性失语;疗效;功能性磁共振
言语功能障碍是脑卒中患者的最常见并发症之一,是影响患者功能恢复和生活质量的常见问题[1]。血氧水平依赖功能磁共振成像(blood oxygen level dependent functional MR imaging,BOLD-fMRI)技术可对神经元活动进行较准确的无创伤定位,有助于卒中后言语功能障碍的恢复过程和机制研究。本研究采用BOLD-fMRI 技术,观测运动性失语患者不同疗效的脑区激活特点,旨在为阐明失语症恢复机制提供证据。
1 资料与方法
1.1 研究对象 选择江苏省扬州五台山医院神经康复科2015-01—2015-12住院康复治疗的脑卒中患者;正常对照组选择年龄、性别等相匹配的健康成人。失语症入组标准[2]:(1)年龄50~65岁,母语为汉语;(2)发病前语言功能正常;(3)首次发病,病程<1个月;(4)运动性失语;(5)头颅单个病灶,且在额叶区;(6)失语症严重程度分级标准,评定为2级者;(7)无严重认知障碍,或其它可能影响脑结构与功能的疾病;(8)小学或以上文化程度;(9)右利手;(10)自愿参加实验,能够配合检查、依从性好。排除标准:(1)视力、听力障碍;(2)MRI检查禁忌者;(3)发病前有构音障碍等语言障碍;(4)病灶累及双侧半球者;(5)有严重听理解障碍者;(6)发病后造成精神障碍者或其他原因不合作者;(7)生命体征不稳定者,伴有其他脏器功能衰竭,不能进行随访者。
正常成人纳入及排除标准[2]:纳入标准:(1)50~65岁,母语为汉语;(2)无口吃、构音障碍等语言功能障碍;(3)无认知障碍;(4)无脑卒中病史或脑外伤病史;(5)无其它可能影响脑结构与功能的疾病;(6)小学或以上文化程度;(7)右利手;(8)自愿参加实验,能够配合检查、依从性好。排除标准:(1)视力、听力障碍;(2)MRI检查禁忌者。
1.2 分组[2]所有运动性失语患者训练前均进行西方失语症成套测验(western aphasia battery,WAB)评价,后进行常规失语症训练,2次/d,上下午各1次,30 min/次,1周休息1 d;训练1个月后再进行WAB评价。根据评价结果分为疗效较好组和疗效较差组。疗效较好组入组标准:(1)WAB评价总分较训练前提高≥10分;(2)命名单项测试成绩较训练前提高≥15%;疗效较差组入组标准:(1)WAB评价总分较训练前提高≤5分;(2)命名单项测试成绩较训练前提高≤5%;最终fMRI检查疗效较好组8例,疗效较差组8例,正常人8例。各组一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
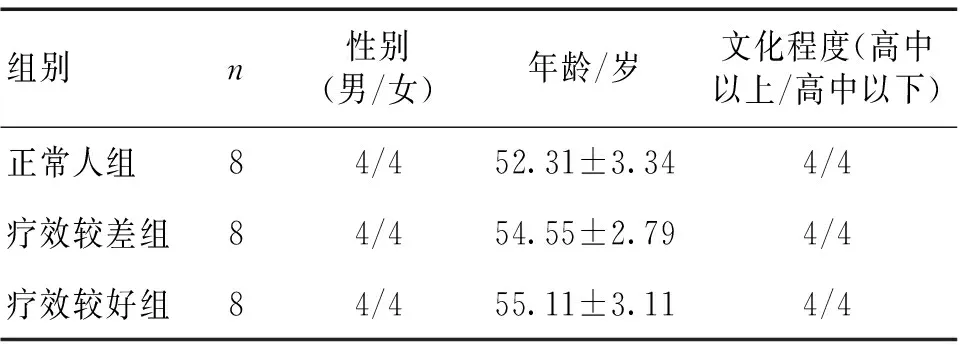
表1 各组一般资料
1.3 实验方法[3]正常人和两组失语症患者均于1个月训练后、再次WAB测试的第2天,进行图片命名任务的fMRI检查。图片任务设计参照文献[3],采用组块设计模式,图片命名任务图片来源于 Snodgrass and Vanderwart标准图谱,在任务状态时间段内随机显示6幅图片,图片均为彩色图片,包含内容为常见物品、动物、任务等,在任务期要求患者采用默读方式命名图片,每幅图片显示5 s,间隔期30 s,静息状态为空白,交替显示。视觉信息呈现经DMDX 软件严格控制时间,经电脑投影仪背投到受试者足端的屏幕上,受试者通过反光镜观察。
1.4 数据采集[3]采用GE 3.0 T Signa超导型磁共振及8通道正交发射/接收头线圈。BOLD-fMRI采用T2WI梯度回波脉冲序列:单次激发多时相回波平面成像,取轴位,平行于前后联合线,定位扫描30层,间隔采集,TR=3 000 ms,TE=60 ms,NEX=1,反转角90。,扫描野为24 cm×24 cm,层厚5 mm,无间隔扫描。BOLD-fMRI扫描时间为375 s,刺激模式采用ON-OFF模式。前15 s为预扫描,接着由30 s任务与30 s静息交替6次进行。
1.5 数据整理与分析[3]实验数据采用SPM 8软件进行整理与分析。数据整理过程包括图像预处理、统计分析、显示结果。脑区激活范围的阈值设定为10个像素,即连续激活像素达到10 个以上的区域为有效激活区,然后获得平均激活图,叠加于Talairach标准三维脑模板上,对脑的激活区进行定位,确定感兴趣区进行分析。由软件自动得出脑区的激活范围(像素值)和相应脑区的激活强度(T值),再进行比较分析。
2 结果
2.1 正常人组图片任务激活脑区 正常人组双侧岛叶(BA13)、左侧Broca区及其右侧镜像区(BA45)、双侧额中回(BA9)、顶上小叶(BA7)及左侧角回(LBA39)等区域有明显激活,皮质下区域未见明显激活;激活脑区多呈片状,相对集中,周边区域无太多散在激活,同时激活区域以左侧半球为多,有明显左侧偏侧性。见图1、表2。
2.2 疗效较差组图片任务激活区 疗效较差组整体激活较正常人组,无论在激活范围和激活强度上,均明显下降,虽然激活区域仍有左侧偏侧性,但左右间差距较正常人组缩小。其中左侧Broca区较正常人组激活范围和激活强度显著下降(P<0.05),而对侧镜像区右侧Broca区较正常人组较正常人组激活范围和激活强度显著增强(P<0.05)。见图1、表2。
2.3 疗效较好组图片任务激活区 疗效较好组整体激活较正常人组,虽然激活范围和激活强度均明显下降,但较疗效较差组有所增强,激活区域左侧偏侧性明显,左右间差距较疗效较差组增大。其中左侧Broca区较正常人组激活范围和激活强度下降,但较疗效较差组则明显增强(P<0.05),而对侧镜像区右侧Broca区也没有出现过度激活(P<0.05)。见图1、表2。
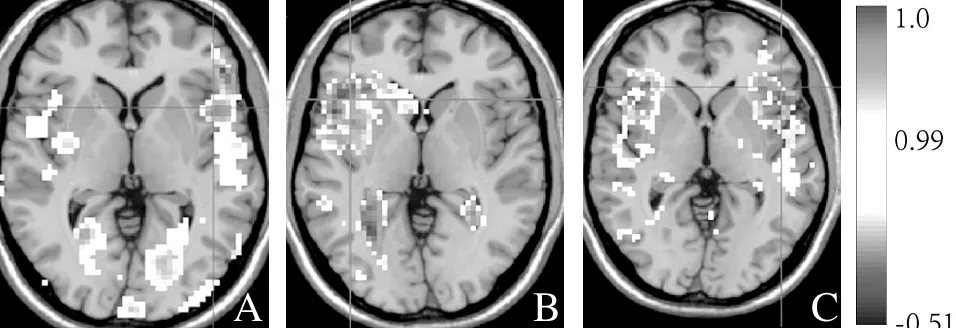
图1 各组测试者图片任务脑区激活情况 红色区域为脑区的有效激活区,低强度的有效激活为红色,随着激活强度的增加,颜色也逐渐加深,由红色逐渐变为橘黄色或者黄色。L代表左侧,R代表右侧。A:正常人组;B:疗效较差组;C:疗效较好组
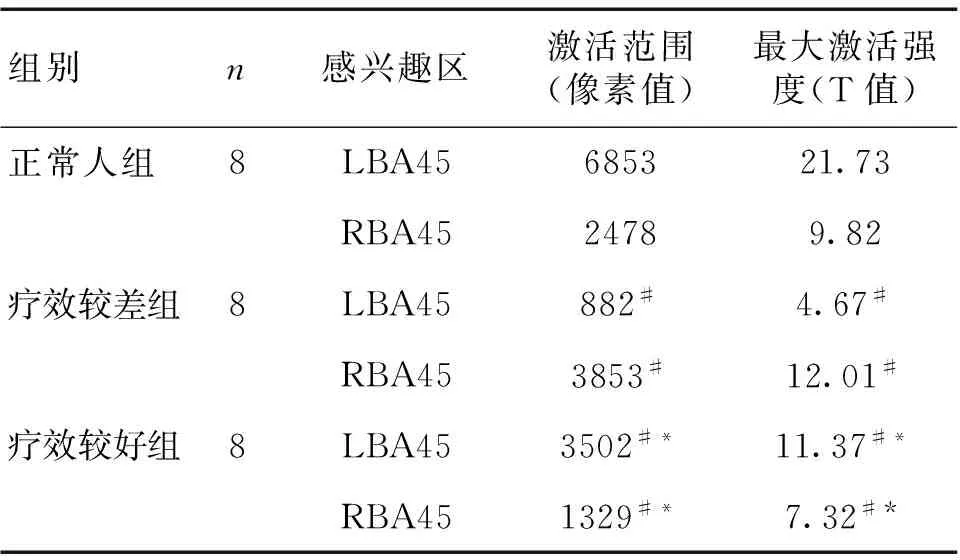
表2 各组图片任务Broca脑区激活情况比较
注:与正常人组比较,#P<0.05;与疗效较差组比较,*P<0.05
3 讨论
本研究采用BOLD-fMRI技术发现,右利手正常人组在完成图片命名任务时,脑区激活有明显的左侧偏侧性,证实了在语言功能中,左侧半球的确占有主导地位。在激活脑区中,左侧Broca区激活范围和激活强度均为最强,结合相关文献,额下回激活与任务产词有关,提示左侧Broca区为语义加工相对特异脑区[4]。同时,岛叶、顶上小叶等也有明显激活,提示大脑在执行某项语言功能时,是由多个脑区共同参与,形成一个脑区功能网络[5-6]。
经过1个月常规失语症康复训练,疗效较差组整体激活较正常人组,激活范围和激活强度均明显下降,虽然激活区域总体仍有左侧偏侧性,但左右间差距较正常人组缩小,甚至右侧Broca区激活高于正常人组,且强度和激活范围都远强于左侧Broca区激活,出现了右侧半球的偏侧性。有研究发现,失语症恢复较好的患者,右侧半球的白质纤维数量增加[7]。甚至患者右侧半球是否得到有效激活,被认为是失语症患者语言能力预后判断的标准之一[8]。但也有研究表明,在失语症恢复患者中,有些患者因为 Broca 区对侧的镜像区被过多的激活,导致失语症恢复效果不好[9-10]。我们的研究结果支持了后一种观点:右侧大脑半球的过多激活,并不利用失语症患者的语言功能的恢复。我们认为,卒中后语言能力恢复有其阶段性,而右半球过多激活,往往会抑制语言功能正常恢复
本文疗效较好组相对于疗效较差组患者,脑部激活区域左侧偏侧性明显,左右间差距较疗效较差组增大;左侧Broca区激活范围和激活强度有所增强,右侧Broca区也没有出现过度激活。提示语言能力恢复较好的患者,在左侧半球残存部分激活的范围更广,说明失语症患者的语言功能依赖于左侧半球未受损部分皮层的大小,与相关文献报道相似[11-12]。
综上所述,正常的语言功能执行是由不同脑区组成的功能网络共同完成的,同时具有明显的功能左侧偏侧性;在运动性失语症患者语言功能恢复过程中,其功能依赖于左侧半球未受损部分皮层的大小,右侧半球过多激活并不利于语言功能的恢复。
[1] Szaflarski JP,Eaton K,Ball AL,Banks C,et al.Poststroke aphasia recovery assessed with functional magnetic resonance imaging and a picture identication task[J].J Stroke Cerebrovasc Dis,2011,20(4):336-345
[2] 王维卓,王美豪,刘会茹,等.脑梗死运动性失语症患者静息态功能连接观察[J].中华医学杂志.2014,94(27):2 135-2 138.
[3] 王鑫,周龙江,王中原,等.脑损害患者数字工作记忆的功能性磁共振研究[J].临床神经病学杂志,2011;2(2):84-87.
[4] Goucha T,Friederici AD.The language skeleton after dissecting meaning:A functional segregation within Broca's Area[J].Neuroimage,2015,114(7):294-302.
[5] Tsvetanov KA,Henson RN,Tyler LK,et al.Extrinsic and Intrinsic Brain Network Connectivity Maintains Cognition across the Lifespan Despite Accelerated Decay of Regional Brain Activation[J].J Neurosci,2016,36(11):3115-3126.
[6] Kims Y,Qi T,Feng X,et al.How does language distance between L1 and L2 affect the L2 brain network? An fMRI study of Korean-Chinese-English trilinguals[J].Neuroimage,2016,129:25-39.
[7] Zipse L,Norton A,Marchina S,et al.When right is all that is left:plasticity of right -hemisphere tracts in a young aphasic patient[J].Ann N Y Acad Sci,2012,1252:237-245.
[8] Pani E,Zheng X,Wang J,et al.Right hemisphere structures predict poststroke speech fluency[J].Neurology,2016,86(17):1 574-1 581.
[9] Marangolo P,Fiori V,Sabatini U,et al.Bilateral Transcranial Direct Current Stimulation Language Treatment Enhances Functional Connectivity in the Left Hemisphere:Preliminary Data from Aphasia[J].J Cogn Neurosci,2016,28(5):724-738.
[10] Galletta EE,Cancelli A,Cottone C,et al.Use of Computational Modeling to Inform tDCS Electrode Montages for the Promotion of LanguageRecovery in Post-stroke Aphasia[J].Brain Stimul,2015,8(6):1 108-1 115.
[11] Szaflarski JP,Eaton K,Ball AL,et al.Poststroke aphasia recovery assessed with functional magnetic resonance imaging and a picture identification task[J].J Stroke Cerebrovasc Dis,2011,20(4):336-345.
[12] Bulteau C,Grosmaitre C,Save-Pédebos J,et al.Language recovery after left hemispherotomy for Rasmussen encephalitis[J].Epilepsy Behav,2015,53:51-57.
(收稿2016-03-25)
The study on MRI characteristics in patients with motor aphasia with different clinical efficacies
WangXin,ShiWei,SunCaihua,QiYueya,YangMin,YangYang
DepartmentofNeurologicalRehabilitation,theAffiliatedWutaishanHospitalofYangzhouUniversity,Yangzhou225000,China
Objective To explore the characteristics of activation zones in brain in motor aphasia patients with different therapeutic effects.Methods All motor-aphasia patients at the same baseline level underwent language rehabilitation training for one month.Based on the evaluation results,all patients were divided into well-efficacy group and bad-efficacy group.We analyzed the differences between activation zones in brain via block-designed picture naming test and fMRI examination applied to all patients and healthy controls.Results Bilateral insular lobes (BA13),Broca area on the left side and mirroring area on the right side showed obvious activations which mainly occurred in the left cerebral hemisphere and presented the left lateralization in healthy controls.Compared with healthy controls,the patients with bad efficacy displayed less total activations largely happening to the right cerebral hemisphere and less distances between the left and the right.The patients with well efficacy showed more obvious left lateralization and larger distances with no more activation zones in the right cerebral hemisphere than those with bad efficacy.Conclusion Language functions shows the markedly left lateralization.And recovery of language functions in patients with motor aphasia may be associated with the undamaged functional zones in the left hemisphere.
Motor aphasia;Therapeutic effect;Functional magnetic resonance imaging
民政部立项课题,编号:2012mzbaj034
R445.2
A
1673-5110(2016)20-0001-03

