乙肝肝硬化背景下肝细胞肝癌的MRI表现:LI-RADS(2014版)定义征象的识别率分析
王鹤,郭小超,王可,陆健,刘爱连,缪小芬,汪禾青,杨学东,王霄英
·LI-RADS临床应用研究专题·
乙肝肝硬化背景下肝细胞肝癌的MRI表现:LI-RADS(2014版)定义征象的识别率分析
王鹤,郭小超,王可,陆健,刘爱连,缪小芬,汪禾青,杨学东,王霄英
目的:分析肝硬化背景上肝细胞肝癌(HCC)的MRI动态增强表现,探讨2014版肝脏影像报告及数据系统(LI-RADS)所定义的各种征象在MRI上的识别率。方法:2008年12月-2014年8月共54例乙肝肝硬化患者入组本多中心研究,所有患者均行MRI平扫和增强扫描、且经病理诊断证实有HCC。由两位阅片者对MR图像进行独立盲法读片,阅片方法遵循LI-RADS流程:对主要征象、次要征象进行评价(出现/未出现),计算2位阅片者对LI-RADS所定义的各种MRI征象的识别率。通过Kappa检验来分析两位阅片者对征象识别的一致性。结果:两位阅片者对病灶的3个主要征象(动脉期高强化、“廓清”表现、“包膜”表现)的识别率依次分别为83.3%和85.2%、77.8%和64.8%、51.9%和61.1%,阅片者间的一致性(Kappa值)分别为0.791、0.512和0.589。对于次要征象,大部分征象均有一定的识别率,以T2WI上稍高信号、扩散受限的识别率最高,分别为90.7%和87.0%、88.9%和90.7%,阅片者间的一致性(Kappa值)分别为0.813和0.899。结论:基于LI-RADS的诊断标准,平扫及动态增强MR图像上乙肝肝硬化背景上的HCC病灶的主要征象能较多地被识别,且阅片者的一致性较好;次要征象中T2WI稍高信号和扩散受限的识别率较高,阅片者间的一致性也非常好。
肝细胞癌;肝硬化;肝脏影像报告及数据系统;磁共振成像
肝细胞肝癌(hepatocellular carcinoma,HCC)是世界上第五大常见肿瘤,约75%~80%的HCC发生在亚洲,且近年来发病率仍然在增长[1-2]。目前,大部分临床指南将CT和MRI动态增强检查作为HCC诊断和分期的一线检查方法[3-7]。最新的一项meta分析显示,与CT动态增强扫描相比,MRI对HCC的诊断敏感性更高[8]。
2011年美国放射学院(American College of Radiology,ACR)发布了针对HCC的CT和MRI诊断的建议流程,即肝脏影像报告及数据系统(Liver Imaging Reporting and Data System,LI-RADS),并在2014年进行了更新[9]。目前LI-RADS已经应用于大
部分欧美国家及部分亚洲国家,并不断得到验证和更新。基于LI-RADS(2014版)的诊断思路,应根据主要征象和次要征象对病灶进行评分,进而得出HCC的总体诊断评分。但在实际工作中,影像工作者是否能比较准确、一致地识别出各种征象,目前尚无定论。本文旨在探讨不同阅片者在分析M R图像上HCC病灶时,对LI-RADS中所定义的HCC的各种征象的识别情况以及阅片者间的一致性。
材料与方法
1.入组进行分析病灶
2008年12月-2014年8月共54例乙肝肝硬化患者入组本多中心研究,所有患者均行MRI平扫和增强扫描、且经病理诊断证实有HCC(有详细的病理记录,具体到细胞的分化程度)。
使用1.5 T及以上MR扫描仪(GE Signa HDe 1.5 T,GE Echospeed HD 1.5 T,GE Signa ExciteTM 3.0 T),射频接收通道8个以上体部相控阵线圈。检查当天清晨禁食6~8 h。检查前对患者进行呼吸和屏气训练,选择呼气末屏气扫描。患者取仰卧位,接收线圈中心与剑突下缘相齐。MRI常规平扫序列包括同、反相位T1WI、脂肪抑制T2WI和DWI。MRI三期动态增强扫描于横轴面采集,使用高压注射器静脉内团注钆双胺对比剂,剂量0.1 mmol/kg,流率2.5~3.0 mL/s。采用三维动态增强序列,使用trigger技术启动扫描,于肺动脉显影约7 s后采集动脉期,动脉期完成后约15 s采集门脉期,注药开始后约3 min采集延迟期。横轴面双回波T1WI序列扫描参数:TR120~250 ms,TE2.25ms/ 4.50 ms(1.5 T)或1.15 ms/ 2.30 ms(3.0 T),翻转角80°~90°,层厚6 mm,间距1.5 mm,矩阵256×160;横轴面T2WI脂肪抑制序列扫描参数:TR6000~8600 ms, TE 70~90 ms,层厚6 mm,间距1.5 mm,矩阵288×224;DWI参数:TR>1500 ms, TE 65 ms,层厚6~8 mm,间距1.5 mm,矩阵128×128,b值600~10000 s/mm2;动态增强扫描参数:TR 3.7 ms(1.5 T)或3.5 ms (3.0 T),TE 1.6 ms,翻转角12°(1.5 T)或15°(3.0 T),层厚≤6 mm,间距0,矩阵256×160。
2.图像分析
由2位放射科医师(分别有肝胆系统阅片经验8和10年)在PACS工作站(Carestream Health,version 11.0)上采用单盲法独立进行读片,阅片者仅被告知本研究病人为慢性乙型肝炎肝硬化、有肝癌风险的病人,而不提供其它临床信息。分析所有病例的平扫及动态增强图像。阅片方法遵循LI-RADS流程:按照肝脏Couinaud分段法记录病灶的部位,根据LI-RADS的要求测量病灶大小,对3个主要征象(动脉期高强化、“廓清”表现、“包膜”表现)和13个次要征象进行评价(出现/未出现)。保存关键图像,以对不同阅片者所读病灶进行匹配。
3.统计学分析
对于LI-RADS所定义的各种征象,通过计算出现的频率来反映其识别率。通过Kappa的分层定性来分析阅片者间的一致性水平:Kappa值0.01~0.20为一致性差,0.21~0.40为一致性一般,0.41~0.60为一致性尚可,0.61~0.80为一致性良好,0.81~0.99视为一致性非常好[10]。使用SPSS 16.0(Chicago,IL)统计软件包。
结 果
入组HCC病灶共54个,直径0.8~4.8 cm,平均2.2 cm。
主要征象及次要征象的识别率见表1。在MR图像上,HCC病灶的三种主要征象均有一定的识别率,动脉期高强化及"廓清"表现的识别率均较高,"包膜"表现的识别率相对较低,但是两位阅片者均发现至少有50%的病灶可见“包膜”表现(图1)。
对于次要征象,MR检查中两个特有征象(T2WI上呈稍高信号及扩散受限)的识别率较高,均接近90%,略高于三种主要征象的识别率(图1)。除了“清晰的环状边缘”(distinctive rim)这个次要征象外,其它征象均至少观察到一次,马赛克征及病灶内脂肪这2个征象的识别率相对较高。
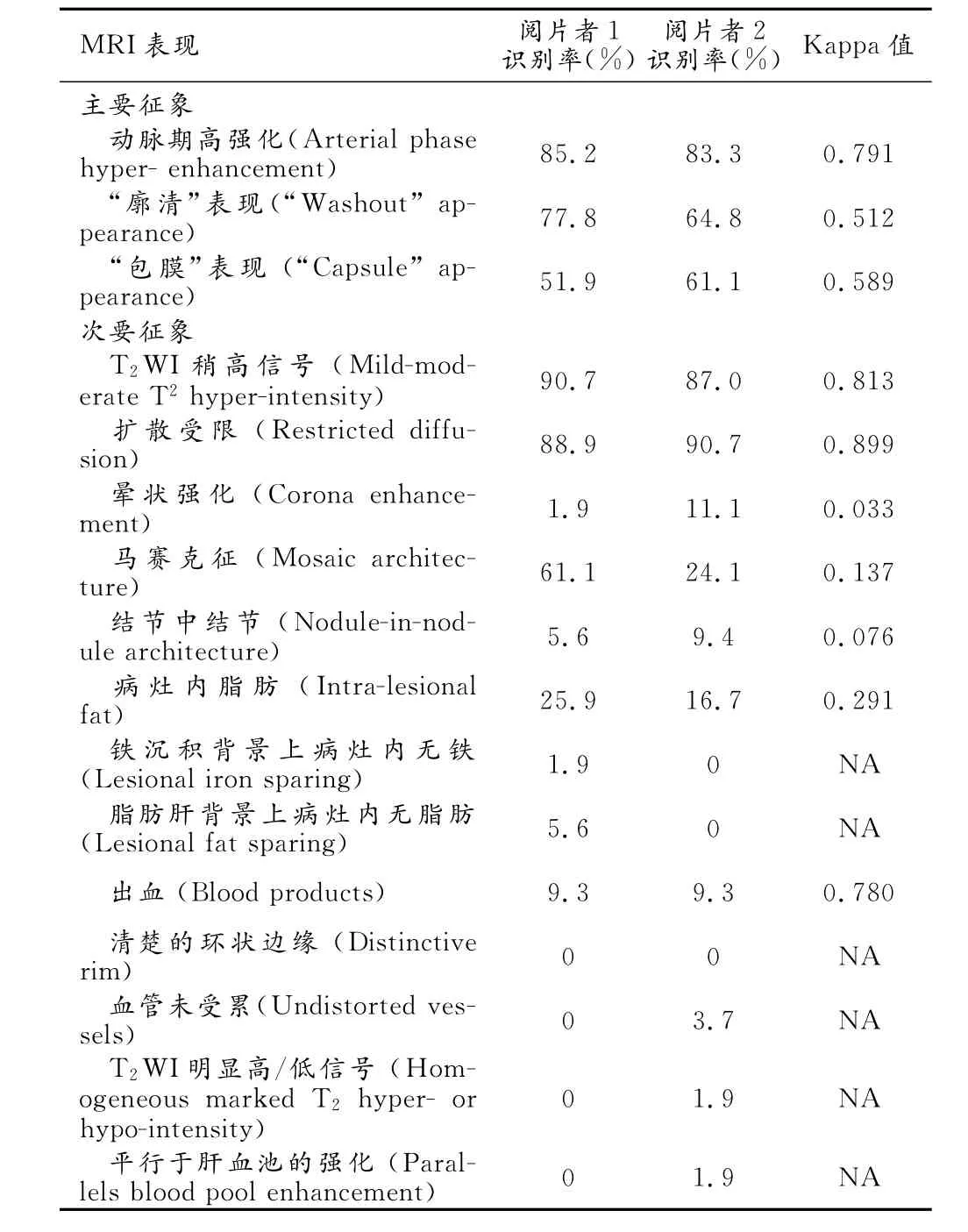
表1 两位阅片者对HCC病灶的LI-RADS征象的识别情况
讨 论
本研究结果显示,基于LI-RADS,两位阅片者对LI-RADS所定义的HCC的MRI主要和次要征象的识别一致性尚可。根据LI-RADS的定义,影像学检查(包括MRI和CT)评判HCC的主要征象是相同的,均为以下5点:病灶大小、病灶增长情况、动脉期高强化、“廓清”表现及“包膜”表现。MRI对动脉期高强化、“廓清”表现及“包膜”表现的显示均较好。
而对于次要征象,与CT相比,MRI有一些特有的次要征象,主要有轻度-中度T2WI高信号(mildm oderate T2hyper-intensity)及扩散受限(restricted diffusion);此外,铁沉积背景上病灶内无铁(iron sparing)也主要在MR图像上观察。这些次要征象的识别率很高,可达到90%左右,提示MRI对HCC的评判可利用的信息更多,诊断效能更高。
轻度-中度T2WI高信号,是指在T2WI上,病灶的信号高于周围正常肝实质,但是低于胆道系统或其它液体的信号。此征象在本研究中的识别率很高,达到90%左右。这是HCC的典型征象之一,在大于3cm的HCC病灶中识别率可达77%。而肝再生结节(regenerative nodule,RN)和再生不良结节(dysplastic nodule,DN)在T2WI上多为等信号或低信号,较少出现稍高信号。因此,在肝硬化背景下,T2WI上轻度-中度高信号的结节应高度怀疑为恶性病变[11]。但是,此征象并非HCC的独有表现,如胆管细胞癌、转移瘤也可出现这种表现。因此,此征象的特异性不高。而且,此征象诊断HCC的敏感性也不足;很多良好分化或中分化的HCC可表现为T2WI等信号或低信号[12-13];此外,肝纤维化可使T2WI上肝脏信号升高,进而减弱病变与周围背景肝实质的对比。因此,此征象仅有部分诊断价值。具有此征象的病灶多为进展期HCC,可以根据增强扫描及肝胆期的相应表现来诊断,故而LI-RADS将此征象作为诊断HCC的次要征象。
另一个识别率较高的次要征象是扩散受限,指在去除T2shine-though效应后,DWI(b值≥400s/mm2)上病灶的信号高于周围肝实质,同时在ADC图上表现为等信号,或部分或全部低于肝脏信号。此征象在本研究中识别率也达到90%左右。扩散受限为倾向于恶性的征象,对于鉴别HCC与DN、小HCC与假病灶有一定价值[14-15]。部分学者提出DWI可以提高病灶的检出率[16],但并非所有研究得出了相同的结果[17]。此征象出现的原理并不十分清楚,可能的主要原因是细胞增多、密集[18]。关于扩散受限征象的意义尚存在很多问题。首先DWI敏感度比较低[16],而且肝纤维化或肝硬化背景会削弱病变与周围肝实质的对比[18]。因此,对于有HCC特征的病变,如果没有表现出扩散受限,也不应该降低其为HCC的可能性。其次,扩散受限并非HCC的特异征象,不能用于鉴别HCC和胆管细胞癌[19]。另外,小HCC与肝海绵状血管瘤也难以鉴别[20]。DWI图像空间分辨率低,而且经常受伪影的影响。因此,DWI上扩散受限征象仅为次要征象,需要结合其它序列的表现进行综合分析。
病灶内脂肪(intralesional fat)指相对于周围肝脏背景,病灶内出现了更多的脂肪聚集[9]。这一征象在本研究中也有一定的识别率,且在MRI上观察比CT更敏感。在MRI中,通过对比同反相位T1WI,观察到反相位图像上出现信号衰减[9]。在CT图像上,因脂肪成分的密度较低,因此其主要表现为病灶内含脂区域的密度减低[21]。但是需要注意的是CT值也会受其它因素的影响。病灶内脂肪变性多见于早期HCC,因此出现此征象可能提示预后较好[22]。另外,此征象在其它肝脏恶性肿瘤中较少见,因此可以作为HCC与其它恶性肿瘤的鉴别点。但是与肝硬化背景下的其它结节相比,此征象并不特异性指向HCC,尚需要与高级别DN和部分低级别DN鉴别。
本研究有一些局限性。第一,由于本研究为多中心研究,质控工作不完善,导致部分图像质量不佳,尤其是DWI图像伪影较大,在之后的研究中需要对图像质量进行进一步严格控制。第二,由于入组条件比较严格,因此入组病例数较少,将来尚需扩充样本量。第三,由于本研究选择的是通过病理确诊HCC的患者,随访的患者较少,因此未对病灶增长这个主要征象进行研究。在将来需要进一步在扩充样本量后对患者的随访信息进行整理,对病灶的大小变化进行进一步研究。
[1] El-Serag HB,Davila JA,Petersen NJ,et al.The continuing increase in the incidence of hepatocellular carcinoma in the United States:an update[J].Ann Intern Med,2003,139(10):817-823.
[2] Chen WQ,Zheng RS,Zhang SW,et al.The incidences and mortalities of major cancers in China 2010[J].Chin J Cancer,2014,33 (8):402-405.
[3] Kudo M.Real practice of hepatocellular carcinoma in Japan:conclusions of the Japan Society of Hepatology 2009 Kobe Congress [J].Oncology,2010,78(Suppl 1):180-188.
[4] Bruix J,Sherman M.Management of hepatocellular carcinoma[J]. Hepatology,2005,42(5):1208-1236.
[5] Bruix J,Sherman M.Management of hepatocellular carcinoma:an update[J].Hepatology,2011,53(3):1020-1022.
[6] EASL-EORTC clinical practice guidelines:management of hepatocellular carcinoma[J].J Hepatol,2012,56(4):908-943.
[7] Omata M,Lesmana LA,Tateishi R,et al.Asian pacific association for the study of the liver consensus recommendations on hepatocellular carcinoma[J].Hepatol Int,2010,4(2):439-474.
[8] Lee YJ,Lee JM,Lee JS,et al.Hepatocellular carcinoma:diagnostic performance of multidetector CT and MR imaging:a systematic review and meta-analysis[J].Radiology,2015,275(1):97-109.
[9] American College of Radiology.Liver imaging reporting and data system version 2014[EB/OL].http://www.acr.org/qualitysafety/resources/LI-RADS,2015-12-07.
[10] Viera AJ,Garrett JM.Understanding interobserver agreement: the Kappa statistic[J].Fam Med,2005,37(5):360-363.
[11] Matsui O,Kadoya M,Kameyama T,et al.Adenomatous hyperplastic nodules in the cirrhotic liver:differentiation from hepatocellular carcinoma with MR imaging[J].Radiology,1989,173 (1):123-126.
[12] Kadoya M,Matsui O,Takashima T,et al.Hepatocellular carcinoma:correlation of MR imaging and histopathologic findings[J]. Radiology,1992,183(3):819-825.
[13] Muramatsu Y,Nawano S,Takayasu K,et al.Early hepatocellular carcinoma:MR imaging[J].Radiology,1991,181(1):209-213.
[14] Vandecaveye V,De Keyzer F,Verslype C,et al.Diffusion-weighted MRI provides additional value to conventional dynamic contrast-enhanced MRI for detection of hepatocellular carcinoma [J].Eur Radiol,2009,19(10):2456-2466.
[15] Xu PJ,Yan FH,Wang JH,et al.Contribution of diffusion-weighted magnetic resonance imaging in the characterization of hepatocellular carcinomas and dysplastic nodules in cirrhotic liver[J].J Comput Assist Tomogr,2010,34(4):506-512.
[16] Kim YK,Kim CS,Han YM,et al.Detection of liver malignancy with gadoxetic acid-enhanced MRI:is addition of diffusion-weighted MRI beneficial[J].Clin Radiol,2011,66(6):489-496.
[17] Yu JS,Chung JJ,Kim JH,et al.Detection of small intrahepatic metastases of hepatocellular carcinomas using diffusion-weighted imaging:comparison with conventional dynamic MRI[J].Magn Reson Imaging,2011,29(7):985-992.
[18] Taouli B,Koh DM.Diffusion-weighted MR imaging of the liver [J].Radiology,2010,254(1):47-66.
[19] Miller FH,Hammond N,Siddiqi AJ,et al.Utility of diffusion-weighted MRI in distinguishing benign and malignant hepatic lesions[J].J Magn Reson Imaging,2010,32(1):138-147.
[20] Galea N,Cantisani V,Taouli B.Liver lesion detection and characterization:role of diffusion-weighted imaging[J].J Magn Reson Imaging,2013,37(6):1260-1276.
[21] Takayasu K,Furukawa H,Wakao F,et al.CT diagnosis of early hepatocellular carcinoma:sensitivity,findings,and CT-pathologic correlation[J].AJR,1995,164(4):885-890.
[22] Siripongsakun S,Lee JK,Raman SS,et al.MRI detection of intratumoral fat in hepatocellular carcinoma:potential biomarker for a more favorable prognosis[J].AJR,2012,199(5):1018-1025.
Recognition of the MR imaging features of HCC foci in cirrhotic liver:based on LI-RADS(2014)definition
WANG He,GUO Xiao-chao,WANG Ke,et al.Department of Radiology,Peking University First Hospital,Beijing 100034,P.R.China
Objective:To evaluate the recognition rate of MR imaging features of hepatocellular carcinoma(HCC)in cirrhotic liver due to HBV based on criteria of LI-RADS(v2014).Methods:From November 2008 to August 2014,54 patients with liver cirrhosis due to HBV infection were enrolled in this multicenter study.All the patients underwent pre-contrast and post-contrast MRI and DWI examination and were confirmed pathologically to have HCC foci.Two radiologists analyzed the images independently.The readers analyzed and categorized the features of the HCC foci based on the definition given by LI-RADS.The recognition rate was calculated for the major and ancillary imaging features.The Kappa test was used to assess inter-reader agreement for all descriptive variables.Results:The recognition rates of the major features of HCC by the two radiologists were as following:hyper-enhancementin arterial phase,83.3% and 85.2%(Kappa=0.791); "washout"appearance,77.8% and 64.8%(Kappa=0.512);"capsule"appearance,51.9% and 61.1%(Kappa=0.589).Most of the ancillary features could be observed,of which mild to moderate hyper-intensity on T2WI(90.7% and 87.0%, Kappa=0.813)and restricted diffusion(88.9% and 90.7%,Kappa=0.899)were more common than the other features. Conclusion:Based on LI-RADS definition,the majorimaging features of HCC on MR images could be recognized with fairly good inter-reader agreement;in the ancillary imaging features,mild to moderate hyper-intensity on T2WI and restricted diffusion might be recognized more frequently,with good inter-reader agreement.
Hepatocellular carcinoma;Liver cirrhosis;Liver imaging reporting and data system;Magnetic resonance imaging
R735.7;R445.2
A
1000-0313(2016)04-0296-04
10.13609/j.cnki.1000-0313.2016.04.003
2016-01-26
2015-03-02)
100034 北京,北京大学第一医院医学影像科(王可、郭小超、王鹤、杨学东、王霄英);226000 江苏,南通市第三人民医院影像科(陆健、缪小芬);116011 辽宁,大连医科大学附属第一医院放射科(刘爱连、汪禾青)
王鹤(1981-),男,天津人,博士,副主任医师,主要从事腹部影像学研究工作。
王霄英,Email:cjr.wangxiaoying@vip.163.com

