11β-HSD1在糖皮质激素联合高脂喂养大鼠胰岛素抵抗中的作用
孙红爽 乜春城 朱小丽 马红芳 陈赫军 种宝贵
·论著·
11β-HSD1在糖皮质激素联合高脂喂养大鼠胰岛素抵抗中的作用
孙红爽 乜春城 朱小丽 马红芳 陈赫军 种宝贵
目的通过糖皮质激素联合高脂喂养建立胰岛素抵抗动物模型,探讨11β-羟类固醇脱氢酶1(11β-HSD1)在该模型中的表达和意义。方法32只雄性Wistar大鼠,按体重随机区组法分为对照组、地塞米松组、高脂饮食组、高脂+地塞米松组(HFD+DEX组),每组8只。对照组和地塞米松组喂以普通饲料,高脂饮食组和HFD+DEX组喂以高脂饲料,8周后地塞米松组和HFD+DEX组辅以地塞米松刺激,12周后进行胰岛素耐量试验,检测血糖、血脂、血胰岛素及皮质酮水平,计算肝指数、内脏肥胖指数及稳态模型评估-胰岛素抵抗(HOMA-IR)指数,检测11β-HSD1基因及蛋白表达情况。结果与对照组相比,其余3组均出现胰岛素抵抗,表现为:胰岛素耐量试验不敏感(注射胰岛素30 min后对照组、高脂饮食组、地塞米松组和HFD+DEX组血糖值分别下降了44.15%,28.14%,32.58%,13.53%)、高血糖、高胰岛素血症、血脂紊乱(总胆固醇、甘油三酯及游离脂肪酸升高,高密度脂蛋白-胆固醇降低)、HOMA-IR指数、肝指数及内脏肥胖指数升高,且HFD+DEX组各项指标变化幅度最大(F=10.89~213.20,P<0.05或P<0.01)。另外,与对照组相比,其余3组内脏脂肪组织11β-HSD1基因及蛋白表达水平也明显升高,且HFD+DEX组明显高于高脂饮食组及地塞米松组(F=32.64~116.00,P均<0.01)。结论地塞米松联合高脂饮食喂养可成功建立大鼠胰岛素抵抗模型,内脏脂肪组织中11β-HSD1基因及蛋白表达升高,可能与胰岛素抵抗的发生密切相关。
11β-羟类固醇脱氢酶1;糖皮质激素;地塞米松;高脂饮食;大鼠
胰岛素抵抗(IR)是糖尿病、高血压、肥胖、非酒精性脂肪性肝病、心脑血管疾病等的重要发病因素,对于其发病机制的研究已成为国内、外热点。糖皮质激素是一种胰岛素的反向调节激素,可对抗胰岛素的降血糖作用,无论是内源性糖皮质激素增多,还是长期使用糖皮质激素类药物,均会导致机体出现IR。11β-羟类固醇脱氢酶(11β-HSD)1在体内具有脱氢和还原双重作用,催化糖皮质激素从无活性的可的松转化为有活性的氢化可的松,继而与糖皮质激素受体结合,发挥生物学效应,因此又被称为糖皮质激素的放大器。目前IR的动物模型建立多通过高脂饲料喂养完成,笔者前期研究发现慢性应激结合高脂饲料喂养可起协同作用,恶化高脂饮食导致的IR、脂质紊乱等[1-2]。本研究在原有造模方式上进行改进,通过高脂喂养联合糖皮质激素建立大鼠IR模型,并分析11β-HSD1在地塞米松恶化高脂喂养大鼠IR、血脂紊乱中的作用,为IR及其相关疾病的药物治疗确立新靶点。
1 材料与方法
1.1 实验动物与分组 雄性Wistar大鼠32只,由河南实验动物中心提供,体重180~220 g,清洁级,生产许可证号:SCXK(豫)2005-0001,动物批号:410116。适应性喂养1周后,32只大鼠按体重随机区组法分成4组:对照组、地塞米松组、高脂饮食组、高脂+地塞米松组(HFD+DEX组),每组8只。对照组和地塞米松组喂以普通饲料,高脂饮食组和HFD+DEX组喂以自制高脂饲料(配方为:25%猪油,5%糖,2%胆固醇,2%食盐,66%基础饲料);8周后地塞米松组和HFD+DEX组再辅以地塞米松刺激,每天8:00及20:00皮下注射地塞米松0.1 mg/kg。动物单笼饲养在恒温[(23±2)℃]、恒湿[(60±5)%]环境中,明暗周期12 h,自由取食饮水。每周称量体重、进食量,实验进行12周后测量相关指标。
1.2 试剂与仪器 游离脂肪酸(FFA)测定试剂盒(南京建成生物工程研究所,20090512);甘油三酯、总胆固醇、高密度脂蛋白-胆固醇(HDL-C)测定试剂盒(长春汇力生物技术有限公司,2009014);胰岛素、皮质醇放射免疫分析药盒(北京北方生物技术研究所,20090520);地塞米松注射液(天津金耀氨基酸有限公司,批号:0908012,规格:1 ml∶5 mg×10盒);两步法RT-PCR试剂盒(Takara公司);11β-HSD1抗体(Santa Cruz公司);SureStep Plus稳步倍加型血糖仪(美国强生公司);T6紫外分光光度计(北京普析通用仪器有限责任公司);M-96型16管手动放射免疫γ计数器(合肥众成生物工程设备有限公司);实时定量PCR仪(美国MJ Research 公司);Western-blotting仪(美国Bio-Rad公司)。
1.3 实验指标的检测
1.3.1 胰岛素耐量试验 12周后,进行胰岛素耐量试验,方法参照文献[3]。



1.3.5 内脏脂肪组织11β-HSD1蛋白表达 每组取3只动物的冻存脂肪组织,提取组织蛋白进行Western印迹检测。上样量10 μl,14.7%分离胶、5%浓缩胶,60 V电泳后转膜2 h,室温封闭2 h,以兔抗小鼠11β-HSD1多克隆抗体为一抗(1∶200稀释),4℃过夜,以羊抗兔IgG-HRP抗体为二抗(1∶800稀释),室温作用2 h,ECL检测。实验所得条带在Bandscan分析软件中测得各自的总灰度值,进行定量分析,并用自身β-actin灰度值校正。

2 结果
2.1 各组体重变化 高脂饲料喂养可使大鼠体重增加更明显,从第10周开始高脂饮食组体重明显高于对照组(P<0.05);地塞米松刺激可使大鼠体重增加缓慢,但地塞米松组与对照组及HFD+DEX组与高脂饮食组之间差异均未见统计学意义(图1)。
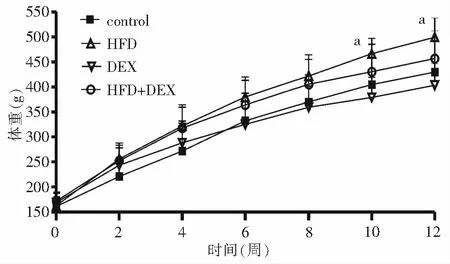
注:control:对照组;HFD:高脂饮食组;DEX:地塞米松组;HFD+DEX:高脂+地塞米松组;与对照组相比,aP<0.05图1 4组Wistar大鼠体重变化情况
2.2 各组进食量变化 高脂饲料喂养使大鼠单位体重的进食量明显减少,从第8周开始高脂饮食组及HFD+DEX组进食量明显低于对照组(P<0.01);与高脂饮食组比较,地塞米松刺激2周后HFD+DEX组进食量增加(P<0.05),4周后增加更明显(P<0.01),见图2。

注:control:对照组;HFD:高脂饮食组;DEX:地塞米松组;HFD+DEX:高脂+地塞米松组;与对照组相比,aP<0.05;与HFD组相比,bP<0.05, cP<0.01 图2 4组Wistar大鼠进食量变化情况
2.3 各组胰岛素耐量试验情况 高脂饮食组与HFD+DEX组的基础血糖(0 min 时血糖值)与对照组相比升高(P<0.01)。腹腔注射胰岛素30 min后,与基础血糖值相比,对照组、高脂饮食组、地塞米松组和HFD+DEX组分别下降了44.15%,28.14%,32.58%,13.53%。3组曲线下面积与对照组相比均显著升高(P均<0.05),且HFD+DEX组升高最明显(P<0.01),见图3。
2.4 各组肝指数及内脏肥胖指数比较 与对照组相比,其余3组肝指数及内脏肥胖指数均明显增加(P均<0.05),且以HFD+DEX组最为明显,见图4。2×2方差分析结果显示,高脂饮食和地塞米松刺激对肝指数及内脏肥胖指数增加均有明显影响(P<0.01);且两因素对内脏肥胖指数升高有协同作用(F=4.88,P<0.05)。
2.5 各组血液生化指标比较 与对照组相比,其余3组血糖、胰岛素及HOMA-IR均明显升高(P均<0.01),且HFD+DEX组明显高于高脂饮食组及地塞米松组(P均<0.01)。2×2方差分析结果显示,高脂饮食、地塞米松刺激对血糖、胰岛素及HOMA-IR的升高均有明显影响(P<0.01),两因素对HOMA-IR的升高有明显协同作用(F=10.05,P<0.01),见表1。
与对照组相比,其余3组血液皮质酮水平均明显升高(P<0.01),地塞米松组高于高脂饮食组(P<0.01),而HFD+DEX组高于地塞米松组(P<0.01)。2×2方差分析结果显示,高脂饮食、地塞米松刺激对皮质酮的升高有明显影响(P<0.01),且两因素存在协同作用(F=5.45,P<0.05)。

注:A:不同时间点血糖水平;B:曲线下面积;control:对照组;HFD:高脂饮食组;DEX:地塞米松组;HFD+DEX:高脂+地塞米松组;AUC:曲线下面积;与对照组相比,aP<0.05,bP<0.01;与HFD组相比,cP<0.01;与地塞米松组相比,dP<0.01图3 4组Wistar大鼠胰岛素耐量的比较(x±s,n=8)
与对照组相比,其余3组总胆固醇、甘油三酯及游离脂肪酸均明显升高(P均<0.01),HDL-C明显下降(P<0.01),且以HFD+DEX组最为明显。2×2方差分析结果显示,高脂饮食、地塞米松刺激对总胆固醇、甘油三酯及游离脂肪酸升高和HDL-C下降均有明显影响(P<0.01);两因素对HDL-C下降有明显协同作用(F=37.69,P<0.01),对总胆固醇及游离脂肪酸升高也有协同作用(F=6.61,P<0.05;F=4.72,P<0.05)。
2.6 各组内脏脂肪组织11β-HSD1基因及蛋白表达比较 与对照组相比,其余3组内脏脂肪组织11β-HSD1 mRNA表达均明显升高,且HFD+DEX组明显高于高脂饮食组及地塞米松组(P<0.01),见图5。2×2方差分析结果显示,高脂饮食、地塞米松刺激对内脏脂肪组织11β-HSD1 mRNA表达均有明显影响(P<0.01),且两因素存在协同作用(F=8.69,P<0.05)。

注:control:对照组;HFD:高脂饮食组;DEX:地塞米松组;HFD+DEX:高脂+地塞米松组;与对照组相比,aP<0.05;bP<0.01;与HFD组相比,cP<0.01;与DEX组相比,dP<0.01图4 4组Wistar大鼠肝指数及内脏肥胖指数比较(x±s,n=8)

表1 4组Wistar 大鼠的血液指标情况
注:与对照组相比,aP<0.01;与高脂饮食组相比,dP<0.05,bP<0.01;与地塞米松组相比,cP<0.01;HFD+DEX组:高脂+地塞米松组;HOMA-IR:稳态模型评估-胰岛素抵抗指数
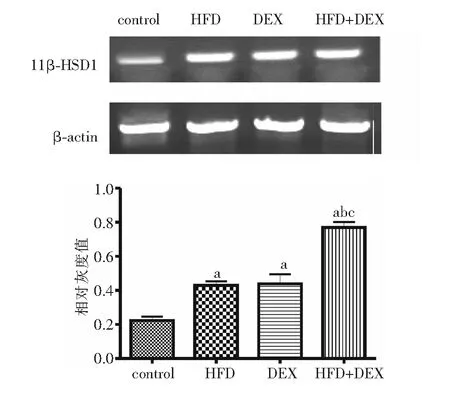
注:control:对照组;HFD:高脂饮食组;DEX:地塞米松组;HFD+DEX:高脂+地塞米松组;11β-HSD1:11β-羟类固醇脱氢酶1;与对照组相比, aP<0.01;与HFD组相比,bP<0.01;与DEX组相比,cP<0.01图5 11β-HSD1基因在4组Wistar大鼠内脏脂肪组织中的表达
与对照组相比,其余3组内脏脂肪组织11β-HSD1蛋白表达均明显升高,且HFD+DEX组明显高于高脂饮食组及地塞米松组(P<0.01),见图6。2×2方差分析结果显示,高脂饮食、地塞米松刺激对内脏脂肪组织11β-HSD1 mRNA表达均有明显影响(P<0.01),两因素不存在协同作用(F=2.57,P>0.05)。
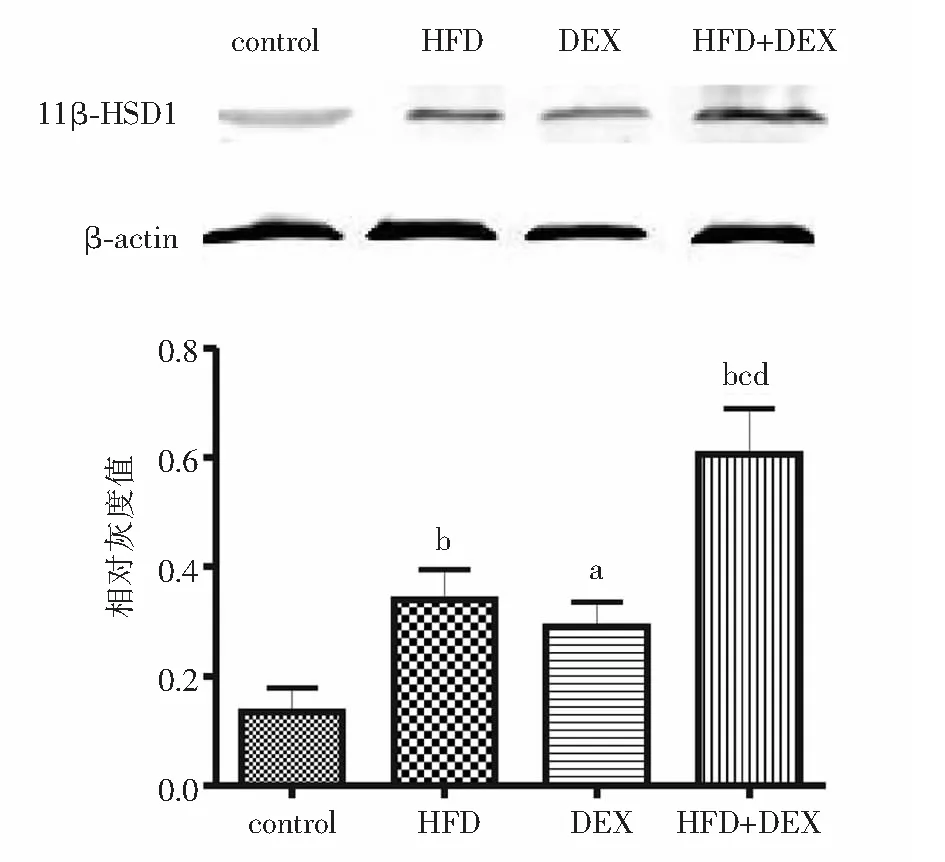
注:control:对照组;HFD:高脂饮食组;DEX:地塞米松组;HFD+DEX:高脂+地塞米松组;11β-HSD1:11β-羟类固醇脱氢酶1;与对照组相比,aP<0.05,bP<0.01;与HFD组相比,cP<0.01;与DEX组相比,d P<0.01 图6 11β-HSD1蛋白在4组Wistar大鼠内脏脂肪组织中的表达
3 讨论
目前关于IR及其动物模型的研究很多,多数通过单纯高脂饲料喂养使动物产生IR,笔者前期研究发现,慢性应激结合高脂饲料喂养可起协同作用,恶化高脂饮食导致的IR、血脂紊乱等[1-2]。慢性应激是一种对长期精神紧张的模拟,如快速生活节奏、工作压力导致的长期精神紧张,可通过激活下丘脑-垂体-肾上腺轴,导致体内糖皮质激素水平升高,从而发挥作用。也有部分研究采用药物与高脂饮食相结合的方式造模。张小华等[4]通过高脂喂养结合地塞米松隔日腹腔注射的方式8周后造模成功,但是报道中注射地塞米松动物的死亡率较高,达20%~30%。因此本研究对原有高脂饲料配方及地塞米松刺激方式做了改进,高脂饲料中增加了胆固醇的含量,地塞米松刺激改为每天皮下注射4周。本次研究结果显示,长期高脂饲料喂养可引起一定程度的IR,具体表现为:血脂紊乱、高血糖、高胰岛素血症、肝指数及内脏肥胖指数增加等,胰岛素耐量试验也显示动物处于IR状态。皮下注射地塞米松可进一步恶化高脂饮食引起的IR,各相关指标变化更加明显,且高脂饮食和地塞米松对血脂、血皮质酮、HOMA-IR及内脏肥胖指数存在协同作用。表明本研究采用皮下注射地塞米松联合高脂饮食的方式建立大鼠IR模型成功。另外,本研究结果显示皮下注射地塞米松后大鼠体重增加缓慢,进食量增加,血液皮质酮水平升高,与现有报道一致[5-6]。
本次研究结果显示,与对照组相比,其余3组内脏脂肪组织11β-HSD1基因及蛋白表达均升高,且HFD+DEX组升高最明显,这种变化趋势与各组动物的IR状态相吻合。11β-HSD1是糖皮质激素代谢的关键酶,催化其从无活性的可的松转化为有活性的氢化可的松,继而与糖皮质激素受体结合,对抗胰岛素的降血糖作用[7]。除此之外,其还可以直接影响胰岛素的分泌[8]。11β-HSD1在体内分布广泛,主要在肝脏、脂肪组织、中枢神经系统和血管平滑肌等糖皮质激素的靶器官表达。局部组织内11β-HSD1的活化以及调节作用异常,是IR的重要发病机制。敲除11β-HSD1基因后,小鼠体内11-脱氢皮质酮不能转化为皮质酮,糖异生关键酶磷酸烯醇式丙酮酸羧激酶及葡萄糖-6-磷酸酶的活性降低,从而避免饮食所引起的肥胖及其他代谢综合征的表现,如IR及高血糖[9]。Okazaki等[10]研究发现,在2型糖尿病小鼠模型中给予选择性11β-HSD1抑制剂能够降低空腹血糖及胰岛素水平,减少肝糖输出,增加胰岛素敏感性。由此推测下调11β-HSD1表达或敲除11β-HSD1基因对于IR的高危人群有保护作用。
由于11β-HSD1非选择性抑制剂可同时抑制肾脏中11β-HSD2的活性,可引起高血压、低钾性碱中毒等不良反应[11]。因此,目前对于11β-HSD1抑制剂的研究主要集中在选择性11β-HSD1抑制剂。芳基磺酰噻唑衍生物包括BVT.528、BVT.14225和VT.2733,前两者能够有效抑制人11β-HSD1水平,后者能抑制鼠11β-HSD1水平[12]。研究发现,BVT.2733能够降低磷酸烯醇式丙酮酸羧激酶和葡萄糖6-磷酸酶mRNA水平,降低血糖及胰岛素的浓度,改善IR[13]。近些年研究发现的INCB-13739以及DIO-902,作为新型11β-HSD1选择性抑制剂,已进入临床试验阶段。这两种药物除了降低血糖、改善IR之外,还能够有效降低血压、血脂,减轻体重[14-15]。另外,近期有研究发现某些中草药也具有选择性抑制11β-HSD1的作用。大黄素是大黄和虎杖的提取物,是一种11β-HSD1的强效选择性抑制剂,可以抑制糖皮质激素的作用,改善糖尿病患者的血糖水平和IR状态[16]。苦瓜提取物也具有选择性抑制11β-HSD1活性,可用于治疗2型糖尿病[17]。
综上所述,本文采用高脂饲料喂养结合皮下注射地塞米松的方式成功诱导实验大鼠出现IR,为该病的发病机制研究及药物试验提供一种可靠而简便的动物模型。本研究还发现,内脏脂肪组织中11β-HSD1的表达水平与IR状态呈正相关,11β-HSD1可能作为IR及其相关疾病治疗的新靶点,但是11β-HSD1在IR发病中的具体作用通路有待进一步研究。
[1] 谭莉莉,孙红爽,谢生荣,等.高脂高糖饲料喂养结合慢性应激促进大鼠胰岛素抵抗[J]. 中国药科大学学报,2009,40(4):380-384.DOI: 10.3321/j.issn:1000-5048.2009.04.018.
[2] Gao S,Han X,Fu J,et al. Influence of chronic stress on the compositions of hepatic cholesterol and triglyceride in male Wistar rats fed a high fat diet[J].Hepatol Res,2012,42(7):686-695.DOI:10.1111/j.1872-034X.2011.00961.x.
[3] 孙红爽,郑文卿,刘雯,等. 急性或慢性应激对高热量饲料喂养大鼠HPA轴的影响 [J]. 安徽医药, 2010, 14(1): 17-19.DOI: 10.3969/j.issn.1009-6469.2010.01.007.
[4] 张小华,张汝学,贾正平,等. 高脂饮食和地塞米松联合诱导胰岛素抵抗大鼠模型 [J].中国实验动物学报,2008,16(5):325-329.DOI: 10.3969/j.issn.1005-4847.2008.05.002.
[5] 孙晓晖, 陈文双, 陈春玲, 等. 长期使用糖皮质激素对大鼠的骨生物力学影响[J]. 中国骨质疏松杂志, 2015, 21(4): 418-451.
[6] Auvinen HE,Coomans CP,Boon MR,et al. Glucocorticoid excess induces long-lasting changes in body composition in male C57Bl/6J mice only with high-fat diet[J].Physiol Rep,2013,1(5):e00103.DOI:10.1002/phy2.103.
[7] 张萍,李圣贤,刘伟. 11β-羟类固醇脱氢酶1与胰岛素抵抗和多囊卵巢综合征 [J].国际内分泌代谢杂志, 2012, 32(2):103-106.DOI: 10.3760/cma.j.issn.1673-4157.2012.02.010.
[8] Schnackenberg CG,Costell MH,Krosky DJ,et al. Chronic inhibition of 11 β -hydroxysteroid dehydrogenase type 1 activity decreases hypertension, insulinresistance, and hypertriglyceridemia in metabolic syndrome[J].Biomed Res Int,2013,2013:427640. DOI:10.1155/2013/427640.
[9] Yoon DS,Wu SC,Seethala R,et al. Discovery of pyridyl sulfonamide 11-beta-hydroxysteroid dehydrogenase type 1 (11β-HSD1) inhibitors for thetreatment of metabolic disorders[J].Bioorg Med Chem Lett,2014,24(21):5045-5049. DOI:10.1016/j.bmcl.2014.09.012.
[10] Okazaki S,Takahashi T,Iwamura T,et al. HIS-388, a novel orally active and long-acting 11β-hydroxysteroid dehydrogenase type 1 inhibitor, amelioratesinsulin sensitivity and glucose intolerance in diet-induced obesity and nongenetic type 2 diabetic murine models[J].J Pharmacol Exp Ther,2014,351(1):181-189. DOI:10.1124/jpet.114.216556.
[11] Holmes MC,Seckl JR. The role of 11beta-hydroxysteroid dehydrogenases in the brain[J].Mol Cell Endocrinol,2006,248(1-2):9-14.
[12] Hult M,Shafqat N,Elleby B,et al. Active site variability of type 1 11beta-hydroxysteroid dehydrogenase revealed by selective inhibitors and cross-species comparisons[J].Mol Cell Endocrinol,2006,248(1-2):26-33.
[13] Feig PU,Shah S,Hermanowski-Vosatka A,et al. Effects of an 11β-hydroxysteroid dehydrogenase type 1 inhibitor, MK-0916, in patients with type 2 diabetes mellitus and metabolic syndrome[J].Diabetes Obes Metab,2011,13(6):498-504.DOI: 10.1111/j.1463-1326.2011.01375.x.
[14] Rosenstock J,Banarer S,Fonseca VA,et al. The 11-beta-hydroxysteroid dehydrogenase type 1 inhibitor INCB13739 improves hyperglycemia in patients with type 2 diabetes inadequately controlled by metformin monotherapy[J].Diabetes Care,2010,33(7):1516-1522. DOI:10.2337/dc09-2315.
[15] Arakaki R,Welles B. Ketoconazole enantiomer for the treatment of diabetes mellitus[J].Expert Opin Investig Drugs,2010,19(2):185-194. DOI:10.1517/13543780903381411.
[16] Feng Y,Huang SL,Dou W,et al. Emodin, a natural product, selectively inhibits 11beta-hydroxysteroid dehydrogenase type 1 and amelioratesmetabolic disorder in diet-induced obese mice[J].Br J Pharmacol,2010,161(1):113-126.DOI:10.1111/j.1476-5381.2010.00826.x.
[17] Blum A,Loerz C,Martin HJ,et al. Momordica charantia extract, a herbal remedy for type 2 diabetes, contains a specific 11β-hydroxysteroiddehydrogenase type 1 inhibitor[J].J Steroid Biochem Mol Biol,2012,128(1-2):51-55.DOI:10.1016/j.jsbmb.2011.09.003.
Effectsof11β-hydroxysteroiddehydrogenasetype1oninsulinresistanceinratsinducedbyglucocorticoidandhighfatdiet
SunHongshuang*,NieChuncheng,ZhuXiaoli,MaHongfang,ChenHejun,ChongBaogui.*
DepartmentofPharmaceutical,HarrisonInternationalPeaceHospital,Hengshui053000,China
NieChuncheng,Email:niechuncheng@163.com
ObjectiveTo set up an insulin-resistant (IR) animal model by glucocorticoid and high-fat diet, and investigate the expression of 11β-hydroxysteroid dehydrogenase type 1 (11β-HSD1) in this model and its significance.MethodsThirty-two male Wistar rats were randomly divided into four groups according to body weight randomized blocks: control group, dexamethasone group (DEX group),high-fat diet group (HFD group),and high-fat diet plus dexamethasone group (HFD+DEX group), with 8 rats in each group. Rats in control group and DEX group were fed with standard rat chow diet, while rats in HFD group and HFD+DEX group were fed with fat- and sugar-enriched diet. After 8 weeks,dexamethasone was injected subcutaneously to DEX group and HFD+DEX group. After 12 weeks, insulin tolerance test was performed, and levels of blood glucose, lipid, insulin and corticosterone were measured. Liver index, visceral obesity index and homeostasis model assessment for insulin resistance (HOMA-IR) were calculated,the expression of 11β-HSD1 gene and protein were measured.ResultsCompared with control group, IR was successfully induced in the other three groups, characterized by insensitivity in insulin tolerance test (30 minutes after insulin injection, blood glucose decreased by 44.15%,28.14%,32.58% or 13.53% in control group,HFD group,DEX group and HFD+DEX group, respectively), hyperglycosemia, hyperinsulinemia, dyslipidemia (elevated total cholesterol, triglyceride and free fatty acids, but reduced high density lipoprotein cholesterol), and the increase of HOMA-IR, hepatic index and visceral obesity index, especially in HFD+DEX group (F=10.89-213.20,P<0.05 or <0.01). In addition, compared with control group, levels of 11β-HSD1 mRNA and protein in visceral adipose tissue of the other three groups were increased significantly, especially in HFD+DEX group (F=32.64-116.00,P<0.01).ConclusionThe combination of dexamethasone and high-fat diet can induce IR in rat successfully, and the expression of 11β-HSD1 mRNA and protein in viseral adipose tissue are increased,which may be closely related to the occurrence of IR.
11β-hydroxysteroid dehydrogenase type 1; Glucocorticoid; Dexamethasone; High-fat diet; Rats
河北省2015年度医学科学研究课题(20150432)
10.3760/cma.j.issn.1673-4157.2016.01.004
053000 衡水,哈励逊国际和平医院药学部(孙红爽,朱小丽,马红芳,陈赫军,种宝贵),生殖医学科(乜春城)
乜春城,Email:niechuncheng@163.com
FundprogramMedical Scientific Research Project of Hebei Province of China in 2015(20150432)
2015-07-01)

