RT-PCR技术对宁夏马铃薯脱毒种薯病毒检测的研究
聂峰杰, 詹 红, 张 丽, 宋玉霞*, 巩 檑,甘晓燕, 陈虞超, 石 磊, 张国辉
(1.宁夏农林科学院农业生物技术研究中心, 银川 750002; 2. 宁夏马铃薯脱毒种薯繁育中心, 银川 750024; 3. 宁夏农林科学院固原分院, 固原 756000)
RT-PCR技术对宁夏马铃薯脱毒种薯病毒检测的研究
聂峰杰1, 詹 红2, 张 丽1, 宋玉霞1*, 巩 檑1,甘晓燕1, 陈虞超1, 石 磊1, 张国辉3
(1.宁夏农林科学院农业生物技术研究中心, 银川 750002; 2. 宁夏马铃薯脱毒种薯繁育中心, 银川 750024; 3. 宁夏农林科学院固原分院, 固原 756000)
病毒病是影响马铃薯生产的重要病害,为了解宁夏地区马铃薯种薯生产中的病毒发生情况,在银川市、固原市和西吉县不同种植模式的脱毒种薯生产基地,对不同品种的原原种、原种、一级种在不同生育期随机采集样品,利用RT-PCR检测技术对4种马铃薯主要病毒PVX、PVY、PVS、PLRV和类病毒PSTVd进行检测。结果表明:PVX、PVY、PVS、PLRV在3个基地均有不同程度检出,成熟期病毒检出率分别为35%、28%、35%和34%,未检出PSTVd;4种病毒检出率在马铃薯现蕾期以后呈现显著性增长;病毒检出率随着种薯繁育级别增加差异显著;6个马铃薯品种均为感病品种;大田种植种薯的病毒检出率显著高于防虫网室。
马铃薯; 病毒检测; RT-PCR
病毒病是危害马铃薯生产的重要病害,在全世界马铃薯产区均有分布。目前,已发现的马铃薯病毒、类病毒有近40种[1],我国常见的有8种,包括马铃薯X病毒(PVX)、马铃薯Y病毒(PVY)、马铃薯S病毒(PVS)、马铃薯卷叶病毒(PLRV)、马铃薯A病毒(PVA)、马铃薯皱缩花叶病毒(PVM)、马铃薯古巴花叶病毒(PAMV)和马铃薯纺锤形块茎类病毒(PSTVd)[2-3]。马铃薯受病毒侵染后主要表现为花叶、卷叶、植株矮小、叶片失绿、块茎变小、龟裂、内部网状坏死等,严重时种薯失去发芽能力,病毒逐代积累引起马铃薯品种退化, 产量和品质下降,一般引起减产20%~30%,如果多种病毒混合侵染可造成减产80%以上[4-5]。目前马铃薯病毒病的防治主要包括生产脱毒种薯、抗病毒品种选育和施用抗病毒药剂,其中生产脱毒种薯是控制马铃薯病毒病最有成效的手段[6-7]。但在脱毒种薯生产中,病毒病的发生与马铃薯品种、脱毒种薯级别、种植地区和生产管理等有很大的相关性,病毒的种类和生产环境也密切相关。马铃薯病毒检测方法主要有血清学检测的酶联免疫吸附试验法(ELISA)和分子生物学的反转录聚合酶链式反应(RT-PCR)。RT-PCR的灵敏度可达pg级,甚至达fg级[8-9],显著高于ELISA,因其具有灵敏度高、特异性强、重复性好的优点,已逐渐取代ELISA成为马铃薯病毒检测中应用最广泛的技术。自二十世纪九十年代起,RT-PCR检测技术已在PVX、PVY、PVS、PVA、PLRV、PSTVd等多种马铃薯病毒、类病毒的检测中广泛应用[10-11]。为了提高检测效率、降低检测成本,董代幸等[12]、罗文斌等[13]相继建立了不同马铃薯病毒的多重RT-PCR技术体系,实现了多种病毒同时检测。
马铃薯是宁夏种植面积第二大的优势特色产业,脱毒种薯生产初具规模。由于宁夏马铃薯脱毒种薯繁育体系起步晚、底子薄、基础弱,与国内外先进生产单位存在一定差距,制约了种薯产业的发展。因此,本研究应用RT-PCR检测技术对宁夏马铃薯脱毒种薯繁育基地的脱毒种薯进行了病毒检测,明确了宁夏主要马铃薯病毒种类,分析了不同种植条件、不同品种和各级别脱毒种薯病毒病的发生情况,探寻马铃薯脱毒种薯生产中存在的主要问题,为病毒病的防治和进一步提高脱毒种薯生产质量提供理论依据。
1 材料和方法
1.1 材料
2014年4-9月,在银川市、固原市及西吉县马铃薯脱毒种薯繁育基地,按照GB18133规定的取样规则,分别于马铃薯幼苗期、现蕾期、盛花期、茎叶衰老期和成熟期,随机采集不同级别种薯(原原种、原种、一级种)植株的幼嫩新鲜叶片,茎叶衰老期和成熟期同时采集新鲜薯块(每个样本数量为30)用于RT-PCR检测。采样地概况、采集品种等见表1。

表1 马铃薯脱毒种苗样品采集信息Table 1 Sample information of virus-free seed potatoes
1.2 试剂与设备
RNA提取试剂盒TransZol UP和TransZol Plant购自Trans公司,反转录试剂和PCR试剂购自Promage公司。高速冷冻离心机、高速微量离心机、超微量分光光度计、PCR仪及凝胶成像系统均为Bio-Rad公司产品。
1.3 样品处理
称取0.5~1.0 g马铃薯叶片或薯块,放入经DEPC水处理后的研钵中,加入液氮磨成细粉,迅速转入1.5 mL离心管中,用于RT-PCR检测,每个样品重复3次。
1.4 马铃薯病毒RT-PCR检测
采用TransZol UP法提取叶片样本RNA,TransZol Plant法提取薯块样本RNA,检测浓度后将样品稀释至500 ng/μL。利用反转录试剂盒(Go Script Reverse Transcription System)合成第一链cDNA。根据马铃薯肌动蛋白基因(actin),马铃薯X病毒(PVX)、马铃薯Y病毒(PVY)、马铃薯S病毒(PVS)和马铃薯卷叶病毒(PLRV)的基因组RNA保守序列设计特异性引物对(表2)。分别利用内参基因actin和病毒基因的上下游引物对合成的cDNA进行一步RT-PCR扩增反应。PCR反应体系的总体积为25 μL,包括:10×buffer 2.5 mmol/L,dNTPs 0.2 mmol/L,上游引物和下游引物各0.4 μmol/L,TaqDNA polymerase 0.1 U,补足ddH2O至25 μL。反应条件为:94℃预变性2 min;94℃变性45 s,55℃复性45 s,72℃延伸1 min,循环34次;72℃保温10 min。扩增产物通过琼脂糖凝胶电泳进行检测。

表2 马铃薯内参基因及病毒基因引物Table 2 Primers for actin and potato virus genes
1.5 数据分析
病毒检出率为所采集样品检出率3次重复平均值。采用 SPSS (20.0) One-way ANOVA程序对检测结果进行方差分析和Duncan氏差异显著性检验。
2 结果与分析
2.1 马铃薯脱毒种薯病毒RT-PCR检测分析
以提取的样本RNA为模板合成cDNA。以actin基因的上下游引物,对合成的cDNA进行RT-PCR扩增反应,扩增产物部分结果见图1,所有样本均能扩增得到227 bp的基因片段,表明提取的RNA反转录的cDNA质量良好,可进一步用于后续检测。以上述反转录合成cDNA为模板,以PVX、PVY、PVS、PLRV和PSTVd基因上下游引物分别进行RT-PCR扩增反应,部分扩增结果见图2,在所检测的样品中,携带PVX、PVY、PVS和PLRV病毒的样品分别扩增出约为562、447、800和336 bp的基因片段,与预期4种病毒基因片段大小相符,可分别判定为PVX、PVY、PVS和PLRV带毒阳性株系,未检出PSTVd。
2.2 脱毒马铃薯不同生育期病毒检测
对银川市、固原市及西吉县3个基地种植的脱毒种薯幼苗期、现蕾期、盛花期、果实膨大期和成熟期的样品进行了检测,检测结果(图3)表明,3个基地的脱毒种薯幼苗期PVX、PVY、PVS和PLRV的检出率分别为1%、1%、2%和1%,未检出PSTVd;至成熟期4种病毒检出率分别为35%、28%、35%和34%,未检出PSTVd。在马铃薯整个生育期中病毒的检出率整体呈现为前期病毒检出率低,后期病毒检出率升高的上升趋势,经方差分析,各种病毒检出率在幼苗期和现蕾期差异不显著,除PVY以外,其他3种病毒现蕾期以后各时期的检出率增长具有呈显著性差异。
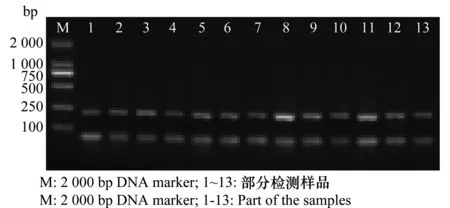
图1 马铃薯脱毒种薯内参基因的RT-PCR检测Fig.1 RT-PCR analysis of actin in virus-free seed potatoes
2.3 不同级别脱毒马铃薯病毒检测
对银川市‘青薯9号’、‘青薯168’的原原种、原种、一级种的成熟期样本进行病毒检测,结果(图4)表明:‘青薯168’和‘青薯9号’的3个级别种薯均可感染PVX、PVY、PVS和PLRV;经方差分析,随着种薯繁育级别增加4种病毒检出率也增加,且差异显著,如‘青薯168’原原种、原种和一级种PVY检出率分别为2.7%、9.7%和27.7%。
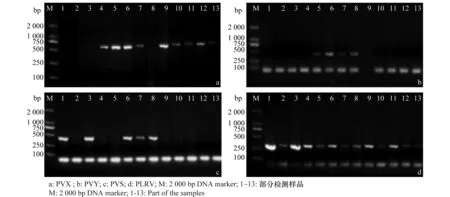
图2 马铃薯脱毒种薯中病毒RT-PCR检测Fig.2 RT-PCR analysis of virus in virus-free seed potatoes
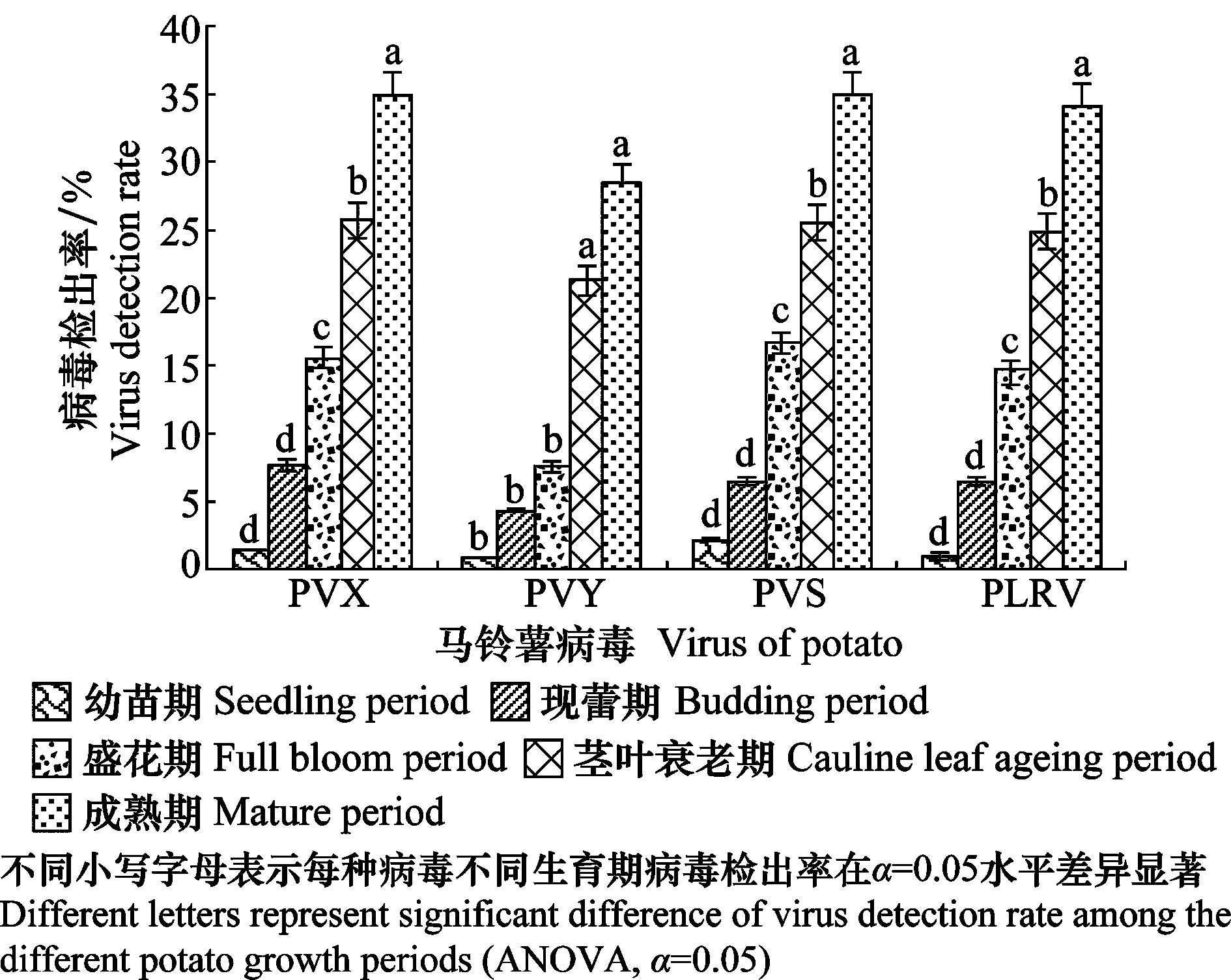
图3 马铃薯不同生育期病毒检出率Fig.3 Virus detection rate in potatoes during different growth periods
2.4 不同品种脱毒马铃薯病毒检测
对银川市、固原市及西吉县3个基地的6个马铃薯主栽品种原原种成熟期样品的病毒检测结果(图5)表明,‘青薯9号’、‘青薯168’、‘黑美人’、‘费乌瑞它’、‘陇薯3号’、‘大西洋’均为感病品种,都不同程度检出PVX、PVY、PVS和PLRV;经方差分析,PVX、PVY和PVS在6个品种中的检出率无显著差异,‘黑美人’中PLRV检出率与‘青薯168’、‘费乌瑞它’和‘陇薯3号’PLRV检出率有显著性差异,检出率分别为13.7%、8.0%、8.0%和7.0%。
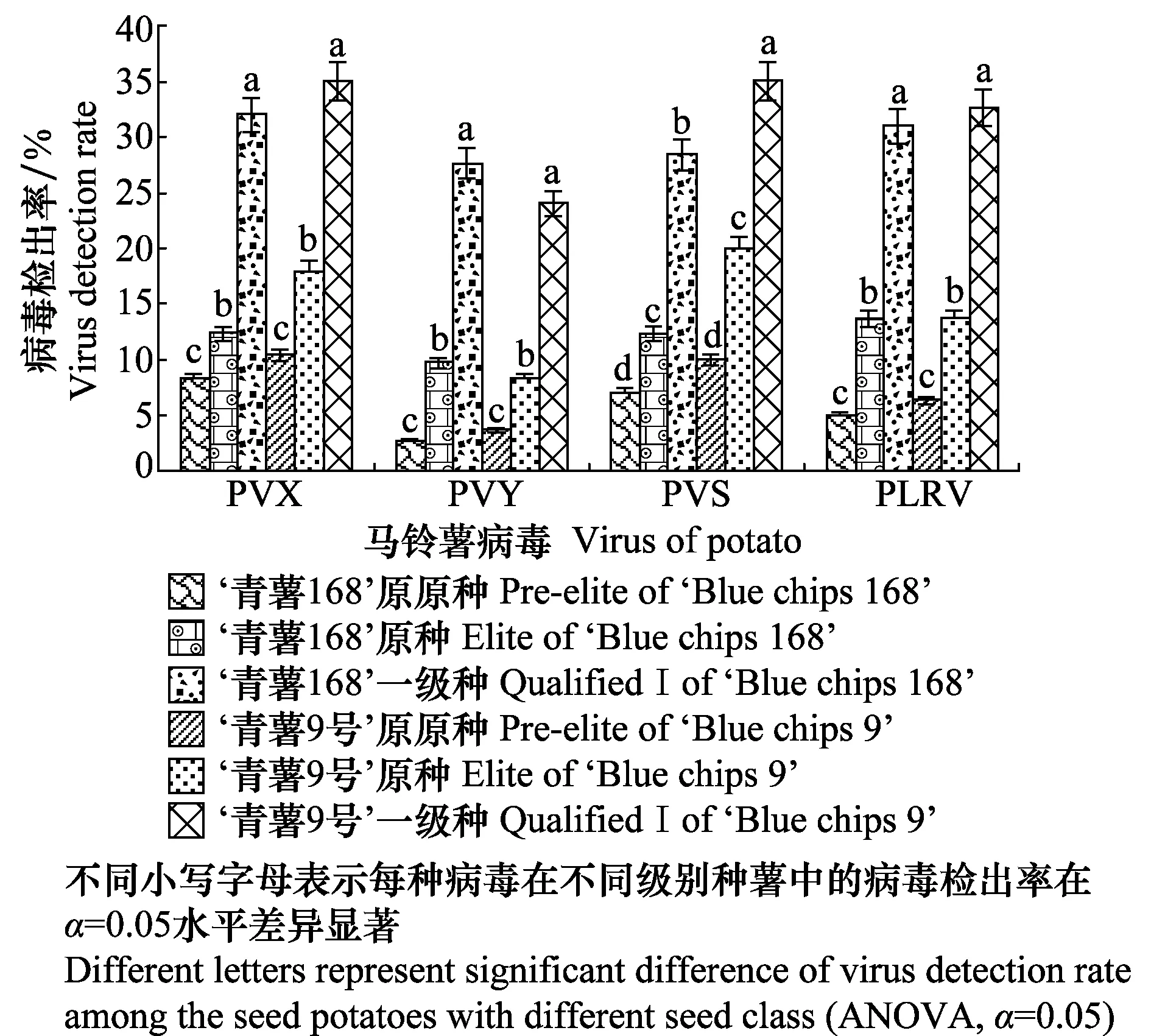
图4 不同级别马铃薯脱毒种薯成熟期病毒检出率Fig.4 Virus detection rate of seed potatoes with the different seed class during mature period
2.5 不同种植环境脱毒马铃薯病毒检测
对3个不同种植环境的马铃薯原原种成熟期样品的检测结果(图6)表明:3个基地的原原种在成熟期均不同程度检出PVX、PVY、PVS和PLRV;经方差分析,西吉县的大田开放式种植脱毒种薯基地的原原种中PVX、PVY、PVS和PLRV的检出率分别为50%、41%、45%和61%,显著高于固原市和银川市防虫网棚内种植的脱毒种薯。
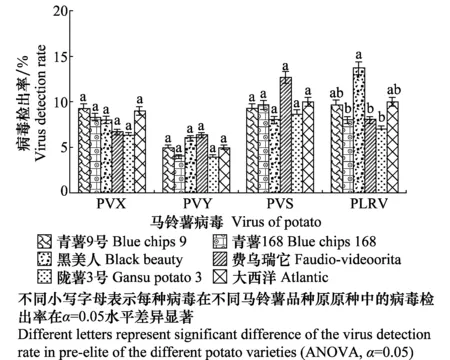
图5 不同马铃薯品种原原种成熟期病毒检出率Fig.5 Virus detection rate in pre-elite of the different potato varieties during mature period
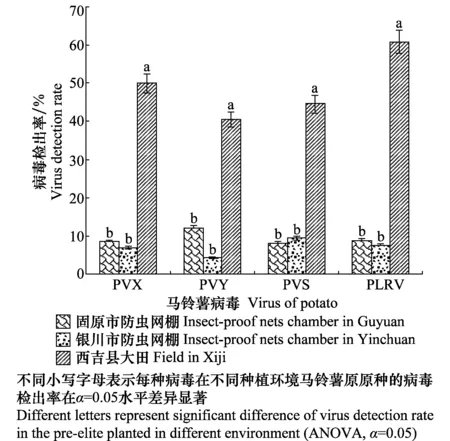
图6 不同种植环境中马铃薯原原种成熟期病毒检出率Fig.6 Virus detection rate in the pre-elite planted in different environment during mature period
3 结论与讨论
传统的茎尖分生组织培养法脱除马铃薯病毒的难易顺序为PVS、PVX、PVM、PVY、PVA和PLRV,以PVS和PVX最难脱除[14]。改进的温热疗法与茎尖分生组织培养相结合[15]的脱毒方法、超低温保存法[16]等,可以成功去除PVX。PSTVd不具有蛋白质外壳,仅由RNA组成[17],无法通过茎尖剥离、组织培养除去,必须通过严格检疫去除。我们对不同品种的马铃薯脱毒种薯检测发现,宁夏主栽品种均为感病品种,其中PVX、PVS的检出率相对较高,未检出PSTVd。由于宁夏主要采取茎尖剥离、组织培养的方法诱导脱毒试管苗[18],各单位脱毒水平和能力参差不齐,造成种苗脱毒不彻底,为病毒病的发生和传播提供了初侵染来源。
对脱毒种薯不同生育期的病毒监测发现,病毒检出率在马铃薯现蕾期以前较低,盛花期时病毒病在田间开始出现明显症状,病毒检出率出现显著性增长。除了带毒种薯,田间自生苗和其他寄主植物上也可能携带病毒成为初侵染源,在田间病毒主要通过蚜虫传播。根据宁夏六盘山地区蚜虫类型及迁飞消长规律[19],马铃薯现蕾期和盛花期与蚜虫为害和迁飞高峰期一致,由此造成病毒检出率在马铃薯现蕾期后开始显著增长。另外,马铃薯生产中常存在几种病毒复合侵染的现象,国内外研究表明[20-21],两种或两种以上病毒复合侵染可诱发比单一病毒更加严重的症状,因此,脱毒种薯生产过程中要加强多种病毒同时脱除,进而避免病毒复合侵染带来更严重的损失。由于马铃薯病毒种类很多,且一种病毒往往有几个株系,各株系在马铃薯不同品种上的反应不同,因而抗病毒育种十分复杂,很难得到兼抗多种病毒的品种,因此有必要有针对性地对当地主要病毒类型进行品种选育工作。
在脱毒种薯的种植过程中严格的田间管理也可以有效地防止病毒病的传播,脱毒种薯应该严格按照行业标准规定在防虫网室种植,但是我们在调查过程中发现,有生产单位存在露天大田种植脱毒种薯的现象,这大大增加了种薯带毒的几率。世界上最大的种薯出口国荷兰,建立了庞大的马铃薯标准体系,在国家法律、法规的保护下有效地实施,对马铃薯的产业发展起到了规范、监督和管理的作用[22]。荷兰的马铃薯生产者和经营者必须申请种薯合格证,种薯生产要经过严格的质量检验,否则不能进入市场,严格的种薯检测认证体系确保了荷兰脱毒种薯的质量,每年检测样品量300多万份,出口80多个国家。虽然我国马铃薯产业发展有国家标准和行业标准指导生产,但是目前这些标准的指导作用和执行力度不大,无法达到标准的水平[23],因此,必须借鉴荷兰等种薯种植先进国家的经验,完善种薯生产体系,加大监管力度,制定相关法律法规,切实提高种薯生产质量。
[1] Gebhardt C,Valkonen J P T.Organization of genes controlling disease resistance in potato genome [J]. Annual Review of Phytopathology,2001,39:79-102.
[2] 库尔斯塔克. 植物病毒比较诊断指南[M]. 裴美云,译. 北京: 农业出版社, 1991.
[3] 李芝芳. 中国马铃薯主要病毒图鉴[M]. 北京: 中国农业出版社, 2004.
[4] 郭志乾, 董凤林. 马铃薯病毒性退化与防治技术[J]. 中国马铃薯, 2004, 18(1): 48-49.
[5] 黄萍, 何庆才, 颜谦. 马铃薯不同级别脱毒种薯病毒再侵染情况及产量变化[J]. 贵州农业科学, 2008, 36(4): 39-40.
[6] 张琼, 孙永平, 夏明霞, 等. 江苏丘陵地区马铃薯脱毒种薯栽培试验研究[J]. 天津农业科学, 2012, 18(6): 129-130.
[7] 董文琦, 戴素英. 高产低耗规模化生产脱毒马铃薯原原种研究[J]. 华北农学报, 2002, 17(Sl): 206-208.
[8] Barker H, McGeachy K D, Toplak N, et al. Comparison of genome sequence of PVY isolates with biological properties[J]. American Journal of Potato Research, 2009, 86(3):227-238.
[9] 程群,朱云芬,沈艳芬,等. 马铃薯S病毒RT-PCR检测技术的研究[J].氨基酸和生物资源,2010,32(4): 8-11.
[10]阎文昭,蒲志刚,钟婷婷. 四川省马铃薯病毒RT-PCR检测体系的建立[J].西南农业学报,2010,23(6): 2171-2173.
[11]朱云芬,程群,沈艳芬,等.马铃薯X病毒的RT-PCR和IC-RT-PCR检测[J].中国马铃薯,2012,26(6):370-373.
[12]董代幸,张祥林,罗明,等.马铃薯病毒一步法多重RT-PCR检测技术的构建[J].微生物学通报,2011,38(1):131-137.
[13]罗文彬,李华伟,汤浩,等.马铃薯5种病毒多重PCR检测技术的建立及应用[J].园艺学报,2015,42(2):280-288.
[14]安颖蔚, 孟令文, 张辉. 马铃薯脱毒及微型薯繁育技术体系的研究与应用[J]. 杂粮作物, 2006, 26(3): 197-199.
[15]Lozoya-Saldana H, Merlin-Lara O.Thermotherapy and tissue culture for elimination ofPotatovirusX (PVX) in Mexican potato cultivars resistant to late blight [J]. American Potato Journal, 1984, 61(12): 735-739.
[16]白建明, 陈晓玲, 卢新雄, 等. 超低温保存法去除马铃薯X病毒和马铃薯纺锤块茎类病毒[J]. 分子植物育种, 2010, 8(3): 605-611.
[17]Diener T O.Potato spindle tuber " virus ". Ⅳ. A replicating, low molecular weight RNA [J]. Virology, 1971, 45(2): 411-428.
[18]聂峰杰, 张丽, 宋玉霞, 等. 宁夏马铃薯脱毒种薯生产及病毒检测技术的现状和发展途径[J]. 中国种业, 2014(7): 17-21.
[19]马全保, 景治忠, 常亮, 等. 泾源县脱毒马铃薯田蚜虫迁飞消长规律的研究[J]. 中国马铃薯, 2009, 23(6): 347-349.
[20]Singh R P, Boucher A, Wang R G.Detection, distribution and long-term persistence ofPotatospindletuberviroidin true potato seed from Heilongjiang, China [J]. American Potato Journal, 1991, 68(1): 65-74.
[21]刘卫平. 马铃薯类病毒与马铃薯Y病毒的互作及其对马铃薯产量的影响[J]. 黑龙江八一农垦大学学报, 2007, 19(1): 40-43.[22]陈晓瑞,赵明.马铃薯产业在宁夏农村经济和粮食生产中的地位[M]∥陈伊里.马铃薯产业与粮食安全. 哈尔滨:哈尔滨工程大学出版社,2009:64-68.
[23]刘卫平.黑龙江省马铃薯脱毒种薯繁育发展现状与对策研究[D].北京:中国农业科学院,2013.
(责任编辑:杨明丽)
Detection of virus on virus-free potatoes in Ningxia by RT-PCR
Nie Fengjie1, Zhan Hong2, Zhang Li1, Song Yuxia1, Gong Lei1, Gan Xiaoyan1,Chen Yuchao1, Shi Lei1, Zhang Guohui3
(1. Agricultural Biotechnology Centre, Ningxia Academy of Agriculture and Forestry Sciences,Yinchuan 750002, China; 2. Ningxia Propagation Center of Virus-free Seed Potatoes, Yinchuan 750024,China; 3. Ningxia Academy of Agriculture and Forestry Sciences Guyuan Branch, Guyuan 756000, China)
Virus disease is one of the important diseases on potato. Pre-elite, elite and qualifiedⅠ samples of different potato varieties under different growth periods were random collected from three potato reproduction bases in Yinchan, Guyuan and Xiji. PVX, PVY, PVS, PLRV and PSTVd were detected by RT-PCR. The results showed that except PSTVd, the PVX, PVY, PVS and PLRV can be detected during maturation of potatoes from three potato reproduction bases,with detection rate of 35%, 28%, 35% and 34%, respectively. The detection rate increased significantly after the beginning of budding period and showed significant increase with breed grade of seed potatoes. All six potato varieties were susceptible cultivars, and the detection rates of samples planted in the field were much higher than those planted in insect-proof nets chamber.
Solanumtuberosum; virus detection; RT-PCR
2016-01-26
2016-03-01
宁夏自然科学基金(NZ14210); 宁夏农林科学院科技创新先导资金项目(NKYG-14-05,NKYG-15-06,NKYG-15-36,NKYG-15-32,NKYG-16-12,NKYQ-14-07)
S 435.32
A
10.3969/j.issn.0529-1542.2016.05.033
* 通信作者 E-mail:Songyx666@163.com

