木霉厚垣孢子可湿性粉剂的研制
张晶晶, 黄亚丽, 马 宏, 贾振华, 刘昆昂, 史延茂
(1. 河北省科学院生物研究所, 河北省主要农作物病害微生物控制工程技术研究中心,石家庄 050081; 2. 河北工业大学化工学院, 天津 300130)
木霉厚垣孢子可湿性粉剂的研制
张晶晶1,2, 黄亚丽1*, 马 宏1, 贾振华1, 刘昆昂1, 史延茂1
(1. 河北省科学院生物研究所, 河北省主要农作物病害微生物控制工程技术研究中心,石家庄 050081; 2. 河北工业大学化工学院, 天津 300130)
通过测定不同载体、润湿剂、分散剂、紫外保护剂对木霉厚垣孢子萌发率和菌丝生长以及不同含量助剂对可湿性粉剂性能的影响,确定了木霉厚垣孢子可湿性粉剂的组成成分和比例,其中厚垣孢子粉为25%(厚垣孢子粉由硅藻土吸附木霉发酵液制备而成),润湿剂十二烷基硫酸钠为4%,分散剂CMC为5%,紫外保护剂糊精为1%,以硅藻土补齐100%。该厚垣孢子可湿性粉剂的活孢子数为2.5×109cfu/g,润湿时间为58 s,总悬浮率为78%,孢子悬浮率为85.27%,pH为6.92,含水量为2.16%,98%通过200目标准筛,该制剂的各项指标均符合可湿性粉剂及微生物制剂的相关标准。该研究的进行为农业生产提供一种新型的木霉制剂,对稳定木霉制剂的田间防效具有重要的意义。
木霉; 厚垣孢子; 可湿性粉剂; 生物相容性
过量施用化学农药所造成的环境污染及人类健康问题日趋严重,采用低污染、低残留的方式进行植物病害防治已经成为农业可持续发展的必然选择[1]。生物防治作为一种环境友好型的病虫害防治技术是目前化学农药减量和替代的主要方式之一[2],而研制出防治效果良好的生防菌剂则是加快化学农药替代化进程的前提。
木霉是目前应用最为广泛的生防真菌之一,对腐霉菌、立枯丝核菌、镰刀菌、灰霉病菌、白绢病菌等引起的植物病害具有良好的防治作用[3-5]。目前,木霉应用所面临的最大问题是如何保持木霉制剂的活性并使其在田间发挥高的活力,研制出货架期长、田间防效稳定的木霉制剂对发挥其生防能力具有非常重要的作用,也是木霉生物防治的主要研究方向。通过多年的研究,研究者已经开发出多种类型的木霉制剂,包括木霉分生孢子的腐植酸吸附制剂、可湿性粉剂、硅藻酸钠制剂[6]等。然而,以分生孢子为主效成分的木霉制剂,由于分生孢子的活力受环境因素影响较大,造成木霉制剂货架期短、田间防效不稳[7]。
厚垣孢子是木霉在逆境下产生的一种繁殖体,该类孢子在储存、萌发及在逆境下的存活能力均远远优于分生孢子,在田间使用时抗逆性强。初步研究表明相同浓度的木霉厚垣孢子悬浮液对辣椒疫病的预防及治疗效果均好于分生孢子悬浮液[8]。因此,研制以厚垣孢子为有效成分的木霉制剂有望解决木霉分生孢子制剂货架期短、田间防效不稳定的问题。
然而,因木霉厚垣孢子发酵技术难度较大,目前还没有木霉厚垣孢子制剂的相关研究。本项目组前期以分离的拮抗木霉Tr-92为试验材料[9],初步建立了木霉厚垣孢子液体发酵工艺[10]。并以此为基础,进行以厚垣孢子为有效成分的木霉可湿性粉剂的研制,通过各种助剂与厚垣孢子的生物相容性和可湿性粉剂质量指标的测定,确定了木霉厚垣孢子可湿性粉剂的组成,以期进一步稳定和提高木霉制剂的田间防效,为更好地利用木霉这一微生物资源提供新的技术支撑。
1 材料与方法
1.1 供试材料
供试菌株为哈茨木霉(Trichodermaharzianum)Tr-92菌株,为本实验室筛选、鉴定。
供试载体为硅藻土、滑石粉、膨润土;润湿剂为十二烷基硫酸钠(SDS)、十二烷基苯磺酸钠(SDBS)、吐温-20;分散剂为木质素磺酸钠、羧甲基纤维素钠(CMC)、皂荚粉、2-萘磺酸甲醛聚合物钠盐(NNO)、拉开粉;紫外保护剂为黄原胶、腐植酸、糊精、荧光素钠、甲基纤维素。所有试剂均为市售产品。
1.2 试验方法
1.2.1 木霉厚垣孢子的发酵及厚垣孢子浆和孢子液的制备
[10]的方法,进行木霉Tr-92的培养,将木霉Tr-92发酵液进行纱布过滤,收集过滤液后经3 000 r/min离心10 min,收集沉淀获得厚垣孢子浆。根据试验需要,通过血球计数板计数法将厚垣孢子浆用灭菌水稀释成不同浓度的厚垣孢子液使用。
1.2.2 载体的筛选
载体对厚垣孢子萌发的影响:将各载体配制成100、500和1 000 μg/mL 3个浓度,并在3种浓度中分别加入等量的厚垣孢子液(浓度为1×108个/mL),混合均匀后28℃摇床培养12 h,之后采用显微观察法测定孢子的萌发数量,并计算萌发率。
载体对木霉菌落生长的影响:将各载体按浓度50 mg/mL加入PDA培养基中,灭菌后倒平板,待凝固后接入直径5 mm的活化3 d的木霉菌饼,28℃培养,每隔24 h测量菌落直径,计算菌落的生长速率[11]。
载体对厚垣孢子浆吸附率:准确称取载体硅藻土、滑石粉、膨润土各5 g分别放于50 mL烧杯中,滴加木霉厚垣孢子浆,用玻璃棒搅拌至载体开始聚成一团,称量吸附悬液后载体质量,并计算载体对厚垣孢子浆的吸附率,每个载体3次重复。
其中q为载体吸附率(g/g),mf为吸附厚垣孢子浆后载体的质量(g),mo为吸附载体前吸附材料的质量(g)。
厚垣孢子粉的制备方法:将载体与厚垣孢子浆按1∶7比例进行混合,在50℃烘箱烘干3 h,烘干后采用粉碎机进行粉碎,得到厚垣孢子粉。
1.2.3 润湿剂的筛选
润湿剂对木霉厚垣孢子萌发和菌丝生长的影响:按照载体筛选方法进行。
润湿剂流点的测定:准确称取厚垣孢子粉1 g并放置于50 mL烧杯中,用移液器将浓度为5%的润湿剂水溶液慢慢滴加到厚垣孢子粉上,同时不断用玻璃棒搅拌使其成糊状,当糊状物刚形成滴滴下时,记下所用的润湿剂体积,并计算单位重量有效成分所需溶液的体积,即为流点。
润湿剂含量测定:按厚垣孢子粉20%,润湿剂分别为1%、2%、3%、4%、5%,并以硅藻土补足100%,采用参考文献[12]的方法测定其润湿时间。
1.2.4 分散剂的筛选
分散剂对木霉厚垣孢子萌发及菌丝生长的影响:按照载体筛选方法进行。
分散剂种类的选择:按厚垣孢子粉20%、分散剂10%、以硅藻土补足100%的配比制成可湿性粉剂,根据文献[12]的方法测定由不同分散剂组成的可湿性粉剂的润湿时间,计算样品的悬浮率。
分散剂含量的确定:按厚垣孢子粉为20%,润湿剂10%,分散剂为1%、3%、5%、7%、9%比例混合,其余硅藻土补足,测定其悬浮率[13],确定分散剂最佳用量。
1.2.5 紫外保护剂的筛选
紫外保护剂对木霉厚垣孢子的萌发及菌落生长的影响:按照载体筛选方法进行。
紫外线照射的情况下,保护剂对木霉厚垣孢子萌发的保护作用:将木霉厚垣孢子用无菌水稀释到1×108个/mL,将浓度为1×108个/mL厚垣孢子悬液与同体积的紫外保护剂液(浓度为1%)混合均匀,以厚垣孢子悬液与无菌水等体积混合液为对照1。吸取5 mL不同处理的木霉厚垣孢子放于直径为9 cm的培养皿中,打开培养皿盖在紫外灯(30 W,光强120 lx)下30 cm处照射3 min后,以厚垣孢子悬液与无菌水等体积混合液未进行紫外照射的处理设为对照2。将不同处理的厚垣孢子液稀释后,吸取0.1 mL涂布于PDA平板上,盖上培养皿盖培养48 h,记录菌落数。
1.2.6 木霉Tr-92菌株可湿性粉剂质量检测
根据GB/T5451-2001[12]、GB/T14825-2006[13]、GB/T25864-2010[14]、GB/T16150-1995[15]要求对木霉Tr-92菌株厚垣孢子的悬浮率、润湿时间、样品细度、pH[16]等进行检测。采用稀释涂平板方法进行可湿性粉剂中活孢子数的测定。
1.2.7 数据统计方法
采用Excel 2007中AVERAGE和STDEVP函数计算样本的均值和标准差,采用SPSS 17.0软件中LSD进行多重比较(P<0.05)。
2 结果与分析
2.1 载体的选择及含量的确定
2.1.1 载体对木霉厚垣孢子萌发和菌落生长的影响
由表1可知不同浓度的3种载体对木霉厚垣孢子萌发均有一定的影响,且随着载体浓度的增加,孢子萌发率降低,其中硅藻土对厚垣孢子萌发率的影响最小,浓度为100 μg/mL时与对照不存在显著差异。3种载体对木霉菌落生长速度的影响与对孢子萌发的影响基本一致,其中以硅藻土对菌丝生长的抑制作用最小,其次为膨润土,以滑石粉对菌丝生长的影响最大。

表1 载体对木霉厚垣孢子萌发和菌落生长的影响1)Table 1 Effects of carrier on the germination of Trichoderma chlamydospore and growth of colony
1) 同列中不同小写字母表示不同处理间显著差异(P<0.05)。下同。
Different lowercase letters in the same column indicate significant difference among treatments at the levelP<0.05.The same below.
2.1.2 载体对厚垣孢子浆吸附率的测定
载体对厚垣孢子浆的吸附率表示载体吸附有效成分的能力,吸附率越大则表明制剂性能越好。由图1可以看出,硅藻土对厚垣孢子浆的吸附能力最强,其次为膨润土,滑石粉对厚垣孢子浆的吸附率最低。综合考虑载体对木霉厚垣孢子萌发率、菌落生长的影响及载体对厚垣孢子浆的吸附率,初步确定硅藻土为木霉厚垣孢子可湿性粉剂的载体。
2.2 润湿剂的筛选
2.2.1 润湿剂对木霉厚垣孢子萌发和菌落生长的影响
由表2可知,不同润湿剂对木霉厚垣孢子萌发率及菌落生长的影响不同。与对照相比,各种润湿剂对木霉厚垣孢子萌发都存在抑制作用,且随浓度的升高,孢子的萌发率降低,其中十二烷基苯磺酸钠对孢子萌发的抑制作用最小。从菌落生长速率来看,十二烷基硫酸钠和十二烷基苯磺酸钠对菌落生长的抑制作用较小,与对照不存在显著差异。

图1 不同载体对厚垣孢子浆的吸附率Fig.1 The absorption rates of different carriers to Trichoderma chlamydospore suspension

润湿剂Wettingagent孢子萌发率/% Germinationrateofchlamydospore100μg/mL500μg/mL1000μg/mL菌丝生长速率/cm·d-1Myceliumgrowthrate十二烷基硫酸钠 Laurylsodiumsulfate(79.2±1.18)b(50.1±2.49)b(30.2±1.58)b(3.79±0.18)a十二烷基苯磺酸钠 Sodiumdodecylbenzenesulfonate(80.3±0.65)b(50.1±1.78)b(31.5±0.56)b(3.58±0.01)a吐温-20 Tween-20(69.0±1.48)c(50.7±0.36)b(30.2±3.27)b(2.90±0.13)bCK(93.2±0.46)a(93.2±0.46)a(93.2±0.46)a(3.97±0.13)a
2.2.2 润湿剂性质的测定
润湿剂流点的高低直接影响可湿性粉剂的质量,3种润湿剂的流点测定结果表明,十二烷基硫酸钠的流点最低,为1.8 g/mL,与十二烷基苯磺酸钠和吐温-20存在显著差异。综合考虑润湿剂的生物相容性和流点的高低,选择十二烷基硫酸钠作为润湿剂。
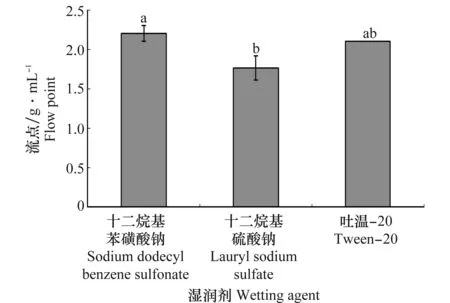
图2 不同润湿剂的流点Fig.2 The flow points of different wetting agents
2.2.3 润湿剂十二烷基硫酸钠含量对润湿时间的影响
润湿剂含量影响可湿性粉剂的润湿时间,润湿时间越短,可湿性粉剂的润湿效果越好。图3为可湿性粉剂中十二烷基硫酸钠含量对润湿时间的影响,
可以看出,十二烷基硫酸钠含量为4%时其润湿时间最短。
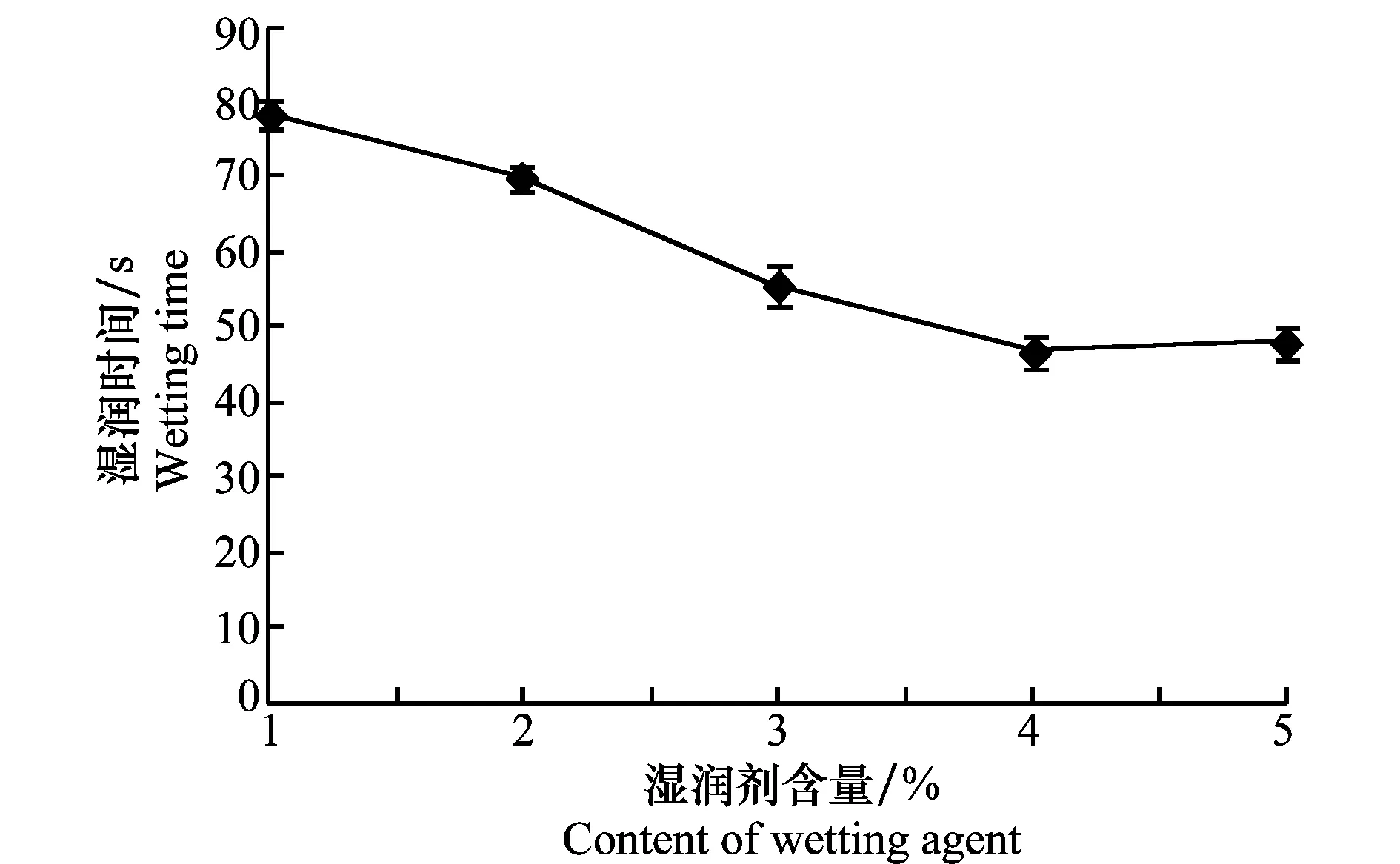
图3 润湿剂十二烷基硫酸钠含量对润湿时间影响Fig.3 Effects of lauryl sodium sulfate content on wetting time
2.3 分散剂的筛选
2.3.1 分散剂对木霉厚垣孢子萌发和菌落生长的影响
不同分散剂对木霉厚垣孢子萌发和菌落生长的影响见表3,木霉厚垣孢子萌发指标显示,分散剂浓度为100 μg/mL时,拉开粉对孢子的萌发抑制率最大,其他分散剂与对照的差异不显著。随着浓度增大,各分散剂对孢子的萌发抑制作用增强。从菌落生长速率看,皂荚粉和拉开粉抑制菌落生长,NNO、CMC、木质素磺酸钠能够促进菌丝生长,综合考虑木霉厚垣孢子萌发率及菌落生长速率,初选NNO、CMC、木质素磺酸钠进行分散剂下一步筛选。

表3 分散剂对木霉厚垣孢子萌发和菌落生长的影响Table 3 Effects of dispersion agents on the germination of Trichoderma chlamydospores and growth of colony
2.3.2 分散剂种类的选择
润湿效果和悬浮率是评价分散剂好坏的重要标准。以十二烷基硫酸钠作为润湿剂,比较不同分散剂处理下样品的润湿时间和悬浮率。结果(表4)表明,以羧甲基纤维素钠(CMC)为分散剂时,厚垣孢子可湿性粉剂的润湿时间较短、悬浮率最高,因此确定CMC作为该可湿性粉剂的分散剂。
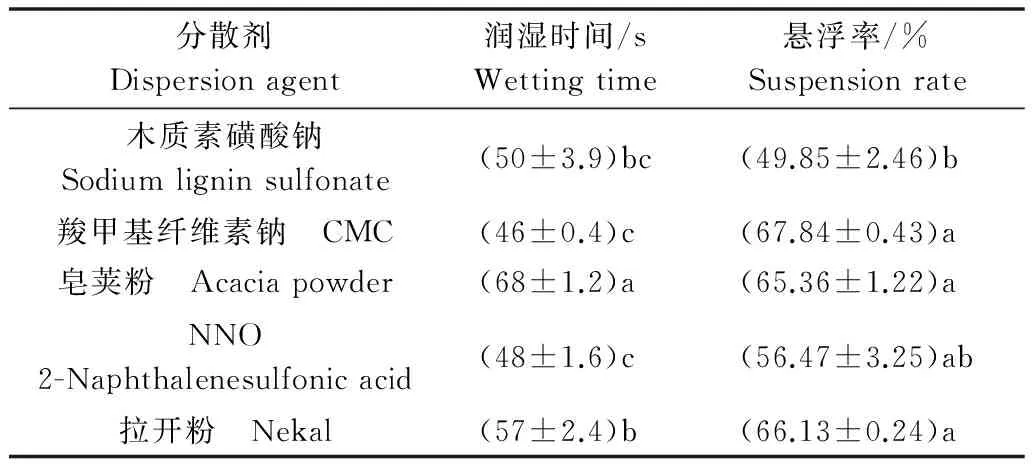
表4 木霉厚垣孢子可湿性粉剂的润湿时间和悬浮率Table 4 Wetting time and suspension rate ofTrichoderma chlamydospore wettable powder
2.3.3 分散剂CMC含量对木霉厚垣孢子可湿性粉剂悬浮率的影响
测定分散剂CMC含量为1%、3%、5%、7%、9%时,木霉厚垣孢子可湿性粉剂的悬浮率,结果(图4)表明,CMC含量为5%时悬浮率最高,为78.15%。因此,初步确定可湿性粉剂的组成中分散剂CMC的含量为5%。
2.4 紫外保护剂的筛选
2.4.1 紫外保护剂对木霉厚垣孢子的萌发及菌落生长速率的影响
不同紫外保护剂对木霉厚垣孢子的萌发及菌落生长速率的影响见表5,其中腐植酸、糊精对厚垣孢子的萌发抑制率相对较小,甲基纤维素和荧光素钠对厚垣孢子萌发抑制率较大;另外,糊精、腐植酸和甲
基纤维素对菌落生长的影响较小,而荧光素钠对菌落生长速度的抑制作用则非常明显。综合考虑木霉厚垣孢子萌发率及菌落生长速度,初选糊精和腐植酸作为紫外保护剂进行下一步的筛选。

图4 CMC含量对可湿性粉剂悬浮率的影响Fig.4 Effects of CMC content on suspension rate
2.4.2 紫外保护剂对木霉厚垣孢子的保护作用
表6列出了不同紫外保护剂存在的情况下,经紫外照射后厚垣孢子的萌发数目。结果表明,与未加紫外保护剂的对照相比,各紫外保护剂都具有保护厚垣孢子的作用,降低了紫外线对厚垣孢子的伤害,其中以糊精对厚垣孢子的保护作用最为明显,其次为腐植酸。综合考虑紫外保护剂与木霉Tr-92的生物相容性以及其对厚垣孢子的保护作用,在该可湿性粉剂中选用糊精作为紫外保护剂。

表5 紫外保护剂对木霉厚垣孢子的萌发及菌落生长的影响Table 5 Effects of UV protective agents on Trichoderma chlamydospore germination and colony growth
2.5 木霉厚垣孢子可湿性粉剂质量检测
通过载体、润湿剂、分散剂、紫外保护剂等因素的筛选,最终确定木霉厚垣孢子可湿性粉剂的组成为:25%厚垣孢子粉、4%十二烷基硫酸钠、5%CMC和1%糊精。在该组成下,木霉厚垣孢子可湿性粉剂的润湿时间为(58±0.82)s、总悬浮率为(78±1.2)%、孢子悬浮率为(85.27±1.32)%、pH为6.92±0.21、含水量为(2.16±0.12)%、(98±0.72)%通过200目标准筛、活孢子数为2.5×109cfu/g,符合国家可湿性粉剂及生物制剂的相关标准。
3 讨论
可湿性粉剂是由不溶于水的原药和载体、表面活性剂、辅助剂形成的易被水润湿并能在水中分散悬浮的粉状农药制剂,具有与环境相容性好、生产成本低、效果好的优点。与化学农药的可湿性粉剂相比,微生物可湿性粉剂加工更为复杂,因为活孢子与助剂的相容性较差,某些助剂可能完全不能使用,所以需要严格测定助剂对孢子萌发及菌落生长的影响[17]。木霉是目前应用最为广泛的生防真菌之一,已经在世界范围内广泛使用,然而目前应用最为广泛的木霉制剂是防治土传病害的木霉吸附剂,对可湿性粉剂的研究相对较少,进行木霉可湿性粉剂研究对扩大木霉的施用范围具有重要的意义。
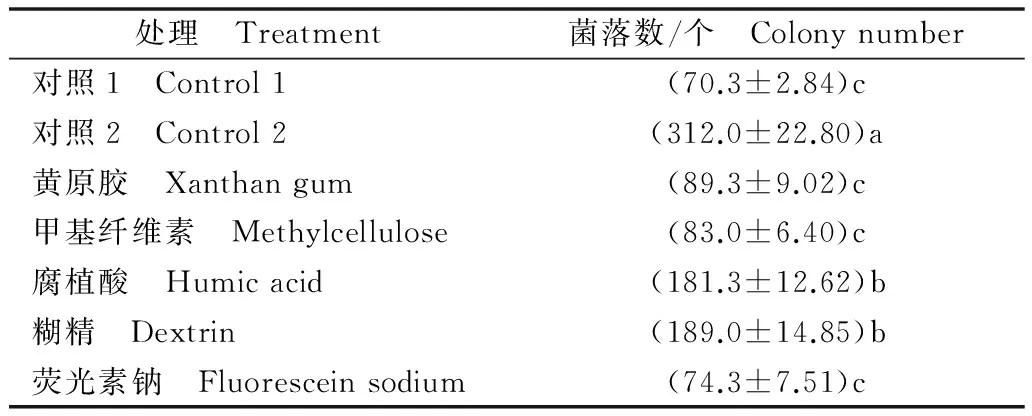
表6 紫外保护剂对木霉厚垣孢子的保护作用1)Table 6 Protective effects of UV protective agents on the activity of Trichoderma chlamydospores
1) 对照1为厚垣孢子悬浮液与无菌水等体积混合液进行紫外照射;对照2为厚垣孢子悬浮液与无菌水等体积混合液不进行紫外照射。
Control 1 is the mixture of chlamydospore suspension and sterile water with ultraviolet irradiation;Control 2 is the mixture of chlamydospore suspension and sterile water without ultraviolet irradiation.
本试验比较了备选助剂对木霉厚垣孢子萌发和菌丝生长的影响,初步筛选出对木霉厚垣孢子萌发及菌丝生长影响较小的助剂。研究发现,不同种类的载体对厚垣孢子萌发和生长的影响不同,相对而言硅藻土对厚垣孢子萌发和菌丝生长的抑制作用要小于滑石粉和膨润土。真菌孢子的疏水性常常使其无法正常喷雾,为降低其表面张力,增加其在水中的分散性,在制剂中必须加入表面活性剂(润湿剂、分散剂等),在待选的3种润湿剂中,十二烷基硫酸钠与木霉厚垣孢子的相容性较好,且流点最低。紫外线对孢子的杀伤是影响真菌制剂田间稳定性的重要因素,因此在可湿性粉剂中加入与孢子相容好的紫外线防护剂能够有效提高生防制剂的田间防效,杨合同等[18]的研究表明,腐植酸和糊精用于木霉分生孢子可湿性粉剂,能够有效降低紫外线对木霉分生孢子的伤害。本研究采用木霉厚垣孢子也取得了与该研究相一致的结果。另外,本研究结果显示尽管糊精有良好的降低紫外线对厚垣孢子伤害的效果,但和未进行紫外照射的对照相比,活孢子数显著降低,该结果与张拥华等的研究结果一致[17]。
本研究以生物相容性和可湿性粉剂的性质为指标,确定了木霉厚垣孢子可湿性粉剂的组成和比例,其中25%为厚垣孢子粉、4%为十二烷基硫酸钠、5%为CMC、1%为糊精,其余部分以硅藻土补足。该制剂在润湿时间、总悬浮率、孢子悬浮率、pH、含水量、活菌数等方面均符合可湿性粉剂及微生物制剂的相关标准。该制剂组成与李舒雯等研制的内生短短芽胞杆菌可湿性粉剂的助剂组成及含量存在很大的差异[19],与杨春平等[20]的木霉分生孢子可湿性粉剂的助剂则基本相同。这表明不同类型的微生物与助剂的生物相容性存在差异。对于木霉分生孢子和厚垣孢子,两者虽然孢子类型不同,但由于是同一种真菌,所以与助剂的生物相容性基本一致。因此,在进行微生物可湿性粉剂研制过程中,可以借鉴其他相同属种微生物可湿性粉剂的组成及制备过程。
成熟的农药制剂需要综合多种因素,对微生物农药来说,这个过程要考虑的更多[15]。本研究初步确定了木霉厚垣孢子可湿性粉剂的各项组分,为制剂的田间应用奠定了基础,对进一步提高木霉制剂的田间防效具有重要的意义。
参考文献
[1] 曾智, 孙运军, 钱荣华, 等. 我国微生物农药的研究应用现状与前景[J]. 农药现代化研究, 2008, 29(2): 254-256.
[2] 邹芳慧, 陈志强, 任卫东. 面向二十一世纪的生物农药[J]. 化学工程师, 2003(6): 44-45.
[3] Howell C R.Effect ofGliocladiumvirensonPythiumultimum,Rhizoctoniasolani, and damping-off of cotton seedlings[J]. Phytopathology, 1982, 72(5): 496-498.
[4] Howell C R.Mechanisms employed byTrichodermaspecies in the biological control of plant diseases: the history and evolution of current concept [J]. Plant Disease, 2003, 87(1): 4-10.
[5] Athul S R, Jisha M S.. Screening and identification of potentialTrichodermasp. against soil borne pathogens ofVanilla(Vanillaplanifolia)[J]. Indian Journal of Agricultural Research, 2014, 48(6): 459-464.
[6] Essa T A A, Muhanna N A S, Mansour A S.Longevity ofTrichodermaharzianumandT.viridein alginate preparations in relation to the stock propagation media [J]. Egyptian Journal of Biological Pest Control, 2014, 24(2): 471-476.
[7] 潘玮. 绿色木霉厚垣孢子与分生孢子生物学特性及生防效果的比较研究[D]. 北京: 中国农业科学院, 2006.
[8] 潘玮, 穆常青, 蒋细良, 等. 木霉的孢子与土壤抑菌作用[J]. 中国生物防治, 2006, 22(2): 87-91.
[9] 黄亚丽, 王淑霞, 杜晓哲, 等. 一株具有诱导抗性木霉菌株的筛选及其对黄瓜灰霉病诱导抗性的初步研究[J]. 植物保护, 2013, 39(1): 38-43.
[10]张晶晶, 黄亚丽, 马宏, 等. 木霉Tr-92菌株厚垣孢子发酵条件的优化[J]. 植物保护, 2015, 41(3): 25-29.
[11]周婷, 安立娜, 刘倩, 等. 球孢白僵菌BD-B015可湿性粉剂配方的筛选[J]. 植物保护, 2013, 39(5): 190-193.
[12]沈阳化工研究院. GB/T 5451-2001, 农药可湿性粉剂润湿性测定方法[S]. 北京:中国标准出版社, 2004.
[13]沈阳化工研究院, 江苏龙灯化学有限公司. GB/T14825-2006, 农药悬浮率测定方法[S]. 北京:中国标准出版社, 2007.
[14]国家林业局森林病虫害防治总站, 安徽农业大学, 中国林业科学院, 等. GB/T25864-2010, 球孢白僵菌粉剂[S]. 北京:中国标准出版社, 2011.
[15]国家技术监督局. GB/T16150-1995, 农药粉剂、可湿性粉剂细度测定方法[S]. 北京:中国标准出版社, 1995.
[16]刘步林. 农药剂型加工技术[M]. 第二版. 北京:化学工业出版社, 1998:623-685.
[17]张拥华, 李磊, 彭志刚, 等. 粘帚霉可湿性粉剂助剂的初步研究[J]. 农药, 2007, 46(2): 94-96.
[18]杨合同. 植物病害生物防治菌-木霉菌的防病机理及其菌剂构建[D]. 北京: 中国农业大学, 1998.
[19]李舒雯, 周金伟, 易有金, 等. 内生短短芽胞杆菌011可湿性粉剂的研制[J]. 植物保护, 2014, 40(4): 96-100.
[20]杨春平, 张晋康, 陈华保, 等. 绿色木霉 L24 菌株分生孢子可湿性粉剂的研制[J]. 西北农业学报, 2010, 19(9): 43-47.
(责任编辑:田 喆)
Preparation of wettable powder formulation ofTrichodermachlamydospores
Zhang Jingjing1,2, Huang Yali1, Ma Hong1, Jia Zhenhua1, Liu Kunang1, Shi Yanmao1
(1. Institute of Biology, Hebei Academy of Sciences, Hebei Engineering and Technology Center of Microbiological Control on Main Crop Disease, Shijiazhuang 050081, China; 2. School of Chemical Engineering and Technology, Hebei University of Technology, Tianjin 300130, China)
By measuring the biological compatibility between chlamydospore and adjuvants, the adjuvants ofTrichodermachlamydospore wettable powder were determined. The results indicated that diatomite as carrier, calcium lignin sulfonate as wetting dispersant, CMC-Na as stabilizer, dextrin as UV protectant showed favorable biological compatibility to the spore germination and colony growth. The contents of different adjuvants were determined by measuring the performance of wettable powder according to the formulation acquirements. The best formulation was chlamydospore powder 25%, sodium dodecyl sulfate 4%, CMC 5%, and UV protector dextrin 1%. Chlamydospore wettable powder on quality inspection were up to national standard: the number of the live spores was 2.5×109cfu/g,the wetting time was 58 s, the total suspension rate was 78%, spore suspension rate was 85.27%, pH was 6.92, water content was 2.16%. Fineness was 98% over 200 mesh sieve, which came up to the formulation standards. The study provide a new type of Trichoderma preparations for agricultural production.
Trichoderma; chlamydospore; wettable power formulation; biological compatibility
2015-09-18
2015-11-17
河北省自然科学基金项目(C2010001565);河北省省级科技计划专项工作类项目(13256504D)
TQ 450.6
A
10.3969/j.issn.0529-1542.2016.05.017
* 通信作者 E-mail:huangyali2291@163.com

