促红细胞生成素载体的构建、分离纯化及其活性检测
潘佳欣,高秀峰△,赵佳浩,罗亚雄,吴晓婷,李永生
(四川大学:1.华西基础医学与法医学院;2.化学工程学院,成都 610065)
论著·基础研究 doi:10.3969/j.issn.1671-8348.2016.28.008
促红细胞生成素载体的构建、分离纯化及其活性检测
潘佳欣1,高秀峰1△,赵佳浩1,罗亚雄1,吴晓婷1,李永生2
(四川大学:1.华西基础医学与法医学院;2.化学工程学院,成都 610065)
[摘要] 目的 为了进一步考察促红细胞生成素(EPO)的组织保护作用,构建了高效表达人源性EPO(rhEPO)的原核表达载体,并通过小鼠体内实验考察了其促红细胞生成活性。方法 构建原核表达载体pET30b(+)-rhEPO;转化至大肠杆菌BL21(DE3),获得高效表达重组转化子菌株;Ni-NAT亲和层析纯化融合蛋白;利用网织红细胞指数考察融合蛋白在小鼠体内的促红细胞活性。结果 成功构建pET30b(+)-rhEPO重组子;实现了在原核生物中的表达;纯化后的融合蛋白达到了电泳级纯;其相对分子质量与理论值相符,原核表达的融合蛋白能够显著提高小鼠体内网织红细胞数,可溶性融合蛋白和包涵体蛋白比活性分别是应用化学科1 059.63 、727.94 U/mg。结论 构建和表达重组载体pET30b(+)-rhEPO,表达的目的蛋白经分离纯化后具有体内生物学活性,为进一步的功能研究奠定基础。
红细胞生成素;遗传载体;分离和提纯;活性检测
[Abstract] Objective To construct the efficient expression vector of the human-derived erythropoietin,and investigate its in vivo activity through experiment in mice,in order to study the tissues protective function for the further research.Methods Prokaryotic expression vector pET30b(+)-rhEPO was constructed,transformed into E.coli BL21(DE3),to obtain low-cost and efficient expression of recombinant transformant strains,fusion protein purificated by Ni-NAT affinity chromatography column,and in vivo activity detected through animal experiment.Results Successfully constructed pET30b(+)-rhEPO prokaryotic expression vector,and realized the expression in prokaryotes.The purified fusion protein showed expected molecular weight and reached the electrophoretic purity level,the reticulocyte number in rats increased significantly showed that the fusion protein has in vivo activity,the specific activity of soluble fusion protein is 1 059.63 μ/mg,and the insoluble fusion protein is 727.94 μ/mg.Conclusion Construction and expression the prokaryotic expression vector pET30b(+)-rhEPO,and the fusion protein has in vivo activity after separate and purify,which can be as the foundation for further study of erythropoietin functions.
促红细胞生成素(erythropoietin,EPO)主要是由肾脏分泌的一种糖蛋白类激素,不仅具有刺激骨髓红细胞系祖细胞分裂、分化为成熟的红细胞[1]的功能,还具有多种组织器官保护、损伤修复等非造血功能[2-4]。然而EPO在发挥非造血功能时会因用量大,周期长而导致血液黏稠、血栓形成、高血压等不良反应[5]。因此,开发无促红细胞生成作用的EPO衍生物成为当今临床应用研究的热点之一。近年来有EPO氨甲酰化、EPO模拟肽等无促红细胞生成作用的EPO衍生物的相关报道[6-8],但存在成本高、易降解等问题。本研究旨在利用基因工程定点突变技术使EPO突变体在发挥组织保护和修复的同时减少因红细胞生成过多导致的不良反应,为心、脑、肾等各种组织损伤的治疗及药物的开发提供实验依据。此阶段的研究内容是构建人源性EPO(rhEPO)原核表达载体,目标蛋白的分离纯化及其活性的检测,为进一步功能研究提供依据,现报道如下。
1 材料与方法
1.1 材料
1.1.1 菌株及载体 克隆宿主菌DH5α种购于北京全式金生物有限公司;表达宿主菌BL21(DE3)由本实验室保存;pBLUE-rhEPO,pET30b(+)均由本实验室保存。
1.1.2 主要试剂 质粒提取试剂盒和DNA胶回收试剂盒购自美国Axygen生物技术公司;NCOⅠ、BamHⅠ限制性核酸内切酶、T4 DNA连接酶均购自美国Thermo Fisher科技公司,IPTG由生工生物工程(上海)股份有限公司进口分装;Ni-NTA HisoBind resin购于上海七海复泰生物科技有限公司,咪唑由美国Sigma公司生产;煌焦油蓝染料购于四川大学华西第二医院;标准EPO购于四川大学华西医院,其他常规化学试剂为国产分析纯试剂。
1.2 方法
1.2.1 原核表达载体pET30b(+)-rhEPO的构建 pBLUE-rhepo质粒和原核表达载体pET30 b(+)均用NCOⅠ和BamHⅠ双酶切过夜,经1.5%琼脂糖电泳后,胶回收目的片段rhepo及pET30b(+)载体大片段,二者经T4 DNA连接酶连接,转化至DH5α感受态细菌,涂平板,挑取阳性单克隆菌落,活化,提取重组质粒,双酶切及测序鉴定。
1.2.2 目的蛋白的表达、纯化
1.2.2.1 目的蛋白的诱导表达及粗蛋白的获得 重组质粒转化BL21(DE3)感受态细胞,将活化后的工程菌接种到LB培养基中,37 ℃、170 r/min培养3 h,加终浓度为0.5 mmol/L 的异丙基-β-D硫代半乳糖苷(IPTG),20 ℃下诱导表达过夜。3 000 r/min离心10 min,收集沉淀,用20 mL/g菌体的缓冲液B1(0.1 mol/L PBS,300 mmol/L NaCl,10 mmol/L咪唑,pH 8.0)重悬菌体,加入10 mg/mL的溶菌酶,室温静止30 min,超声裂解,功率150 W,工作5 s、间歇12 s,共180个循环。4 500 r/min离心,取上清液,12 000 r/min离心,沉淀为包涵体粗蛋白,上清液为可溶性粗蛋白。
1.2.2.2 Ni-NTA亲和层析分离纯化可溶性蛋白rhEPO 用缓冲液B1平衡镍柱,将上清粗蛋白液循环上样;用缓冲液B1洗去未结合杂蛋白;用缓冲液B2(0.1 mol/L PBS,300 mmol/L NacL,30 mmol/L咪唑,pH 8.0)清洗杂蛋白,再用缓冲液B3(0.1 mol/L PBS,300 mmol/L NacL,200 mmol/L咪唑,pH 8.0)进行目标蛋白洗脱并收集洗脱液,分离纯化过程用MC99-3自动液相色谱分离层析仪监测,流速为1 mL/min;纯化效果经十二烷基硫酸钠-聚丙烯酰胺凝胶电冰(SDS-PAGE)鉴定。
1.2.2.3 Ni-NTA亲和层析分离纯化包涵体蛋白rhEPO 包涵体粗蛋白液经8 mmol/L尿素变性后,分离纯化方法同1.2.2.2。
1.2.3 目的蛋白体内活性检测 将27只昆明小鼠分为生理盐水组,标准EPO组(2 、4 、8 、12 、16 、20 U组),样品EPO组(包涵体组,可溶性上清液组),共9组,每组3只。腹腔注射EPO 200 μL,连续用药3 d,于第0天,第4天于眼眶静脉丛取血,经煌焦油蓝染色,涂片,在油镜下计数至少1 000 个红细胞中的网织红细胞数,计算网织红细胞指数。
2 结 果
2.1 原核表达载体pET30b(+)-rhEPO的构建 将质粒pBLUE-rhEPO和载体pET30 b(+)双酶切后胶回收结果如图1所示。目的片段rhEPO和pET30 b(+)大片段的分子量符合理论值。连接转化DH5α感受态细菌,提取重组质粒DNA,双酶切,鉴定结果如图2所示。双酶切得到了目的片段,原核表达载体构建成功。
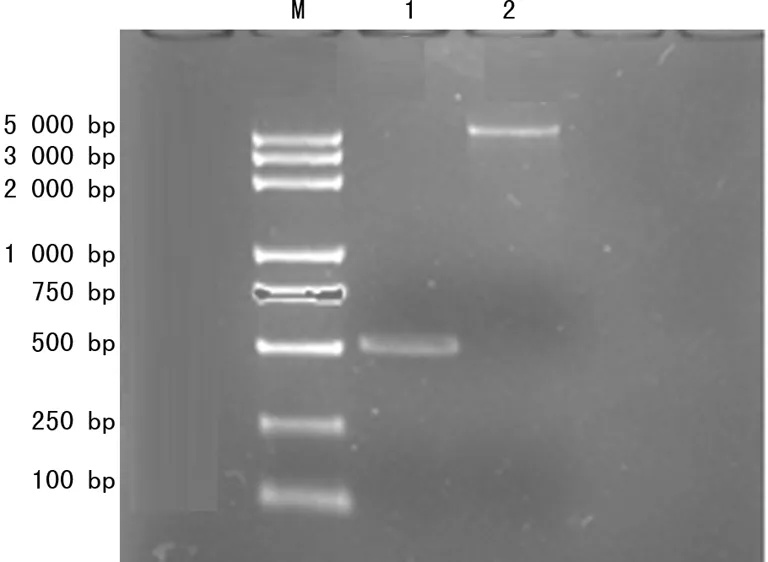
M:DNA 分子标记物;1:rhEPO片段;2:pET30b(+)大片段。
图1 rhEPO和pET30b(+)大片段回收结果
2.2 目的蛋白rhEPO分离纯化 样品经Ni-NTA亲和层析柱纯化,得到纯化的目的蛋白,SDS-PAGE鉴定结果如图3、4所示,目的蛋白相对分子质量约为28×103,与理论值符合。利用考马斯亮蓝法测定电泳级纯的rhEPO蛋白浓度,包涵体rhEPO蛋白浓度为40.8 mg/L,可溶性rhEPO蛋白浓度为21.8 mg/L。
2.3 目的蛋白体内活性检测 采用网织红细胞指数法,考察了小鼠第4天网织红细胞指数,检测结果如图6所示。生理盐水组网织红细胞为0.442%,包涵体rhEPO网织红细胞为1.176%,可溶性rhEPO网织红细胞为1.069%,说明rhEPO融合蛋白具有体内活性。以标准EPO作标准,得到的标准曲线。根据样品EPO注射后测得的Ret%及融合蛋白浓度计算,得出可溶性rhEPO融合蛋白比活性为1 059.63 U/mg,包涵体rhEPO融合蛋白比活性为727.94 U/mg。
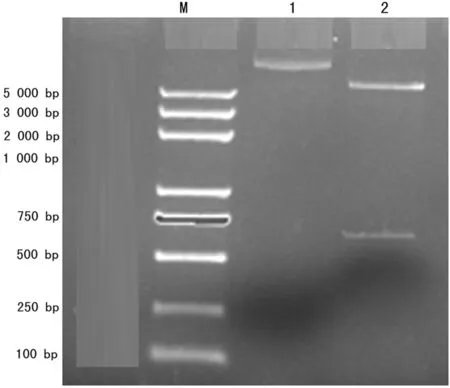
M:DNA 分子标记物;1:pET30b(+)-rhEPO质粒;2:pET30b(+)-rhEPO双酶切。
图2 pET30b(+)-rhEPO酶切鉴定结果
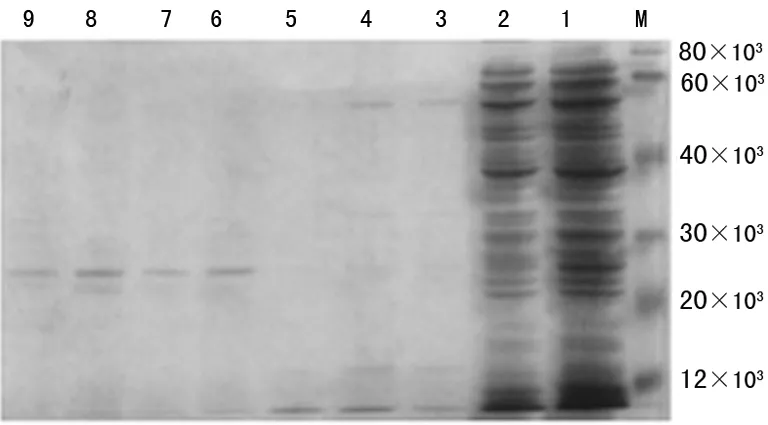
M:蛋白分子标记物;1:上清rhEPO粗蛋白液;2:漏出液;3~5:30 mmol/L咪唑洗脱液;6~9:200 mmol/L咪唑洗脱液。
图3 纯化上清rhEPO的SDS-PAGE鉴定
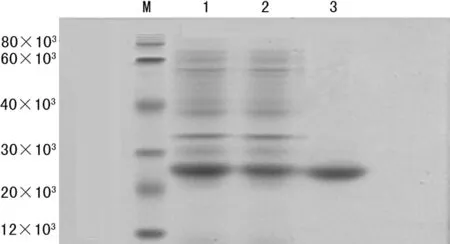
M:蛋白分子标记物;1:包涵体rhEPO;2:漏出液;3:200 mmol/L咪唑洗脱液。
图4 纯化包涵体rhEPO的SDS-PAGE鉴定
3 讨 论
EPO是一条含166个氨基酸残基的高糖基化多肽链,由2个二硫键连接形成4个稳定的α-螺旋结构。EPO通过与EPO受体(erythropoietin receptor,EPOR)结合发挥功能效应,EPO与经典受体EPOR结合后,EPOR形成同源二聚体,偶联酪氨酸激酶(Janus tyrosine kinase-2,JAK2),激活JAK2、转录激活子(signal transducer and activator of transcription-5,STAT5)、信号转导子、促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和核因子κB等,从而启动下游一系列因子,发挥红细胞增埴、分化等功能作用[9-12]。研究发现EPO是个多效性因子,可以抗炎、抗氧化、抗凋亡、促进血管的生成、调节细胞营养因子、调节体液免疫等[13],表现出除了促红细胞生成作用之外的组织保护和修复的作用。近来研究表明,在一些非造血组织中存在β-common 受体(βcR,CD131),是IL-3 、IL-5和GM-CSF的受体共同亚单位,能与EPOR形成异源二聚体,发挥组织保护和修复的作用,但不启动造血信号的转导[14]。这两种受体都可以介导组织损伤的修复,但是,EPO对同源受体的亲和力远远大于对异源受体[15],因此,EPO在用于组织损伤修复时,必然会导致红细胞增多,血液粘稠,进一步加重组织损伤。目前,国内外有关EPO衍生物研究中氨甲酰化EPO、去唾液酸化EPO,EPO模拟肽[6-8]表现出组织保护和修复作用而促红细胞生成作用降低的现象。但是这些衍生物存在成本高或者寿命短的问题,因此,开发低成本高效的新将EPO衍生物对心脑血管的保护显得尤为重要。
在有关氨甲酰化EPO的研究证实EPO中的赖氨酸氨甲酰化形成高瓜氨酸后,对异源受体的亲和力是同源受体的100倍,在对组织修复作用的同时,促红细胞生成作用下降,由此看出,EPO中的赖氨酸是决定EPO和EPOR同源受体及EPOR-βcR异源受体亲和力的关键点,通过分析发现谷氨酰胺和高瓜氨酸在结构和理化性质上相似。因此,本研究拟通过基因突变的方法EPO中赖氨酸突变为谷氨酰胺,改变EPO的结构,期望能够达到氨甲酰化EPO类似的效应。
目前,本研究构建了原核表达载体pET30b(+)-rhEPO,原核表达和纯化得到了rhEPO融合蛋白,并检测出具有生物学活性,其中,可溶性rhEPO融合蛋白比活性为1 059.63 U/mg,包涵体rhEPO融合蛋白比活性为727.94 U/mg。为进一步基因突变及组织保护功能研究奠定了基础。
[1]Jelkmann W.Physiology and pharmacology of erythropoietin[J].Transfus Med Hemother,2013,40(5):302-309.
[2] Beuf AD,Verhulst A,Helbert M,et al.Tubular Erythropoietin Receptor Expression Mediates Erythropoietin-Induced Renoprotection[J].Open Hematolo J,2009,3(1):1-10.
[3]Nichol A,French C,Little L,et al.Erythropoietin in traumatic brain injury:study protocol for a randomised controlled trial[J].Trials,2015,16(1):39-49.
[4]Coldewey SM,Khan AI,Kapoor A,et al.Erythropoietin attenuates acute kidney dysfunction in murine experimental sepsis by activation of the β-common receptor[J].Kidney Int,2013,84(3):482-490.
[5]Bennett CL,Silver SM,Djulbegovic B,et al.Venous thromboembolism and mortality associated with recombinant erythropoietin and darbepoetin administration for the treatment of cancer-associated anemia[J].JAMA,2008,299(8):914-924.
[6]Gan Y,Xing J,Jing Z,et al.Mutant erythropoietin without erythropoietic activity is neuroprotective against ischemic brain injury[J].Stroke,2012,43(11):3071-3077.
[7]Stanislava P,Darya K,Katrins S.et al.Neuroprotective properties of a novel,non-haematopoietic agonist of the erythropoietin receptor[J].Brain,2010,133:(8)2281-2293
[8]Leist M,Ghezzi P,Grasso G,et al.Derivatives of erythropoietin that are tissue protective but not erythropoietic[J].Science,2004,305(5681):239-242.
[9]Brines M,Grasso G,Fiordaliso F,et al.Erythropoietin mediates tissue protection through an erythropoietin and common beta-subunit heteroreceptor[J].Proc Natl Acad Sci U S A,2004,101(41):14907-14912.
[10]Jelkmann W,Bohlius J,Hallek M,et al.The erythropoietin receptor in normal and cancer tissues[J].Crit Rev Oncol Hematol,2008,67(1):39-61.
[11]Barber DL,Beattie BK,Mason JM,et al.A common epitope is shared by activated signal transducer and activator of transcription-5(STAT5)and the phosphorylated erythropoietin receptor:implications for the docking model of STAT activation[J].Blood,2001,97(8):2230-2237.
[12] Szenajch J,Wcislo G,Jeong JY,et al.The role of erythropoietin and its receptor in growth,survival and therapeutic response of human tumor cells From clinic to bench- a critical review[J].Biochim Biophys,2010,1806(1):82-85.
[13]段爱华.促红细胞生成素的研究进展[J].中国全科医学,2008,11(3):264-267.
[14]Wojchowski DM,Sathyanarayana P,Dev A.Erythropoietin receptor response circuits[J].Curr Opin Hematol,2010,17(3):169-176.
[15] Swartjes M,Morariu A,Niesters M,et al.ARA290,a peptide derived from the tertiary structure of erythropoietin,produces long-term relief of neuropathic pain[J].Anesthesiology,2011,115(10):84-92.
The vector construction,separation,purification and activity detection of human-derived erythropoietin
PanJiaxin1,GaoXiufeng1△,ZhaoJiahao1,LuoYaxiong1,WuXiaoting1,LiYongsheng2
(1.WestChinaSchoolofPreclinicalandForensic;2.SchoolofChemicalEngineering,SichuanUniversity,Chengdu,Sichuan610065,China)
erythropoietin;genetic vector;isolation and purification;activity detection
潘佳欣(1990-),在读硕士,主要从事蛋白质基因工程研究。△
R34
A
1671-8348(2016)28-3913-03
2016-06-18
2016-07-06)

