RNAi沉默ERCC1基因对肺腺癌细胞顺铂敏感性的影响
王巍炜,巫正伟,王德光,张 勇
(昆明医科大学第三附属医院胸外科 650118)
论著·基础研究 doi:10.3969/j.issn.1671-8348.2016.28.005
RNAi沉默ERCC1基因对肺腺癌细胞顺铂敏感性的影响
王巍炜,巫正伟,王德光,张 勇△
(昆明医科大学第三附属医院胸外科 650118)
[摘要] 目的 目的用包含切除修复交叉互补(ERCC1)基因特异 RNA 序列的慢病毒,将其转染入宣威肺腺癌细胞XWCL05中,沉默ERCC1基因表达,初步探讨其基因沉默效果及对顺铂敏感性的影响,为顺铂耐药逆转提供思路和依据。方法 经 293T 细胞包装后构建ERCC1基因 RNAi 的慢病毒载体及阴性对照,分别使用XWCL05空白组(空白对照)、XWCL05-neg 组(转染空载体)、XWCL05-RNAi 组(转染 ERCC1-RNAi 慢病毒)。Western blot 法检测转染前后XWCL05 细胞中ERCC1 蛋白的表达。12.5 μg/mL 顺铂作用 48 h 后,用四甲基偶氮唑蓝(MTT)法检测顺铂对各组XWCL05细胞增殖抑制率的影响;流式细胞术检测各组中XWCL05 细胞的凋亡率。结果 (1)Western blot 结果显示,XWCL05-RNAi 组中 ERCC1蛋白表达水平显著低于XWCL05-neg组(P<0.05),而XWCL05-neg和XWCL05空白组差异无统计学意义(P>0.05)。(2)MTT法检测显示相同浓度顺铂作用下,XWCL05-RNAi组的增殖抑制率显著高于XWCL05-neg组和XWCL05空白组(P<0.05),而XWCL05-neg组。(3)流式细胞术检测结果显示,XWCL05-RNAi组凋亡率显著高于XWCL05-neg组和XWCL05空白组(P<0.05)。而顺铂作用后,各组凋亡率较前均显著升高(P<0.05),且XWCL05-RNAi组凋亡率显著高于其余两组。结论 ERCC1基因 RNAi 的慢病毒能够有效地沉默宣威肺腺癌细胞XWCL05中ERCC1基因的表达,并增强XWCL05对顺铂的敏感性。
遗传载体;RNA 干扰;ERCC1;肺腺癌细胞
[Abstract] Objective RNAi targeted ERCC1 were used to transfected Xuanwei lung adenocarcinoma cell line XWCL05 by lentivirus in order to further investigate ERCC1 gene silencing effect on the cisplatinum sensitivity of XWCL05.We wish this could be reference for cisplatinum-resistance reversion.Methods Lentivirus contained ERCC1 targeted RNAi were cultured in 293T cell line and XWCL05 wild type(control),XWCL05-neg(blank vector)and XWCL05-RNAi(ERCC1-RNAi)were cultured for further analysis.Western blot was applied to test ERCC1 expression in XWCL05 before and after transfection.After co-cultured with cisplatinum(concentration 12.5 μg/mL)for 48 hours,MTT was used to test cell proliferation and flow cytometry(FCM)was used to test cell necrosis.Results (1)Western blot showed ERCC1 expression was significantly lower in XWCL05-RNAi(P<0.05) and its expression between XWCL05 wild type and XWCL05-neg showed no significantly difference(P>0.05).(2)In MTT test,there was significant proliferation inhibiting effect in XWCL05-RNAi group compared with XWCL05-neg group.(3)In FCM,the necrosis rate of XWCL05-RNAi was significantly higher(P<0.05)than that of other two groups and there was also no significant difference between XWCL05 wild type and XWCL05-neg.However after treated with cisplatinum,the necrosis rate of these 3 groups increased significantly when compared with their counterpart before the treatment of cisplatinum(P<0.05)and necrosis rate of XWCL05-RNAi decreased the most.Conclusion ERCC1 RNAi lentivirus can effectively silence ERCC1 gene expression in XWCL05 and enhance XWCL05 sensitivity to cispaltinum.
以铂类联合第3代化学治疗药物是肺癌的标准化学治疗方案,但无论是初治还是复发的肺癌患者,均可能存在对铂类药物尤其是顺铂不同程度的耐药,严重影响肺癌化学治疗疗效[1-4]。因此,如何避免或逆转患者对顺铂耐药是当前的研究热点。DNA损伤修复能力增强是导致实体肿瘤对顺铂耐药的主要原因。研究表明,DNA修复存在5种途径:核苷酸切除修复(NER)、同源重组修复(HRR)、非同源末端连接(NHEJ)、碱基切除修复(BER)和错配修复(MRR)。DNA损伤主要通过NER途径修复,而切除修复交叉互补(ERCC1)基因在NER中起关键作用。因此,反向抑制ERCC1蛋白表达,可能会减弱DNA修复功能,增加肺癌细胞对顺铂的敏感性,促进细胞凋亡。宣威地区是云南省乃至全国肺癌高发区之一,流行病学研究显示其高发人群主要为农民,组织学分型以腺癌为主,女性患者比例高于男性。前期研究也发现宣威肺腺癌患者中ERCC1基因高表达[5]。慢病毒载体介导的RNA干扰(RNA interference,RNAi)是研究基因功能和细胞信号转导的重要方法,可持续有效地抑制靶基因的表达。本研究通过构建ERCC1基因慢病毒干扰载体,将其转导入宣威地区肺腺癌患者的癌细胞XWCL05中,探讨其对ERCC1蛋白表达的作用和对顺铂敏感性的影响,以期为肺癌患者顺铂耐药逆转提供参考。
1 材料与方法
1.1 材料 宣威肺腺癌细胞株XWLC-05,由昆明医科大学第一附属医院建株,昆明医科大学第三附属医院肿瘤研究所提供。工具细胞293T由昆明医科大学第三附属医院肿瘤研究所提供。RPMI-1640培养液、胰蛋白酶、胎牛血清、Lipofectamine 2000试剂盒均购自XXLIFE公司。BCA蛋白质定量试剂盒、细胞及组织总蛋白抽提试剂盒、Western blot 试剂盒、HRP兔二抗等购自碧云天有限公司。其他试剂均为进口和国产分析纯。
1.2 慢病毒包装 利用公用网站按照RNA序列设计原则,设计多个RNA靶点序列,根据设计软件进行评估测定,选择最佳的动力学参数靶点进入后续实验流程。由上海吉凯基因公司合成含干扰序列的双链 DNA oilgo,其两端含酶切位点粘端,直接连入酶切后的RNA干扰载体上。将连接好的产物转入制备好的细菌感受态细胞,对长出的克隆进行PCR鉴定,测序比对正确的克隆即为构建成功的目的质粒。将编码慢病毒颗粒的重组病毒颗粒及其两种辅助包装载体质粒分别进行高纯度无内毒素抽提,按Lipofectamine 2000试剂盒使用说明进行共转染293T细胞,转染后按说明书进行培养,之后收集、浓缩富含慢病毒颗粒的细胞上清液,在293T细胞中测定并标定病毒滴度。制作完成慢病毒包装产生的病毒液(ERCC1-RNAi-LV、ERCC1-negative-LV)由上海吉凯基因技术公司帮助合成包装。
1.3 慢病毒转染 将置于-80 ℃冰箱中保存的细胞株取出,培养、传代,取处于对数生长期的细胞进行实验。细胞分为XWCL05空白组(空白对照)、XWCL05-neg组(转染空载体)、XWCL05-RNAi组(转染 ERCC1-RNAi慢病毒)。感染前1 d,将XWLC05细胞接种于6孔板中,每孔接种细胞1×105,于37 ℃、5%CO2培养箱培养。24 h后,开始病毒感染,加入RPMI-1640培养液每瓶5 mL,再加入稀释病毒液 100 μL(MOI值相当于10),培养 6 h 后换液,继续培养 72 h 后进行后续实验。
1.4 Western blot检测ERCC1蛋白表达 病毒感染3 d后,分别取感染后的各组细胞,提取总蛋白并测定蛋白质浓度,BCA试剂盒定量,5×十二烷基硫酸钠(SDS)上样缓冲液及蛋白裂解液将样品浓度定为3 μg/μL。取 20 μg改为24 μg或8 μL蛋白质,与 2×SDS 上样缓冲液1∶1混合,100 ℃变性10 min。置冰上 2 min,进行12% SDS-聚丙烯酰胺凝胶电泳(PAGE)胶电泳。电泳完毕后,切胶、转膜。聚偏氟乙烯(PVDF)膜用 20 mL封闭液(含5%脱脂奶粉的PBST)室温孵育1 h,弃封闭液,分别加入ERCC1多克隆抗体(1∶1 000),4 ℃孵育过夜后洗膜,加入HRP标记的二抗(1∶4 000)孵育后洗膜。加入 ECL 化学发光显色试剂,反应 5 min,X线片曝光后显影、定影。以 β-actin 为内参。
1.5 四甲基偶氮唑蓝(MTT)法检测细胞增殖抑制率 分别取对数生长期的XWCL05空白组、XWCL05-neg组、XWCL05-RNAi 组细胞,其中,XWCL05组为空白对照组。均以 6×104/mL接种于96孔板培养 24 h 至细胞单层铺满孔底,加入不同浓度梯度的顺铂。本研究设置5个浓度梯度:3.125、6.250、12.500、25.000、50.000 μg/mL,每组均设5个复孔。37 ℃、5%CO2继续培养48 h,每孔加入 20 μL MTT 溶液,继续培养4 h后终止,除去孔内培养液。每孔加入 150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。用酶联免疫检测仪测量490 nm波长处吸光度(OD)值;重复3次,肿瘤细胞抑制率=(1-实验OD值/对照组OD值)×100%。
1.6 流式细胞检测细胞凋亡情况 顺铂作用48 h后,将各组细胞用胰酶处理后悬浮,每组取至少1×106/mL细胞,以1 000 r/ min速度离心5 min,弃培养液。PBS 洗1遍,加入70%冷乙醇固定,4 ℃过夜。加入PI染色液I mL,置于4 ℃冰箱中避光染色,0.5 h后用流式细胞仪检测,用相关软件分析数据,计算凋亡细胞所占的百分比。检测前先以人淋巴细胞作为标准品,调校仪器CV值在3.0%内。实验重复 3 次。

2 结 果
2.1 转染前后ERCC1蛋白表达情况 XWCL05组、XWCL05-neg组、XWCL05-RNAi组细胞中ERCC1蛋白的相对表达量分别为0.57±0.02、0.54±0.03、0.11±0.02。XWCL05-RNAi组细胞中ECRR1蛋白的相对表达量显著低于其余两组(P=0.00),而XWCL-05空白组、XWCL05-neg 组差异无统计学意义(P=0.81),见图1。
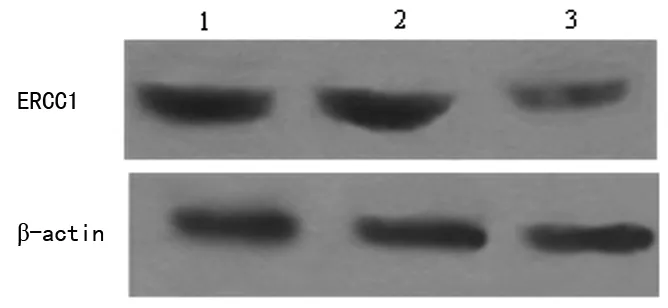
1:XWCL05空白组;2:XWCL05-neg 组;3:XWCL05-RNAi 组。
图1 RNAi转染对ERCC1蛋白表达的影响
2.2 RNAi转染对顺铂药物敏感性的影响 MTT法测定顺铂细胞毒作用分析显示,XWCL05-neg组细胞对顺铂的IC50为(14.21±3.72)μg/mL,而XWCL05-RNAi组细胞对顺铂的IC50为(5.93±2.76)μg/mL;在一定范围内,相同浓度顺铂作用下XWCL05-RNAi 组的增殖抑制率显著高于XWCL05-neg 组,见图2。
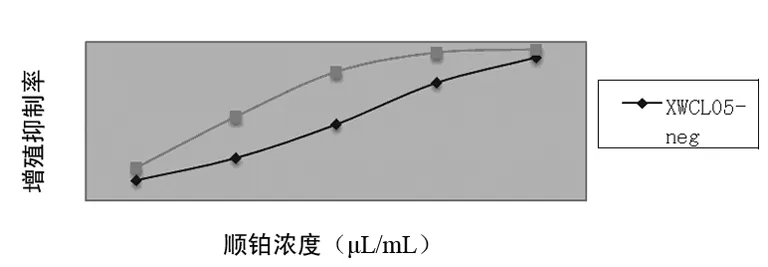
图2 RNAi转染对DDP药物敏感性的影响
2.3 RNAi转染对细胞凋亡率的影响 流式细胞术检测XWCL05空白组、XWCL05-neg组和XWCL05-RNAi组的细胞凋亡率分别为(1.81±0.31)%、(1.73±0.42)%和(16.04±3.62)%,XWCL05-RNAi组凋亡率高于其余两组,差异有统计学意义(P<0.05),XWCL05-neg组和XWCL05空白组凋亡率差异无统计学意义(P>0.05)。而当用12.5 μg/mL 顺铂作用48 h后,XWCL05空白组、XWCL05-neg组和XWCL05-RNAi组的细胞凋亡率分别为(47.00±3.61)%、(51.00±3.43)%和(81.2±4.33)%,可见顺铂作用后,各组凋亡率均显著升高(P<0.05),XWCL05-RNAi组凋亡率高于其余两组,差异有统计学意义(P=0.00)。
3 讨 论
铂类联合第3代化学治疗药物一直是肺癌化学治疗的标准方案,有着极其广泛的应用[6]。如何提高铂类药物敏感性,减少耐药已经成为临床研究的热点。铂类药物的细胞毒作用主要是形成铂-DNA加合物,抑制DNA复制及转录,导致DNA断裂和错误编码从而引起细胞死亡,因此当DNA损伤修复能力增强时,机体即会对顺铂产生耐药性[7]。前期研究表明ERCC1的表达产物与ERCC4(XPF)形成杂合二聚体ERCC1-XPF,该二聚体是一个特异性的连结5′端的核酸内切酶,具有损伤识别和切除5′端的双重作用,在NER中起到限速或调节的重要作用。ERCC1高表达的情况下,肿瘤细胞修复顺铂造成的损伤的功能可能增强。多项临床研究中也发现,在ERCC1高表达的肺癌患者中采用铂类方案进行化学治疗,其近期疗效和远期效果都欠佳[8-10]。同时,近期研究发现,ERCC1基因异构体[11]的存在及人群中ERCC1基因的多态性[12],使得ERCC1导致的铂类耐药更加复杂。RNAi技术是利用双链RNA高效、特异性地降解细胞内同源信使RNA(messenger RNA,mRNA),从而阻断特定基因表达,使细胞出现靶基因缺失的表型。采用RNAi技术可减少肿瘤耐药性,增加肿瘤对放、化疗药物的敏感性,这在其他肿瘤细胞的相关实验研究中也得到了证实[13-15]。
本研究采用ERCC1表达较高的宣威肺腺癌细胞株XWCL05,构建ERCC1干扰基因,通过慢病毒载体将其转导入XWCL05,结果显示XWCL05-RNAi 组细胞中ERCC1蛋白的相对表达量明显低于XWCL05组和XWCL05-neg组,说明通过RNAi干扰XWCL05中ERCC1基因的表达,在细胞层面上是切实可行的。在本研究中,笔者发现,ERCC1表达被干扰后,宣威肺腺癌细胞株XWCL05的IC50浓度明显降低,说明通过抑制ERCC1表达能够明显提高XWCL05对顺铂药物的敏感性。流式细胞检测显示,通过单用XWCL05-RNAi病毒或顺铂给药都能促进宣威肺腺癌细胞株XWCL05凋亡,且在XWCL05-RNAi病毒联合顺铂的组别中,其凋亡更为明显,提示在细胞层面,通过有效的RNAi转染能够提高宣威肺腺癌细胞XWCLO5对顺铂的敏感性。
综上所述,采用RNAi干扰技术能够有效地沉默肺癌细胞系中ERCC1的表达,提高肺腺癌细胞对顺铂的敏感性。这一发现为肺癌治疗提供了新思路,也为肺腺癌铂类耐药机制的认识提供了新的视角。
[1]McHugh PJ,Spanswick VJ,Hartley JA.Repair of DNA interstrand crosslinks:molecular mechanisms and clinical relevance[J].Lancet Oncol,2001,2(8):483-490.
[2]单利,韩志刚,刘莉,等.晚期非小细胞肺癌ERCC1和BRCA1的表达及与顺铂耐药性的临床研究[J].肿瘤.2009(6):571-574.
[3]苏彤,赵立军,常文军,等.ERCC1、XPD和BRCA1基因多态与晚期非小细胞肺癌患者铂类药物化疗效果的相关性[J].第二军医大学学报,2010,31(2):117-122.
[4]周彩存,徐妍,苏春霞,等.ERCC1在非小细胞肺癌中表达及其临床意义[J].中国癌症杂志,2006,16(8):622-625.
[5]李高峰,邓首军,王巍伟,等.老年性非小细胞肺癌ERCC1表达与新辅助化疗疗效的关系[J].南方医科大学学报,2010,30(9):2131-2133.
[6]Otvos R,Szulkin A,Hillerdal CO,et al.Drug sensitivity profiling and molecular characteristics of cells from pleural effusions of patients with lung adenocarcinoma[J].Genes Cancer,2015,6(3/4):119-128.
[7]姚草原,江涛,韩晓黎,等.靶向survivin的RNAi联合顺铂抑制肺腺癌A549细胞增殖的实验研究[J].重庆医科大学学报,2009,34(2):178-181.
[8]Shiraishi K,Kohno T,Tanai C,et al.Association of DNA repair gene polymorphisms with response to platinum-based doublet chemotherapy in patients with non-small-cell lung cancer[J].J Clin Oncol,2010,28(33):4945-4952.
[9]Soria JC.ERCC1-tailored chemotherapy in lung cancer:the first prospective randomized trial[J].J Clin Oncol,2007,25(19):2648-2649.
[10]Tan DS,Ng QS,Tan IB,et al.Truth about ERCC1 in lung cancer[J].J Clin Oncol,2010,28(10):162-164.
[11]Friboulet L,Olaussen KA,Pignon JP,et al.ERCC1 isoform expression and DNA repair in non-small-cell lung cancer[J].N Engl J Med,2013,368(12):1101-1110.
[12]Lee MS,Liu CY,Su L,et al.Polymorphisms in ERCC1 and ERCC2/XPD genes and carcinogen DNA adducts in human lung[J].Lung Cancer,2015,89(1):8-12.
[13]Foged C.siRNA delivery with lipid-based systems:promises and pitfalls[J].Curr Top Med Chem,2012,12(2):97-107.
[14]Wang W,Li GF,Hong ZP,et al.The effect of Survivin antioligonucleotide on the apoptosis of Xuanwei lung adenocarinome cell[J].Chinese-German Journal of Clinical Oncoloy,2011,10(5):252-255.
[15]邵军,余文静,肖斌,等.RN Ai基因沉默对消化系统肿瘤化疗敏感性的影响[J].重庆医学,2014,43(12):1471-1473.
The effect of RNAi silencing ERCC1 gene on the cisplatinum sensitivity of lung adenocarcinoma cell line*
WangWeiwei,WuZhengwei,WangDeguang,ZhangYong△
(DepartmentofThoracicSurgery,theThirdAffiliatedHospitalofKunmingMedicalCollege,Kunming,Yunnan650118,China)
genetic vector;RNA interference;ERCC1;lung adenocarcinoma cell
云南省科技厅-昆明医科大学2013年联合基金资助项目(2013FB164);昆明医科大学第三附属医院博士基金资助项目(BS55201510)。 作者简介:王巍炜(1979-),副教授,博士,主要从事肺癌的多学科综合治疗研究。△
R453.9
A
1671-8348(2016)28-3904-03
2016-06-18
2016-07-06)

