黄地老虎飞行能力研究
郭江龙,付晓伟,赵新成,吴孔明*
(1. 河南农业大学植物保护学院,郑州 450002;2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
黄地老虎飞行能力研究
郭江龙1,2,付晓伟2,赵新成1,吴孔明2*
(1. 河南农业大学植物保护学院,郑州 450002;2. 中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
黄地老虎Agrotissegetum是一种重要的农业迁飞性害虫,研究飞行生物学对明确其迁飞机理有重要意义。本项研究利用昆虫飞行磨系统对黄地老虎的飞行能力进行了测定。对实验室种群飞行能力的测定结果表明:1日龄成虫的飞行能力最弱;3日龄飞行能力最强,其24 h平均飞行时间、平均飞行距离和平均飞行速率分别达到12.16±0.74 h、48.94±3.40 km 和3.76±0.12 km/h。雌蛾与雄蛾间的各项飞行参数均无显著差异,但处女成虫平均飞行距离和平均飞行速率均显著高于已交配个体。对渤海湾野外迁飞种群飞行能力的测定显示,早季节北迁个体和晚季节回迁个体的平均飞行时间和平均飞行距离无显著差异,但皆显著低于实验室种群。黄地老虎具有较强的飞行能力,日龄和交配是影响其飞行能力的关键因素。
黄地老虎;飞行能力;飞行磨;日龄;交配状态
黄地老虎AgrotissegetumDenisetSchiffermülle别名土蚕,隶属鳞翅目Lepidoptera夜蛾科Noctuidae,广泛分布于欧亚和非洲大陆(Tribeletal.,1984;吕昭智等,2006;Esbjergetal.,2014)。该虫在我国除海南和两广地区未见报道外,其余省份均有分布,但长江流域以北地区为害较重,每年可发生2-4代,以老熟幼虫或蛹在7-10 cm土层中越冬,无明显滞育现象。黄地老虎寄主植物较广,嗜食小麦、玉米、棉花、甜菜、水稻等多种农作物,幼虫主要取食嫩苗的近地面茎部组织,常造成整株死亡和缺苗断垄;该虫还具有昼伏夜出、隐蔽性强、在土层以下活动等特点,防治难度较大,一般年份可造成20%-30%的产量损失,大发生年份产量损失可达50%以上(王敬儒等,1962;陈婧等,2013)。
迁飞是昆虫在长期进化过程中应对生境变化所产生的一种从“空间”上保证其种群繁衍的行为对策,也是害虫异地突发致灾和造成农牧业产量严重损失的重要原因(Dingle and Drake,2007)。昆虫迁飞(飞行)能力不仅受成虫自身生理状态(如日龄、性别、交配状态、卵巢发育程度等)的影响,还与其所处的外部环境条件如温度、相对湿度、光周期等密切相关。准确获取迁飞性昆虫的飞行行为参数,以及明确自身生物学和外部环境因子对其迁飞能力的影响,一直是国内外相关领域的研究热点(程遐年,1992;罗礼智等,1999),对揭示害虫的异地灾变规律、提高预测预报水平、制定相应的综合防治策略等具有重要的理论和实践意义(Dent,2000)。室内飞行磨吊飞技术是目前研究昆虫飞行行为的常用手段,国内外利用该技术已对棉铃虫Helicoverpaarmigera(吴孔明和郭予元,1996,1997)、小地老虎Agrotisypsilon(贾佩华和曹雅忠,1992)、粘虫Mythimnaseparata(张志涛和李光博,1985;罗礼智等,1999)、草地螟Loxostegesticticalis(罗礼智和李光博,1992)、甜菜夜蛾Spodopteraexigua(Jiangetal.,2010)、稻纵卷叶螟Cnaphalocrocismedinalis(黄学飞等,2010)、绿盲蝽Lyguslucorum(Luetal.,2007)、二点委夜蛾Athetislepigone(郑作涛等,2014)、桔小实蝇Bactroceradorsalis(袁瑞玲等,2014)、中华草蛉Chrysoperlasinica(Liuetal.,2011)、宽棘缘蝽Cletusrusticus(Cui and Cai,2008、2009)、赤条蝽Graposomarubrolineata(Cui and Cai,2008)、亚洲玉米螟Ostriniafurnacalis(翟保平和陈瑞鹿,1989)、麦长管蚜Sitobionavenae(程登发等,2002)、麦红吸浆虫Sitodiplosismodellana(Wuetal.,2006)等多种农林害虫的飞行行为进行了研究,并取得了显著研究进展。
Guo等(2015)的研究结果在国内外首次证实了黄地老虎自然种群具有季节性远距离迁飞行为,初步明确了该虫在中温带(夏季繁殖区)和暖温带(安全越冬区)之间的季节性迁飞规律。迁飞过程中日龄、交配状态、卵巢发育的变化可能对黄地老虎迁飞轨迹、迁入区发生为害程度和测报水平等产生重要影响,目前国内外还缺乏有关该虫的相关研究报道。因此,本文利用昆虫飞行磨系统,测定了不同日龄、性别、交配状态对黄地老虎飞行速率、飞行距离和飞行时间等参数的影响,以期为改善和提高黄地老虎的异地测报水平提供依据。
1 材料与方法
1.1 虫源及饲养
1.1.1 实验室种群虫源及饲养
黄地老虎成虫采自中国农业科学院植物保护研究所长岛有害生物防治野外科学观测试验站(38°23′N,120°55′E,以下简称长岛站)的高空测报灯下,采集方法同Fu等(2015)。采集后的成虫在温度24℃±1℃、相对湿度75%±5%,光周期L14 ∶D10的人工气候箱内饲以5%蜂蜜水(V/V),用无菌脱脂纱布收集卵粒。初孵幼虫在温度24℃±1℃、相对湿度50%±5%,光周期L14 ∶D10的人工气候箱内连续多代饲养,人工饲料参照吴坤君(1985),饲养方法如下:1-3日龄幼虫(5-10)头/管(玻璃管,直径2.5 cm,高12 cm),4日龄后单头单管饲养,直至化蛹(张安邦等,2015)。
1.1.2 野外迁飞种群虫源
黄地老虎野外迁飞种群成虫采自长岛站的高空测报灯下。2015年4-10月份,每晚日落朦影时将网袋悬挂于高空测报灯下,次日日出前收取网袋,捕捉处于迁飞状态的黄地老虎成虫作为测试野外迁飞成虫飞行能力的虫源,在测试前不进行任何营养补充。按照Guo等(2015)和付晓伟(2015)关于北迁期和回迁期的划分标准,5月初至8月初诱捕的黄地老虎成虫为北迁种群,9月初至10月底诱捕的黄地老虎成虫为回迁种群。
1.2 飞行能力测定
测试仪器为鹤壁佳多科工贸股份有限公司研制的24通道昆虫飞行信息系统(FXMD-24型),飞行磨吊臂为长30 cm、直径0.4 cm不锈钢丝,采样误差≤1圈。吊飞方法参考Liu等(2011)并作部分调整:测试前先用乙醚将黄地老虎成虫轻微麻醉,用毛笔轻轻除去胸腹连接处的鳞毛,用502胶将自制吊环(直径0.5 mm铜丝)连接到成虫胸腹交界处,随后将吊环套接于吊臂末端,放置约50-80 s,待成虫完全苏醒后,用嘴轻轻吹气或轻弹吊臂,观察其能否振翅,若能振翅飞翔,则将吊臂放回飞行磨上进行测试。信息采集卡自动记录并计算出测试昆虫的累积飞行时间、累积飞行距离、平均飞行速率、最大飞行速率等参数。测试均在温度24℃±1℃、相对湿度75%±5%、完全黑暗的室内进行,吊飞时间为24 h。所有测试均在长岛站进行。
1.2.1 测定不同日龄成虫的飞行能力
实验室种群成虫羽化后雌、雄蛾分开,单笼群体饲养,选取1、2、3、4、5日龄的健康处女雌蛾和处女雄蛾进行测试。
1.2.2 测定交配成虫的飞行能力
实验室种群成虫羽化后雌、雄单头配对,任其自由交配。由于黄地老虎1-2日龄蛾交配率极低,3日龄蛾的交配率较高且多数未产卵,4日龄开始产卵,因此选取尚未产卵的3日龄健康雌蛾和雄蛾进行测试。测试完毕后对雌蛾进行卵巢解剖,通过有无精包来确定雌蛾是否交配。如有精包则为交配雌蛾,与其配对的则为交配雄蛾,反之亦然,剔除未交配个体的测试数据。
1.2.3 测定不同迁飞期野外迁飞种群的飞行能力
1.2.3.1 北迁种群飞行能力
5月初至8月初,每天日落朦影时将网袋悬挂于高空测报灯下,次日日出前收取网袋,捕捉处于迁飞状态的黄地老虎成虫,挑选健康完整的雌蛾和雄蛾,不进行任何营养补充,立即测定其飞行能力。
1.2.3.2 回迁种群飞行能力
9月初至10月底为黄地老虎回迁期,飞行能力测定方法同北迁种群测定方法。
1.3 数据分析
本文所有数据均用平均值±标准误来表示。为了分析不同因素(龄期、性别、交配状态)对黄地老虎成虫飞行能力的影响,实验室种群不同龄期成虫的平均飞行时间、平均飞行距离和平均飞行速率的均值差异分析均采用单因素方差分析(ANOVA),如果差异显著则进行Tukey’s HSD多重比较;不同性别、不同交配状态的成虫的平均飞行时间、平均飞行距离和平均飞行速率均值的差异分析采用t-测验。方差分析前,先对平均飞行时间、平均飞行距离、平均飞行速率的原始数据进行正态性检验,如不符合正态分布,则将数据进行平方根转换后再做统计分析,分析的显著水平为P<0.05。所有数据均利用SPSS 20.0软件中处理分析。
鉴于以前对渤海湾迁飞个体卵巢发育等级的分析结果,北迁种群雌蛾与实验室5日龄雌蛾卵巢发育等级接近,回迁种群雌蛾与实验室2日龄雌蛾卵巢发育等级接近(Guoetal.,2015),因此为了比较野外迁飞种群成虫与实验室成虫飞行能力的强弱,将野外北迁种群成虫、野外回迁种群成虫、实验室2日龄成虫和实验室5日龄成虫的各项飞行参数(飞行时间、飞行距离、飞行速率)的均值差异分析分别进行单因素方差分析(ANOVA),如果差异显著则进行Tukey’s HSD多重比较。
2 结果与分析
2.1 不同日龄黄地老虎实验室种群的飞行能力
2.1.1 平均飞行时间
在24 h连续吊飞条件下,黄地老虎成虫的平均飞行时间存在显著的日龄差异(F=9.99,df1=4,df2=273,P<0.01)且呈单峰分布:1日龄飞行时间较短,仅为5.88±0.92 h;2-3日龄达到峰值,分别为10.10±1.01 h和12.16±0.74 h;4-5日龄则下降至9.05±0.94 h和6.97±0.85 h(图1)。在测试的278头成虫中,累积飞行时间最长可达24 h、最短仅为0.11 h。
2.1.2 平均飞行距离
黄地老虎成虫的平均飞行距离存在显著的日龄差异(F=12.90,df1=4,df2=273,P<0.01)且呈单峰分布:1日龄平均飞行距离相对较短,仅为18.07±3.00 km;2-3日龄显著增加并达到峰值,分别为35.45±3.96 km和48.94±3.40 km;4-5日龄平均飞行距离下降至33.58±4.17 km和24.07±3.76 km(图1)。在测试的278头成虫中,累计飞行距离最长可达142.77 km、最短仅为0.12 km。

图1 不同日龄黄地老虎的飞行能力Fig.1 Flight performance parameters (mean±SE) as a function of age for Agrotis segetum注:不同字母代表经Tukey,s HSD多重比较在0.05水平差异显著,相同字母为差异不显著。Note: Bars sharing the different letter indicate that there were significant differences in different age of Agrotis segetum at the 5% level by Tukey’s HSD tests.
2.1.3 平均飞行速率
黄地老虎成虫的平均飞行速率存在显著的日龄差异(F=9.28,df1=4,df2=273,P<0.01)且呈单峰分布:1日龄飞行速率为2.70±0.12 km/h,3日龄飞行速率达到峰值为3.76±0.12 km/h,5日龄降至3.02±0.16 km/h(图1)。在测试的278头成虫中,平均飞行速率最大可达6.82 km/h,最小仅为0.71 km/h;而瞬时极大飞行速率最大可达10.17 km/h、最小仅为0.68 km/h。
2.2 不同性别黄地老虎实验室种群的飞行能力
在24 h连续吊飞条件下,黄地老虎雌蛾和雄蛾的飞行能力无显著差异:平均飞行时间(t=0.18,df=276,P=0.86)、平均飞行距离(t=0.74,df=276,P=0.46)和平均飞行速率(t=1.77,df=276,P=0.08)无显著差异(表1)。
2.3 不同交配状态黄地老虎实验室种群的飞行能力
在24 h连续吊飞条件下,3日龄处女成虫除平均飞行时间(t=1.46,df=141,P=0.15)与3日龄已交配成虫无显著差异外,其余平均飞行距离(t=3.84,df=141,P<0.01)和平均飞行速率(t=5.99,df=139.70,P<0.01)均显著高于已交配成虫(表2)。
2.4 黄地老虎野外迁飞种群的飞行能力
在24 h连续吊飞条件下,野外北迁和回迁种群与实验室2日龄和5日龄成虫的平均飞行时间(F=9.99,df1=3,df2=536,P<0.01)、平均飞行距离(F=9.99,df1=3,df2=536,P<0.01)和平均飞行速率(F=9.99,df1=3,df2=536,P<0.01)均存在显著的差异,其中野外回迁种群的平均飞行时间和平均飞行距离略强于北迁种群,无显著差异(P>0.05),但皆显著低于实验室2日龄和5日龄成虫(P<0.05)(表3)。
3 结论与讨论
本研究结果表明,黄地老虎成虫具有较强的飞行潜力,在24 h连续吊飞条件下,黄地老虎实验室种群成虫累计飞行时间最长可达24 h,累计飞行距离最远可达142.77 km,与已报道的具有远距离迁飞习性的棉铃虫和粘虫的测试结果接近(张志涛和李光博,1985;吴孔明和郭予元,1996),而显著高于草地螟(罗礼智和李光博,1992)。综上结果表明,就黄地老虎飞行能力而言其具备远距离迁飞的特征。不同昆虫间的飞行能力差异与多种因素有关(体型大小、飞行肌、翅结构等),其中翅的结构、组成及其物理性能的微小变化均会对飞行效率产生巨大的影响(Combes,2003)。邢振龙等(2014)研究结果表明,黄地老虎、棉铃虫和小地老虎翅的各项力学参数(硬度、压入模量等)均有不同程度的差异,这些因素的不同可能与昆虫的飞行效率密切相关。
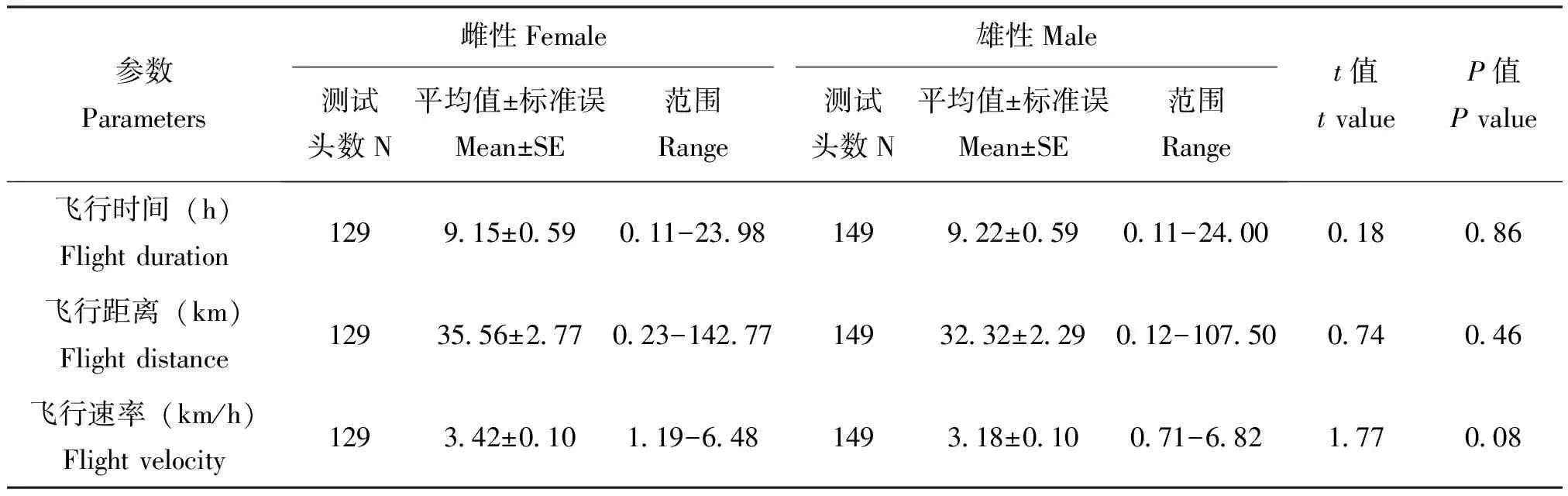
表1 不同性别对黄地老虎飞行能力的影响
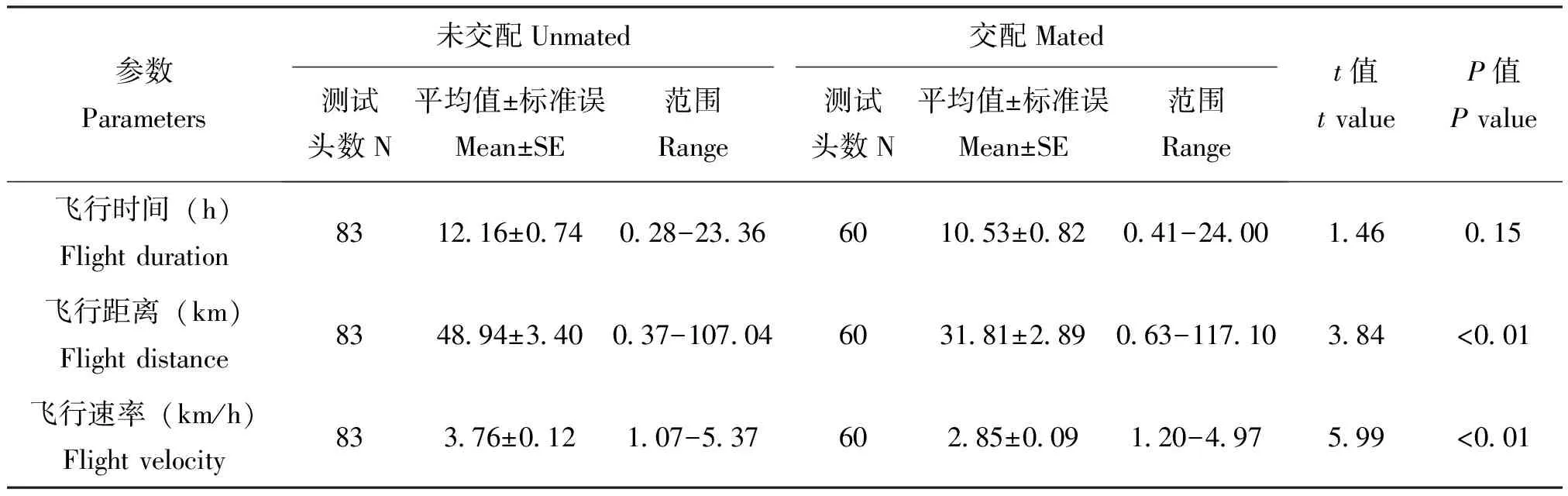
表2 交配状态对黄地老虎飞行能力的影响

表3 黄地老虎野外迁飞种群和实验室种群飞行能力的比较
注:表中同列数据后的不同小写字母表示经Tukey’s HSD多重比较差异显著(P<0.05),相同小写字母表示差异不显著。Note: Data followed by different letters in the same column indicate significantly different at 0.05 level by Tukey’s HSD test.
不同生理条件(性别、龄期、交配状态等)对昆虫的飞行能力存在很大影响(Stewart and Gaylor,1994;Wuetal.,2006)。黄地老虎实验室种群成虫的飞行能力随日龄的增加而呈现先升后降的类“抛物线”变化趋势。1日龄飞行能力最低但具备一定的飞行能力,3日龄飞行能力最强,4日龄开始下降,这与已研究的具有迁飞习性的小地老虎(Thomas and William,1991)、二点委夜蛾(郑作涛等,2014)以及稻纵卷叶螟(潘攀等,2013)的飞行能力变化趋势类似。其原因可能是初羽化黄地老虎飞行肌发育尚未健全,飞行能源物质及与飞行有关的酶系活性较低。随着龄期的增加,飞行肌等飞行系统发育逐渐健全,飞行能源物质不断积累以及酶活性增强,飞行能力开始显著上升,并在3日龄达到最强。但随着保幼激素含量的上升,卵巢进一步发育,能量使用的重点由飞行转向生殖,此时飞行肌干重下降,飞行能源物质含量降低,从而引起黄地老虎飞行能力的降低(Johnson,1969;Sunetal.,2012)。从性别来看,实验室种群雌雄蛾间的飞行能力无显著性差异,这可能与吊飞时间的长短有关,例如在连续吊飞12 h条件下,二点委夜蛾的飞行能力并无显著的性别差异,而连续吊飞80 h,结果显示雄蛾的飞行能力明显强于雌蛾(郑作涛等,2014)。
交配对生殖和飞行能力的影响已经在多种昆虫中得到研究。通过比较3日龄已交配和未交配成虫的飞行能力可知,未交配黄地老虎成虫的飞行能力显著强于交配成虫的飞行能力,交配状态显著影响了黄地老虎成虫的飞行能力,这与已研究的粉纹夜蛾Trichoplusiani(Sharpeetal.,1975)和棉铃虫(Armes and Cooter,1991)的结果类似,一旦成虫完成交配,就会寻找合适的寄主和产卵场所,降低迁飞能力。同时,在交配过程中雄虫向雌虫体内转移了许多生理效应的物质,包括肽类物质、保幼激素类似物、前列腺素等多种“交配因子”(华容胜等,2010),从而促使雌虫将用于飞行的能源物质转移到生殖方面,导致已交配的雌虫飞行能力显著下降。此外,交配也能够诱导飞行肌细胞裂解,使飞行肌发生降解并将降解产物转移到生殖等方面重新利用(Hanskietal.,1996)。
昆虫的季节性迁飞活动在其行为、生殖及生理方面等具有不同的适应特征。本研究结果表明黄地老虎野外回迁种群成虫的飞行能力略强于北迁种群成虫的飞行能力,但除平均飞行速率达到显著水平外,平均飞行时间和平均飞行距离均未达到显著水平。同时,Guo等(2015)研究发现,北迁雌蛾卵巢发育程度普遍较高且超过50%的个体已经性成熟并交配(如5月份平均交配率为87.11%,性成熟比例为84.02%),而回迁雌蛾卵巢发育程度和交配率较低(9月份平均交配率为9.52%±2.30%,性成熟比例为14.42%±3.90%)。综上结果,其主要原因可能是野外种群采集地距离北迁种群虫源地较远,而距回迁种群虫源地较近。北迁种群较回迁种群经过了更长时间的飞行,其能量消耗较大,并且在迁飞过程中随着保幼激素滴度的逐渐增加,卵巢也在不断的发育,导致其飞行能力降低。因此,黄地老虎成虫的飞行与生殖存在拮抗作用,可能符合“卵子发生-飞行拮抗综合症候”现象。
通过比较黄地老虎实验室种群与野外迁飞种群间飞行能力可知,实验室种群的飞行能力显著强于野外迁飞种群的飞行能力。该结果可能是由于野外迁飞种群在诱捕前已经经过了较长时间的飞行,消耗了大量的能源物质,且在实验前并未对其补充营养,使得其飞行能力较测试前补充营养且未进行长距离飞行的实验室种群有所减弱。对棉铃虫的相关研究结果表明,成虫期补充营养对其飞行有重要的影响,是棉铃虫持续飞行的重要因素(吴孔明等,1997)。同时,对桔小实蝇飞行能力的研究表明,补充营养后,其飞行能力有一定程度的增加(袁瑞玲等,2014)。迁飞昆虫在迁飞时取食足够的补充营养与其迁飞势能是密切相关的。昆虫的迁飞行为具有生态空间的概念,昆虫的生物学特性,生理条件及所处的环境等对其飞行能力均存在很大的影响(袁瑞玲等,2014)。因此,使得本研究测试的黄地老虎实验室种群与野外迁飞种群的飞行能力存在一定程度的差异。
尽管本试验对不同日龄、性别和交配状态的黄地老虎成虫实验室种群和野外迁飞种群的飞行能力进行了初步研究,并且明确了日龄和交配是影响其飞行能力的关键因素。但是对于解决黄地老虎远距离迁飞的年龄及生殖模式还是不够的,而且田间的条件复杂,还有哪些因素影响或决定着黄地老虎的飞行能力,都尚不清楚,还需要做更深一步的研究。
References)
Armes NJ, Cooter RJ. Effects of age and mated status on flight potential ofHelicoverpaarmigera(Lepidoptera: Noctuidae)[J].Physiologicalentomology, 1991, 16: 131-144.
Chen J, Luo SK, Liu R,etal. Analysis on population dynamics ofAgrotissegetumin Alaer Reclamation Area, Southern Xinjiang[J].ChinaCotton, 2013, 40(4): 28-30. [陈婧, 罗树凯, 刘蓉, 等.新疆南部阿拉尔垦区棉田黄地老虎成虫种群动态分析[J].中国棉花, 2013, 40(4): 28-30]
Cheng DF, Tian Z, Li HM,etal. Influence of temperature and humidity on the flight capacity ofSitobionavenae[J].ActaEntomologicaSinica, 2002, 45(1): 80-85. [程登发, 田喆, 李红梅, 等.温度和湿度对麦长管蚜飞行能力的影响[J].昆虫学报, 2002, 45(1):80-85]
Cheng XN. Recent advances in research on the migrating insects in China[J].EntomologicalKnowledge, 1992, 29: 146-149. [程遐年.中国迁飞昆虫的研究进展[J].昆虫知识, 1992, 29: 146-149]
Combes SA. Wing Flexibility and Design for Animal Flight[D].Washington: University of Washington, 2003.
Cui JX, Cai WZ. Diversity of flight performance of tetheredCletusrusticusStål (Hemiptera: Coreidae). In: Sheng XC, Zhang RZ, Ren YD, eds. Classification and Distribution of Insect in China[M]. Beijing: China Agricultural and Technical Press, 2008:539-551.
Cui JX, Cai WZ. Flight patterns ofCletusrusticus(Stål) (Hemiptera: Coreidae).In:Computer Science and Information Engineering, 2009 WRI World Congress on. Insitute of Electrical and Electronics Engineers[C]. 2009, 1: 617-621.
Cui JX, Cai WZ.Flight performance of a tethered stink bug,Graposomarubrolineata(Westwood) (Hemiptera: Pentatomidae)[J].JournalofLifeSciences, 2008, 2(12): 5-11.
Dent D. Insect Pest Management[M]. London: CAB International, 2000: 1-432.
Dingle H, Drake VA. What is migration?[J].Bioscience, 2007, 57: 113-121.
Esbjerg P, Sigsgaard L. Phenology and pest status ofAgrotissegetumin a changing climate[J].CropProtection, 2014, 62: 64-71.
Fu XW, Zhao XY, Xie BT,etal. Seasonal pattern ifSpodopteralitura(Lepidoptera: Noctuidae) migration across the Bohai Strait in northern China[J].JournalofEconomicEntomology, 2015, 108(2): 525-528.
Fu XW. Study on the Community Structure and Population Dynamics of Migratory Insects across the Bohai Strait[D].Beijing: Chinese Academy of Agricultural Sciences, 2015.[付晓伟.“渤海湾通道”迁飞性昆虫群落结构及种群动态研究[D].北京:中国农业科学院, 2015]
Guo JL, Fu XW, Wu X,etal. Annual migration ofAgrotissegetum(Lepidoptera: Noctuidae): Observed on a small isolated island in northern China[J].PLoSONE, 2015, 10(6): e0131639.
Hanski I,Saastamoinen M,Ovaskainen O.Dispersal-related life-history trade-offs in a butterfly metapopulation[J].JournalofAnimalEcology, 2006, 75(1):91-100.
Hua RS, Qi ZL, Shi LG. Advance of insect mating factor[J].BulletinofScienceandTechnology, 2010, 26(4): 556-559.[华荣胜,戚志良, 时连根. 昆虫交配因子的研究进展[J].科技通报, 2010, 26(4): 556-559]
Huang XF, Zhang XX, Zhai BP. Effect of copulation on flight capacity and remigration capacity ofCnaphalocrocismedinalis(Guenée)[J].JournalofNanjingAgriculturalUniversity, 2010, 33(5): 23-28. [黄学飞,张孝羲,翟保平.交配对稻纵卷叶螟飞行能力及再迁飞能力的影响[J].南京农业大学学报, 2010, 33(5): 23-28]
Jia PH, Cao YZ. The flight activity of the black cutworm moth[J].ActaEntomologicaSinica,1992,35(1): 59-65.[贾佩华,曹雅忠.小地老虎成虫的飞翔活动[J].昆虫学报,1992,35(1): 59-65]
Jiang XF, Luo LZ, Thomas WS. Relationship of flight and reproduction in beet armyworm,Spodopteraexigua(Lepidoptera: Noctuidae), a migrant lacking the oogenesis-flight syndrome[J].JournalofInsectPhysiology,2010,56(4): 1631-1637.
Johnson CG. Migration and Dispersal of Insects by Flight[M]. London: Methuen,1969:745-763.
Liu ZF, Jeremy NM, Wu KM. Flight mill performance of the LacewingChrysoperlasinica(Neuroptera: Chrysopidae) as a function of age, temperature, and relative humidity[J].JournalofeconomicEntomology, 2011, 104(1): 94-100.
Lu YH, Wu KM, Guo YY. Flight potential of the green plant bug,Lyguslucorum(Meyer - Dür) (Heteroptera: Miridae)[J].environmentalEntomology,2007,36: 1007-1013.
Luo LZ, Jiang XF, Li KB,etal.Influences of flight on reproduction and longevity of the oriental armyworm,Mythimnaseparate(Walker)[J].ActaEntomologicaSinica, 1999, 42(2): 150-158. [罗礼智,江幸福,李克斌,等.粘虫飞行对生殖及寿命的影响[J].昆虫学报,1999,42(2):150-158]
Luo LZ, Li GB.The flight ability and behavior research of meadow moth on different days[J].YouthEcologicalSciences,1992,2:303-308. [罗礼智,李光博.草地螟不同蛾龄成虫飞行能力和行为的研究[J].青年生态学论丛,1992,2:303-308]
Lv ZZ, Wang PL, Zhang QH,etal.Relationships between overwinteringAgrotissegetumpopulation and snow[J].ChineseJournalofEcology,2006,25(12):1532-1534.[吕昭智,王珮玲,张秋红,等.黄地老虎种群动态与积雪的关系[J].生态学杂志,2006,25(12): 1532-1534]
Pan P, Luo LZ, Jiang XF,etal.The characteristics of flight in the rice leaf roller,Cnaphalocrocismedinalis[J].ChineseJournalofAppliedEntomology,2013,50(3):583-591.[潘攀,罗礼智,江幸福,等.稻纵卷叶螟飞行行为特征[J].应用昆虫学报,2013,50(3): 583-591]
Qi GJ, Qin RR, Xiao MK,etal.Occurrence of the third and fourth generations ofCnaphalocrocismedinalisin the mixed cropping rice region in Anqing, Anhui Province[J].ChineseJournalofRiceScience,2008,22(2):513-518.[齐国君,秦冉冉,肖满开,等.安徽安庆混作稻区稻纵卷叶螟第三、四代发生规律研究[J].中国水稻科学,2008,22(2):513-518]
Sharpe JL, McLaughlin JR, Ashley TR,etal.Flight ability ofTrichoplusianiin the laboratory[J].AnnalsoftheEntomologicalSocietyofAmerica,1975,68:755-758.
Stewart SD, Gaylor MJ. Effects of age, sex, and reproductive status on flight by the tarnished plant bug (Heteroptera: Miridae)[J].EnvironmentalEntomology,1994,23:80-84.
Sun BB, Jiang XF, Zhang L,etal.Methoprene influences reproduction and flight capacity in adults of the rice leaf roller,Cnaphalocrocismedinalis(Guenée) (Lepidoptera: Pyralidae)[J].ArchivesofInsectBiochemistryandPhysiology,2012,82(1):1-13.
Thomas WS,William BS.Implications for migration of age-related variation in flight behavior ofAgrotisipsilon(Lepidoptera: Noctuidae)[J].AnnalsoftheEntomologicalSocietyofAmerica,1991,84(5):560-565.
Tribel SA, Voblov AP. Be aware of cutworms[J].ZascitaRastnij,1984,4:28-29.
Wang JR, Dai SH, Yu RL,etal.The overwintering and spring occurrence ofAgrotissegetum[J].XingjiangAgriculturalSciences,1962,3: 105-107.[王敬儒,戴淑慧,禹如龙,等.黄地老虎越冬及春季发生规律[J].新疆农业科学,1962, 3:105-107]
Wu HH, Wu KM, Wang DY,etal. Flight potential of pink bollworm,PectinophoragossypiellaSaunders (Lepidoptera: Gelechiidae)[J].EnvironmentalEntomology,2006,35:887-893.
Wu KJ. Alucerne-wheat germ diet for rearing the cotton bollworm,Heliothisarmigera(Hübner)[J].ActaEntomologicaSinica,1985,28(1): 22-29.[吴坤君. 棉铃虫的紫云英-麦胚人工饲料[J].昆虫学报,1985,28(1):22-29]
Wu KM, Guo YY.Effects of food quality and larval density on flight capacity of cotton bollworm[J].ActaEntomologicaSinica,1997,40(1):51-57.[吴孔明,郭予元.营养和幼期密度对棉铃虫飞翔能力的影响[J].昆虫学报,1997,40(1):51-57]
Wu KM, Guo YY. The flight activity of cotton bollworm[J].ActaEcologlcaSinica,1996,16(6):612-617.[吴孔明,郭予元.棉铃虫的飞翔活动[J].生态学报,1996,16(6):612-617]
Wu KM, Zhai BP, Feng HQ,etal.Radar observation on the migratory behavior of the second generation cotton bollworm moths in the northern China[J].ActaPhytophylacicaSinica,2006,33(2):163-167.[吴孔明,翟保平,封洪强,等.华北北部地区二代棉铃虫成虫迁飞行为的雷达观测[J].植物保护学报,2006,33(2):163-167]
Xing ZL, Fu XW, Liu YQ,etal.The nano-indentation method for analyzing the mechanical properties of Lepidopteran insects,wings[J].ChineseJournalofAppliedEntomology,2014,51(6):1604-1611.[邢振龙,付晓伟,刘永强,等.鳞翅目昆虫翅膀纳米力学性能的测定方法[J].应用昆虫学报,2014,51(6):1604-1611]
Yuan RL, Yang S, Wang XW,etal.Test on flight ability ofBactroceradorsalis[J].JournalofWestChinaForestryScience,2014,43(6): 66-71. [袁瑞玲,杨珊,王晓渭,等.桔小实蝇飞行能力测试[J].西部林业科学,2014,43(6):66-71]
Zhai BP, Chen RL.Flight capacity of Asian corn borer (OstriniafurnacarisGuenée)[J].JilinAgriculturalScience,1989,14(1):40-46.[翟保平,陈瑞鹿.亚洲玉米螟飞翔能力的初步研究[J].吉林农业科学,1989,14(1):40-46]
Zhang AB, Nangong ZY, Song P,etal.Efficacy of entomopathogenic nematodes againstAgrotissegetumlarvae[J].JournalofEnvironmentalEntomology,2015,37(3):591-597.[张安邦,南宫自艳,宋萍,等.昆虫病原线虫对黄地老虎致病力的研究[J].环境昆虫学报,2015,37(3):591-597]
Zhang ZT, Li GB.The preliminary research on the flight biological characteristics of armyworm[J].ActaPhytophylacicaSinica,1985,12: 93-100.[张志涛,李光博.粘虫飞翔生物学特性初步研究[J].植物保护学报,1985,12:93-100]
Zhen ZT,Jiang XF,Zhang L,etal. Flight ability ofAthetislepigone[J].ChineseJournalofAppliedEntomology,2014,51(3): 643-653.[郑作涛,江幸福,张蕾,等.二点委夜蛾飞行行为特征[J].应用昆虫学报,2014,51(3): 643-653]
Preliminary study on the flight capacity ofAgrotissegetum(Lepidoptera: Noctuidae)
GUO Jiang-Long1,2, FU Xiao-Wei2, ZHAO Xin-Cheng1, WU Kong-Ming2*
(1.College of Plant Protection, Henan Agricultural University, Zhengzhou 450002, China; 2. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
The turnip mothAgrotissegetumDenis & Schiffermüller (Lepidoptera: Noctuidae) is an important migratory insect pest of many crops throughout the World. The investigation on its flight capacity is helpful for understanding migratory mechanism of this insect. The flight performances ofA.segetumwere tested by tethering individuals to computerized flight mills for a 24 h trial period. The results indicated that the laboratory population of 1-d-old moths showed a weak flight capacity, but the 3-d-old moths took the strongest flight ability. The mean flight duration, mean flight distance and mean flight velocity for 3-d-old moths reached 12.16±0.74 h, 48.94±3.40 km and 3.76±0.12 h, respectively. There were no significant differences of flight ability between female and male moths. The mean flight distance and velocity of the virgin moths were significantly higher than that of mated individuals. Both wild populations captured from early-middle and late seasons at Beihuang Island presented similar flight activity, which were significantly weaker than that of the laboratory population. These findings suggested thatA.segetumpossessed a strong flight capacity, and both age and mating status were the key factors affecting its flight.
Agrotissegetum; flight capacity; flight mill; age; mating status
国家农业转基因生物重大专项 (2014ZX0812-004)
郭江龙,男,1989年生,河北邢台人,硕士研究生,研究方向为昆虫生态学,E-mail: jianglongguo88@163.com
*通讯作者Author for correspondence, E-mail: kmwu@ippcaas.cn
Received:2016-02-24;接受日期Accepted:2016-05-27
Q965;S433.4
A
1674-0858(2016)05-0888-08

