肠道菌群/肝药酶系对天然皂苷类成分的代谢研究进展Δ
曹伟宇,冯 斌,王晓娟(军事口腔医学国家重点实验室/口腔疾病国家临床医学研究中心/陕西省口腔生物工程技术研究中心/第四军医大学口腔医院药剂科,西安 710032)
·综述讲座·
肠道菌群/肝药酶系对天然皂苷类成分的代谢研究进展Δ
曹伟宇*,冯斌,王晓娟#(军事口腔医学国家重点实验室/口腔疾病国家临床医学研究中心/陕西省口腔生物工程技术研究中心/第四军医大学口腔医院药剂科,西安710032)
目的:为从天然皂苷类成分的代谢物中寻找活性化合物提供参考。方法:以“肠道菌群”“肝药酶系”“皂苷”“代谢”“Intestinal bacteria”“Liver microsomes”“Saponins”“Metabolism”等为
,组合查询1994年1月-2016年1月在PubMed、Web of Science、中国知网、中国生物医学等数据库中的相关文献,对天然皂苷类化合物在肠道菌群/肝药酶系中的代谢研究情况进行综述。结果与结论:共检索到相关英文文献200余篇、中文文献800余篇,其中有效文献37篇。皂苷类化合物主要被肠道菌群代谢,吸收进入体内的代谢物经肝脏代谢的较少,大多数以次生苷或苷元直接发挥其药理作用。对皂苷类化合物代谢的研究大多集中在单一的代谢系统,并没有将肠道菌群/肝药酶系作为整体对物质的代谢进行研究。因此,可以基于肠道菌群/肝药酶系,应用液质联用和液核联用等现代分析技术对代谢产物进行分离、鉴定与富集,从而筛选出天然皂苷类化合物在人体内外转化处置后的最终活性代谢产物。
肠道菌群;肝药酶系;天然皂苷;代谢
胃肠道和肝脏是口服药物在体内代谢的重要场所,肠道内寄居的大量微生物及肝脏中的各种酶系对药物的代谢发挥着非常重要的作用。大多数皂苷类化合物具有溶血性,无法通过静脉给药,而口服给药后肠道吸收差、生物利用度低,这已成为皂苷类药物研发的瓶颈。近年来,肠道菌群/肝药酶系对天然皂苷类成分的生物转化研究已成为国内外学者关注的热点。文献[1-2]报道,皂苷类化合物经口服到达靶器官起作用的活性物质,很大一部分是经肠道菌群生物转化后的活性代谢产物。因此,从皂苷的代谢产物中寻找活性更强、药动学性质更好的活性成分是突破上述瓶颈的重要手段之一。笔者以“肠道菌群”“肝药酶系”“皂苷”“代谢”“Intestinal bacteria”“Liver microsomes”“Saponins”“Metabolism”等为关键词,组合查询1994年1月-2016年1月在PubMed、Web of Science、中国知网、中国生物医学等数据库中的相关文献。结果,共检索到相关英文文献200余篇、中文文献800余篇,其中有效文献37篇。现对天然皂苷类化合物在肠道菌群/肝药酶系中的代谢研究情况进行综述,以期为从天然皂苷类成分的代谢物中寻找活性化合物提供参考。
1 基于肠道菌群/肝药酶系从皂苷类成分的代谢物中筛选活性物质
天然皂苷类化合物一般因其分子质量和极性较大,口服后首先在肠道内滞留一定时间,与肠道菌群发生作用。文献报道,肠道菌群对皂苷类化合物的代谢途径主要是以水解和还原反应为主[3]。因此,皂苷类化合物经微生物转化后代谢物的极性降低、脂溶性增加,使其有利于被机体吸收。Ruan JQ等[4]采用人结肠腺癌细胞(Caco-2细胞)模型对三七皂苷R1肠道菌群代谢物的肠渗透性进行研究时发现,三七皂苷R1代谢物的脂溶性增加,因而可大大提高其肠通透性。如图1所示,天然皂苷在肠道菌群的生物转化下可形成代谢物M1、M2和M3,转化后的M1因其分子质量降低、脂溶性增加可以顺利通过胃肠道吸收进入体内循环发生药理作用;M2经胃肠道吸收后可能还需体内肝药酶系再次转化,最终形成活性代谢产物M4而发挥药理作用;而代谢物M3不被小肠吸收,直接排出体外。同时,天然皂苷还可以直接经胃肠道吸收进入体内,在肝药酶系的作用下生成活性代谢产物M5发挥药效,而不经肠道菌群和肝药酶系作用直接进入体内循环发挥疗效的天然皂苷类化合物很少。因此,天然皂苷类成分经口服后,可以通过A途径在肠道菌群的生物转化下生成活性代谢产物M1;也可以通过B途径直接吸收进入体内经肝药酶系作用生成活性代谢产物M5;还可以通过C途径先经肠道菌群生物转化,再吸收进入体内循环经肝药酶系形成活性代谢产物M4。这些活性代谢产物是真正作用于疾病靶点的物质。
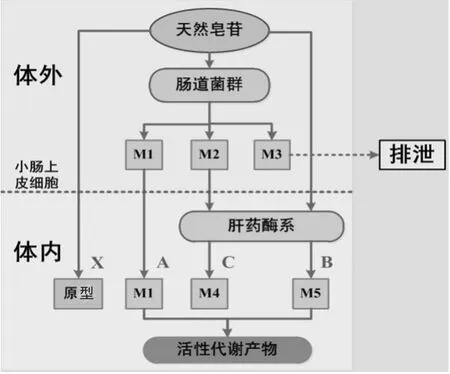
图1 从肠道菌群/肝药酶系中筛选天然皂苷类成分活性代谢物的一般途径
2 肠道菌群对天然皂苷类药物的代谢研究
2.1天然皂苷类药物与肠道菌群的相互作用
日本学者小桥恭一、服部征雄等作为先导者,从20世纪80年代起对天然皂苷有效成分的肠道菌群代谢途径做了大量的工作,先后证明人参皂苷、甘草皂苷等多种天然皂苷口服后经肠道菌群代谢所得的活性代谢产物吸收入血发挥治疗作用,并提出了天然前药的概念。国内也有人提出中药吸收代谢后药物(Post absorption/metabolism drug,PAMD)的概念。天然皂苷的肠道菌群代谢处置的研究已被许多国家学者所重视,并成为一个受国际关注的重要发现。
大量研究表明,人和动物的肠道菌群对皂苷类成分具有非常强大的代谢能力,肠道菌群对皂苷类化合物的代谢途径主要是以水解和还原反应为主。因而天然产物中到达靶器官起作用的活性物质,很大一部分是经胃肠道代谢后的产物。许多中药成分都是借助肠道细菌的代谢转化为有效成分而达到治疗作用,尤其是具有糖苷键的皂苷类化合物。这类化合物通常在肠道内难以吸收、生物利用度低、肠内滞留时间较长而易受到肠道菌群的作用,其原型物药理活性较小,经肠道菌群代谢后被水解生成次生苷或苷元而发挥药理作用。Bae EA等[5]采用离体培养人肠道菌群法对人参皂苷Rg3进行代谢研究发现,其主要代谢产物为人参皂苷Rh2和原人参二醇,且体外试验证明代谢产物具有抑制肿瘤细胞增殖的作用。Bae EA等[6]接着对人参皂苷Re进行人肠道菌群代谢研究发现,其代谢产物人参皂苷Rh1能很快吸收进入体内发挥雌激素样作用。Kim DH等[7]研究发现,常春藤皂苷K可被人肠道菌群代谢,动物体内实验证明其代谢物具有较强的抗炎作用。杨秀伟等[8]采用人肠内细菌和短乳杆菌粗酶分别对七叶树皂苷-Ⅰa进行代谢研究并提出七叶树皂苷-Ⅰa是“前药”,其代谢产物去酰基七叶树皂苷-Ⅰa对小鼠肉瘤S-180、肝癌和肺癌细胞的生长具有抑制作用。
不同种属之间肠道菌群的组成和稳定性有一定差异,对同一天然皂苷类化合物的生物转化方式也存在一定的差异。皂苷中人参皂苷的研究最为广泛。王毅等[9]发现,人参皂苷Rg1在大鼠体内的代谢途径为Rg1→Rh1/F1→Ppt,Rh1与F1为同分异构体,在人肠道菌中的代谢途径为Rg1→Rh1→原人参三醇,表明人参皂苷Rg1在人和大鼠肠道菌中的代谢存在差异。随后,Hasegawa H等[10]证实人参皂苷Rg1代谢物原人参三醇为主要抗肿瘤成分,通过刺激脾脏自然杀伤(NK)细胞生成肿瘤细胞毒素,抑制肿瘤细胞生长。钱静等[11]发现,经肠道菌群的作用,人参皂苷Rb1在有氧和厌氧条件下仅检测到代谢产物人参皂苷Rd、F2、C-K,在大鼠肠道菌群中的代谢途径为Rb1→Rd→F2→C-K。Wang HY等[12]研究发现,人参皂苷Rb1经肠道菌群代谢时有不同的代谢途径及代谢产物,如人参皂苷Rg3、Rh2。故推测不同地域、不同种属之间有差异。
2.2主要研究方法
2.2.1体内法①口服与非口服(静脉、腹腔注射等)药物比较[13-14]:比较动物给药前后肠内容物、血液、尿中的物质及含量,初步筛选肠道菌群的代谢产物。该法仅产生微量的代谢产物,且受内源性代谢产物影响,不利于代谢产物的富集。②无菌动物与普通动物的肠道内代谢产物比较[15-16]:无菌动物免疫功能低下,其消化道菌群种类数量与普通动物有区别,可以考察肠道菌群对药物的作用。对药物在肠道内容物、粪便、血样及尿样中代谢产物进行分析,进一步明确肠道菌群在天然药物生物转化过程中的作用。该法对动物和饲养条件要求较高,不利于大批量开展实验,现很少用。
2.2.2体外法①离体培养肠道菌群[17-19]:以人或动物的新鲜粪便制备肠道菌液进行厌氧培养得到孵育液,然后观察天然产物与之作用后的代谢产物。该法使用的是人或动物的粪便,方便易得,可以从离体培养的肠道菌群代谢样品中分离富集。②筛选对药物起主要代谢作用的菌株[20-21]:研究药物成分特性,分析与其代谢相关的酶类,保留该种酶的菌种,对其进行研究。该法要通过一定技术手段筛选出特异菌株,虽然专一性好,但难度大、耗时长,且成本较高。
3 肝药酶系对天然皂苷类化合物的代谢研究
3.1天然皂苷类化合物与肝药酶系的相互作用
因肝细胞内存在有微粒体混合功能酶系统,而该系统能促进多种药物发生转化,故称肝药酶系。在肝脏中参与药物代谢的酶主要为细胞色素P450(CYP),其含量约占肝内CYP酶总量的80%以上,该酶可使药物发生氧化、还原、水解等反应,引入或脱去功能基团(—OH、—NH2、—SH),使原型药生成极性增高的代谢物[22-23]。药物作为CYP的底物,可通过诱导CYP加速自身的代谢转化成水溶性高的物质后,经尿和胆汁排泄,也可能抑制CYP活性,延缓药物的代谢过程甚至在体内发生蓄积性中毒。新药研发的早期阶段,常利用肝微粒体模型对候选化合物药动学特点进行初筛,以便在研究开发的早期确定该候选化合物是否有继续开发的价值。
口服天然皂苷类化合物经肝脏代谢发现活性代谢物的研究相对较少,大部分经肠道菌群代谢的天然皂苷吸收进入体内几乎不被肝脏所代谢。Hasegawa H等[24-25]研究发现人参皂苷Rb1经肠道菌群水解后的混合物IBM,然后对其抗肿瘤转移能力进行研究。结果显示,混合物IBM的抗肿瘤转移的能力强于人参皂苷Rb1,与5-氟尿嘧啶(5-FU)相似,M1是混合物IBM中的一个代谢产物,其在肝脏中又被代谢为EM1,而在抑制肿瘤细胞的生长中,EM1的抑制率显著高于M1,由此认为EM1可能是人参皂苷Rb1中起药理作用的物质。也就是说,EM1是从肠道菌群/肝药酶系中发现的具有潜在开发价值的抗肿瘤活性物质。田莉[26]采用体外大鼠肝微粒体孵育系统研究CYP对甘草酸(GL)、甘草次酸(GA)代谢的影响时发现,CYP对GL代谢没有影响,几乎不被肝脏所代谢。综上所述,天然皂苷类成分经肝脏代谢发现活性代谢物的研究相对较少,主要是在胃肠道中被肠道菌群转化而降解吸收入血发挥药理活性。
3.2主要研究方法
3.2.1体内法体内实验是通过动物给药后收集肝微粒体进行检测分析从而筛选代谢产物。其优点在于实验是在动物整体用药的基础上进行的,可以直观、准确地反映生命机体在生理状态下的药物代谢状况,但易受个体机能状态、个体差异、用药耐受量、合并用药有无干扰等因素的影响及伦理道德的限制,实验规模往往较小、重复性差。
3.2.2体外法①肝微粒体孵育法[27-28]:肝微粒体孵育法是从动物或人肝脏中提取肝微粒体辅以氧化还原型辅酶,加入药物在模拟生理温度及生理环境条件下进行体外孵育试验。肝微粒体孵育技术目前最常用的是CYP酶体外试验。②肝细胞孵育法[29]:该法的关键是肝细胞的制备,其他与肝微粒体孵育法相似,即以制备的肝细胞辅以氧化还原型辅酶在模拟生理环境条件下进行体外孵育试验。③精密肝切片法[30]:精密肝切片技术能保存较完整的组织结构及细胞间联系,是介于器官与细胞水平间较接近生理状况的一种技术手段,可在较长的孵育时间内保持代谢活性。④重组CYP孵育法[31]:是利用基因工程及细胞工程将调控CYP酶表达的基因整合到载体上,经细胞培养,表达高水平的CYP酶,然后经过分离、纯化得到纯度较高的单一的CYP同工酶。⑤离体肝灌流法[32]:在大鼠麻醉状态下用手术和插管使其肝脏形成体外循环,在人工控制剂量和条件下,直接观察药物通过肝脏或反复循环地通过肝脏后,药物本身的代谢变化或其对肝脏的影响,上述方法具体优缺点见表1。
4 现代分析技术在天然皂苷类成分代谢物检测方面的应用
随着现代分析技术的发展,液质联用(LC-MS)目前已成为体内外代谢研究的重要手段,其高灵敏度、微量分析的特点恰巧符合体内生物样品分析检测的要求[33]。近年来采用串联质谱技术(LC-MS/MS)对中药成分体内代谢的研究被广泛使用,为中药成分体内代谢产物的鉴定提供了捷径[34]。但纵观这些研究报道,大部分研究仅停留在测定药物的体内外代谢产物的浓度的药动学领域,很少直接对其结构进一步确认。大部分都是借助体外的大量合成或者富集代谢产物最后通过核磁共振(NMR)进行结构鉴定。随着NMR技术的发展,出现了高效液相色谱(HPLC)-固相萃取(SPE)-NMR联用技术[35]。此联用系统可根据需要对HPLC馏分进行在线富集,增加了样品池中的样品量,随样品浓度的增加,可以直接对代谢样品中的未知化合物进行结构鉴定。Cao WY等[36]利用HPLCMS和HPLC-NMR技术对九节龙皂苷Ⅰ(ADS-Ⅰ)人肠道菌代谢产物(M1和M2)进行了结构鉴定,为ADS-Ⅰ在人肠道内的转化吸收研究提供了科学依据。Gampe N等[37]对从豆科植物红芒柄花根部中提取的异黄酮苷类成分进行了系统的分离,并鉴定了34种新化合物,为红芒柄花植物的进一步研发提供了参考和思路。
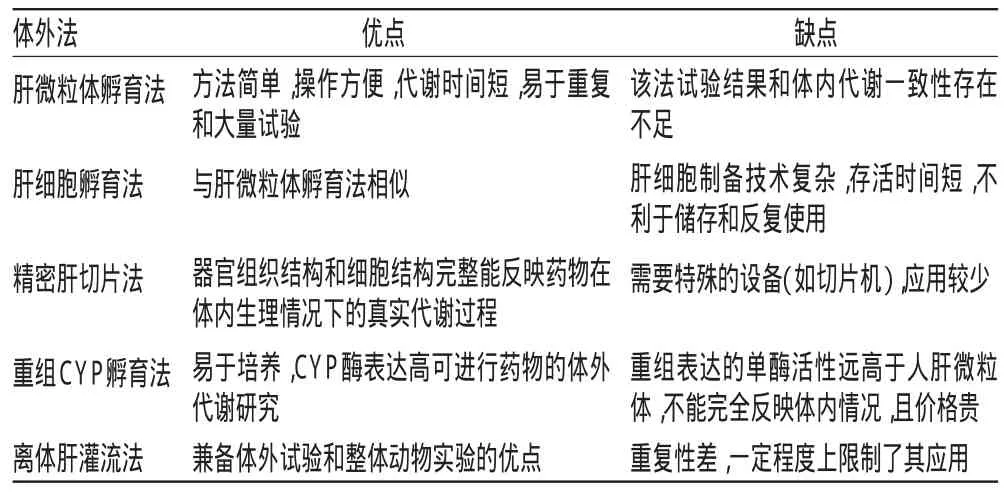
表1 不同体外肝代谢方法的优缺点
5 结语
通过文献回顾,笔者发现皂苷类成分极易被肠道菌群代谢为新的物质,而这些新的物质分子质量减小、极性降低,往往更容易被机体吸收从而发挥药理活性。然而,通过查阅文献,笔者还发现对皂苷类化合物代谢的研究大多集中在单一的代谢系统,并没有将肠道菌群/肝药酶系作为整体对物质的代谢进行研究。因此,可应用LC-MS和LC-NMR等现代分析技术对代谢产物进行分离、鉴定与富集,从而筛选出天然皂苷类化合物在人体内外转化处置后的最终活性代谢产物。此研究突破了传统天然皂苷类化合物研发的瓶颈,为寻找新活性化合物提供了一个新的思路和方法。深入研究肠道菌群/肝药酶系对皂苷类成分代谢的影响,对于开发活性更强、药动学性质更好的新药具有重要意义。
[1]Yang Z,Wang JR,Niu T,et al.Inhibition of P-glycoprotein leads to improved oral bioavailability of compound K,an anticancer metabolite of red ginseng extract produced by gut microflora[J].Drug Metab Dispos,2012,40(8):1538.
[2]Kang KA,Piao MJ,Kim KC,et al.Compound K,a metabolite of ginseng saponin,inhibits colorectal cancer cell growth and induces apoptosis through inhibition of histone deacetylase activity[J].Int J Oncol,2013,43(6):1907.
[3]张李赢,杨轶舜,张彤,等.肠道菌群对中药苷类成分的代谢研究进展[J].中药材,2011,34(7):1155.
[4]Ruan JQ,Leong WI,Yan R,et al.Characterization of metabolism and in vitro permeability study of notoginsenoside R1 from Radix notoginseng[J].J Agric Food Chem,2010,58(9):5770.
[5]Bae EA,Han MJ,Choo MK,et al.Metabolism of 20(S)-and 20(R)-ginsenoside Rg3 by human intestinal bacteria and its relation to in vitro biological activities[J].Biol Pharm Bull,2002,25(1):58.
[6]Bae EA,Shin JE,Kim DH.Metabolism of ginsenoside Re by human intestinal microflora and its estrogenic effect [J].Biol Pharm Bull,2005,28(10):1903.
[7]Kim DH,Bae EA,Han MJ,et al.Metabolism of kalopanaxsaponin K by human intestinal bacteria and antirheumatoid arthritis activity of their metabolites[J].Biol Pharm Bull,2002,25(1):68.
[8]杨秀伟,赵静,崔景荣,等.七叶树皂苷-Ⅰa的人肠内细菌生物转化产物及其抗肿瘤活性研究[J].北京大学学报:医学版,2004,36(1):31.
[9]王毅,刘铁汉,王巍,等.肠内菌群对人参皂苷Rg1的代谢转化作用的研究[J].中国中药杂志,2001,26(3):188.
[10]Hasegawa H,Suzuki R,Nagaoka T,et al.Prevention of growth and metastasis of murine melanoma through enhanced natural-killer cytotoxicity by fatty acid-conjugate of protopanaxatriol[J].Biol Pharm Bull,2002,25(7):861.
[11] 钱静,康安,狄留庆,等.人参皂苷Rb1在体外肠道菌群模型中的代谢研究[J].南京中医药大学学报,2015,31(6):567.
[12]Wang HY,Hua HY,Liu XY,et al.In vitro biotransformation of red ginseng extract by human intestinal microflora:metabolites identification and metabolic profile elucidation using LC-Q-TOF/MS[J].Journal of Pharmaceutical and Biomedical Analysis,2014,98(10):296.
[13]Lee PS,Han JY,Song TW,et al.Physicochemical characteristics and bioavailability of a novel intestinal metabolite of ginseng saponin(IH901)complexed with β-cyclodextrin[J].Int J Pharm,2006,316(1/2):29.
[14]Wang XJ,Cui H,Wang R,et al.Metabolism and pharmacokinetic study of ardipusillosideⅠ in rats[J].Planta Med,2012,78(6):565.
[15]Akao T,Hayashi T,Kobashi K,et al.Intestinal bacterial hydrolysis is indispensable to absorption of 18β-glycyrrhetic acid after oral administration of glycyrrhizin in rats [J].J Pharm Pharmacol,1994,46(2):135.
[16]Takeda S,Wakui Y,Mizuhara Y,et al.Gastrointestinal absorption of paeoniflorin in germ-free rats[J].J Tradit Med,1996,13(3):248.
[17] 周鹏飞,王建壮,庞小雄,等.离体培养人肠道菌群对芦丁代谢的研究[J].广东药学院学报,2011,27(6):582.
[18]Wan JY,Liu P,Wang HY,et al.Biotransformation and metabolic profile of American ginseng saponins with human intestinal microflora by liquid chromatography quadrupole time-of-flight mass spectrometry[J].J Chromatogr A,2013,doi:10.1016/j.chroma.2013.02.053.
[19]Ha YW,Na YC,Ha IJ,et al.Liquid chromatography/ mass spectrometry-based structural analysis of new platycoside metabolites transformed by human intestinal bacteria[J].J Pharm Biomed Anal,2009,51(1):202.
[20]Quan LH,Jin Y,Wang C,et al.Enzymatic transformation of the major ginsenoside Rb2 to minor compound Y and compound K by a ginsenoside-hydrolyzing β-glycosidase from Microbacterium esteraromaticum[J].J Ind Microbiol Biotechnol,2012,39(10):1557.
[21]李学,臧埔,张连学,等.微生物转化法制备人参皂苷Compound K的研究进展[J].食品科学,2012,33(11):323.
[22]Guengerich FP.Cytochrome P450s and other enzymes in drug metabolism and toxicity[J].AAPS J,2006,8(1):101.
[23]Lynch T,Price A.The effect of cytochrome P450metabolism on drug response,interactions,and adverse effects [J].Am Fam Physician,2007,76(3):391.
[24]Hasegawa H,Uchiyama M.Antimetastatic efficacy of orally administered ginsenoside Rb1 in dependence on intestinal bacterial hydrolyzing potential and significance of treatment with an active bacterial metabolite[J].Planta Med,1998,64(8):696.
[25]Hasegawa H,Lee KS,Nagaoka T,et al.Pharmacokinetics of ginsenoside deglycosylated by intestinal bacteria and its transformation to biologically active fatty acid esters[J].Biol Pharm Bull,2000,23(3):298.
[26]田莉.复方甘草酸苷片的研制及体外代谢研究[D].乌鲁木齐:新疆医科大学,2008:70.
[27]黄果,李凯鹏,杨洁,等.吴茱萸成分在大鼠肝微粒体对盐酸小檗碱代谢的影响[J].中国药学杂志,2010,45(20):1544.
[28] 曹秀珍,张伟,姚志红,等.甲基原薯蓣皂苷对人肝微粒体中7种CYP450酶活性的影响[J].沈阳药科大学学报,2008,25(11):914.
[29]Komoroski BJ,Parise RA,Egorin MJ,et al.Effect of the St.John’s wort constituent hyperforin on docetaxel metabolism by human hepatocyte cultures[J].Clin Cancer Res,2005,11(19):6972.
[30]van Midwoud PM,Janssen J,Merema MT,et al.Online HPLC analysis system for metabolism and inhibition studies in precision-cut liver slices[J].Anal Chem,2011,83(1):84.
[31]李春正,林庆辉,庄笑梅,等.重组人源CYP同工酶介导的罗通定O-去甲基代谢[J].药学学报,2010,45(3):307.
[32]Jin H,Wang J,Gerber JP,et al.Disposition of isosteviol in the rat isolated perfused liver[J].Clin Exp Pharmacol Physiol,2010,37(5/6):593.
[33]Lewis RJ,Bernstein MA,Duncan SJ,et al.A comparison of capillary-scale LC-NMR with alternative techniques:spectroscopic and practical considerations[J]. Magn Reson Chem,2005,43(9):783.
[34] 姜艳彬,单吉浩,王莹,等.LC-MS/MS技术在药物代谢研究中的应用进展[J].药物分析杂志,2014,34(3):385.
[35] 肖卫红,何伟,徐宏峰,等.LC-MS/MS法测定人血浆中伊伐布雷定及其活性代谢产物的浓度[J].中国药房,2014,25(22):2050.
[36]Cao WY,Wang YN,Wang PY,et al.Ardipusilloside-Ⅰmetabolites from human intestinal bacteria and their antitumor activity[J].Molecules,2015,20(11):20569.
[37]Gampe N,Darcsi A,Lohner S,et al.Characterization and identification of isoflavonoid glycosides in the root of Spiny restharrow(Ononis spinosa L.)by HPLC-QTOFMS,HPLC-MS/MS and NMR[J].J Pharm Biomed Anal,2016,doi:10.1016/j.jpba.2016.01.058.
(编辑:余庆华)
R93
A
1001-0408(2016)28-3999-04
10.6039/j.issn.1001-0408.2016.28.34
陕西省中医药管理局中医药科研课题(No.13-ZY041)
*硕士研究生。研究方向:天然产物抗肿瘤研究。电话:029-84773998。E-mail:464970076@qq.com
主任药师。研究方向:天然产物的新药研发。电话:029-84776189。E-mail:wxjyh231@fmmu.edu.cn
(2016-01-03
2016-02-26)

