卡维地洛鼻用微乳凝胶的制备及性质考察
张爱武,张友智(武汉科技大学附属天佑医院,武汉 430064)
卡维地洛鼻用微乳凝胶的制备及性质考察
张爱武*,张友智#(武汉科技大学附属天佑医院,武汉430064)
目的:制备卡维地洛鼻用微乳凝胶,考察其性质。方法:通过溶解度和伪三元相图筛选微乳处方的表面活性剂、表面活性剂-助表面活性剂比例(Km)和油相;以胶凝温度、凝胶强度、pH、黏附力和外观筛选凝胶基质泊洛沙姆和卡波姆的用量。考察所制卡维地洛鼻用微乳凝胶的主药含量、体外释放度、凝胶稳定性和纤毛毒性。结果:微乳的乳化剂为聚山梨酯80,聚山梨酯80-二乙二醇单乙基醚的Km为1∶1,油相为油酸聚乙二醇甘油酯,凝胶基质为19%的泊洛沙姆和1%的卡波姆。所制卡维地洛鼻用微乳凝胶的胶凝温度为(33.4±0.4),凝胶强度为(37.5±1.2)s,pH为(5.71±0.03),黏附力为(64.4±0.5)mg/cm2,外观为白色透明状(n=5),主药含量为99.48%(n=3);8 h体外累积释放度为87.11%(n=5);离心、低温、高温、光照下的RSD均小于5%且无分层、破乳现象(n=3);纤毛毒性与生理盐水比较无差异,符合用药要求。结论:所制备的卡维地洛微乳凝胶剂具有性质稳定、纤毛毒性低、可生物黏附的特点,较片剂释放完全,符合鼻用制剂标准。
卡维地洛;微乳;伪三元相图;鼻用凝胶;体外释放度
卡维地洛(Carvedilol)是一种新型具有多种药理作用的抗高血压药,其是一种α、β-受体阻滞药,高浓度还有钙拮抗作用;但该药物难溶于水,半衰期较短,且有较大的首关效应,生物利用度较低[1-2]。目前,国内外上市的卡维地洛制剂,主要为片剂、胶囊等剂型,而这些剂型一般都被设计为等间隔、等剂量多次给药,频繁的给药次数导致体内血药浓度波动较大,而大多数高血压患者需要长期甚至终身服药,其长期波动的血药浓度会导致头晕、头痛、乏力及心动过缓等不良反应[3]。为了克服这些缺点,笔者研制了卡维地洛鼻用微乳凝胶,通过对卡维地洛进行微乳化后制备鼻用温敏凝胶,避免药物的首关效应,延长卡维地洛的半衰期,为卡维地洛的临床应用提供新的给药途径。
1 材料
1.1仪器
LC-10Atvp型高效液相色谱(HPLC)仪,包括SPD-10Avp紫外检测器、Class-vp型色谱工作站(日本岛津公司);3000HS型激光粒度分析仪(英国马尔文仪器有限公限);H27650型透射电子显微镜(日本Hitach公司);TDL80型高速离心机(上海市离心机厂研究所,离心半径:15 mm);TG-328型光学读数分析天平(湘仪天平仪器厂,感量:0.1 mg);超声波溶解仪(上海宁商超声仪器有限公司);ZRS-8G型智能溶出度测定仪(天津大学无线电厂)。
1.2药品与试剂
卡维地洛原料药(山东齐鲁制药有限公司,批号:20131026,纯度:99.6%);卡维地洛对照品(中国食品药品检定研究院,批号:100730-201001,纯度:99.5%);卡维地洛片(山东鲁抗辰欣药业有限公司,批号:20141120,规格:10 mg/片);聚甘油脂肪酸酯、单亚油酸甘油酯、油酸聚乙二醇甘油酯、辛酸癸酸聚乙二醇甘油酯、二乙二醇单乙基醚(plurol、maisine35-1、labrafil M-1944、labrasol、transcutol P,法国Gattefosse公司);油酸乙酯(中国医药集团上海化学试剂公司,批号:20130822,药用级);聚山梨酯80(天津基准化学试剂有限公司,批号:20130911,注射级);泊洛沙姆407(P407,德国BASF公司);卡波姆934(廊坊聚通化工有限公司,批号:20120723);甲醇、乙腈(美国SigmaAldrich公司,色谱纯);其余试剂均为分析纯。
1.3动物
中华大蟾蜍,体质量30~40 g,♂♀兼有,由湖北省实验动物研究中心提供,动物合格证号:SCXK(鄂)2010-0006。
2 方法与结果
本研究通过伪三元相图筛选合适的乳化剂,将卡维地洛制成微乳制剂,然后根据胶凝温度和凝胶强度选择适当的凝胶基质制成鼻用凝胶,并对鼻用凝胶进行含量测定、体外释放度和纤毛毒性实验评价。
2.1卡维地洛的含量测定
采用HPLC法测定卡维地洛的含量。色谱柱:大连依利特C18(250 mm×4.6 mm,5µm);流动相:甲醇-0.033 mol/L磷酸盐缓冲液(将4.59 g KH2PO4和0.619 g K2HPO4溶于1 000 ml蒸馏水中)-冰醋酸溶液(6∶4∶0.3);流速:1 ml/min;检测波长:241 nm;柱温:30;进样量:20 μl。在该色谱条件下,卡维地洛的质量浓度(c)对峰面积(A)的回归方程为A=12 569c+9 860.7(r=0.999 5),质量浓度的线性范围为1.0~100.0 μg/ml。按相关方法[4]进行检测,高、中、低质量浓度的回收率分别为98.51%、99.23%、99.33%,RSD分别为2.05%、1.75%、1.94%(n=3);卡维地洛溶液在室温放置24h内稳定(RSD=1.91%,n=3)。
2.2不同溶剂对卡维地洛溶解度的影响
比较卡维地洛在不同溶剂中的溶解度。将足量的卡维地洛分别加入1 ml不同溶剂的试管中,溶剂分别为油酸乙酯、plurol、maisine35-1、labrafil M-1944、聚山梨酯80、labrasol、transcutol P,密封后将试管于50水浴中振摇24 h。然后将混合物于4 000 r/min(离心半径15 mm)离心10 min,吸取0.5 ml上清液,用甲醇稀释100倍,采用HPLC法测定卡维地洛的含量,计算溶解度。结果,上述溶剂中卡维地洛的溶解度分别为8.55、15.71、24.38、42.36、53.04、125.17、288.35 mg/ml,可见卡维地洛在transcutol P中的溶解度最大。
2.3微乳处方的筛选
根据“2.2”项下结果,以transcutol P作为微乳的助表面活性剂(COSA),以maisine35-1、labrafil M-1944、油酸乙酯为油相,以聚山梨酯80和labrasol为表面活性剂(SA),以微乳面积(ME)的大小为指标,采用伪三元相图[5]筛选卡维地洛微乳的SA、SA-COSA的比例(Km)、油相。
2.3.1SA的选择在具塞的三角烧瓶中,将聚山梨酯80或labrasol与一定量的油相labrafil M-1944混合均匀,使成为混合液,在不断振摇下逐滴加入蒸馏水,同时不停振摇使各组分混合均匀,记下系统的状态变化情况(由清至浊或由浊至清),记录临界点时水的质量数,把相应的点(各组分百分比)绘制在伪三元相图上,曲线的阴影部分为ME。结果显示,以聚山梨酯80为SA时所形成的ME较labrasol大,因此选用聚山梨酯80作为微乳的SA。不同SA的伪三元相图见图1。
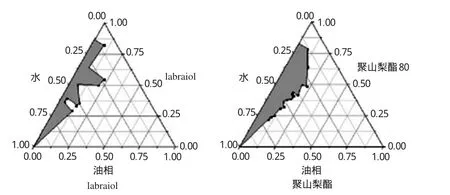
图1 不同SA的伪三元相图Fig 1 The pseudo-ternary phase diagram of different SA
2.3.2Km的确定以聚山梨酯80为SA,以transcutol P为COSA,以Km分别为1∶2、1∶1、2∶1的比例混合,同“2.3.1”项下方法绘制伪三元相图。结果显示,当Km为1∶1时所形成的ME最大,因此确定Km为1∶1。不同Km的伪三元相图见图2。

图2 不同Km的伪三元相图Fig 2 The pseudo-ternary phase diagram of different Km
2.3.3油相的选择分别以maisine35-1、labrafil M-1944、油酸乙酯为油相,同“2.3.1”项下方法绘制伪三元相图。结果显示,以labrafil M-1944为油相所形成的ME最大,因此选用labrafil M-1944作为油相。不同油相的伪三元相图见图3。
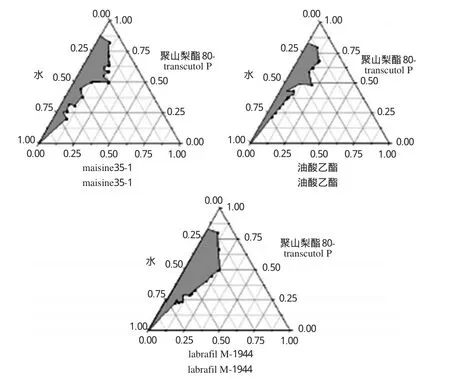
图3 不同油相的伪三元相图Fig 3 The pseudo-ternary phase diagram of different oil phase
2.4卡维地洛微乳的制备
根据“2.3”项下结果,将5.0 g卡维地洛溶于适量labrafil M-1944中作为油相,然后将混合乳化剂(聚山梨酯80-transcutol P之比为1∶1)加入到油相中,涡旋均匀,缓慢加水到混合油相中,油、乳、水三者比例为2∶4∶4,最后使成100 ml。形成的乳剂外观半透明,具白色乳光。
2.5卡维地洛微乳的质量评价
2.5.1外观形态[6]将载有支持膜的铜网置于腊板上,在膜上分别滴加卡维地洛微乳液各1滴,自然晾干30 min,再滴加2%磷钨酸1滴,自然晾干10 min,用滤纸吸去多余的液体,置于透射电子显微镜下观察。结果显示,卡维地洛微乳的外观圆整,粒径分布均匀。卡维地洛微乳的透射电子显微镜图见图4。
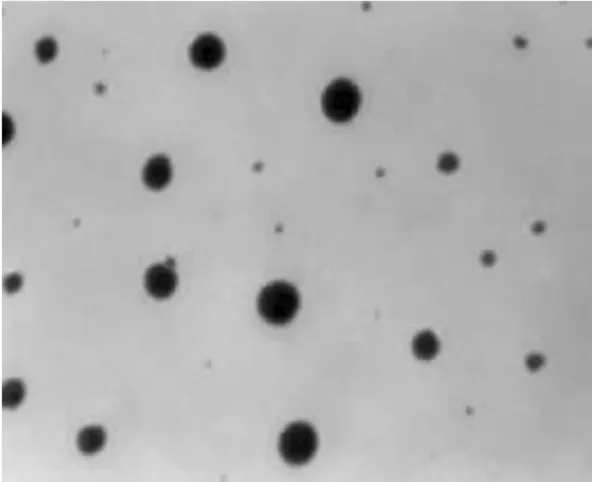
图4 卡维地洛微乳的透射电子显微镜图(×55000)Fig 4 Transmission electron micrograph of Carvedilol microemulsion(×55000)
2.5.2粒径及Zeta电位的测定采用激光粒度分析仪分别测定卡维地洛微乳的粒径分布和Zeta电位。结果,卡维地洛微乳的平均粒径为(60.3±10.8)nm,Zeta电位为(-1.63±0.02)mV(n=9),表明所制得卡维地洛微乳的粒径较小、带负电荷量较大,利于微乳的稳定和保存。
2.5.3稳定性考察将卡维地洛微乳于12 000 r/min(离心半径15 mm)离心20 min,与离心前微乳相比无明显差异,体系不分层、无沉淀、均匀半透明,表明卡维地洛微乳稳定性较好。
2.6载药鼻用微乳凝胶的制备
2.6.1基质种类及用量选择鼻用凝胶目前以温敏型凝胶基质材料采用得最多,常见的有泊洛沙姆、卡波姆、壳聚糖、纤维素等。参考相关文献[7],本研究以不同质量分数的P407和卡波姆组成不同鼻用凝胶处方,以胶凝温度(29~33)[6]及凝胶强度(<40 s)作为筛选标准,筛选基质用量,基质配方组成和结果见表1。

表1 鼻用凝胶基质处方组成和结果(n=5)Tab 1 The dosage screening results of nasal gel matix(n=5)
由表1可知,配方3、4、5、6的胶凝温度和凝胶强度在合适范围内,考虑鼻腔内温度为32~34[8]。结合胶凝温度和凝胶强度的数据,选用配方3、4作为适宜配方作进一步优化研究。
2.6.2载药鼻用微乳凝胶的制备与处方优化称取0.5 g、1.0 g卡波姆分别加入至10.0 g卡维地洛微乳中放置24 h使其充分溶胀,将混合物冷却至4,然后缓慢加入不同量的P407,边加边搅拌,加蒸馏水至100 g;将混合物放置于4过夜,得乳白色黏液,即得2组配方的卡维地洛鼻用微乳凝胶。然后考察2组配方鼻用微乳凝胶的pH、胶凝温度、凝胶强度、黏附力和外观,进一步优化处方,结果见表2。
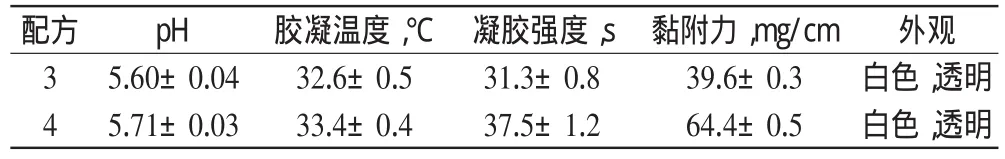
表2 不同配方卡维地洛鼻用微乳凝胶的理化性质(x ±s,n=5)Tab 2 Physicochemical property of Carvedilol microemulsion-based nasal gels with different formula(x ±s,n=5)
鼻用微乳凝胶不仅需要具有适宜的胶凝温度,使其能在人体生理温度内发生相转变,而且应具有合适的黏附力(50~100 mg/cm2),过低易从鼻黏膜上脱落,过高则易造成鼻黏膜的损伤[9]。由表2可知,综合考虑各项指标,以配方4为最适宜配比,因此选用配方4制成卡维地洛鼻用微乳凝胶进行含量测定、体外释放度、稳定性和纤毛毒性实验。
2.7鼻用微乳凝胶性质考察
2.7.1含量测定取自制的卡维地洛鼻用微乳凝胶3批,精密称取5.0 g(相当于卡维地洛25 mg),置于50 ml量瓶中,用甲醇适量破乳后加甲醇至刻度,摇匀过滤,精密量取续滤液3 ml至25 ml量瓶中,流动相稀释至刻度,按“2.1”项下色谱条件测定峰面积,以外标法分别计算3批样品中卡维地洛的含量。结果,卡维地洛平均含量分别为标示量的98.45%、100.31%、99.67%(n=3)。
2.7.2体外释放度测定取自制卡维地洛鼻用微乳凝胶和市售卡维地洛片,照溶出度测定法[2015年版《中国药典》(四部)溶出度与释放度测定法][10],分别以500 ml蒸馏水、pH 6.8磷酸盐缓冲液为溶出介质,转速为50 r/min,温度为37。分别于1、2、4、8、12、24 h取样2 ml,并补液2 ml,经0.22 μm微孔滤膜过滤。取续滤液20 μl注入HPLC仪进行分析,并计算累积释放度,结果见图5。

图5 卡维地洛鼻用微乳凝胶和片剂的体外释放曲线(n=5)Fig 5 Cumulative release curves in vitro of Carvedilol microemulsion-based nasal gels and Carvedilol tables(n=5)
由图5可知,鼻用微乳凝胶中卡维地洛快速均衡释放,在2 h后达到稳定状态,然后缓慢持续释放,8 h达到累积释放度87.11%,药物释放比较完全;而片剂中卡维地洛8 h累积释放度为59.13%,释放较慢且不规则,累积释放度较鼻用微乳凝胶小;但两者24h的累积释放度差异无统计学意义(P>0.1)。
2.7.3凝胶稳定性试验按照2015年版《中国药典》(四部)9001(原料药物与制剂稳定性试验指导原则)进行离心、低温、高温和光照试验。结果,卡维地洛鼻用微乳凝胶制剂稳定,无分层、破乳现象。
2.7.4纤毛毒性实验[11]采用在体蟾蜍上颚模型法考察卡维地洛鼻用微乳凝胶的纤毛毒性,以生理盐水作对照,结果见表3。

表3 卡维地洛鼻用微乳凝胶对蟾蜍纤毛运动时间的影响(n=6)Tab 3 Effects of Carvedilol microemulsion-based nasal gels on the duration of toad ciliary movement(n=6)
由表3可知,卡维地洛鼻用微乳凝胶的纤毛持续运动时间为生理盐水的96.0%,经统计分析,两组差异无统计学意义(P>0.05),说明卡维地洛鼻用微乳凝胶的纤毛毒性很低,作为鼻用制剂具有较好的安全性。
3 讨论
目前微乳凝胶多用于鼻黏膜给药[12]。乳剂型凝胶含有水、油、乳化剂和凝胶基质,当局部应用黏膜给药时,药物的药-时曲线下面积有很大提高[13]。本研究制备了具有一定黏附力和良好透过效果的卡维地洛鼻用微乳凝胶,兼具了微乳和凝胶两种剂型的优点。微乳中卡维地洛能快速释放,凝胶在鼻腔内原位凝胶化并迅速黏附于黏膜表面,延长了药物作用时间,提高了药物疗效。
温敏型鼻用凝胶是根据贮藏条件与鼻腔内温度差异而使高分子溶液发生“溶液-凝胶”的相转变过程,目前国内外常用的鼻用凝胶基质为泊洛沙姆,泊洛沙姆溶液具有反向胶凝的特性,当温度升高时可由溶液状态转变为凝胶状态。其机制是泊洛沙姆分子在水溶液中形成以疏水性PPO为内核,以亲水性PEO为外壳的球状胶束,当温度升高至胶凝温度时,胶束间相互缠结和堆积,从而形成半固体状的凝胶。本试验以P407为主要凝胶基质,辅以一定量的卡波姆,这是因为P407溶液的胶凝温度受聚氧乙烯/聚氧丙烯的比例、浓度等影响,在P407中加入一定浓度的卡波姆可以起到调节胶凝温度、凝胶强度和黏附力的作用[14],且卡波姆可增加药物的释放速率[15],提高生物利用度[16]。
鼻用微乳凝胶制剂不仅要在鼻腔温度下胶凝、吸附,而且要有一定的药物释放速度和释放时间,笔者从卡维地洛微乳的制备,鼻用微乳凝胶的基质筛选,胶凝温度、凝胶强度、凝胶黏附力和体外释放度的测定,最后确定了卡维地洛鼻用微乳凝胶的处方。所制备的凝胶各项指标均符合要求,为卡维地洛的临床应用开发了新的给药途径。
[1]周洁,蒋曙光,周建平.卡维地洛羟丙基-β-环糊精包合物的制备与评价[J].中国现代应用药学,2012,29(6):516.
[2]刘璠,丁秀婷.卡维地洛治疗高血压病的临床特点及应用研究进展[J].中国药业,2015,24(19):135.
[3]吴卫,周娜.卡维地洛缓释片的制备及其释放度考察[J].中南药学,2012,10(4):261.
[4] 国家药典委员会.中华人民共和国药典:二部[S].2015年版.北京:中国医药科技出版社,2015:193.
[5]李秀英,郑力,姜同英,等.姜黄素鼻用微乳凝胶剂的制备及性质考察[J].沈阳药科大学学报,2010,27(2):98.
[6]范永春,戴薇,李步阳.蟾蜍毒素微乳的制备及体外透皮吸收考察[J].中国实验方剂学杂志,2013,19(21):49.
[7]赵宇,王晓波,张治然,等.温敏凝胶的研究与进展[J].中国药房,2015,26(1):132.
[8]宋艳红,崔颖.盐酸文拉法辛温敏型原位凝胶的研制[J].西北药学杂志,2015,30(2):165.
[9]Mahajan HS,Shah SK,Surana SJ.Nasal in situ gel containing hydroxy propyl β-cyclodextrin inclusion complex of arthemeter:development and in vitro evaluation[J].J Incl Phenom Macrocycl Chem,2011,70(1):49.
[10]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:121.
[11] 姚娜,黄庆德,胡建萍,等.灯盏花素鼻用微乳凝胶剂的鼻纤毛毒性研究[J].中医临床研究,2014,6(16):19.
[12]姚娜,黄庆德.中药微乳凝胶剂的研究进展与应用[J].浙江中医药大学学报,2013,37(2):217.
[13]王曙东,刘文雅.凝胶剂的研究进展及应用概况[J].中国药业,2010,19(21):1.
[14]姚少毅,邱凯峰,廖华卫,等.盐酸美普他酚鼻用温敏型凝胶的制备及其体外释放度考察[J].中国药房,2010,21(37):3515.
[15]Liu Y,Zhu YY,Wei G,et al.Effect of carrageenan on poloxamer-based in situ gel for vaginal use:improved in vitro and in vivo sustained-release properties[J].Eur J Pharm Sci,2009,37(3/4):306.
[16]莫镇涛,方永奇.鼻腔给药的优势及影响因素[J].今日药学,2010,20(7):1.
(编辑:邹丽娟)
Preparation and Properties Study of Carvedilol Microemulsion-based Nasal Gels
ZHANG Aiwu,ZHANG Youzhi(The Affiliated Tianyou Hospital of Wuhan University of Science and Technology,Wuhan 430064,China)
OBJECTIVE:To prepare Carvedilol microemulsion-based nasal gels,and to investigate its properties.METHODS:The surfactant,the ratio of surfactant to cosurfactant(Km)and oil phase of microemulsion prescription were screened by using solubility and pseudo-ternary phase diagram.The amounts of gel matrix as poloxamer and carbomer were screened by using gelation temperature,gel strength,pH,adhesion and appearance.The nasal gels was inspected in respects of the content of main component,release rate in vitro,gel stability and the cilia toxicity.RESULTS:The emulsifier was tween-80;Kmof tween-80-diethylene glycol monoethyl ether was 1∶1;oil phase was labrafil M-1944;gel matrix were 19%poloxamer and 1%carbomer.The parameters of prepared nasal gel were as follows as gelation temperature of(33.4±0.4),gel strength of(37.5±1.2)s,pH of(5.71± 0.03),adhesion of(64.4±0.5)mg/cm2,white transparent appearance(n=5).The content of main component was 99.48%(n=3),and 8 h accumulative release rate in vitro was 87.11%(n=5).RSDs were all lower than 5%and no stratification or demulsification was found under the condition of centrifugation,low temperature,high temperature and light(n=3).There was no difference in cilia toxicity and normal saline,and they conformed to claim of drug use.CONCLUSIONS:Prepared Carvedilol microemulsion gels show the characteristics of quality stabilization,low cilia toxicity and biological adhensive.Prepared gels can be released completely compared to tablet and in line with the standard of nasal preparations.
Carvedilol;Microemulsion;Pseudo-ternary phase diagram;Nasal gel;Release degree in vitro
R943
A
1001-0408(2016)28-3992-04
10.6039/j.issn.1001-0408.2016.28.32
*主管护师。研究方向:合理用药。电话:027-51228526。E-mail:1095454743@qq.com
主任药师。研究方向:药物制剂。电话:027-51228443。E-mail:zyz_0525@sina.com
(2016-01-11
2016-04-18)

