复方葛丹胶囊的安全毒理学评价Δ
丁文宇,王志斌,丁丽娜,张宪党(山东省内分泌与代谢病研究所,济南 250062)
复方葛丹胶囊的安全毒理学评价Δ
丁文宇*,王志斌,丁丽娜,张宪党#(山东省内分泌与代谢病研究所,济南250062)
目的:对复方葛丹胶囊的安全毒理学进行评价。方法:根据最大耐受量(MTD)试验经口累计染毒20 g/kg,连续观察14 d,进行急性毒性实验。设置污染物致突变性实验(Ames实验)、小鼠骨髓嗜多染红细胞(PCE)微核实验、小鼠精子畸变实验,考察复方葛丹胶囊的遗传毒性。Ames实验采用鼠伤寒沙门氏菌组氨酸营养缺陷型TA97、TA98、TA100、TA102进行,采用平板掺入法,设复方葛丹胶囊剂量为8、40、200、1 000、5 000µg/皿,在加与不加S-9混合液条件下,统计各组回变菌落数;小鼠骨髓PCE微核实验取50只小鼠分为阴性对照组(蒸馏水)、阳性对照组(环磷酰胺40 mg/kg)和复方葛丹胶囊低、中、高剂量组(2.5、5.0、10.0 g/kg),每组10只,ig给药,末次给药6 h后计算微核细胞率及PCE与正染红细胞数比值;精子畸变实验取25只小鼠分组给药剂量同上,每天ig给药1次,连续5 d,35 d后统计精子畸变率。30 d喂养实验取80只大鼠随机分成阴性对照组和复方葛丹胶囊低、中、高剂量组(0.67、1.33、2.67 g/kg),ig给药,连续30 d,观察大鼠体质量增量、进食量、食物利用率、血常规等指标的变化。结果:雌雄两组小鼠经口MTD均大于20 g/kg;3项遗传毒性试验结果均为阴性;30 d喂养实验结果显示,喂养期间各组大鼠均未出现中毒症状,血液学、血液生化和病理组织学检查等各项指标均处于正常范围内,未有异常变化。结论:复方葛丹胶囊属于无毒级,不具有遗传毒性,大鼠30d喂养后未见明显毒性反应。
复方葛丹胶囊;急性毒性;遗传毒性;30d喂养实验;小鼠;大鼠
1 材料
1.1仪器
CX21生物显微镜(日本Olympus公司);CD3700血细胞分析仪(美国Abbott公司);7180全自动生化分析仪(日本Hitachi公司);全自动菌落计数器(西班牙IUL公司)。
1.2菌株、药品与试剂
组氨酸营养缺陷型鼠伤寒沙门氏菌TA97、TA98、TA100、TA102和S-9混合液均由中国疾病预防控制中心营养与食品安全所提供;复方葛丹胶囊(委托山东鲁信药业有限公司制备,批号:20101221,规格:0.4 g/粒);2-氨基芴(美国Sigma-Aldich公司,批号:14F-3451,纯度:98%);对二甲基氨基苯重氮磺酸钠(美国 Chem Service公司,批号:425-161B,纯度:98.8%);甲基磺酸甲酯(美国Acros Organics公司,批号:A016101301,纯度:99.0%);1,8-二羟基蒽醌(德国默克公司,批号:7238243,纯度:97.0%);环磷酰胺(江苏恒瑞医药股份有限公司,批号:10110633,纯度:99.0%);其余试剂均为分析纯。
1.3动物
断乳SD大鼠85只,SPF级,♀♂各半,体质量63~84 g;ICR小鼠95只,SPF级,♀(35只)、♂(60只)兼有,体质量18~22 g。动物均购自北京华阜康生物科技股份有限公司[许可证号:SCXK(京)2009~0004]。
考虑海上平台空间限制,结合水质分析与认识,设计采用CDFU+两级过滤器,并辅以水处理药剂的小型化生产水处理工艺,工艺流程如图3所示。
2 方法
2.1急性毒性实验
选20只小鼠(♀♂各半),按照最大耐受量(MTD)法进行实验,按不同性别分为2组。取复方葛丹胶囊用蒸馏水制成终质量浓度为0.50 g/ml的样品溶液,分3次ig给药,每次给药间隔时间为4 h,每次给药剂量为0.2 ml/10 g,累计染毒剂量为20.0 g/kg。实验前小鼠禁食不禁水16 h,称体质量;ig给药后记录小鼠的中毒表现及死亡情况,连续观察14d。
2.2遗传毒性实验
2.2.1Ames实验选用鉴定合格的组氨酸营养缺陷型鼠伤寒沙门氏菌TA97、TA98、TA100、TA102进行实验,采用平板掺入法,在加与不加S-9混合液的条件下进行。称取复方葛丹胶囊5.00 g,以蒸馏水作溶剂,定容至100 ml量瓶中,用蒸汽消毒器灭菌20 min,冷却后取出,4℃条件下保存。实验设立自发回变组、溶剂对照组、复方葛丹胶囊组和阳性对照组,每个剂量平行做3个平皿。复方葛丹胶囊组分别加入质量浓度为50 000、10 000、2 000、400、80µg/ml的样品溶液,每皿加入0.1 ml,即给药量为5 000、1 000、200、40、8µg/皿。阳性对照组所用阳性药物为对二甲基氨基苯重氮磺酸钠(500 μg/ml)、2-氨基芴(100µg/ml)、甲基磺酸甲酯(5 μl/ml)和1,8-二羟基蒽醌(500 μg/ml),所用溶剂均为二甲基亚砜,使用时每皿加入0.1 ml。融化顶层琼脂培养基,依次加入测试菌株新鲜增菌液0.1 ml、复方葛丹胶囊溶液0.1 ml(活化时加入S-9混合液0.5 ml),混匀,迅速倾入底层培养基上,转动平皿使顶层培养基均匀分布在底层上,固化,37℃培养48 h。观察结果,计算每皿的回变菌落数。若回变菌落数为自发回变菌落数的2倍以上,并具有剂量-反应关系,则判定为阳性结果。相同条件下实验重复2次。
2.2.2小鼠骨髓PCE微核实验选50只小鼠,随机分成5组,包括染毒剂量为2.5、5.0、10.0 g/kg(分别为1/8、1/4和1/2半数致死量,下同)的实验组,蒸馏水阴性对照组和环磷酰胺阳性对照组(40 mg/kg),每组10只(♀♂各半)。制备含复方葛丹胶囊样品终质量浓度为0.125、0.250、0.500 g/ml的样品溶液,ig给药,给药量为0.2 ml/10 g,共给药2次,给药间隔为24 h。末次给药6 h后处死小鼠,取胸骨骨髓,经小牛血清稀释后涂片,经甲醇固定和吉姆萨染色液染色。每只小鼠镜检1 000个PCE,记录微核细胞数,计算微核细胞率。同时观察200个PCE,计数观察到的正染红细胞(NCE)数目,并计算PCE/NCE比值。
2.2.3小鼠精子畸变实验选25只小鼠(♂)随机分成5组,每组5只。实验设染毒剂量分别为2.5、5.0、10.0 g/kg的实验组,蒸馏水阴性对照组和环磷酰胺阳性对照组(40 mg/kg)。制备含复方葛丹胶囊样品终质量浓度分别为0.125、0.250、0.500 g/ml的样品溶液,ig给药,给药量为0.2 ml/10 g,每天1次,持续5 d。首次给药后第35天,取小鼠双侧附睾尾、制片、伊红染色。每只小鼠计数1 000个结构完整的精子,记录畸变类型和数量,计算精子畸变率。
2.330d喂养实验
2.3.1喂养及取材选80只大鼠(♀♂各半)随机分成4组,每组20只。设置复方葛丹胶囊低、中、高剂量组(0.67、1.33、2.67 g/kg,分别为人体推荐用量的25、50、100倍剂量)和蒸馏水阴性对照组,每天ig给药1次,持续30 d。每周称1次体质量,称2次食物剩余量和撒食量,计算每周摄食量与体质量增量的比值(即食物利用率)。实验第31天禁食16 h后,称取动物体质量(供测定计算肝、脾、肾、睾丸等脏器系数)后,经腹主动脉取血,进行血液学和生化指标的测定,解剖动物并取各脏器组织。
2.3.2血液学和生化指标的测定血液学测定采用乙二胺四乙酸二钾(EDTA-K2)抗凝血,测定指标包括血红蛋白、红细胞计数、白细胞总数及其分类等。血液生化学测定采用血清,测定指标包括丙氨酸转氨酶、天冬氨酸转氨酶、尿素、肌酐、胆固醇、三酰甘油、血糖、总蛋白和白蛋白,并计算白蛋白和球蛋白比值。
2.3.3脏器系数实验结束时对所有大鼠脏器进行大体检查;称定脏器质量,根据脏器质量和禁食后的动物体质量之比,计算各脏器的脏器系数。将肝、脾、肾、胃、肠、睾丸、卵巢等脏器固定保存,进行组织病理学检查。
2.4统计学方法
3 结果
3.1急性毒性实验结果
结果显示,复方葛丹胶囊累计染毒剂量为20.0 g/kg时♀♂2组小鼠饮食、活动均处于正常状态,体质量正常,表明复方葛丹胶囊对小鼠生长没有影响。且小鼠未见明显中毒症状,14 d内未出现死亡情况,表明复方葛丹胶囊对两种性别小鼠的MTD均大于20 g/kg。根据急性毒性分级标准,复方葛丹胶囊属于无毒级。
3.2遗传毒性实验结果
3.2.1Ames实验2次实验结果表明,复方葛丹胶囊各剂量组回变菌落数均未超过自发回变菌落数的2倍,不具有剂量-反应关系,试验结果为阴性。这表明在加与不加S-9溶液时复方葛丹胶囊样品对组氨酸营养缺陷型鼠伤寒沙门氏菌TA97、TA98、TA100、TA102等4株实验菌株均未见有致基因突变的作用,未呈现出遗传毒性,结果详见表1、表2。
表1 第1次Ames实验结果(±s,n=3)Tab 1 Results of the firstAmes tes(t±s,n=3)
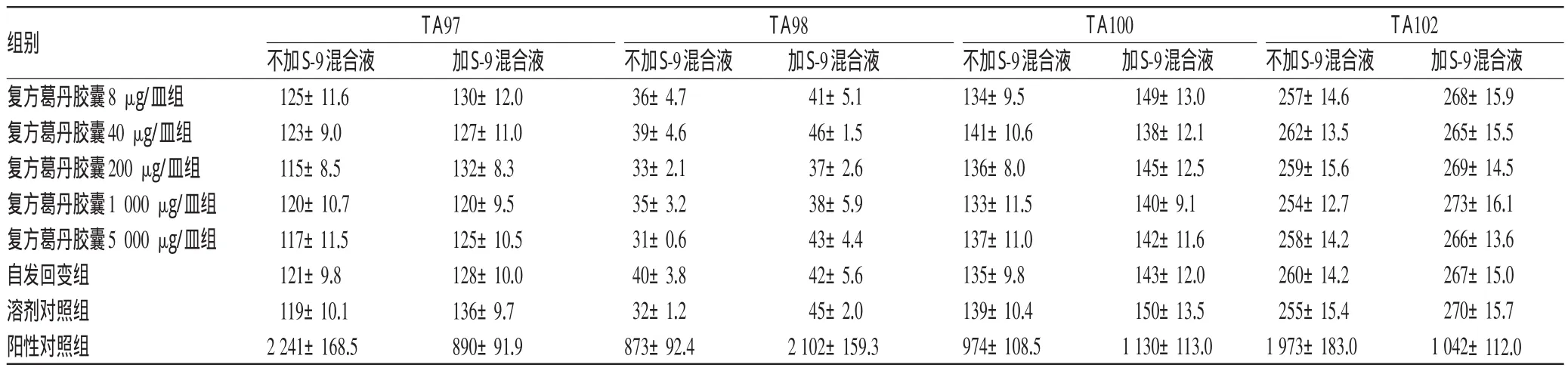
表1 第1次Ames实验结果(±s,n=3)Tab 1 Results of the firstAmes tes(t±s,n=3)
组别复方葛丹胶囊8 μg/皿组复方葛丹胶囊40 μg/皿组复方葛丹胶囊200 μg/皿组复方葛丹胶囊1 000 μg/皿组复方葛丹胶囊5 000 μg/皿组自发回变组溶剂对照组阳性对照组TA97TA98TA100TA102不加S-9混合液125±11.6 123±9.0 115±8.5 120±10.7 117±11.5 121±9.8 119±10.1 2 241±168.5加S-9混合液130±12.0 127±11.0 132±8.3 120±9.5 125±10.5 128±10.0 136±9.7 890±91.9不加S-9混合液36±4.7 39±4.6 33±2.1 35±3.2 31±0.6 40±3.8 32±1.2 873±92.4加S-9混合液41±5.1 46±1.5 37±2.6 38±5.9 43±4.4 42±5.6 45±2.0 2 102±159.3不加S-9混合液134±9.5 141±10.6 136±8.0 133±11.5 137±11.0 135±9.8 139±10.4 974±108.5加S-9混合液149±13.0 138±12.1 145±12.5 140±9.1 142±11.6 143±12.0 150±13.5 1 130±113.0不加S-9混合液257±14.6 262±13.5 259±15.6 254±12.7 258±14.2 260±14.2 255±15.4 1 973±183.0加S-9混合液268±15.9 265±15.5 269±14.5 273±16.1 266±13.6 267±15.0 270±15.7 1 042±112.0
表2 第2次Ames实验结果(±s,n=3)Tab 2 Results of the secondAmes test(±s,n=3)

表2 第2次Ames实验结果(±s,n=3)Tab 2 Results of the secondAmes test(±s,n=3)
组别复方葛丹胶囊8 μg/皿组复方葛丹胶囊40 μg/皿组复方葛丹胶囊200 μg/皿组复方葛丹胶囊1 000 μg/皿组复方葛丹胶囊5 000 μg/皿组自发回变组溶剂对照组阳性对照组TA97TA98TA100TA102不加S-9混合液118±9.0 113±11.1 120±10.5 124±10.0 119±9.5 118±10.6 126±10.1 2 283±149.7加S-9混合液134±11.6 131±9.7 125±11.0 129±9.8 133±10.7 135±11.5 129±12.1 854±104.8不加S-9混合液33±2.1 38±4.0 32±1.2 42±4.2 35±3.2 34±2.6 39±5.6 896±120.5加S-9混合液41±5.0 36±3.6 44±3.8 37±5.1 40±4.6 43±3.5 45±3.1 2 173±143.3不加S-9混合液139±13.0 142±10.4 135±8.5 132±10.3 136±12.7 140±12.9 134±12.0 945±89.5加S-9混合液148±13.1 138±12.1 143±12.0 146±14.0 137±13.6 141±12.6 152±9.0 1 096±124.7不加S-9混合液261±13.5 256±14.1 263±14.6 260±15.0 253±14.0 257±14.5 264±15.6 1 954±181.4加S-9混合液265±16.0 271±15.4 267±15.7 262±16.4 270±14.2 273±15.5 269±13.0 1 082±104.1
3.2.2小鼠骨髓PCE微核实验当小鼠性别为♂时,阴性对照组小鼠的PCE/NCE比值约为1.39,实验组小鼠的比值约在1.37~1.39之间;当小鼠性别为♀时,阴性对照组小鼠的PCE/ NCE比值约为1.37,实验组小鼠的比值约在1.36~1.39之间。各剂量组不同性别小鼠PCE/NCE比值均不低于阴性对照组的20%,说明复方葛丹胶囊对骨髓细胞没有产生细胞毒性。复方葛丹胶囊各剂量组小鼠微核细胞率与阴性对照组比较差异无统计学意义(P>0.05),而环磷酰胺阳性对照组与阴性对照组比较差异有统计学意义(P<0.01),表明复方葛丹胶囊在本实验剂量条件下无致小鼠骨髓PCE微核作用,未呈现遗传毒性,结果详见表3。
表3 各组小鼠骨髓PCE微核实验结果(±s)Tab 3 Results of marrow polychromatic erythrocytes of mice in each group(±s)

表3 各组小鼠骨髓PCE微核实验结果(±s)Tab 3 Results of marrow polychromatic erythrocytes of mice in each group(±s)
注:与阴性对照组比较,*P<0.01Note:vs.negative control group,*P<0.01
PCE/NCE 1.37±0.27 1.39±0.22 1.37±0.27 1.39±0.25 1.19±0.25 1.39±0.26 1.36±0.25 1.37±0.26 1.37±0.24 1.22±0.22性别♂动物只数♀组别复方葛丹胶囊低剂量组复方葛丹胶囊中剂量组复方葛丹胶囊高剂量组阴性对照组阳性对照组复方葛丹胶囊低剂量组复方葛丹胶囊中剂量组复方葛丹胶囊高剂量组阴性对照组阳性对照组5 5 5 5 5 5 5 5 5 5检查细胞个数5×1 000 5×1 000 5×1000 5×1000 5×1000 5×1000 5×1000 5×1000 5×1000 5×1000微核细胞个数9 10 10 11 134 9 11 10 9 130微核细胞率,‰1.8±0.45 2.0±0.71 2.0±1.00 2.2±0.84 26.8±4.32*1.8±0.84 2.2±0.84 2.0±1.22 1.8±1.48 26.0±5.83*
3.2.3小鼠精子畸变实验复方葛丹胶囊各剂量组小鼠精子畸变率分别约为2.14%、2.40%、2.50%,与阴性对照组的精子畸变率2.34%比较差异无统计学意义(P>0.05);环磷酰胺阳性对照组的精子畸变率约为6.84%,与阴性对照组比较差异有统计学意义(P<0.01)。实验结果表明,复方葛丹胶囊未对小鼠精子畸变发生率产生明显影响,无致小鼠精子畸变作用,未呈现遗传毒性,结果详见表4。
表4 各组小鼠精子畸变实验结果(±s)Tab 4 Results of sperm abnormality test of mice in each group(±s)

表4 各组小鼠精子畸变实验结果(±s)Tab 4 Results of sperm abnormality test of mice in each group(±s)
注:与阴性对照组比较,*P<0.01Note:vs.negative control group,*P<0.01
2.34±0.33 6.84±0.65*组别复方葛丹胶囊低剂量组复方葛丹胶囊中剂量组复方葛丹胶囊高剂量组阴性对照组阳性对照组动物只数 胖头 双头双尾尾折叠 畸变率,% 5 5 5 5 5受检精子个数5×1 000畸变精子个数无钩14香蕉型12无定型73总数1072.14±0.21 5×1 000139891202.40±0.32 5×1 0001614851252.50±0.24 5×1 000 5×1 000 13 54 11 65 7 9 8 9 5 0 82 154 0 0 1 1 6 1 0 1 1 8 0 0 0 0 5 117 342
3.330d喂养实验结果
3.3.1一般情况30 d喂养实验周期内各剂量组大鼠总体生长状况良好,未出现中毒体征或死亡情况。复方葛丹胶囊各剂量组大鼠体质量增量、总进食量、总食物利用率与阴性对照组比较差异均无统计学意义(P>0.05),且均在正常值范围内,表明复方葛丹胶囊对大鼠体质量、进食量、食物利用率未发生显著影响,结果详见表5。
表5 各组大鼠一般情况测定结果(±s,n=20)Tab 5 Results of general situation of rats in each group(± s,n=20)
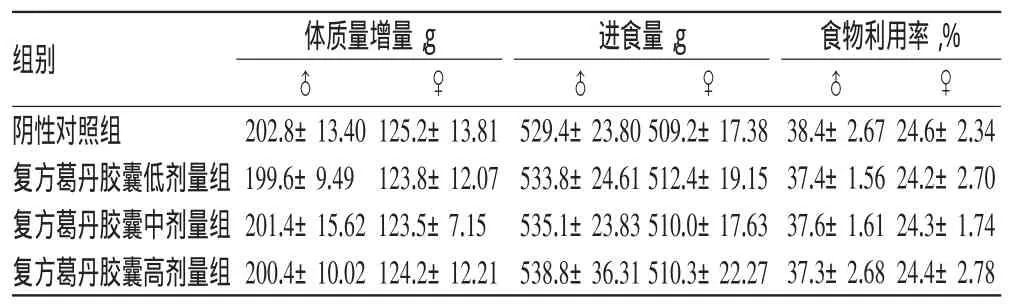
表5 各组大鼠一般情况测定结果(±s,n=20)Tab 5 Results of general situation of rats in each group(± s,n=20)
?
3.3.2血液学指标测定复方葛丹胶囊各剂量组大鼠血液白细胞数目、红细胞数目及血红蛋白水平等血液学指标均处于正常值范围内,且与阴性对照组比较差异均无统计学意义(P>0.05),表明复方葛丹胶囊对大鼠血液学指标未产生明显影响。结果详见表6。
表6 各组大鼠血液流变学测定结果(±s,n=20)Tab 6 Results of hemorheology test of rats in each group(±s,n=20)

表6 各组大鼠血液流变学测定结果(±s,n=20)Tab 6 Results of hemorheology test of rats in each group(±s,n=20)
组别阴性对照组复方葛丹胶囊低剂量组复方葛丹胶囊中剂量组复方葛丹胶囊高剂量组血红蛋白,g/L♂143.0±2.3 137.9±3.5 142.7±4.7 140.3±9.4♀♀♀140.6±5.0 142.4±5.8 137.7±7.8 138.1±6.2红细胞计数,×1012L-1♂6.85±0.22 6.63±0.24 6.76±0.24 6.58±0.45 6.83±0.25 6.91±0.38 6.78±0.38 6.82±0.47白细胞计数,×109L-1♂16.5±3.8 16.2±3.6 16.0±2.8 15.6±3.8 10.8±2.8 11.9±3.9 10.6±2.3 12.3±3.4
3.3.3血液生化学指标复方葛丹胶囊各剂量组大鼠丙氨酸转氨酶、天冬氨酸转氨酶、尿素、肌酐及总胆固醇等血液生化学指标均处于正常值范围内,除雌性大鼠肌酐水平外,其余各组大鼠上述指标与对阴性照组比较差异均无统计学意义(P>0.05),表明复方葛丹胶囊对大鼠血液生化学未产生明显影响,结果详见表7。
表7 各组大鼠血液生化指标检测结果(±s,n=20)Tab 7 Results of blood biochemical indexes of rats in each group(±s,n=20)

表7 各组大鼠血液生化指标检测结果(±s,n=20)Tab 7 Results of blood biochemical indexes of rats in each group(±s,n=20)
注:与阴性对照组比较,*P<0.05Note:vs.negative control group,*P<0.05
性别♂♀组别阴性对照组复方葛丹胶囊低剂量组复方葛丹胶囊中剂量组复方葛丹胶囊高剂量组阴性对照组复方葛丹胶囊低剂量组复方葛丹胶囊中剂量组复方葛丹胶囊高剂量组丙氨酸转氨酶,U/L 59.4±9.7 63.6±11.0 63.0±12.5 64.7±12.7 58.9±10.9 62.4±12.4 59.9±7.2 60.3±12.6天冬氨酸转氨酶,U/L 163.6±9.7 167.2±22.9 165.8±17.4 168.0±23.4 161.0±20.9 176.4±15.3 151.1±25.8 172.9±31.9尿素氮,mmol/L 6.50±0.55 6.41±0.25 6.63±0.65 6.36±0.29 6.56±0.51 6.04±0.55 6.52±0.54 6.40±0.55肌酐,μmol/L 59.3±2.5 58.5±1.5 61.7±2.4 59.8±2.8 54.2±3.2 53.7±3.4 55.1±4.6 58.9±4.4*总胆固醇,mmol/L 1.34±0.24 1.32±0.17 1.24±0.25 1.26±0.20 1.26±0.27 1.24±0.21 1.21±0.09 1.22±0.24三酰甘油,mmol/L 0.67±0.11 0.70±0.12 0.68±0.09 0.72±0.12 0.62±0.06 0.62±0.10 0.66±0.06 0.63±0.06血糖,mmol/L 6.13±0.54 5.86±0.72 5.65±0.47 5.73±0.77 5.93±0.58 5.91±0.66 6.30±0.44 5.52±0.67总蛋白,g/L 61.0±1.5 59.7±0.9 59.5±1.8 60.6±1.9 61.0±1.3 60.8±1.4 60.9±1.3 60.2±1.9白蛋白,g/L 29.0±1.2 28.7±1.2 28.5±1.0 28.9±1.2 29.2±1.5 29.5±1.0 29.9±1.8 29.4±0.5白蛋白/球蛋白0.91±0.08 0.93±0.05 0.92±0.08 0.91±0.05 0.92±0.07 0.94±0.06 0.97±0.12 0.96±0.08
3.3.4脏器系数两种性别的实验组大鼠的肝、脾、肾、睾丸、卵巢等脏器的脏器系数均处于正常范围内,与阴性对照组比较差异均无统计学意义(P>0.05)。结果表明,复方葛丹胶囊对试验组大鼠的肝、脾、肾、睾丸、卵巢等脏器的质量和脏器系数等未产生显著影响,结果详见表8。
表8 各组大鼠重要脏器系数测定结果(±s,n=20)Tab 8 Results of key organ coefficient of rats in each group(±s,n=20)
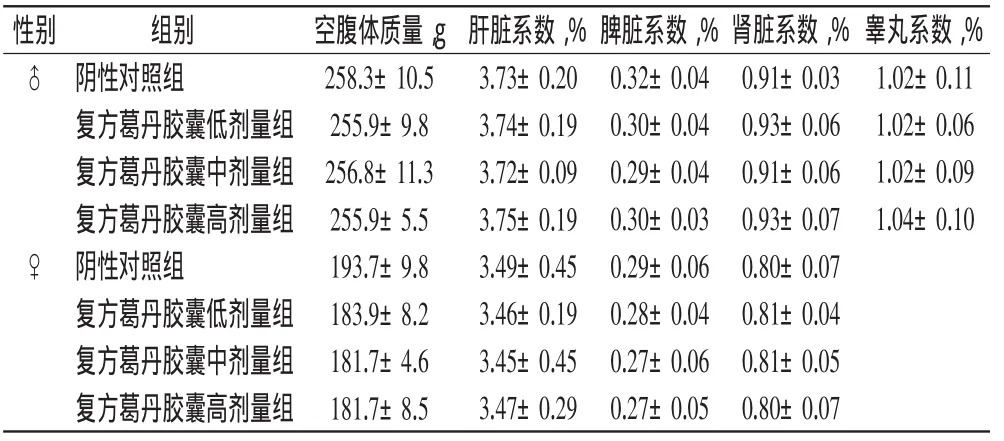
表8 各组大鼠重要脏器系数测定结果(±s,n=20)Tab 8 Results of key organ coefficient of rats in each group(±s,n=20)
性别睾丸系数,%组别 空腹体质量,g 肝脏系数,%脾脏系数,%肾脏系数,%
综上,30 d喂养实验期内各实验组大鼠生长发育良好,体质量增量、食物利用率、脏器系数、血液学和血液生化学指标均在正常值范围内;大体解剖及病理组织学检查中,各试验组大鼠被检脏器均未见有意义的病理改变。这提示复方葛丹胶囊对大鼠的生长、发育及健康状况均无显著影响,无潜在毒性。
4 讨论
糖尿病属于中医“消渴”范畴,传统认为其病机为阴津亏损,燥热偏胜,疾病本质是阴虚为本,燥热为标,属本虚标实[6]。本产品配方中,各方药配伍机理为:葛根,甘辛性凉,轻扬升散,具有发汗解表、解肌退热、透发麻疹之功效,常用于热病烦渴、阴虚消渴、热泄热痢、脾虚泄泻,在方中作为君药。丹参,性微寒而缓,具活血祛瘀、凉血活血、清热消痈止痛之功效,又善于通行血脉、祛瘀止痛,常用于血热瘀滞等各种瘀血病症,在方中作为臣药。葛根、丹参君臣相伍,可去燥热、消瘀阻、通脉络、畅气机。生地黄,清热凉血、养阴生津,性甘寒质润,能清热生津止渴,又因甘寒养阴、苦寒泄热,入肾经而滋阴降火,养阴津而泄伏热,常用于治疗阴虚内热之消渴证;黄芪健脾补中、升阳举陷、益卫固表、利尿、托毒生肌,为补中益气之要药,对脾虚不能布津之消渴,能补气生津,促进津液的生成与输布而有消渴之效;五味子收敛固涩、益气生津、补肾宁心,具有益气生津止渴之功,可用于治疗阴虚内热、口渴多饮之消渴证。三者合用,生地生津养阴,黄芪补中益气,五味子益气生津,均可治疗阴虚内热之消渴证,在方中为佐使药。方中各药相伍,生津养阴,活血祛瘀,解表退热,使诸证皆愈[7-9]。
由实验结果可知,复方葛丹胶囊对♀♂两种性别小鼠的MTD均大于20 g/kg,根据急性毒性分级标准,属于无毒级;遗传毒性实验(Ames实验、小鼠骨髓PCE微核实验、小鼠精子畸形实验)结果均为阴性,表明复方葛丹胶囊无致突变作用、无细胞毒性作用、对生殖细胞无致突变作用,不具有遗传毒性。复方葛丹胶囊30 d喂养实验结果显示,各剂量组大鼠均未出现异常症状,也无死亡情况发生,大鼠的体质量增量、总食物利用率、血常规、血生化指标、脏器系数、大体解剖及病理组织观察均在正常值范围内,未见特异性病变,表明复方葛丹胶囊对SD大鼠的生长、发育及健康状况均无显著影响,无潜在的毒性,可以长期服用。
综上所述,在本次实验剂量范围内复方葛丹胶囊安全无毒、无致基因突变作用、无细胞毒性作用、无遗传毒性、无潜在的毒性。本文安全毒理学试验评价的结果,为下一步开展复方葛丹胶囊的临床试验及应用奠定了基础。
[1]杨文超,顾正位,路其康,等.复方葛根片对糖尿病肾病模型大鼠肾组织的保护作用[J].中国药房,2015,26(34):4807.
[2]姚蓝,辛小红,姚雪梅,等.古今中医治疗糖尿病用药异同探析[J].中国实验方剂学杂志,2013,19(18):342.
[3]陈颜颜,谢雁鸣,黎元元.中医药治疗2型糖尿病处方规律的现代文献研究[J].中华中医药杂志,2015,30(11):4036.
[4]金汀龙,陈霞波.临床常用中药降糖作用研究进展[J].浙江中西医结合杂志,2015,25(5):526.
[5]罗毅,付玉山.中医治疗糖尿病用药规律及效果分析[J].现代医药卫生,2015,31(1):118.
[6] 周仲瑛.中医内科学[M].北京:中国中医药出版社,2003:429.
[7] 马晓霞,李廷保.基于数据挖掘治疗糖尿病的中药配伍体系研究[J].西部中医药,2015,28(3):100.
[8]郭东臣,张惠敏,梁淑新,等.中成药治疗2型糖尿病证治-方药的调查分析[J].中成药,2015,37(2):442.
[9]赵红霞,汪文来,贾海骅,等.单味中药防治糖尿病的现代研究探讨[J].中国医药导刊,2013,15(10):1692.
(编辑:林静)
Evaluation on Toxicological Security of Compound Gedan Capsule
DING Wenyu,WANG Zhibin,DING Lina,ZHANG Xiandang(Shandong Institute of Endocrine and Metabolic Diseases,Jinan 250062,China)
OBJECTIVE:To evaluate the toxicological security of Compound gedan capsule.METHODS:According to maximal tolerance dose(MTD)test,mice were orally treated with Compound gedan capsule at the dose of 20 g/kg for 14 days in the acute toxicity test.Ames test,marrow polychromatic erythrocytes(PCE)micronucleus test and mice sperm abnormality test were set up to investigate the inherent toxicity of Compound gedan capsule.In Ames test,the number of revertant colonies was recorded after Bacillus breslaviensis histidine auxotrophy TA97,TA98,TA100 and TA102 were treated with Compound gedan capsule at 8,40,200,1 000,5 000 μg/plate combined with or without S-9 suspension.In marrow PCE micronucleus test,50 mice were divided into negative control group(distilled water),positive control group(cyclophosphamide 40 mg/kg)and Compound gedan capsule low-dose,medium-dose and high-dose groups(2.5,5.0,10.0 g/kg)with 10 mice in each group;they were given relevant medicine intragastrically;the rate of micronucleus cell,the ratio of PCE to normochromatic erythrocyte were calculated 6 h after last administration.In mice sperm abnormality test,25 mice were grouped and treated with relevant medicine(same dose as above)intragastrically once a day,for consecutive 5 d;the rate of sperm abnormality was calculated 35 days later.In thirty-days feeding study,80 rats were randomly divided into negative control group and Compound gedan capsule low-dose,medium-dose and highdose groups(0.67,1.33,2.67 g/kg);they were given relevant medicine intragastrically for consecutive 30 d.The changes of body weight,weight gain,food intake,food utilization and blood routine index were observed in rats.RESULTS:The oral MTD in both male and female mice were more than 20 g/kg.The results of three genetic toxicity tests were all negative.The thirty-days feeding study of rats demonstrated that no toxicity symptom was found,and the index of blood test,blood biochemical index test and histopathological examination were all within normal range;no abnormal change was found.CONCLUSIONS:Compound gedan capsule is atoxic and doesn’t show genetic toxicity.No obvious toxic reaction is found in thirty-days feeding study of rats.
Compound gedan capsule;Acute toxicity;Genetic toxicity;Thirty-days feeding study;Mice;Rats
R285
A
1001-0408(2016)28-3925-05
10.6039/j.issn.1001-0408.2016.28.11
山东省自主创新及成果转化专项(No.2015ZDZX05004);山东省医学科学院院级科技计划项目(No.2015-49)
*主治医师。研究方向:糖尿病营养健康与治疗。电话:0531-82595790。E-mail:18660129597@163.com
研究员,硕士。研究方向:中药治疗糖尿病机制研究及产品开发。电话:0531-82919799。E-mail:xiandangzh@163.com
(2016-01-11
2016-04-18)

