5种外来动物疫病并联荧光定量PCR检测方法的研 究
于恒智,刘 晔,程 玮,张旭东,苗富春,赵 丹,张守峰,刘芳伊,牛文博
(1. 锦州出入境检验检疫局,辽宁锦州 121013;2. 中国人民解放军军事医学科学院军事兽医研究所,吉林长春 130122; 3. 辽宁省农业经济学 校,辽宁锦州 121001)
技术支撑
5种外来动物疫病并联荧光定量PCR检测方法的研 究
于恒智1,刘晔2,程玮3,张旭东1,苗富春2,赵丹3,张守峰2,刘芳伊1,牛文博1
(1. 锦州出入境检验检疫局,辽宁锦州121013;2. 中国人民解放军军事医学科学院军事兽医研究所,吉林长春130122; 3. 辽宁省农业经济学 校,辽宁锦州121001)
根据 GenBank 中发表的相关病毒的基因序列,通过分析比较小反刍兽疫病毒(PPRV)、非洲猪瘟病毒(ASFV)、西尼罗河热病毒(WNV)、亨德拉病毒(HeV)和尼帕病毒(NiV)的保守区域(PPRV的N基因、ASFV的P72基因、HeV和NiV的H基因,以及WNV的PrM基因),各设计筛选出一套特异性引物和Taqman探针,建立了5种外来动物疫病并联荧光定量RT-PCR检测方法。利用该方法,对103份样本进行了临床检测,结果除阳性对照外,其他均为阴性。检测结果验证了本研究建立的Taqman模式并联荧光定量PCR检测方法具有鉴别诊断的特点,可以作为临床检测这5种病原体的参考方法。
外来动物疫病:小反刍兽疫病毒;非洲猪瘟病毒;西尼罗河热病毒;亨德拉病毒;尼帕病毒;荧光定量PCR
非洲猪瘟(African swine fever,ASF)、西尼罗河热(West Nile fever,WN)、尼帕病(Nipah)以及亨德拉病(Hendra)在我国境内均未发生过疫情,小反刍兽疫(peste des petits ruminants,PPR)近几年刚传入我国。这5种外来动物疫病在全球范围内属于烈性、易感染传染病,并且具有传播范围及宿主范围不断扩大的趋势。除ASF和PPR外,其他3种疫病均属于人兽共患传染病,不仅对动物,还对人类产生了威胁。非洲猪瘟病毒是非洲猪瘟病毒科、非洲猪瘟病毒属的唯一成员,是目前发现的唯一一种虫媒传播的DNA病毒,其宿主范围广,几乎能感染所有种类的猪,是目前世界范围对于养猪业危害最严重的病毒之一[1]。西尼罗河热病毒是黄病毒科、黄病毒属成员,与日本乙型脑炎病毒、圣路易脑炎病毒、墨累溪谷脑炎病毒等同属日本脑炎病毒复合群。西尼罗河热已先后在非洲、亚洲和欧洲的20多个国家或地区流行,每次流行都有人类死亡。2012年美国再次发生大规模的西尼罗河热流行,超过4 500人感染,183人死亡[2]。亨德拉病最早于1994年在的澳大利亚昆士兰布利斯班郊区的亨德拉镇被发现,当时有20匹赛马发病,13匹死亡,驯马师和养马员也被感染,次年9月驯马师死亡。尼帕病于1998年首次发现于马来西亚尼帕小镇,当时发现猪和人感染此病,人类的死亡率达40%,绝大多数患者为养猪场或屠宰场工人。亨德拉病毒和尼帕病毒同属于副黏病毒科、副黏病毒亚科、亨尼帕病毒属成员,被称为新发烈性人兽共患传染病。小反刍兽疫病毒最早于1945年发现于西非的法国殖民地象牙海岸科特迪瓦,感染后的发病率可达100%,严重暴发期致死率可高达100%[3]。小反刍兽疫病毒是副黏病毒科、麻疹病毒属,因对小反刍危害巨大而引起全球重视。
本研究通过GenBank中登录的相关病毒的序列,经过对比,筛选出保守序列进行人工合成,将合成序列插入到pUC57中构成重组质粒,以此作为荧光定量PCR的模板,使用Primer Express 3.0软件设计引物和Taqman探针,并采用简并碱基提高检测范围,建立了这5种病原Taqman模式的并联荧光定量PCR方法。
1 材料与方法
1.1 材料
rTaq及琼脂糖购自TaKaRa;37 ℃恒温细菌摇床购自上海天呈实验仪器制造有限公司;小提质粒试剂盒购自爱思进生物技术有限公司;台式离心机购自德国SIGMA公司;小型低速离心机购自北京百晶生物科技有限公司;荧光定量PCR仪购自美国ABI公司。
Amp+抗性的LB液体培养基:Tryptone 10 g、Yeast Extract 5 g、NaCl 10 g,加入800 mL去离子水充分搅拌溶解,滴加5 N NaOH,调节pH至7.0后,定容至1 L,然后高温高压灭菌,冷却至室温后,加入1 mL Amp+(100 mg/mL)混合均匀后分装,4 ℃保存。
1.2 方法
1.2.1 病毒基因序列的比对与合成。根据GeneBank中登录的小反刍兽疫病毒(PPRV)、非洲猪瘟病毒(ASFV)、西尼罗河热病毒(WNV)、亨德拉病毒(HeV)及尼帕病毒(NiV)的基因序列,选择各自保守的基因序列(PPRV的N蛋白部分基因序列、ASFV P72蛋白部分基因序列、NiV及HeV 的H蛋白部分基因序列和WNV PrM蛋白部分基因序列)由南京进瑞斯生物科技有限公司合成,合成序列大小在350~550 bp之间(表1)。
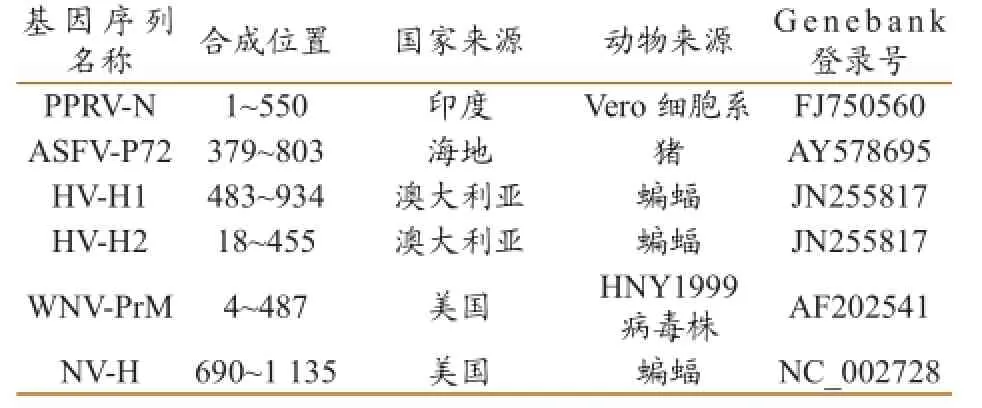
表1 5种主要外来病病毒基因序列合成明细
1.2.2 引物及探针的设计与合成。利用Primer Express 3.0软件,针对各合成基因片段,设计相应的引物及Taqman探针;选择Tm值相近且较好的引物和Taqman探针,根据GenBank中登录的各病毒相关序列比对结果,将有差异的序列用简并碱基替代,以设计针对多数病毒株的引物和Taqman探针。每条引物和Taqman探针中最多含有3个简并碱基,Taqman探针的5' 端标记荧光报告基团6-羧基荧光素(6-carboxyfl uorescein,FAM),3' 端标记荧光淬灭基团6-羧基四甲基诺丹明(6-carboxy-N,N,N',N'-tetramethylrhodamine,TAMRA)。将设计完成的引物和Taqman探针送生物公司进行合成(表2)。
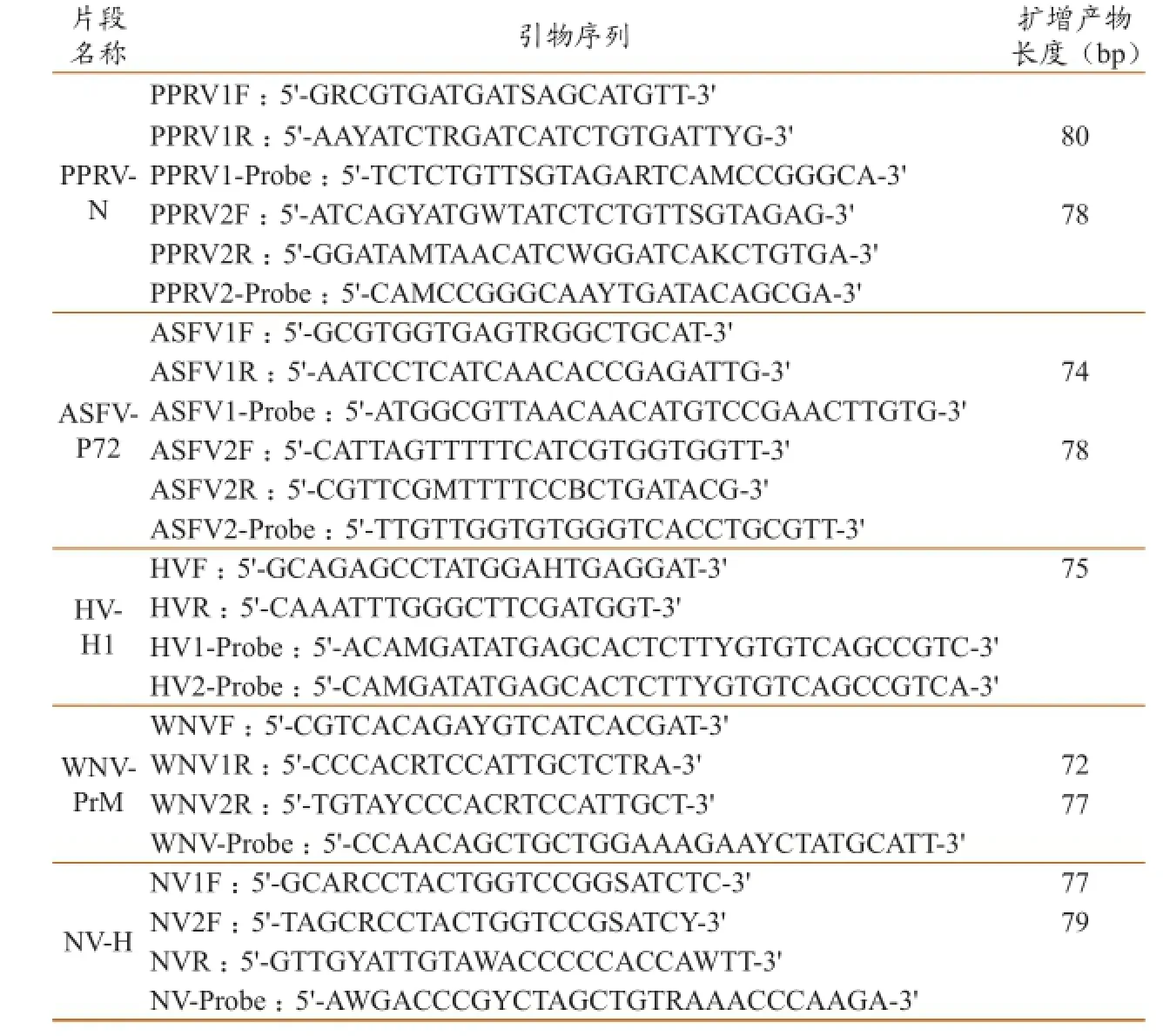
表2 5种主要外来病病毒相关基因引物及Taqman探针
1.2.3 Taqman模式的并联荧光定量PCR条件的优化。根据引物的Tm值调节退火温度,并对退火时间、循环次数、引物及探针的量、模板的量、PCR体系和循环方式进行优化,选择扩增效果最佳的方法进行下一步试验。
1.2.4 Taqman模式的并联荧光定量PCR标准曲线的制作。使用重组质粒作为标准品制作标准曲线。对标准品进行1 0倍的倍比稀释,以对应浓度100~10-4ng/μL的重组质粒标准品作为模板,进行Taqman模式的并联荧光定量PCR试验。其中每个标准品稀释度6个重复。以Cq值为y轴,标准品的稀释度为x轴,制作标准曲线,计算标准曲线的斜率和反应相关系数。
1.2.5 鉴别诊断试验。小反刍兽疫病毒属副黏病毒科成员,故选择犬瘟热病毒、鸡新城疫病毒来检测引物及Taqman探针的特异性;同理,非洲猪瘟病毒选择典型猪瘟病毒、猪圆环病毒、猪蓝耳病病毒,尼帕病毒和亨德拉病毒以及西尼罗病毒选择蝙蝠病毒,进行相关引物和Taqman探针的特异性检测。
1.2.6 灵敏度试验。将人工合成的小反刍兽疫病毒、非洲猪瘟病毒、亨德拉病毒、尼帕病毒以及西尼罗病毒的相关基因所在的质粒作为模板,并对其进行10倍的倍比稀释,使其浓度分别为100 ng/μL、10 ng/μL、1 ng/ μL、10-1ng/μL、10-2ng/μL、10-3ng/ μL、10-4ng/μL。在相同条件下对不同浓度的模板量进行荧光定量PCR,观察并分析结果。
1.2.7 稳定性和重复性试验。分别对这5种病毒合成基因的Taqman模式的并联荧光定量PCR进行组间及组内的重复性试验。组间试验为分别于1个月、2个月和3个月,从同一管样品中取出模板,进行Taqman模式的并联荧光定量PCR;组内试验是每次进行Taqman模式的并联荧光定量PCR时,每个样品进行6个重复,观察并分析结果。
1.2.8 检测方法的初步应用。从吉林通化、江西等地采集45份食虫蝙蝠样品进行西尼罗河病毒、亨德拉病毒及尼帕病毒检测;从吉林、广东广州等地采集38份猪样品进行非洲猪瘟病毒检测;从河北收集20份绵羊和山羊分泌物病料进行小反刍兽疫病毒检测。
2 结果
2.1 并联荧光定量PCR条件优化结果
为获得引物和Taqman探针的最佳扩增效果和最高敏感性,对扩增的条件进行了摸索和调整,最终确定了本试验的扩增体系为rTaq 10 μL,模板1 μL,上、下游引物各1 μL,Taqman探针0.5 μL,4dH2O 6.5 μL,总体系20 μL。最佳扩增条件为94 ℃ 5 min;94 ℃ 20 s,52 ℃ 30 s,72 ℃ 15 s,40个循环。
2.2 标准曲线的制作
以100~10-4ng/μL的重组质粒标准品作为模板,进行Taqman模式的并联荧光定量PCR试验。其中每个标准品稀释度6个重复。以Cq值为y轴,标准品的稀释度为x轴,制作标准曲线。ASFV标准曲线的斜率为-3.800,反应的相关系数为0.947,计算公式为Y= -3.800X+0.947(图1);HeV标准曲线的斜率为-2.968,反应的相关系数为0.964,计算公式为Y=-2.968X+0.964(图2);NiV标准曲线的斜率为-2.489,反应的相关系数为0.809,计算公式为Y= -2.489X+0.809(图3);PPRV标准曲线的斜率为-3.572,反应的相关系数为0.969,计算公式为Y= -3.572X+0.969(图4);WNV标准曲线的斜率为-3.698,反应的相关系数为0.966,计算公式为Y=3.698X+0.966(图5)。其中反应相关系数的计算方式为斜率平方的倒数。
2.3 鉴别诊断试验结果
通过鉴别诊断试验证明,PPRV、ASFV、HeV的第1对引物和Taqman探针较好,NiV和WNV第2对引物和Taqman探针效果较好(图6~10)。
2.4 灵敏度试验结果
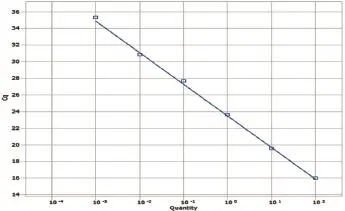
图1 ASFV标准曲线
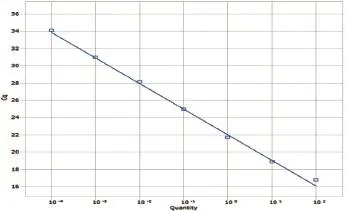
图2 HeV标准曲线
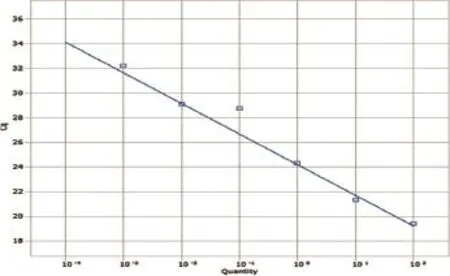
图3 NiV标准曲线

图4 PPRV标准曲线
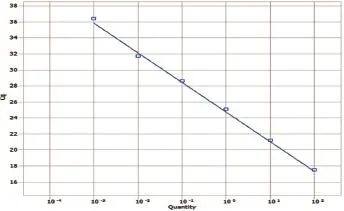
图5 WNV标准曲线
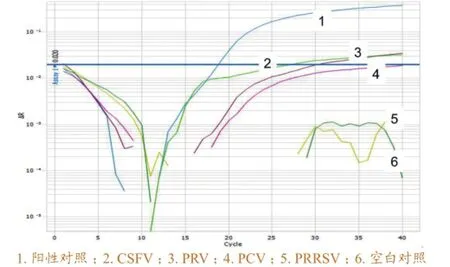
图6 ASFV第1套引物和Taqman探针的鉴别诊断试验试验
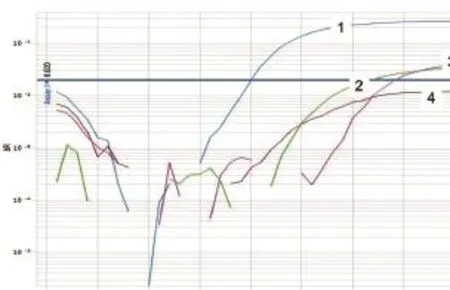
图7 HeV第1套引物和Taqman探针的特异性试验
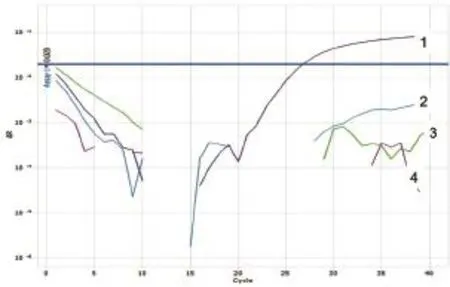
图8 NiV第2套引物和Taqman探针鉴别诊断试验试验
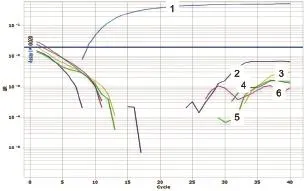
图9 PPRV第1套引物和Taqman探针鉴别诊断试验试验
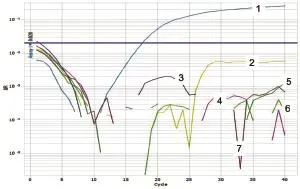
图10 WNV第2套引物和Taqman探针鉴别诊断试验试验
以PPRV、ASFV、HeV、NiV和WNV相关基因阳性质粒为模板,经1~10-6稀释后进行Taqman模式的并联荧光定量PCR检测,以确定此体系的灵敏度。结果显示,这5种病毒的检测灵敏度均可达到10-3ng/μL(图11~15)。
2.5 稳定性和重复性试验
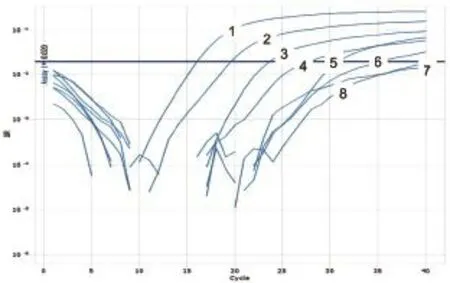
图11 ASFV第1套引物和Taqman探针灵敏度试验
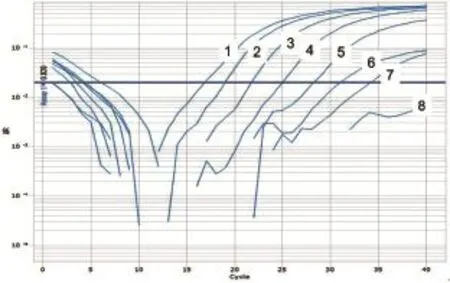
图12 HeV第1套引物和Taqman探针灵敏度试验
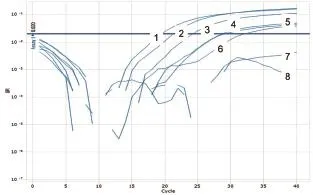
图13 NiV第2套引物和Taqman探针灵敏度试验
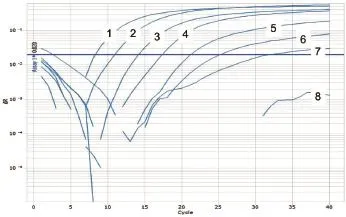
图14 PPRV第1套引物和Taqman探针灵敏度试验

图15 WNV第2套引物和Taqman探针灵敏度试验
阳性样品于-20 ℃保存,分别于1个月、2个月、3个月取出,对其10-5倍稀释后进行Taqman模式的并联荧光定量PCR检测,每个样品重复3次。结果显示,PPRV的Ct值平均数为17.27±0.47,ASFV的Ct值平均数为16.34±0.20,HeV的Ct值平均数为16.03±0.57,NiV的Ct值平均数为29.02±0.56,WNV的Ct值平均数为16.88±0.13。5种病毒的Ct值平均数差异均不显著,说明阳性重组质粒完整性良好,无降解。
2.6 检测方法的初步应用
用HeV、NiV和WNV的相应引物和Taqman探针,对采集的45份蝙蝠样品的cDNA进行检测,用PPRV的引物和Taqman探针对20份羊分泌物的cDNA样品进行荧光定量PCR的检测,用ASFV的引物和Taqman探针对38份猪脾、肺、肾样品DNA进行荧光定量PCR检测。结果表明,除阳性对照外,其他样品检测均为阴性。(图16~20)
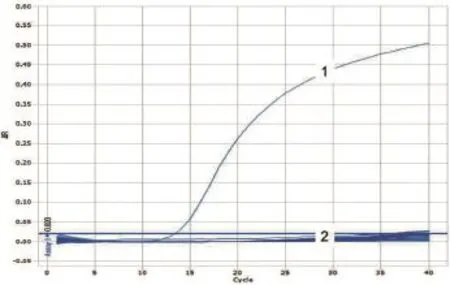
图16 ASFV样品检测
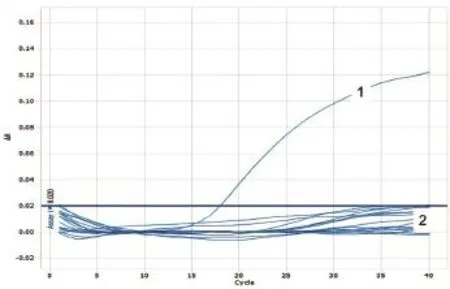
图17 HeV样品检测
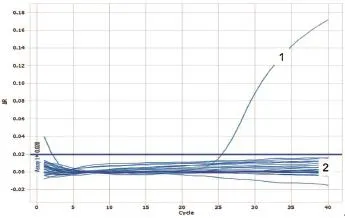
图18 NiV样品检测
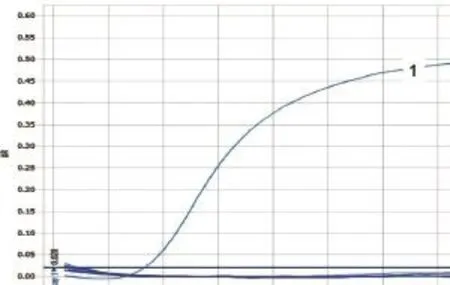
图19 PPRV样品检测
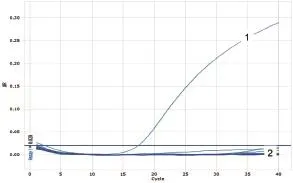
图20 WNV样品检测
3 讨论
目前,对ASFV、PPRV、HeV、NiV和WNV的研究很多,用于检测这几种病毒的方法也很多,尤其在有这几种病毒流行的地区和国家。无论是针对病原体,还是针对这几种病原体的抗体,检测方法一般比较成熟。现阶段,我国除了有PPRV的报道以外,ASFV、HeV、NiV和WNV在我国均未发生过。为防患于未然,我国科研人员对ASFV、HeV、NiV和WNV建立了很多检测方法。对ASFV,马世东[4]开发了间接ELISA诊断试剂盒,王华等[5]建立了LAMP检测等方法。对NiV,郭丽霞[6]建立了荧光RT-PCR等方法。对WNV,于萍[7]建立了巢式RTPCR和荧光定量RT-PCR等方法。国内对于HeV研究较少。可能是因为该病毒目前仅在澳大利亚流行,且对人的感染率和死亡率较NiV低,传入我国的风险较小。但不论国内还是国外,对于这5种病毒的检测方法研究多数仅限于针对单种病毒,还没有将这5种疾病的检测方法进行并联研究。本研究根据PPRV、ASFV、HeV、NiV和WNV的基因序列,通过NCBI中Blast比对,并结合他人的研究内容,选择这5种病毒基因组中相对保守的序列进行人工合成,并根据合成序列,利用Primer Express 3.0软件进行引物和Taqman探针的设计,采用简并碱基增加其检测范围,每条引物和探针使用2~3个简并碱基,以避免非特异性反应的增加。
在这5种病原体中,由于PPRV是我国严格控制的病毒,因此本研究选择合成病毒的部分基因作为研究内容,既避免了病毒的外散,又得到了研究所需资源。ASFV、HeV、NiV和WNV在我国尚未发现,因此只能人工合成研究所需基因片段与PPRV的基因片段一起进行建立并联的Taqman模式的荧光定量PCR方法。
在没有得到确定病毒毒种的情况下,引物和探针的设计不免具有一定的局限性,特别是对我国目前尚未发现的病毒。对于这些病毒的研究也只能通过它们的流行史及地区分布进行推测,选择风险较大的毒株作为参考毒株建立检测方法。本研究所建立的方法均以DNA/cDNA为模板,因此在实际应用中需要提取病毒的RNA并将其反转录为cDNA。本研究建立的方法在临床样品的初步应用中效果良好。除阳性对照外,其他样品均呈现阴性结果。以往的检测方法多针对的是单一病原,检测范围较小。本研究采用并联荧光定量PCR方法同时检测多种病毒,建立的方法具有灵敏度高、稳定性好及重复性强的特点,为我国对小反刍兽疫、非洲猪瘟、西尼罗河热、亨德拉病、尼帕病的检测提供了一个具有一定参考意义的方法。
[1] 王功民,田克恭. 非洲猪瘟[M]. 北京:中国农业出版社,2010:236-239.
[2] 于萍,魏荣,王志亮,等. 西尼罗病毒蚊媒的种类、研究进展及监控措施[J].中国媒介生物学及控制杂志,2005,16(4):324-327.
[3] 李林,吴晓东,包静月,等. 小反刍兽疫病毒RT-LAMP检测方法的建立[J]. 中国动物检疫,2010,27(4):32-41.
[4] 马世东. 非洲猪瘟的间接ELISA诊断试剂盒的研究[D].乌鲁木齐:新疆农业大学,2000.
[5] 王华,王君玮,徐天刚,等. 非洲猪瘟病毒环介导等温扩增诊断方法建立[J]. 中国兽医科学,2010,40(9):940-944.
[6] 郭丽霞,陈继明,孙承英,等. 尼帕病毒TaqMan荧光RT-PCR检测方法的建立[C]//中国畜牧兽医学会. 2006学术年会论文集(下册). 北京:中国畜牧兽医学会,2006:615-619.
[7] 于萍. 西尼罗病毒巢式RT-PCR和荧光定量RT-PCR两种检测方法的建立[D]. 福州:福建农林大学,2005.
(责任编辑:朱迪国)
Development of Parallel Fluorescene Quantitative PCR for Detection of the Five Exotic Animal Diseases
Yu Hengzhi1,Liu Ye2,Cheng Wei3,Zhang Xudong1,Miao Fuchun2,Zhao Dan3,Zhang Shoufeng2,Liu Fangyi1,Niu Wenbo1
(1. Jinzhou Entry-exit Inspection and Quatantine Bureau,Jinzhou,Liaoning 121013;2. Military Veterinary Research Institute of the Academy of Military Medical Sciences,Changchun,Jilin 130122;3. Agricultural Economy School of Liaoning Province,Jinzhou,Liaoning 121001)
According to the gene sequences of related viruses reported in Genbank,primers and probes were designed based on the conservative region of Peste des petits ruminants virus(PPRV)African swine fever virus(ASFV),West Nile fever virus(WNV),Hendra virus(HeV)and Nipah virus(NiV)(the conservative regions were N gene of PPRV,p72 gene of ASFV,H gene of HEV and NIV,and PRM gene of WNV,respectively). After screening a set of specifi c primers and a TaqMan probe,a real-time fl uorescene quantitative PCR for detection of the above fi ve exotic animal diseases was established. The clinical detection results of 103 samples used this method showed that all the samples were tested negative except the positive control,which verifi ed the parallel fl uorescene quantitative PCR of Taqman mode established in this study has characterisitics of differential diagnosis. The method can be used as a reference method for clinical detection of above-mentioned fi ve kinds of pathogens.
exotic animal diseases;Peste des petits ruminants virus(PPRV);African swine fever virus(ASFV);West Nile fever virus(WNV);Hendra virus(HeV);Nipah virus(NiV);fl uorescene quantitative PCR
S851.3
B
1005-944X(2016)11-0079-07
10.3969/j.issn.1005-944X.2016.11.022
辽宁检验检疫局科研计划项目(LK07-2015)

