亲水色谱柱对氨基酸及其美拉德反应初始中间体的分离
曹长春,梁晶晶,王 蒙,侯 莉,谢建春,孙宝国
(北京工商大学 食品质量与安全北京实验室,北京市食品风味化学重点实验室,北京市食品添加剂工程技术研究中心,北京 100048)
亲水色谱柱对氨基酸及其美拉德反应初始中间体的分离
曹长春,梁晶晶,王 蒙,侯 莉,谢建春*,孙宝国
(北京工商大学 食品质量与安全北京实验室,北京市食品风味化学重点实验室,北京市食品添加剂工程技术研究中心,北京 100048)
采用Xbridge BEH Amide和Atlantis HILIC Silica两亲水色谱柱分离半胱氨酸、甘氨酸及其与木糖形成的美拉德反应初始中间体2-木糖基噻唑烷-4-羧酸、甘氨酸-Amadori和半胱氨酸-Amadori 5 个化合物。通过研究流动相中有机相(乙腈)的比例、缓冲盐浓度、pH值、柱温、流速对容量因子和分离度的影响,分别找到较佳分离条件。在BEH Amide色谱柱上5 个化合物之间的分离度均达到2.28以上,对比可知,采用BEH Amide色谱柱更好。
亲水色谱;半胱氨酸;2-木糖基噻唑烷-4-羧酸;甘氨酸;甘氨酸-Amadori;半胱氨酸-Amadori;分离
半胱氨酸与还原糖发生美拉德反应是产生含硫肉香味物质的重要途径[1-4]。在同时含有半胱氨酸和其他氨基酸的复杂美拉德反应体系中,初始美拉德反应阶段半胱氨酸与其他氨基酸在与还原糖发生作用时存在竞争性[5-6]:可形成半胱氨酸-Amadori重排物和其他氨基酸-Amadori重排物,以及半胱氨酸因含有巯基官能团形成2-糖基噻唑烷-4-羧酸中间体。为了解上述复杂反应体系中半胱氨酸和其他氨基酸在初始美拉德反应阶段的竞争性,本课题组选用甘氨酸为“其他氨基酸”的代表,选用木糖为“还原糖”的代表,设计“半胱氨酸-木糖-甘氨酸”模型反应体系,拟分析检测不同反应条件下的模型反应体系内初始美拉德反应中间体的含量及其变化。发现模型体系内存在的2-木糖基噻唑烷-4-羧酸、甘氨酸-Amadori、半胱氨酸-Amadori重排物及半胱氨酸、甘氨酸5 个化合物(图1),极性相似,均具有较强的亲水性,在常用的反相色谱(reversed phase liquid chromatography,RPLC)柱上保留很弱,不适于RPLC分离。现有文献[5-6]往往采用胺型阳离子交换色谱柱用于美拉德反应中间体的分离,但实验表明,采用这些方法对5个化合物(图1)仅可实现一定程度地分离,且由于样品中的糖分子中的羰基与固定相的氨基存在不可逆作用,色谱柱的稳定性较差、使用寿命较短。
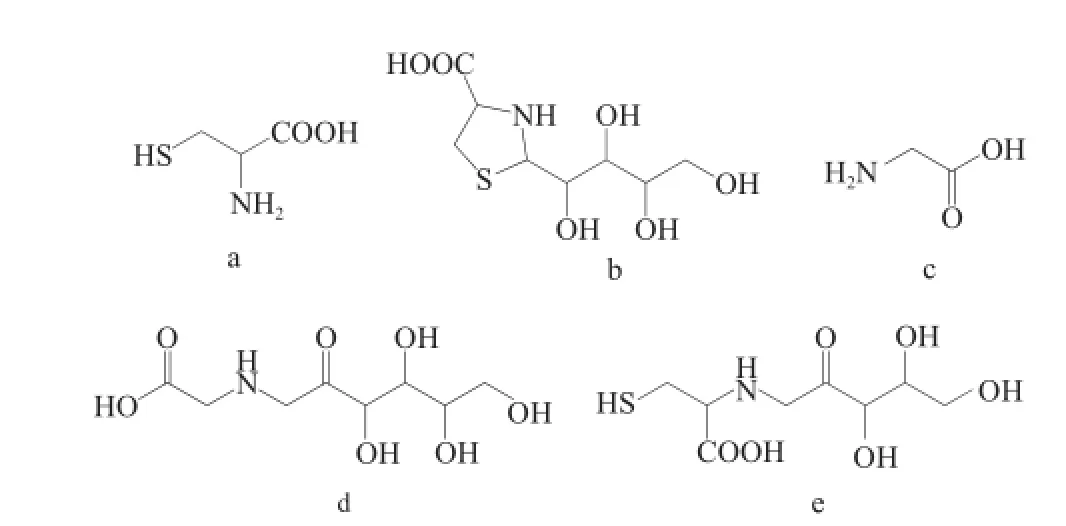
图1 半胱氨酸(a)、2-木糖基噻唑烷-4-羧酸(b)、甘氨酸(cc)、甘氨酸-Amadori(d)和半胱氨酸-Amadori(ee)的结构Fig.1 Structures of cysteine (a), 2-xylulosylthiazolidine-4-carboxylic acid (b), glycine (c), glycine-Amadori (d), and cysteine-Amadori (e)
亲水作用色谱(hydrophilic interaction liquid chromatography,HILIC)是近年发展的替代反相色谱用于强极性及亲水性化合物分离的另一色谱模式。李玉珍等[7]利用Merck ZIC-HILIC色谱柱分离检测保健食品中L-亮氨酸等3 种支链氨基酸的含量;张璐等[8]利用HILIC色谱分离检测饮料中的4-甲基咪唑及其异构体2-甲基咪唑。由于HILIC的特性,其应用在各行业越来越广泛[8-13],但亲水作用色谱在美拉德反应中间体的分离检测应用报道还较少。
本实验采用Xbridge BEH Amide及Atlantis HILIC Silica两亲水色谱柱,对半胱氨酸-Amadori重排物、2-木糖基噻唑烷-4-羧酸、甘氨酸-Amadori及半胱氨酸、甘氨酸5 种物质的分离进行研究。比较了两亲水柱的分离差异,考察了流动相中有机相比例、缓冲盐浓度、pH值、柱温等因素的影响,找到了较佳的分离条件。研究结果可为美拉德反应动力学及美拉德反应制备肉香味的机理研究提供参考。
1 材料与方法
1.1 材料与试剂
L-半胱氨酸、D-(+)-木糖、甘氨酸、L-半胱氨酸盐酸盐一水合物(均为生化试剂)、二水合磷酸二氢钠、甲酸铵、甲酸、氢氧化铵、氢氧化钠(均为分析纯) 国药集团北京化学试剂有限公司;三油酸甘油酯(99%) 百灵威科技有限公司;乙腈(色谱纯)迪马科技有限公司;AG 50W-X4H-型阳离子交换树脂美国Bio-Rad公司。
1.2 仪器与设备
1100高效液相色谱仪 美国Agilent公司;SEDEX75蒸发光散射检测器 法国Sedere公司;XWK-Ⅲ无油空气泵 天津市华生分析仪器厂;BS-100A自动液相色谱分离层析仪 上海青浦沪西仪器厂;PHSJ-5型pH计 上海仪电科学仪器股份有限公司;ALPHA 2-4 LSC冷冻干燥机 德国Christ公司;OSB-200油浴型旋转蒸发仪 日本Eyela公司;DF-101型集热式恒温加热磁力搅拌器 河南巩义市予华仪器有限公司。
1.3 方法
1.3.1 初始Maillard反应中间体的制备
按照如下方法制备反应产物,然后阳离子交换树脂处理,冷冻干燥得产品。阳离子交换树脂利用自动液相色谱分离层析仪进行,层析柱Φ1.6 cm×40 cm,紫外检测波长220 nm。上样后,先用去离子水淋洗,再用0.3 mol/L氨水洗脱,根据紫外检测信号收集流分。
1.3.1.1 2-木糖基噻唑烷-4-羧酸
在装有温度计、回流冷凝管的150 mL三口烧瓶中,加入L-半胱氨酸盐酸盐一水合物3.5 g(0.02 mol)、D-(+)木糖3.3 g(0.022 mol)、磷酸氢二钠7.2 g(0.02 mol)、水2.5 mL,放入集热式恒温加热磁力搅拌器的水槽中,50 ℃反应1 h得产物A,一次性全部上样,阳离子交换树脂柱处理,得2-木糖基噻唑烷-4-羧酸0.5 g,高效液相色谱分析相对峰面积为100%。
1.3.1.2 半胱氨酸-Amadori
按1.3.1.1节方法得产物A,然后用NaOH溶液调pH值至5,旋转蒸发除水得乳白色黏稠液体,再放入集热式恒温加热磁力搅拌器的水槽中,70 ℃反应3 h,得黄褐色黏稠液体,加水5 mL,一次性全部上样,阳离子交换树脂柱处理,得半胱氨酸-Amadori 0.3 g,高效液相色谱分析相对峰面积为95%~100%。
1.3.1.3 甘氨酸-Amadori
在装有温度计、回流冷凝管的250 mL四口烧瓶中,加入D-(+)-木糖40 g、甘氨酸5 g、焦亚硫酸钠8 g、水8 mL,放入集热式恒温加热磁力搅拌器的水槽中,90 ℃反应20 min,得黑褐色黏稠液体,加水100 mL,每次上样50 mL,阳离子交换树脂柱处理,两次共得甘氨酸-Amadori 4 g,高效液相色谱分析相对峰面积为100%。
1.3.2 样品处理及高效液相色谱分离
按物质的量比大约1∶1将L-半胱氨酸、2-木糖基噻唑烷-4-羧酸、甘氨酸、甘氨酸-Amadori、半胱氨酸-Amadori 5个化合物混合,用乙腈-水(50∶50,V/V)稀释,配制成0.1 mmol/L样品溶液。
Waters Xbridge BEH Amide(4.6 mm×150 mm,3.5 μ m)色谱柱和A t l a n t i s H I L I C S i l i c a(4.6 mm×150 mm,3 μm)色谱柱;进样量3 μL;蒸发光散射检测器检测,蒸发管温度40 ℃,雾化气(空气)压力3.5 bar,增益值5。
通过调节流动相中有机相(乙腈)的比例、缓冲盐(甲酸铵溶液)浓度、pH值、柱温、流速等色谱参数,研究各因素对分离的影响及寻找较佳的分离条件。
按式(1)、(2)计算容量因子(k)和分离度(RS):

式中:tR为样品的保留时间/min;t0为死时间(进样三油酸甘油酯得到)/min。

式中:tR1、tR2分别为前后相邻两个峰的保留时间/min;W1、W2为该两色谱峰的峰宽。
2 结果与分析
2.1 BEH Amide色谱柱上的分离条件
2.1.1 流动相中有机相比例的确定
柱温25 ℃,流动相为A(30 mmol/L甲酸铵溶液,pH 6)和B(乙腈),流速0.5 mL/min,所得色谱图见图2。
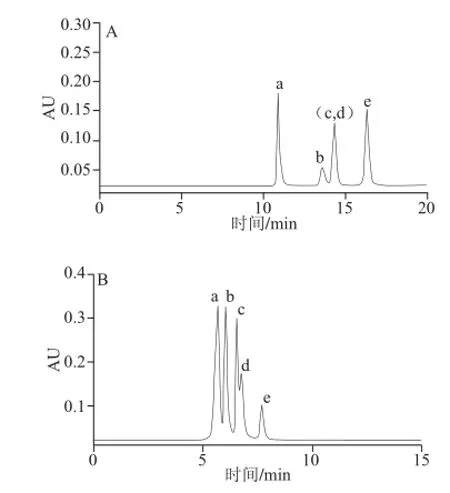
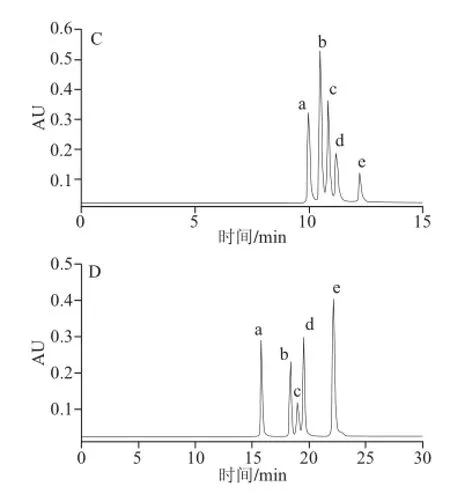
图2 BEH Amide色谱柱上改变流动相中有机相比例所得色谱图Fig.2 Chromatograms on the BEH Amide column when different ratios of the organic phase (CH3CN) were used in the mobile phase
图2中5种物质的出峰顺序用标准品比对法确定。由图2A可知,其他3 个化合物之间均实现分离,化合物c、d即甘氨酸与甘氨酸-Amadori共流出。图2B中,其他3 个化合物之间的分离度较小,化合物c、d出现分离趋势,因此考虑运用梯度洗脱调节流动相中有机相比例。其他条件不变,梯度洗脱程序为:0~5 min,80%~60% B;5~15 min,60% B(梯度1),结果如图2C所示,可知,5 个化合物均得到分离,但未实现基线分离。改变梯度洗脱程序为:0~5 min,95%~75% B;5~25 min,75%~65% B;25~30 min,65%~95% B(梯度2),如图2D所示,化合物a、c之间及d、e之间分离度变大,但化合物b、c、d之间即2-木糖基噻唑烷-4-羧酸、甘氨酸和甘氨酸-Amadori之间仍未实现基线分离,因此继续探讨流动相中缓冲盐浓度、pH值、柱温等其他因素的影响。
2.1.2 流动相中缓冲盐浓度的影响
洗脱程序为梯度2,柱温及流速同2.1.1节,甲酸铵浓度由30 mmol/L改变为50、10 mmol/L。所得色谱图见图3,分离参数的结果见表1。
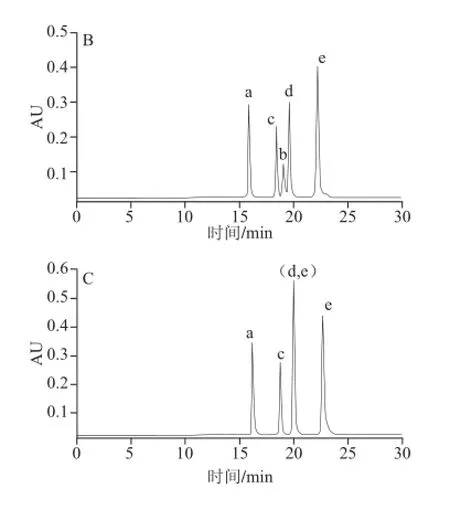
图3 BEH Amide色谱柱上改变流动相A中甲酸铵浓度所得色谱图Fig.3 Chromatograms on the BEH Amide column at different concentrations of ammonium formate in mobile phase A

表1 BEH Amide柱上改变甲酸铵浓度所得容量因子及分离度Table 1 Capacity factors and resolution factors at varyingconcentrations of ammonium formate in the mobile phase on theBEH Amide column
由表1可知,甲酸铵浓度由30 mmol/L增大为50 mmol/L时,5 个化合物的容量因子均增大,化合物b的容量因子大于化合物d,从而b、c、d 3 个化合物出峰先后顺序发生变化,化合物c、d间与化合物b、e间的分离度增大,但化合物d、b即甘氨酸-Amadori和2-木糖基噻唑烷-4-羧酸间的分离度(Rd,b)仅为0.55。当甲酸铵浓度由30 mmol/L减小为10 mmol/L时,5 个化合物的容量因子均减小,化合物b的容量因子小于化合物c,从而b、c、d 3 个化合物出峰先后顺序也发生了变化;但与甲酸铵浓度30 mmol/L的条件相比,b、c、d 3化合物之间的分离度均大于1.5,实现了基线分离,因此甲酸铵浓度为10 mmol/L较好。
2.1.3 流动相pH值的影响
洗脱程序为梯度2,柱温及流速同2.1.1节,甲酸铵浓度为10 mmol/L,A流动相的pH值由6分别改变为3、8,所得色谱图见图4,分离参数的结果见表2。
由表2可知,pH值由6减小为3时,5 个化合物的容量因子均增大,化合物b的容量因子大于d,从而b、c、d 3 个化合物的出峰先后顺序发生变化,与pH 6条件下的结果相比,其他3 个化合物间的分离度增大,但化合物d、b即甘氨酸-Amadori和2-木糖基噻唑烷-4-羧酸间的分离度(Rd,b)仅为0.47。pH值由6增大为8时,5 个化合物的容量因子均小幅减小,b、c、d 3 个化合物的出峰顺序与pH 6时相同,5 个化合物之间的分离度变化不一致,但仍全部实现较好的分离。考虑到pH 6为甲酸铵溶液的自然pH值,为此选择pH 6作为较佳分离条件。
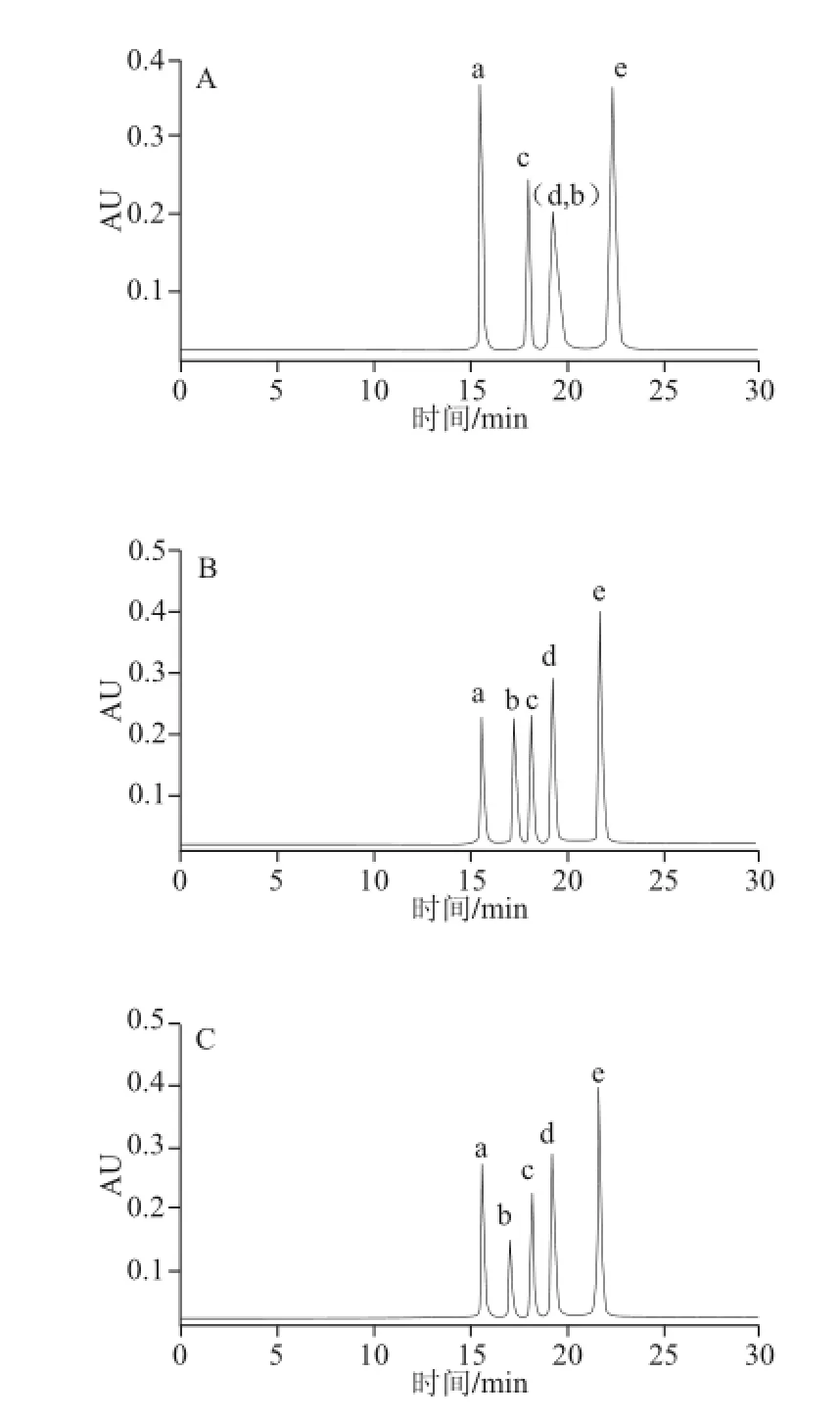
图4 BEH Amide色谱柱上改变流动相A pH值所得色谱图Fig.4 Chromatograms on the BEH Amide column at different pH values of mobile phase A
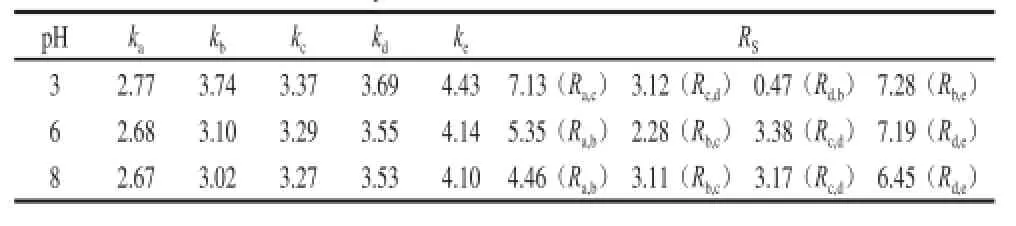
表2 BEH Amide柱上改变pH值所得容量因子及分离度Table 2 Capacity factors and resolution factors at different pH valuesof the mobile phase on the BEH Amide column
2.1.4 柱温的影响
洗脱程序为梯度2,柱温及流速同2.1.1节,甲酸铵浓度为10 mmol/L,流动相A为pH 6,柱温由25 ℃分别改变为45、70 ℃,所得分离参数的结果见表3。
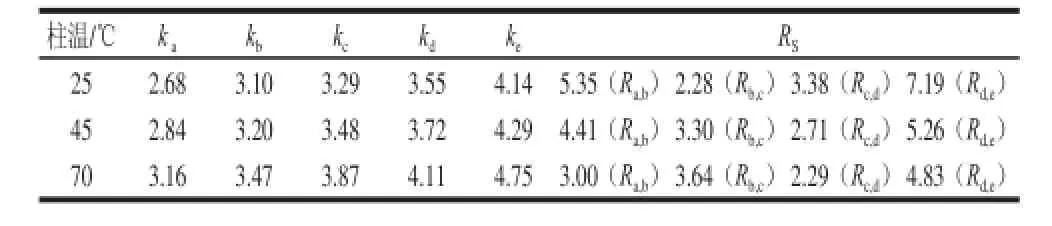
表3 BEH Amide柱上改变柱温所得容量因子及分离度Table 3 Capacity factors and resolution factors at different columntemperatures on the BEH Amide column
由表3可知,随着柱温升高,5 个化合物的容量因子均呈逐渐增大,但出峰先后顺序未发生变化;除b、c即2-木糖基噻唑烷-4-羧酸和甘氨酸之间的分离度(Rb,c)逐渐增大外,其他化合物之间的分离度(Ra,b、Rc,d、Rd,e)均逐渐减小。在3 种柱温条件下,5 个化合物均处于基线分离,但考虑到色谱柱使用寿命,选择柱温为25 ℃较好。
2.2 Atlantis HILIC Silica柱的分离条件
2.2.1 流动相中有机相比例的确定
参考BEH Amide柱的分离结果,对于Atlantis HILIC Silica柱直接采用梯度洗脱条件调节流动相中的有机相比例。
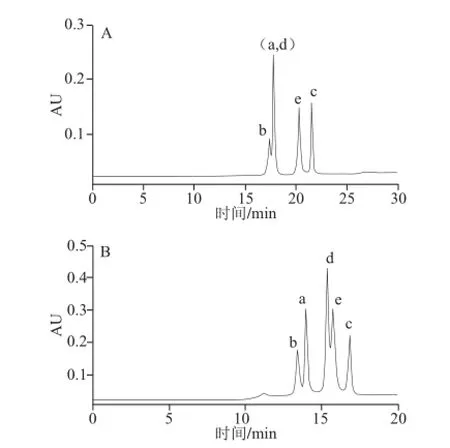
图5 Atlantis HILIC Silica色谱柱上改变流动相中有机相比例所得色谱图Fig.5 Chromatograms on the Atlantis HILIC Silica column when different ratios of the organic phase (CH3CN) were used in the mobile phase
柱温70 ℃,流速0.5 mL/min,流动相:A(10 mmol/L甲酸铵溶液,pH 6)和B(乙腈),洗脱程序为:0~15 min,95%~75% B;15~25 min,75%~60% B;25~30 min,60%~95% B(梯度3),如图5A所示,可知化合物c、e实现基线分离,但化合物a、d共流出,化合物b与(a,d)仅部分分离。柱温70 ℃,其他条件同上,改变洗脱程序为:0~5 min,95%~75% B;5~15 min,75%~70% B;15~20 min,70%~95% B(梯度4),如图5B所示,此时的分离状况优于梯度3条件,化合物b、a之间的分离增大,化合物a、d之间达到基线分离,但化合物d、e之间仅部分分离,因此需继续探讨其他因素的影响。
2.2.2 流动相缓冲盐浓度的影响
洗脱程序为梯度4,柱温及流速2.2.1节,甲酸铵浓度由10 mmol/L改变为30、50 mmol/L。所得色谱图见图6,分离参数的结果见表4。
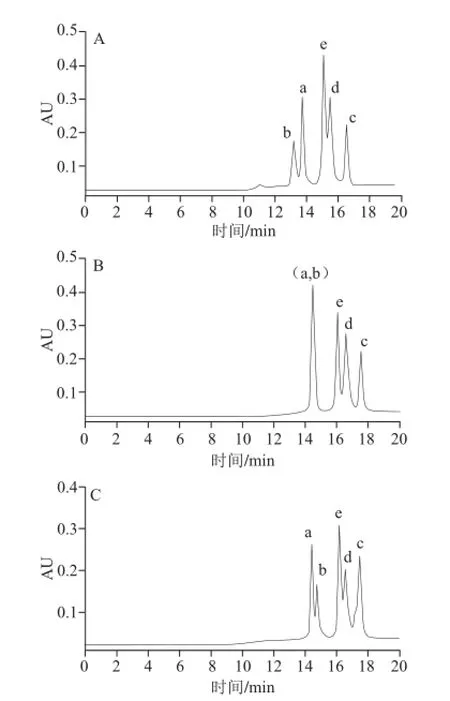
图6 Atlantis HILIC Silica色谱柱上改变流动相A中甲酸铵浓度所得色谱图Fig.6 Chromatograms on the Atlantis HILIC Silica column at different concentrations of ammonium formate in mobile phase A

表4 Atlantis HILIC Silica柱上改变甲酸铵浓度所得容量因子及分离度Table 4 Capacity factors and resolution factors when theconcentrations of ammonium formate in the mobile phase were changedon the Atlantis HILIC Silica column
由表4可知,甲酸铵浓度由10 mmol/L增加为30 mmol/L时,5 个化合物的容量因子均不同程度增大,化合物出峰先后顺序不变;化合物b、a即2-木糖基噻唑烷-4-羧酸和半胱氨酸共流出,分离度(Rb,a)为0;化合物e、d即半胱氨酸-Amadori和甘氨酸-Amadori间的分离度(Re,d)略增大,为0.88,仍为部分分离。当甲酸铵浓度由10 mmol/L增大为50 mmol/L时,5 个化合物的容量因子也均增大,但化合物a、b出峰先后顺序发生变化,化合物a、b之间,及e、d之间分离度(Ra,b、Re,d)分别减为0.83、0.75。综上,甲酸铵浓度选择10 mmol/L较好。
2.2.3 流动相pH值的影响
洗脱程序为梯度4,柱温及流速同2.2.1节,甲酸铵浓度为10 mmol/L,流动相A的pH值由6分别改为3、8,所得色谱图见图7,分离参数结果见表5。
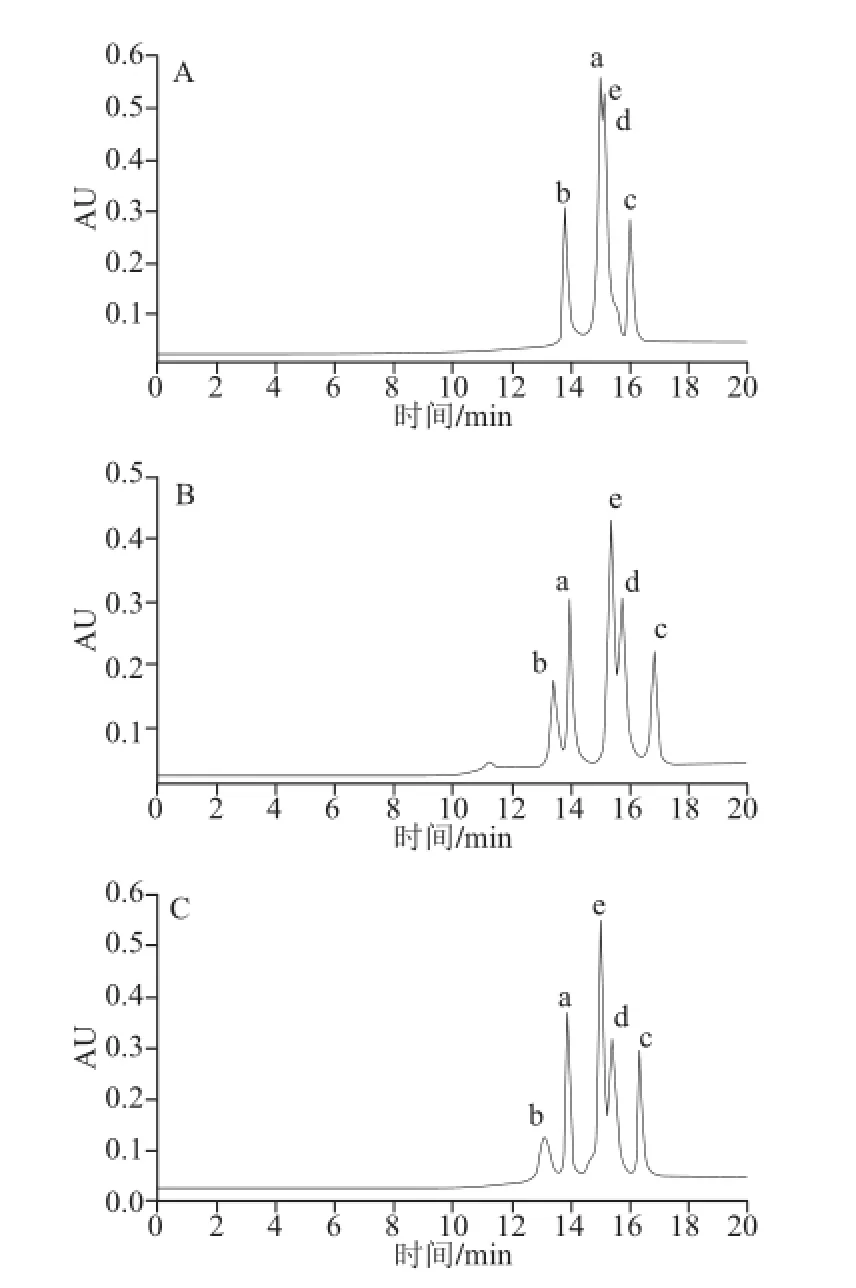
图7 Atlantis HILIC Silica色谱柱上改变流动相A pH值所得色谱图Fig.7 Chromatograms on the Atlantis HILIC Silica column at different pH values of mobile phase A
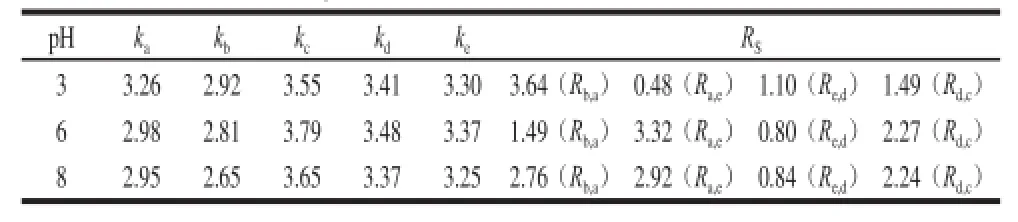
表5 Atlantis HILIC Silica柱上改变pH值所得容量因子及分离度Table 5 Capacity factors and resolution factors at different pH valuesof the mobile phase on the Atlantis HILIC Silica column
由表5可知,pH值由6变为3时,化合物a、b的容量因子增大,而化合物c、d、e的容量因子减小,但5 个化合物的出峰顺序没发生变化;化合物b、a间的分离度(Rb,a)增大为3.64,但化合物a、e间的分离度(Ra,e)减小为0.48,化合物d、c间的分离度(Rd,c)减小为1.49。pH值由6变为8时,5 个化合物的容量因子均不同程度减小,5 个化合物的出峰顺序也没发生变化,化合物b、a的分离度(Rb,a)增大为2.76,即化合物2-木糖基噻唑烷-4-羧酸和半胱氨酸实现基线分离,而其他化合物之间的分离无明显改善。综合以上分析及考虑到pH 6为甲酸铵溶液的自然pH值,选择pH 6作为较合适分离条件。
2.2.4 柱温的影响
洗脱程序为梯度4,流速同2.2.1节,甲酸铵浓度为10 mmol/L,流动相A的pH值为6,柱温由70 ℃分别改变为25、45 ℃,所得分离参数结果见表6。
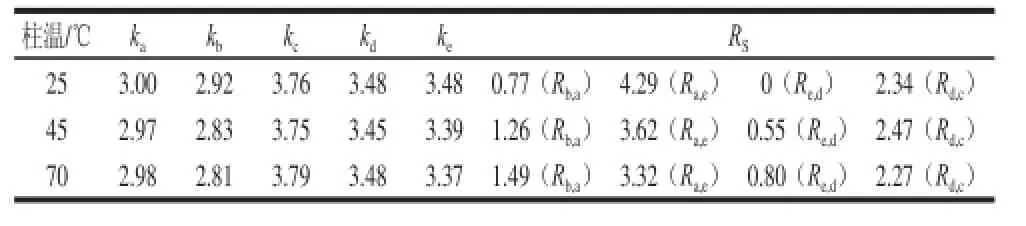
表6 Atlantis HILIC Silica柱上改变柱温所得容量因子及分离度Table 6 Capacity factors and resolution factors at different columntemperatures on the Atlantis HILIC Silica column
由表6可知,随着柱温降低,5 个化合物的容量因子均呈稍增大趋势或变化不大,出峰先后顺序未发生改变。当柱温由70 ℃降为25 ℃时,b、a两化合物之间的分离度(Rb,a)减小为0.77,化合物e、d间的分离度(Re,d)为0,即半胱氨酸-Amadori和甘氨酸-Amadori共流出。当柱温由70 ℃降为45 ℃时,化合物b和a、e和d间的分离度(Rb,a、Re,d)分别减小为1.26、0.55。总体而言,柱温为70 ℃时分离较好。
2.3 两柱分离结果的比较
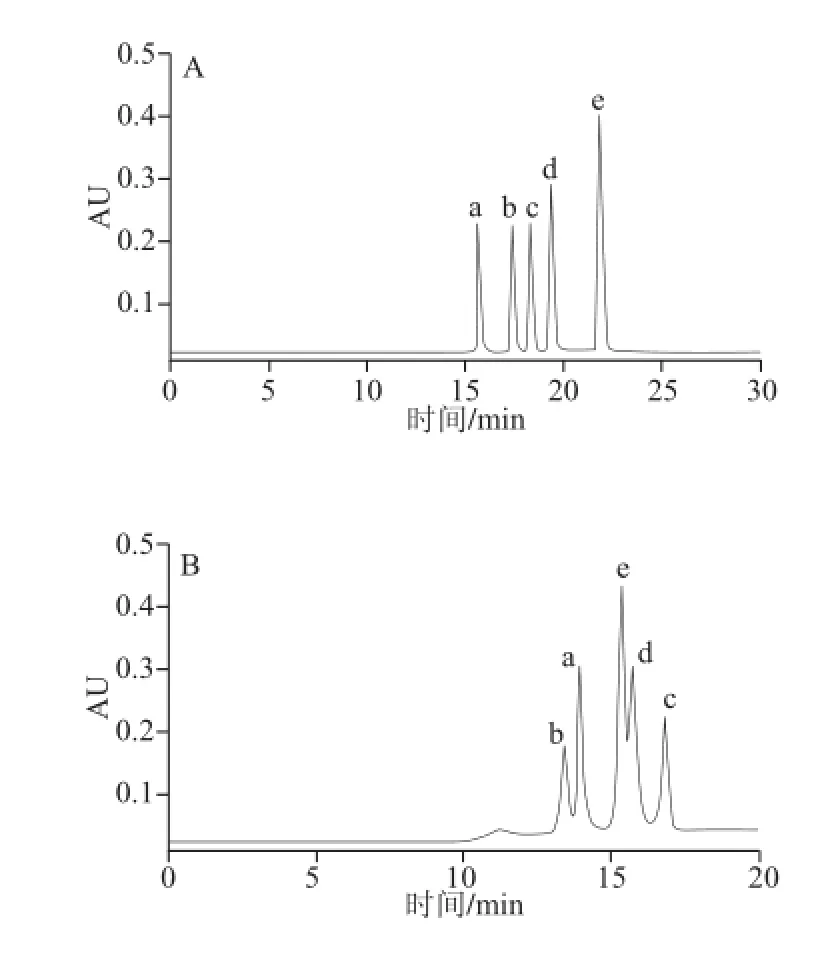
图8 较佳条件下流速为0.5 mL/min时BEH Amide色谱柱(A)与Atlantics HILIC Silica色谱柱(B)分离色谱图Fig.8 Chromatograms on the BEH Amide and the Atlantis HILIC Silica column under the optimum conditions with a flow rate of 0.5 mL/min
根据以上优化过程,分别得到两柱的较佳分离条件,BEH Amide色谱柱:柱温25 ℃,流动相流速0.5 mL/min,流动相为A:10 mmol/L甲酸铵溶液(pH 6),B:乙腈,梯度洗脱程序2。Atlantis HILIC Silica色谱柱:柱温70 ℃,流动相流速0.5 mL/min,进样量3 μL,流动相为A:10 mmol/L甲酸铵溶液(pH 6),B:乙腈,梯度洗脱程序4。所得色谱图见图8。
2.4 调节流速及最终分离条件的确定
流速一般不影响色谱分离选择性,但会影响分离时间和色谱柱效。增大流速,将会使分离时间缩短,从而提高分离效率。考虑到流动相流速为0.5 mL/min时,所用分离时间较长,故固定上述的其他较佳条件,采用1 mL/min的流速进行分离实验,采用BEH Amide色谱柱和Atlantis HILIC Silica色谱柱所得色谱图见图9。
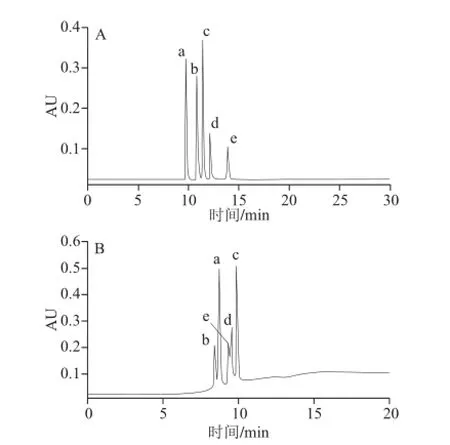
图9 较佳条件下流速为1 mL/min时BEH Amide色谱柱(A)与Atlantics HILIC Silica色谱柱(B)分离色谱图Fig.9 Chromatograms on the BEH Amide and the Atlantis HILIC Silica column under the optimum conditions with a flow rate of 1 mL/min
由图8、9可知,采用1 mL/min两色谱柱的分离时间可分别由30 min缩短为20 min、20 min缩短为15 min。但对于Atlantis HILIC Silica色谱柱,流速为1 mL/min的条件下,化合物e、d间分离度减小,基线发生明显漂移。
综合以上实验结果,认为采用BEH Amide色谱柱较好,故最终较佳分离条件为:柱温25 ℃,流动相流速1 mL/min,流动相为A:10 mmol/L甲酸铵溶液(pH 6),B:乙腈,梯度洗脱程序2。
3 讨论与结论
亲水作用色谱设计用于分离各种强极性的亲水化合物,尤其适用于在高比例有机相、高温及高pH值条件下,进行碳水化合物等亲水性化合物的分离。本实验所用BEH Amide色谱柱,其键合相为基于亚乙基桥杂化(BEH)颗粒的三键键合酰胺基;Atlantis HILIC Silica色谱柱,键合相为未经键合的高纯硅胶颗粒,对极性、碱性、水溶性分析物的保留极佳。两种色谱柱近年来受到广泛应用,如BEH Amide色谱柱常用于分离糖类、双氰胺等[14-17],Atlantis HILIC Silica色谱柱用于分离测定酰胺类化合物、甜菜碱、L-羟脯氨酸等[11,18-19]。
美拉德反应中氨基酸、多肽及其与糖反应形成的Amadori重排物等都是亲水性物质,适于亲水作用色谱分离。但这些化合物在紫外检测时吸收很弱,因而采用较为通用的蒸发光散射检测器检测。实验发现,半胱氨酸(a)、2-木糖基噻唑烷-4-羧酸(b)、甘氨酸(c)、甘氨酸-Amadori(d)和半胱氨-Amadori酸(e)5 种物质,在BEH Amide色谱柱和Atlantis HILIC Silica色谱柱上具有不同的分离选择性。在BEH Amide色谱柱上,b、c、d 3 个化合物之间较难分离,在所尝试的条件下它们之间往往分离度较小或共流出,是分离的关键所在。在Atlantis HILIC Silica色谱柱上,a与b、e与d这两对化合物较难分离,在所尝试的条件下它们往往分离度较小或共流出,是分离的关键所在。
亲水作用色谱模式下,影响化合物保留的主要因素包括流动相中的有机相比例、流动相的缓冲盐浓度及pH值、柱温等[20-21]。
3.1 流动相中有机相比例的影响
在HILIC色谱模式中通常以高比例有机溶剂(常为乙腈)为流动相[17],通过逐渐增大水的比例调节流动相的极性,依次洗脱出极性不同的溶质。该色谱模式中,化合物的保留随其极性的增大而增强,流动相中有机相的含量是控制分离的主要因素[17]。实验发现,流动相中乙腈比例及其变化对化合物保留的影响较大,进而影响分离选择性及分离度。例如,BEH Amide色谱柱,等度洗脱时,流动相A-B体积比由25∶75调节为35∶65,乙腈的比例减小(水相比例增大),流动相的洗脱能力增强,5 个化合物保留时间均缩短,而分离选择性有所改善,c、d这对原共流出峰出现了分离趋势(图2)。
对于两色谱柱,通过降低起始流动相中水相的比例(为5%),有利于溶质与固定相作用,然后采用梯度洗脱,逐步增大水相的比例,使流动相的洗脱能力逐步增强,有利于提高b、c、d 3 个化合物或a、b及e、d这两对化合物之间的分离选择性,获得较高的分离度。Schlichtherle-Cerny等[22]用TSK-Gel Amide色谱柱在流动相为乙酸铵缓冲溶液(pH 5.5)和乙腈,其中流动相中乙腈的含量为由90%逐渐变为60%,流动相的极性由弱到强,从而逐步分离亮氨酸、丝氨酸等氨基酸和一些亲水性二肽、三肽,除丝氨酸和谷氨酰胺外,其他氨基酸和大部分肽类均实现基线分离。
3.2 流动相中缓冲盐浓度的影响
流动相中加入缓冲盐可以降低带电荷溶质与固定相之间的静电作用,调节物质的保留及峰形,流动相中不加缓冲盐时易出现峰拖尾现象[17]。此外,缓冲盐浓度还将影响可电离的溶质的保留。半胱氨酸(a)、2-木糖基噻唑烷-4-羧酸(b)、甘氨酸(c)、甘氨酸-Amadori(d)和半胱氨酸-Amadori(e)5 种物质均为两性物质,pH值不变,仅增大甲酸铵的浓度时(由10 mmol/L增大到30、50 mmol/L),将有利于5 种物质的带电荷的解离形式的稳定性,从而增大了溶质与固定相的作用,因而表现为各物质的容量因子增大,保留增强。Guo Yong等[23]也曾发现使用Atlantis HILIC Silica色谱柱分离胞嘧啶时,当乙酸铵浓度由5 mmol/L增大到20 mmol/L时,胞嘧啶的保留增强。但本实验中增大流动相中缓冲盐浓度时,对b、c、d 3 个化合物或a、b及e、d这两对化合物之间的分离选择性改善不明显甚至变差,两色谱柱均是在甲酸铵浓度低(10 mmol/L)时,对于5 个化合物的分离结果更好。
3.3 流动相pH值的影响
流动相的pH值是重要的色谱参数,影响固定相及溶质的电荷状态,而溶质在不同电荷状态下在固定相上的保留不同,溶质带电荷时亲水性更强,在HILIC中保留增强[17]。本研究发现流动相pH值对几种溶质的分离有较大影响,而pH值对每种物质的保留的影响不仅与物质本身还与固定相种类有很大关系。在BEH Amide色谱柱上,流动相pH值较高时(pH 6、8),容量因子均小幅减小,物质的保留减弱;流动相pH值较高时,还表现为有利于b、c分离但不利于c、d 分离(表2)。Atlantis HILIC Silica色谱柱,pH值较高时,半胱氨酸、2-木糖基噻唑烷-4-羧酸和半胱氨酸-Amadori的容量因子减小,而甘氨酸和甘氨酸-Amadori的容量因子先增大再减小;流动相pH值较低时(pH 3)有利于a、b和d、e而不利于d、c和a、e的分离(表5)。Guo Yong等[23]发现在Atlantis HILIC Silica色谱柱上,流动相pH值由3.3增至4.0时,胞嘧啶的保留增强,由4.0增至4.8时,其保留减弱,由4.8增至6.5时,保留增强。以上发现的pH值的影响,可能是由于不同pH值条件下,BEH Amide色谱固定相的酰胺基或HILIC Silica色谱固定相的硅醇羟基以带电荷或非电荷形式存在的比例不同,5 个化合物以酸性、碱性形式存在的比例不同,从而影响了分离的选择性。
3.4 柱温的影响
温度不仅影响流动相黏度及化合物的扩散系数而且影响其在流动相与固定相之间的焓变(ΔH),通常随温度升高化合物的保留减弱[17]。表6中,随温度升高,对于Atlantis HILIC Silica色谱柱,5 个化合物的容量因子减小或基本不变;表4中,对于BEH Amide色谱柱,5 个化合物的容量因子则增大。这可能仍与5 个化合物在不同温度条件下以酸性、碱性解离形式存在的比例不同,及BEH Amide固定相的酰胺基或Atlantis HILIC Silica色谱固定相的硅醇羟基以带电荷或非电荷形式存在的比例不同等复杂情况有关。
从分离度看,温度对Atlantis HILIC Silica色谱柱的分离影响较大,较高温度条件下,其对5 个化合物的分离更好(表6),这可能与温度升高流动相黏度降低及化合物的扩散系数增大,从而柱效提高有关。Hao Zhigang等[21]使用Hypersil silica色谱柱研究了温度等对甘氨酸和其二肽、三肽及对应的3种Amadori化合物的分离的影响,发现在其他条件合适的情况下,高温条件能够使6 个化合物分离度更大且峰形更好。
3.5 流速的影响
按照所用色谱柱的内径,较佳流速应在1 mL/min左右,但因所用流动相中含水和缓冲盐,黏度较大,为了有利于传质及两相分配平衡,开始时选择0.5 mL/min进行实验。对于BEH Amide色谱柱,在较佳的其他条件下,将流速提高到1 mL/min时,分离结果好且分离时间缩短(图8、9)。而对于Atlantis HILIC Silica色谱柱,由于其较佳的柱温高(70 ℃),流速提高到1 mL/min时,分离稳定性不好,梯度洗脱时随着流动相中水相的比例增大出现基线漂移,分离选择性变差。
综合以上讨论知,对于氨基酸、多肽、蛋白质、糖等食品基本组分的分离,亲水作用色谱模式代替常用的正、反相色谱,在食品科学领域的应用具有广阔的前景。由于所涉及的半胱氨酸、甘氨酸、2-木糖基噻唑烷-4-羧酸、半胱氨酸-Amadori、甘氨酸-Amadori化合物,均为两性物质,在不同pH值、缓冲盐浓度、有机相比例、及不同温度条件下,其酸性、碱性解离形式及中性形式的存在比例不同,分离机理极其复杂,在不同条件下分离结果往往存在多变性。对比两色谱柱的分离结果,分离半胱氨酸、甘氨酸及其Amadori重排产物等美拉德反应初始中间物时,选择BEH Amide色谱柱更合适。
[1] MOTTRAM D S, NOBREGA I C C. Formation of sulfur aroma compounds in reaction mixtures containing cysteine and three different forms of ribose[J]. Journal of Agricultural and Food Chemistry, 2002, 50(14): 4080-4086. DOI:10.1021/jf0200826.
[2] CERNY C, GUNTZ-DUBINI R. Formation of cysteine-S-conjugates in the Maillard reaction of cysteine and xylose[J]. Food Chemistry, 2013, 141: 1078-1086. DOI:10.1016/j.foodchem.2013.04.043.
[3] HOFMANN T, SCHIEBERLE P. Identification of potent aroma compounds in thermally treated mixtures of glucose/cysteine and rhamnose/cysteine using aroma extract dilution techniques[J]. Journal of Agricultural and Food Chemistry, 1997, 45: 898-906. DOI:10.1021/ jf960456t.
[4] CERNY C, DAVIDEK T. Formation of aroma compounds from ribose and cysteine during the Maillard reaction[J]. Journal of Agriculturaland Food Chemistry, 2003, 51(9): 2714-2721. DOI:10.1021/jf026123f.
[5] de ROOS K B. Meat flavor generation from cysteine and sugars[M]// TERANISHI R, TAKEOKA G R, GÜNTERT M. Flavor precursors. Washington, DC: ACS symposium series; American Chemical Society, 1992: 203-216. DOI:10.1021/bk-1992-0490.ch016.
[6] de ROOS K B, WOLSWINKEL K, SIPMA G. Amadori compounds of cysteine and their role in the development of meat flavor[M]// WEERASINGHE D K, SUCAN M K. Process and reaction flavors. Washington, DC: ACS Symposium Series. American Chemical Society, 2005: 117-129. DOI:10.1021/bk-2005-0905.ch009.
[7] 李玉珍, 聂舟, 吴韶敏, 等. 亲水作用色谱-蒸发光散射检测保健食品中三种支链氨基酸的含量[J]. 分析科学学报, 2014, 30(4): 537-540. DOI:10.13526/j.issn.1006-6144.2014.04.022.
[8] 张璐, 孔祥虹, 何强, 等. UPLC-MS-MS检测饮料中的4-甲基咪唑及其同分异构体2-甲基咪唑[J]. 食品科学, 2014, 35(8): 244-248. DOI:10.7506/spkx1002-6630-201408049.
[9] 赵恒强, 耿岩玲, 苑金鹏, 等. UAE-HILIC-DAD-ESI-Q-TOF/MS法测定大枣中的环磷酸腺苷[J]. 食品研究与开发, 2013, 34(18): 46-50. DOI:10.3969/j.issn.1005-6521.2013.18.012.
[10] 王嘉林, 王斯坦. HILIC-HPLC-ELSD测定山药中尿囊素的含量[J]. 中国药师, 2015, 18(4): 582-584. DOI:10.3969/j.issn.1008 -049X.2015.04.017.
[11] 张明, 唐访良, 范晓开, 等. 固相萃取-亲水相互作用液相色谱法同时测定环境水样中3 种酰胺类化合物[J]. 分析化学, 2012, 40(10): 1555-1560. DOI:10.3724/SP.J.1096.2012.20064.
[12] 郎海磊, 王昇, 赵贝贝, 等. HILIC-MS/MS测定家兔血液中的NNK及其7 种代谢物[J]. 烟草科技, 2013(3): 31-36. DOI:10.39 69/ j.issn.1002-0861.2013.03.009.
[13] 刘京晶, 郭宝林, 黄文华, 等. HILIC-HPLC测续断药材中多种皂苷含量[J]. 中国中药杂志, 2011(17): 2367-2371. DOI:10.4268/ cjcmm20111714.
[14] 徐虹, 张海静, 宋焕禄. 高效液相色谱-质谱法同时测定食品中5 种单、双糖的含量[J]. 食品科学, 2011, 32(12): 234-238.
[15] 王川丕, 诸力, 刘新, 等. 超高效液相色谱-质谱联用技术测定茶叶中8 种单、寡糖的含量[J]. 食品科学, 2014, 35(20): 164-169. DOI:10.7506/spkx1002-6630-201420033.
[16] 王建凤, 曹英华, 张春梅, 等. 婴幼儿乳粉中双氰胺的超高效液相色谱串联四极杆质谱法测定[J]. 分析试验室, 2015, 34(4): 462-465.
[17] 李瑞萍, 袁琴, 黄应平. 硅胶色谱柱的亲水作用保留机理及其影响因素[J]. 色谱, 2014, 32(7): 675-681. DOI:10.3724/SP.J.11 23.2014.04048.
[18] 王晓菁, 吴燕, 王黎明. 固相萃取-高效液相色谱法测定枸杞中甜菜碱[J]. 食品科学, 2010, 31(8): 199-201.
[19] 赵善贞, 邓晓军, 彭涛, 等. 亲水性相互作用色谱-四极杆串联线性离子阱质谱测定蛋白食品中L-羟脯氨酸残留[J]. 分析化学, 2011, 39(9): 1373-1379. DOI:10.3724/SP.J.1096.2011.01373.
[20] HAO Z G, XIAO B M, WENG N D. Impact of column temperature and mobile phase components on selectivity of hydrophilic interaction chromatography (HILIC)[J]. Journal of Separation Science, 2008, 31(9): 1449-1464. DOI:10.1002/jssc.200700624.
[21] HAO Z G, CHIH-YING (JOEY) L, XIAO B M, et al. Separation of amino acids, peptides and corresponding Amadori compounds on a silica column at elevated temperature[J]. Journal of Chromatography A, 2007, 1147(2): 165-171. DOI:10.1016/j.chroma.2007. 02.057.
[22] SCHLICHTHERLE-CENY H, AFFOLTER M, CEMY C, et al. Hydrophilic interaction liquid chromatography coupled to electros-pray mass spectrometry of small polar compounds in food analysis[J]. Analytical Chemistry, 2003, 75(10): 2349-2354. DOI:10.10 21/ac026313p.
[23] GUO Y, SHEETAL G. Retention behavior of small polar compounds on polar stationary phases in hydrophilic interaction chromatography[J]. Journal of Chromatography A, 2005, 1074(1/2): 71-80. DOI:10.1016/j.chroma.2005.03.058.
Separation of Amino Acids and Their Initial Maillard Reaction Intermediates by Hydrophilic Interaction Liquid Chromatography
CAO Changchun, LIANG Jingjing, WANG Meng, HOU Li, XIE Jianchun*, SUN Baoguo
(Beijing Laboratory for Food Quality and Safety, Beijing Key Laboratory of Flavor Chemistry, Beijing Engineering and Technology Research Center of Food Additives, Beijing Technology and Business University, Beijing 100048, China)
An Xbridge BEH Amide column and an Atlantis HILIC Silica column, which work on hydrophilic interaction liquid chromatography (HILIC), were used to separate cysteine, glycine, and their initial Maillard reaction intermediates with xylose including 2-xylulosylthiazolidine-4-carboxylic acid, glycine-Amadori, and cysteine-Amadori. The effects of the ratio of the organic phase (CH3CN), the concentration of ammonium formate (the buffer salt), the pH value and flow rate of the mobile phase, and column temperature on capacity factor and resolution factor were investigated. Then optimum separation conditions for the Xbridge BEH Amide column and the Atlantis HILIC Silica column were established, respectively. Using the BEH Amide column, the resolution factors achieved for the five compounds all exceeded 2.28. The results showed that the BEH Amide column was more suitable for the chromatographic separation.
hydrophilic interaction liquid chromatography; cysteine; 2-xylulosylthiazolidine-4-carboxylic acid; glycine; glycine-Amadori; cysteine-Amadori; separation
10.7506/spkx1002-6630-201602011
TQ656.1
A
1002-6630(2016)02-0063-09
曹长春, 梁晶晶, 王蒙, 等. 亲水色谱柱对氨基酸及其美拉德反应初始中间体的分离[J]. 食品科学, 2016, 37(2): 63-71. DOI:10.7506/spkx1002-6630-201602011. http://www.spkx.net.cn
CAO Changchun, LIANG Jingjing, WANG Meng, et al. Separation of amino acids and their initial Maillard reaction intermediates by hydrophilic interaction liquid chromatography[J]. Food Science, 2016, 37(2): 63-71. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602011. http://www.spkx.net.cn
2015-06-30
国家自然科学基金面上项目(31371838;31171755);北京市教委科技发展计划重点项目(KZ20101001011);“十二五”国家科技支撑计划项目(2011BAD23B01)
曹长春(1990—),女,硕士研究生,研究方向为食品风味化学。E-mail:skyccchun@163.com
*通信作者:谢建春(1967—),女,教授,博士,研究方向为食品风味化学、热反应肉味香精。E-mail:xjchun@th.btbu.edu.cn

