p53可调控表达的B细胞淋巴瘤小鼠模型的建立
黄 亚, 王继军, 顾 欣, 庞 磊, 成 语, 张艳青, 郁多男, 2
(1. 扬州大学医学院RNA研究中心; 2. 扬州大学比较医学研究院, 江苏 扬州,225001)
p53可调控表达的B细胞淋巴瘤小鼠模型的建立
黄亚1, 王继军1, 顾欣1, 庞磊1, 成语1, 张艳青1, 郁多男1, 2
(1. 扬州大学医学院RNA研究中心; 2. 扬州大学比较医学研究院, 江苏 扬州,225001)
目的探讨p53可调控表达的B细胞淋巴瘤小鼠模型的建立。方法利用MYC过表达同时p53失活原理建立了B细胞淋巴瘤小鼠模型,利用敲入的可编码p53和雌激素受体(ER)融合蛋白p53 ERTAM的等位基因,可实现对p53的“失活”与“活化”两种状态的调控。结果过表达c-Myc及p53功能缺失足以使正常骨髓细胞恶变成为肿瘤细胞。RT-PCR证实肿瘤细胞呈Rag1阳性和TdT阴性,说明肿瘤细胞确实来源于B细胞的早期发育阶段。结论p53可调控小鼠B细胞淋巴瘤模型不仅具备B细胞淋巴瘤特征,而且可实现p53活性的可控。
p53; c-Myc; B细胞淋巴瘤; 小鼠模型
B细胞淋巴瘤是人淋巴系统最常见的恶性肿瘤,它们大多源自位于生发中心的B细胞,或源自经过生发中心反应的B细胞[1]。在中国B细胞淋巴瘤约占全部恶性肿瘤的3%左右,死亡率在恶性肿瘤中排第11~13位[2]。许多人类B细胞淋巴瘤是多克隆性的,这提示在肿瘤形成中有1~2个基因变异事件就可以引起肿瘤发生[3]。研究[4]发现Myc基因是一个定位于染色体8q24上的与细胞增殖密切相关的关键调控基因,常参与生发中心B细胞发生的人类淋巴瘤的染色体易位。这种易位在约10%的弥漫性大B细胞淋巴瘤和几乎所有散发性Burkitt淋巴瘤中出现。
Myc易位可使其受免疫球蛋白μ重链基因增强子(Eμ)的调控。Eμ-myc的转基因小鼠形成淋巴瘤有着人类母细胞淋巴瘤的病理特点,但其成瘤时间长约1年[5], 因此用其作为研究人类B细胞淋巴瘤存在一定困难。另外,在面临多种可能致癌因素比如DNA受损、缺氧、营养胁迫及促癌基因过表达时可以激发p53的活性[6]。在肿瘤形成过程中, p53活化信号是持续存在的,重启p53的肿瘤抑制通路也是目前肿瘤细胞特异性治疗策略之一[7]。本文利用MYC过表达同时p53失活原理建立了B细胞淋巴瘤小鼠模型,利用敲入的可编码p53和雌激素受体(ER)融合蛋白p53ERTAM的等位基因,可实现对p53的“失活”与“活化”两种状态的调控[8]。
1 材料与方法
1.1细胞与动物
1.1.1细胞培养: GP+E86包装细胞受赠于美国宾夕法尼亚大学Andrei Thomas-Tikhonenko实验室, DMEM, 10%胎牛血清, 10%双抗, 37℃, 5%CO2培养。
1.1.2质粒构建:以LXSN为逆转录病毒载体,成功构建过表达肿瘤基因c-Myc的LMycSN逆转录病毒。细胞转染: Lip 2000脂质体40 μL, gagpol 2 μg, vsvg 2 μg, LMycSN 10 μg, 混匀后室温静置20 min, 加入GP+E86细胞中,过夜后换液, 48 h后行neomycin (G418)筛选,细胞继续扩增培养。
1.1.3荷瘤: p53ERTAM小鼠受赠于美国加利福尼亚大学旧金山分校Gerard Evan实验室,并与扬州大学比较医学中心C57BL/6小鼠回交并做基因鉴定确认。方法:选用回交后的第8代小鼠,取小鼠股骨骨髓,用1 mL注射器吸取PBS冲洗出骨髓组织,并与已消化的转染LMycSN的GP+E86细胞混匀后,同时以空白载体LXSN及p53ERTAM小鼠骨髓组织为对照,选择6~8周C57BL/6小鼠作为宿主,5只一组,共3组,分别进行皮下荷瘤,观察成瘤效果。
1.2药物
肿瘤生长至约1.5 cm时,他莫昔芬(Sigma, T5648)超声溶解于玉米油(sigma, C8267)中, 1 mg/只,腹腔注射,1次/2 d。
1.3肿瘤组织Hematoxylin和Eosin (H&E)染色
切除肿瘤后,4%多聚甲醛固定,梯度脱水后石蜡包埋,切成4 μm/片,H&E染色。
1.4流式分析
细胞流式分析:分离肿瘤后,用70 μm尼龙网研磨,红细胞裂解液裂解红细胞后,肿瘤细胞用标记抗体。CD45R(B220)、CD19、CD4、CD8、CD11b、F4/80、CD11c、NK1.1、IgM、IgD抗体及凋亡检测试剂盒均购自BD公司,采用FACScalibur流式细胞仪分析肿瘤细胞表面标记及注射药物后肿瘤细胞早期凋亡变化。
1.5RT-PCR
研磨肿瘤组织并将研磨后的肿瘤细胞裂解于Trizol中,苯酚抽提,乙醇沉淀,提取出总RNA。纯化并反转录成cDNA, PCR扩增后将PCR产物上样于1.5%琼脂糖电泳。引物序列如下: gag-myc: TTGTACACCCTAAGCCTCCG(F,gag)、TGCTGCTGGTAGAAGTTCTC(R,myc); Rag-1: TGCAGACATTCTAG-CACTCTGG(F)、ACATCTGCCTTCACGTCGAT(R); TdT: GAAGATGGGAACAACTCGAAGAG(F)、CAGGTGCTGGAACATTCTGGGAG(R)。
2 结 果
将p53ERTAM小鼠骨髓细胞和可以分泌c-Myc逆转录病毒的病毒包装细胞GP+E86混合后经小鼠皮下注射,4周左右肿瘤可以生长成直径约1.5 cm。但是, p53ERTAM小鼠骨髓细胞本身或者只转染逆转录病毒空载体LXSN, 即没有过表达c-Myc的p53ERTAM小鼠骨髓细胞无法在相同时间内成瘤,在2个月之后也没有发现肿瘤。荷瘤结果为LMycSN成瘤时间28 d时为5/5, LXSN处死时间60 d时为0/5, p53ERTAM处死时间60 d时为0/5。这一结果表明,过表达c-Myc及p53功能缺失足以使正常骨髓细胞恶变成为肿瘤细胞。
组织学检测显示肿瘤组织由大量淋巴样细胞组成,细胞明显大于正常淋巴细胞,核分裂象明显增多,提示可能是淋巴瘤(图1A)。RT-PCR证实Myc逆转录病毒确实已经整合到肿瘤细胞的基因组DNA中(图1B)。流式细胞检测肿瘤细胞呈B220和CD19强阳性及CD43弱阳性,说明肿瘤细胞来源于B淋巴细胞。但IgM阴性说明这些肿瘤细胞来源于早期B淋巴细胞(图1C)。CD4、CD8阴性说明肿瘤细胞不是来源于T淋巴细胞, F4/80、CD11b阴性说明肿瘤细胞非来源于单核细胞, CD11c阴性说明肿瘤细胞非来源于树突状细胞, NK1.1阴性说明肿瘤细胞非来源于NK细胞 (图1C)。为了进一步证实肿瘤细胞确实来源于早期发育阶段的B淋巴细胞,作者利用RT-PCR证实肿瘤细胞呈Rag1阳性和TdT阴性,说明肿瘤细胞确实来源于B细胞的早期发育阶段[9](图1D、E)。


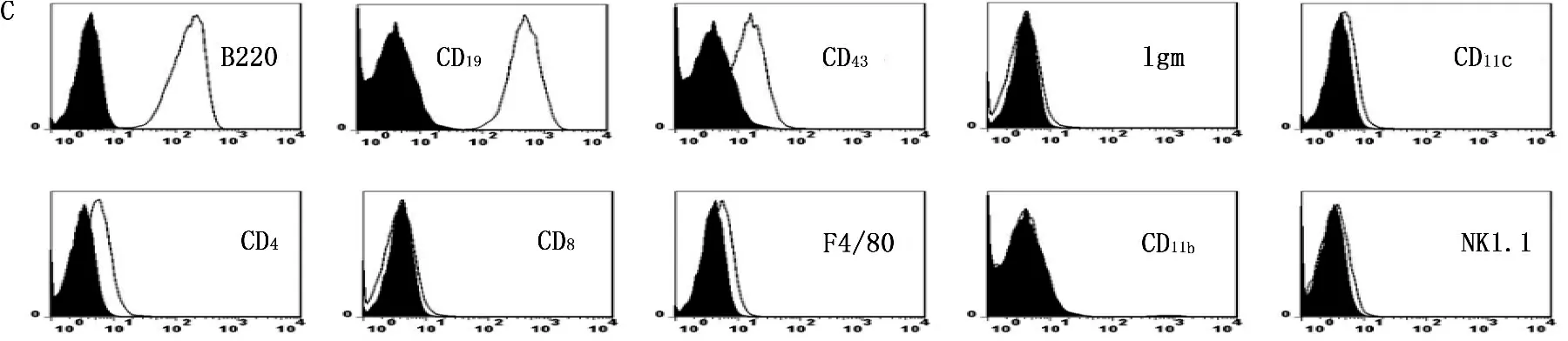


A: 肿瘤组织切片H&E染色(400倍); B: 肿瘤组织的gag-myc RT-PCR扩增后产物电泳图,1、2、3、4分别是不同小鼠的肿瘤组织,小鼠脾脏细胞为阴性对照, LMycSN质粒为阳性对照; C: 肿瘤细胞表面标记流式分析结果; D、E: 肿瘤组织的Rag1及TdT RT-PCR扩增后产物电泳图,1、2、3、4分别是不同肿瘤组织,人胃癌细胞株BGC823位阴性对照,小鼠胸腺细胞为阳性对照。
图1小鼠肿瘤的检测结果
对荷瘤小鼠腹腔注射他莫昔芬后肿瘤逐渐变小,4~6 d后在原荷瘤处已无肉眼可见肿瘤(图2A右侧)。事实上,注射他莫昔芬0.5和1 h后流式检测显示肿瘤细胞发生凋亡,凋亡率随着时间变化明显增加 (6.80%、25.5%)(图2B)。由于敲入的雌激素受体(ER)有突变,因此不受小鼠体内雌激素干扰。这充分提示他莫昔芬可以活化肿瘤细胞内p53, 实现p53的“开”与“关”两种状态的调控。

A: 小鼠肿瘤注射他莫昔芬前后比较,左图为未注射他莫昔芬时背部肿瘤,右图箭头所指为原肿瘤所在处;B: 注射他莫昔芬后0、0.5及1 h流式细胞仪检测肿瘤细胞早期凋亡情况。
图2小鼠肿瘤形成后注射他莫昔芬后肿瘤消失
3 讨 论
目前,建立B细胞淋巴瘤的动物模型的方法大致可分为自发型淋巴瘤模型、诱发型淋巴瘤模型、移植型淋巴瘤模型和基因工程型淋巴瘤模型[10]。作者研究发现将能产生编码myc的逆转录病毒的包装细胞与p53ERTAM骨髓细胞混合后皮下可以成瘤,而不是采用病毒上清感染,该方法感染率更高,方法更简便[11]。由于回交8代后p53ERTAM骨髓细胞与荷瘤宿主小鼠已基本同源,而包装细胞与荷瘤小鼠非同源,这样可避免包装细胞干扰成瘤结果。
p53作为抑癌基因在遏制肿瘤起始和进展中有着重要作用,它的功能有: ① 阻滞细胞周期。p53的调节功能主要体现在G1和G2/M期的周期阻滞。② 促进细胞调亡。③ 维持基因组稳定[12]。人类多种肿瘤中存在p53失活的现象[13]。大量研究[14-17]揭示了p53的下游靶基因,如p21、14-3-3-δ、Gadd45、Bax、PTEN等。近年来研究[18-20]发现p53可通过调控微小RNA抑制肿瘤形成及调控肿瘤干细胞的生物学特性。B细胞淋巴瘤的相关研究进展不断,但对淋巴瘤的发病原因、机制未完全明了,临床治疗效果不佳,预后差。作者发现p53可调控小鼠B细胞淋巴瘤模型不仅具备B细胞淋巴瘤特征,而且可实现p53活性的可控,提高临床治疗效果,为研究人类B细胞淋巴瘤及P53调控的靶基因以及淋巴瘤干细胞等提供了非常有用的动物模型。
[1]World Cancer Report. Geneva, Switzerland:World Health Organization, International Agency for Research on Cancer [R]. WHO Press, 2014: 706-707.
[2]郑荣寿, 张思维, 吴良有, 等. 中国肿瘤登记地区 2008 年恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2012, 21(1): 1-12.
[3]Pelicci P G, Knowles D M, Arlin Z A, et al. Multiple monoclonal B cell expansions and c-myc oncogene rearrangements in acquired immune deficiency syndrome-related lymphoproliferative disorders. Implications for lymphomagenesis[J]. J Exp Med, 1986, 164, 2049-2060.
[4]Chi V D. MYC on the Path to Cancer[J]. Cell, 2012, 149(1): 22-35.
[5]Harris A W, Pinkert C A, Crawford M, et al. The E mu-myc transgenic mouse. A model for high-incidence spontaneous lymphoma and leukemia of early B cells[J]. J Exp Med, 1988, 167: 353-371.
[6]Wade M, Wang Y V, Wahl G M. The p53 orchestra: Mdm2 and Mdmx set the tone[J]. Trends Cell Biol, 2010, 20(5): 299-309.
[7]Liu Y, Shannon E, Yasuhiko Miyata, et al. p53 regulates hematopoietic stem cell quiescence[J]. Cell Stem Cell, 2009, 4(1): 37-48.
[8]Christophorou M A, Martin-Zanca D, Soucek L, et al. Temporal dissection of p53 function in vitro and in vivo[J]. Nat Genet, 2005, 37: 718-726.
[9]Steven H S, Elias C, Stefano A P, et al. The 2016 revision of the World Health Organization (WHO) classification of lymphoid neoplasms[J]. Blood, 2016, 127 (20): 2391-405.
[10]熊豫麟, 张远旭, 黄云超, 等. 淋巴瘤实验动物模型构建的研究与应用[J]. 广东医学, 2014, 35(9): 1429-1432.
[11]Duonan Yu, Andrei Thomas-Tikhonenko. A non-transgenic mouse model for B-cell lymphoma: in vivo infection of p53-null bone marrow progenitors by a Myc retrovirus is sufficient for tumorigenesis[J]. Oncogene, 2002, 21: 1922-1927.
[12]Deb S P. Mutant p53 and MDM2 in Cancer[M]. Springer Netherlands, 2014: 10-12.
[13]Petitjean A, Mathe E, Kato S. Impact of mutant p53 functional properties on TP53 mutation patterns and tumor phenotype: lessons from recent developments in the IARC TP53 database[J]. Hum Mutat, 2007, 28: 622-629.
[14]Meek D W. Regulation of the p53 response and its relationship to cancer[J]. Biochem J, 2015, 469(3): 325-46.
[15]Hünten S, Kaller M, Drepper, et al. p53-Regulated Networks of Protein, mRNA, miRNA, and lncRNA Expression Revealed by Integrated Pulsed Stable Isotope Labeling With Amino Acids in Cell Culture (pSILAC) and Next Generation Sequencing (NGS) Analyses[J]. Mol Cell Proteomics, 2015, 14(10): 2609-29.
[16]Chang C J, Chao C H, Xia W, et al. p53 regulates epithelial-mesenchymal transition and stem cell properties through modulating miRNAs[J]. Nat Cell Biol, 2011, 13(3): 317-23.
[17]吴俭, 金国强, 杨利丽, 等. 复方丹参注射液对感染性休克大鼠脑损伤时一氧化氮、B-细胞淋巴瘤-2蛋白及S100的影响[J]. 中华实用儿科临床杂志, 2014, 29(10): 97-101.
[18]林东京, 傅迪, 彭梅, 等. 美罗华联合CHOP方案与依托泊苷联合CHOP方案治疗弥漫大B细胞淋巴瘤临床研究[J]. 中国实用内科杂志, 2016(1): 60-63.
[19]刘瑜, 王劲, 曾艳, 等. 自体外周血造血干细胞移植术治疗弥漫大B细胞淋巴瘤的临床研究[J]. 实用临床医药杂志, 2015, 19(11): 12-14.
[20]苏毅, 赖思含, 易海, 等. 异基因造血干细胞移植术治疗自体造血干细胞移植术后复发的恶性淋巴瘤17例效果分析[J]. 第三军医大学学报, 2012, 34(24): 2456-2458.
Establishment of a B lymphoma rat model with regulatable expression of p53
HUANG Ya1, WANG Jijun1, GU Xin1, PANG Lei1, CHENG Yu1,ZHANG Yanqing1, YU Duonan1, 2
(1.RNAResearchCenterofCollegeofMedicineofYangzhouUniversity;2.InstituteofComparativeMedicineofYangzhouUniversity,Yangzhou,Jiangsu, 225001)
ObjectiveTo explore the establishment method of a B lymphoma rat model with regulatable expression of p53. MethodsThe B lymphoma rat model with regulatable expression of p53 was established by MYC over expression and p53 inactivation principles, and the “deactivation” and “activation”of p53 were regulated by the encoding p53 and allelic gene of estrogen receptor (ER) fusion protein p53ERTAM. ResultsOver-expressed c-Myc and the functional deficiency of p53 was able to make normal bone marrow cells become malignant tumor cells. RT-PCR confirmed that the tumor cells were positive for Rag1 and negative for TdT, which proved that the tumor cells did originate from the early stage of B cells. ConclusionThe B lymphoma rat model with regulatable expression of p53 not only has the characteristics of B cell lymphoma, but also can realize the control of p53 activity.
p53; c-Myc; B cell lymphoma; rat model
2016-06-10
国家自然科学基金(NO.81470277); 江苏省高等教育优先发展项目; 中央财政(生物医学)创新团队项目
郁多男
R 733
A
1672-2353(2016)19-001-04DOI: 10.7619/jcmp.201619001

