黑美人葡萄组培育苗技术研究
王林德
(甘肃省武威市林业综合服务中心,甘肃 武威 733000)
黑美人葡萄组培育苗技术研究
王林德
(甘肃省武威市林业综合服务中心,甘肃武威733000)
通过对黑美人葡萄组培外植体选择、灭菌、启动分化、初代、继代、生根培养基进行对比筛选研究,以期建立黑美人的再生体系。结果表明:1/2MS培养基附加6-BA1.0mg/L+IAA0.1mg/L、6-BA0.05mg/L+IAA1.0mg/L、IBA1.0mg/L+活性炭0.2mg/L对茎段腋芽萌发、继代繁殖、生根培养的效果较好;继代繁殖周期在25d较为适宜;河沙:腐殖质=1:1的基质,移栽成活率达92%。
黑美人葡萄;茎段;组织培养
“黑美人”是由“美人指”实生选育而成的优质中晚熟葡萄新品种。该品种果穗长圆锥形,果粒着生紧凑,大小整齐,平均穗重850~980g,平均粒重9.5g,最大粒重13g。果粒长椭圆形,蓝黑色,果粉厚,果皮薄,果肉较软,可溶性固形物含量18%~19.5%。“黑美人”遗传性状稳定,植株生长势强,稳产高产,着色好,易管理。而且果实成熟后留树时间长,适宜温室栽培,具有良好的推广应用前景[1]。本研究对黑美人葡萄组培中的样品采集处理、培养基选择、优化及炼苗移栽进行研究总结,确定了技术关键,为我市葡萄产业发展提供了优良品种。
1 供试材料
供试材料取自武威市林业综合服务中心2012年引进,并收集保存于武威市林木良种繁育中心葡萄品种园中的黑美人葡萄。
2 试验方法
2.1样品的采集及处理
采集当年生枝条距离顶部约4~8cm并带有2~4个节位芽的嫩枝,剪去叶片,用无菌水冲洗后,在超净工作台内按以下步骤操作:0.1%升汞液消毒3~5min;无菌水漂洗5次后用灭菌滤纸吸干水分;切成1.0~2.0cm长单芽茎段,接种于培养基上;接种后置于2支40瓦日光灯下(光强约2500Ix)进行茎段萌芽诱导、继代繁殖、生根培养,每天光照9±1h,温度25~30℃。
2.2培养基选择
离体萌芽诱导、继代繁殖、生根3类培养基均加入蔗糖3%,琼脂0.4%,pH值为5.8。其中,离体萌芽诱导培养采用MS、1/2MS、GS三种培养基,并分别附加植物生长调节剂6-BA1.0mg/L+IAA0.1mg/L和6-BA1.0mg/L+NAA0.1mg/L2组配比,进行茎段腋芽诱导发芽对比试验。继代繁殖培养采用MS、1/ 2MS两种培养基分别附加 6-BA0.02~0.1mg/L+ IAA0.5~2.0mg/L,定期观察小苗节位生长速度。生根培养基采用 MS、1/2MS两种培养基,分别附加IBA1.0mg/L+NAA0.2mg/L、IBA1.0mg/L+活 性 炭0.2mg/L和IBA0.5~1.0mg/L+IAA0.01mg/L。
2.3培养基优化
将清洗消毒处理后的外植体剪为1.0~1.5cm带芽茎段接种于(MS+6-BA1.0mg/1+NAA0.2mg/1,0.7%琼脂粉,pH5.8~6.0)基本培养基中。研究3%蔗糖与白砂糖、蒸馏水与自来水配置培养基对外植体诱导的影响。每个处理3个重复,每个重复接种50个外植体,培养温度为(25±2)℃,光照强度2500lx,光照时间10h/d。30d后统计腋芽诱导率。
2.4组培苗炼苗、移栽及定植
组培苗生根、炼苗后,在装有自动喷雾保湿装置的塑料大棚内,移栽于各种不同基质的穴盘内,成活后出圃定植。
3 结果与分析
3.1不同种类培养基对茎段腋芽萌发的影响
MS、1/2MS、GS三种培养基附加植物生长调节剂对葡萄腋芽萌发诱导培养结果表明:1/2MS培养基茎段腋芽萌发率最高,MS、GS培养基次之。其萌发率分别为32.0%、33.3%和28.7%。但在附加NAA配比的培养基上,接种1周后茎段外植体生长良好、饱满,随后迅速膨胀肿大,形成愈伤组织块,明显抑制茎段腋芽的萌发,三种培养基萌发率均<5%。表明该品种对NAA较为敏感,与已有的研究报道[2]基本类似。因此,本品种诱导培养以1/2MS培养基附加6-BA1.0mg/L+IAA0.1mg/L为宜,见表1。
3.2不同种类培养基对继代繁殖的影响

表1 不同培养基茎段腋芽萌发率%
将离体诱导萌发的幼芽,切成带有腋芽和叶片的小芽段,插在不同的培养基上繁殖,25d、30d、35d节位抽生数见表2。结果表明:附加6-BA0.05mg/L+ IAA1.0mg/L在1/2MS培养基上生长的小芽,25d内可生长3个以上的节位,可满足组培快繁要求的繁殖系数。35d后节位抽生速度相对降低。
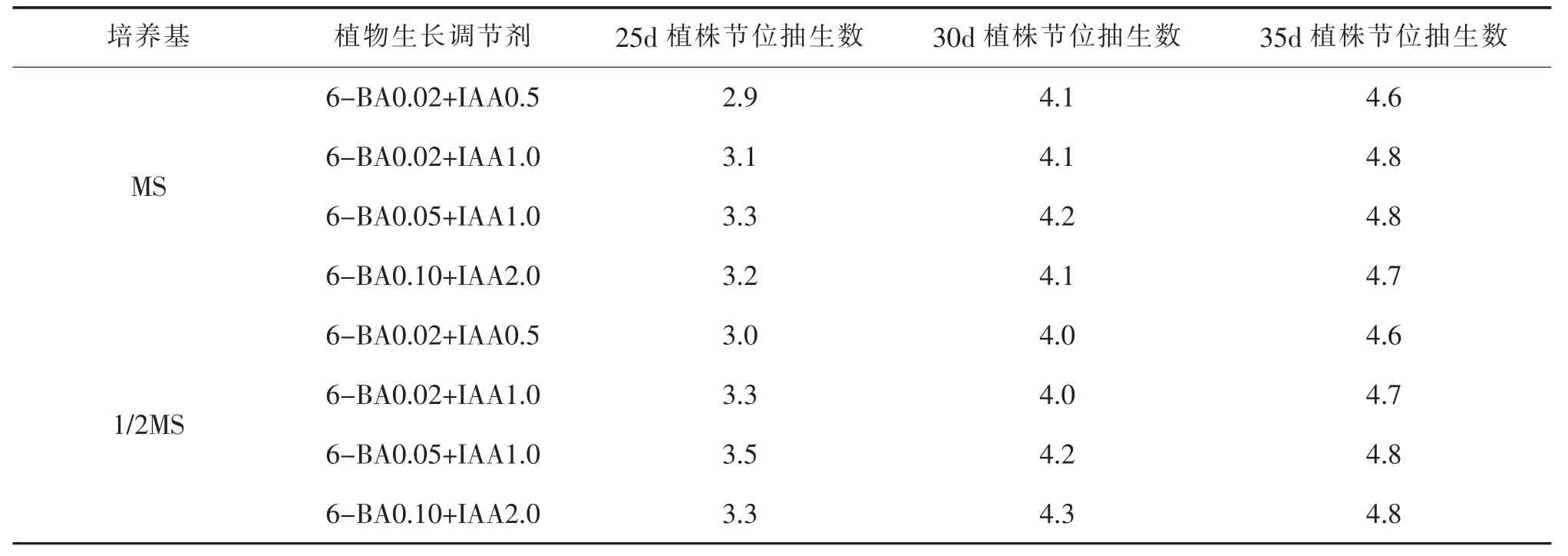
表2 不同培养基对继代繁殖的影响
3.3不同碳源和水对腋芽增殖的影响
组织培养需要大量配制培养基,除去蔗糖、琼脂等的消耗外,以蒸馏水消耗最大,一般使用为二重蒸馏水。自来水与二重蒸馏水微量元素与金属离子相差极大,同样蔗糖与白砂糖成本也相差较大。在有些植物增殖培养阶段,可用白砂糖代替蔗糖,用自来水代替蒸馏水[3]。在有些植物的组织培养中,也可以将自来水煮沸以降低其中Ca2+、Mg2+等离子浓度,从而用自来水代替蒸馏水[4]。但也有相关研究者表示怀疑。为了在研究中加以验证,在上述增殖和生根试验的基础上,用白砂糖代替蔗糖,用煮沸的自来水代替蒸馏水,分别研究其对增殖的影响(见表3)。

表3 不同碳源和水对金叶锦带腋芽增殖的影响
由表3可知,蔗糖和白砂糖对腋芽的出芽率影响无显著差异,表明蔗糖和白砂糖均可用于黑美人葡萄腋芽的快繁培养,在产业化生产中,可以用白砂糖替代蔗糖。煮沸的自来水对新生芽诱导率显著降低,表明水质对其的快繁影响较大。因此,在黑美人葡萄组培生产中,不能使用自来水代替蒸馏水。
3.4不同植物生长调节剂对生根的影响
由表4可以看出:所有参试的植物生长调节剂均能促使植株生根。附加IBA1.0mg/L+BA0.01mg/L的培养基生根效果较佳。附加NAA的培养基,植株根部愈伤组织产生率高达16%,严重的可阻止根系生长,影响移植成活率。

表4 不同植物生长调节剂对生根的影响
3.5不同基质对组培苗移栽成活率的影响
组培苗生根后,先置于2500~3000lx自然散射光下炼苗20~30d;在装有自动喷雾装置的塑料大棚内,移植于各种不同基质的穴盘内对比试验,光照强度从弱逐渐增强,控制在约2500~3000lx之间,湿度在90%以上。移植成活后移入营养杯,30d小苗老熟后出圃定植。移栽基质最佳配比为:河沙:腐殖质1:1,成活率高达92%。
4 讨论与结论
本研究结果表明,使用1/2MS培养基附加6-BA1.0mg/L+IAA0.1mg/L、6-BA0.05mg/L+IAA1.0mg/ L、IBA1.0mg/L+活性炭0.2mg/L对茎段腋芽萌发、继代繁殖、生根培养均有较好的效果。继代繁殖周期在25d较为适宜,繁殖系数达1:3以上,可满足组培快繁的要求。使用河沙:腐殖质=1:1的基质,移栽成活率高达92%。对该品种开展组培快繁,应用于规模化生产,从条件和技术操作上是可行的。
本试验使用含有NAA的培养基时,植株极易产生愈伤组织,茎段腋芽萌发无效。如何把握NAA的用量和使用方法以及探索更有效的组培配方,解决植株玻璃化和愈伤组织产生现象等问题有待于进一步研究。
[1] 赵占春,徐卫东,孙素芬,等.葡萄新品种“黑美人”的选育及其栽培技术要点[J].中国南方果树,2015,44(4):125-127.
[2] 邹瑜,牟海飞,吴代东,等.野生毛葡萄两性花优良株系种苗繁育技术研究[J].中国南方果树,2011,40(3):76-78.
[3] 闫爱玲,徐海英,张国军.香妃葡萄的简化组培快繁[J].落叶果树,2006,38(2):8-9.
[4] 陈佰鸿,张军拾.自来水的软化处理在葡萄组织培养中的应用[J].甘肃农业大学学报,2002.3(37):290-294.
S722.8

