基于涂膜法FTIR的食用油羰基值快速检测
李易文,陈 倩,张 鹏,李 晶,张 睿,于修烛*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
基于涂膜法FTIR的食用油羰基值快速检测
李易文,陈 倩,张 鹏,李 晶,张 睿,于修烛*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
为了建立食用油羰基值快速检测方法,以菜籽油为实验材料,茴香醛为羰基标准物配制系列羰基值(0~60 mmol/kg)油量。用涂膜法采集油量光谱,建立羰基值与特征吸收峰1 703/1 570 cm-1处(1 703 cm-1处峰高两点基线均为1 570 cm-1,下同)吸光度的关系。然而,不同种类零羰基值的食用油在特征吸收峰1 703 cm-1处的吸收不相同而引起基底效应。因此,利用二维相关振动光谱技术寻找特征吸收峰的相关吸收峰,以校正食用油间的基底效应。结果表明:油量在1 703 cm-1处的吸光度与羰基值高度线性相关,利用相关吸收峰3 472 cm-1校正后的模型为y=0.005 4x+0.090 9;相关系数(R)为0.991 9,标准偏差(s)为0.013 mmol/kg。模型预测值与国标法测定值高度线性相关,所得方程的斜率接近于1,R值均在0.99以上,两种方法测定结果十分接近。表明涂膜法傅里叶变换红外光谱检测食用油羰基值是可行的。
食用油;傅里叶变换红外光谱;羰基值;检测
李易文, 陈倩, 张鹏, 等. 基于涂膜法FTIR的食用油羰基值快速检测[J]. 食品科学, 2016, 37(8): 226-230. DOI:10.7506/ spkx1002-6630-201608041. http://www.spkx.net.cn
LI Yiwen, CHEN Qian, ZHANG Peng, et al. Rapid Fourier transform infrared spectroscopic (FTIR) determination of carbonyl value in edible oils using polyethylene film[J]. Food Science, 2016, 37(8): 226-230. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201608041. http://www.spkx.net.cn
油脂氧化生成氢过氧化物,可进一步分解产生醛和酮等羰基化合物[1-4]。羰基值是食用油氧化的重要安全性指标之一[5-7],其国标法检测是基于比色法对碱性条件下生成的腙类显色物质定量测定[8]。Endo等[9-10]分别用异丙醇和正丁醇取代苯进行改进研究,结果较好。李昌模[11]用正丁醇作溶剂,己醛作标准物质对传统苯法进行改进,取得较好的研究结果,但己醛具有一定毒性,且操作较为复杂。王亚鸽等[12]利用近红外光谱在9 739~6 274 cm-1范围内进行偏最小二乘法建模,实现对煎炸油羰基值的实时监控,但方法需要大量的建模量品,对光谱的预处理也较为复杂。傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)技术测定快速准确,已广泛应用于食用油的掺假及煎炸过程中劣变的监控与检测[13-14]。Zhang Han等[15]通过FTIR衰减全反射光谱技术在4 000~650 cm-1范围内偏最小二乘法建立土豆煎炸过程中羰基值的检测模型,但FTIR衰减全反射光谱技术液池光程短(5~7 μm),光谱信号弱,其检测精度不高。
本研究小组构建基于涂膜法FTIR技术,即把油量涂在聚乙烯(polyethylene,PE)等介质薄膜上,通过油脂特征吸收峰来校正量品光程。该法已经成功应用于食用油中地沟油掺伪检测,游离脂肪酸、过氧化值和反式脂肪酸的定量分析[12,16-18]。本研究以无毒且溶解性好的茴香醛为标准物质配制标准油量,采用涂膜法FTIR建立食用油羰基值的红外检测模型,并校正由油脂种类间差异引起的基底效应,使模型具有通用性。同时比较模型的预测值与国标法的测定值,以期为食用油羰基值的快速检测提供参考。
1 材料与方法
1.1材料与试剂
菜籽油(金龙鱼牌,浸出)、油茶籽油(金龙鱼牌)、食用调和油(金龙鱼牌,浸出) 益海嘉里(兴平)投资有限公司;大豆油(福临门牌,浸出) 中粮食品营销有限公司;山茶油(大康时代,压榨) 内蒙古万利福生物科技有限公司;亚麻籽油(关中油坊牌,冷榨) 陕西关中油坊油脂有限公司;各类散装食用油,不同氧化程度的油脂,均购于陕西省杨凌区某农贸市场。
茴香醛(纯度98%) 阿拉丁试剂公司;2,4-二硝基苯肼、氢氧化钾、甲苯、浓硫酸、三氯乙酸、无水乙醇均为分析纯;硅胶(60~100 目);超凡牌PE保鲜膜浙江超凡日用品有限公司。
1.2仪器与设备
FTIR光谱仪(检测器为氘化硫三肽) 德国布鲁克公司;OMNIC 7.3和TQ Analyst 7.2分析软件 美国尼高力公司;UV-1240紫外-可见分光光度计 日本岛津公司。
1.3方法
1.3.1油量配制
取适量硅胶在120 ℃条件下活化4~5 h,装成一定大小硅胶柱,菜籽油过硅胶柱以去除油中游离脂肪酸和氢过氧化物等,其羰基值为未检出,不影响建模精度可视为零羰基值[18]。处理后的菜籽油中添加茴香醛,配制成羰基值为0~60 mmol/kg的标准量品。用25 g零羰基值菜籽油制备油量时,每10 mmol/kg羰基值需添加茴香醛0.034 g,混合均匀,在4 ℃冰箱中保存备用。
1.3.2羰基值测定
参照GB/T 5009.37—2003《食用植物油卫生标准的分析方法》中羰基值的测定。
1.3.3光谱采集与处理
光谱采集条件为:光谱范围为6 000~400 cm-1,温度设定为25 ℃,相对湿度为20%,分辨率为4 cm-1,扫描次数为16 次,以PE膜为背景。在测定过程中由于受噪音和空气湿度等因素的影响,可能会使红外光谱的某些信息被噪音掩盖或干扰,基线发生倾斜或漂移等影响建模精度[12,19],因而用OMNIC 7.3软件进行基线校正等处理。
1.3.4建立模型
将100 µL油量均匀涂覆在PE薄膜上进行光谱扫描。为确保不同油量通过相同光程,根据食用油在4 334/4 300 cm-1处特征吸收,将不同油量光谱的光程统一为0.1 mm[20],测定光谱1 703 cm-1处吸光度并与羰基值建立关系。尽快完成光谱采集和羰基值测定,以减小实验误差。
1.3.5校正基底效应
由于油脂种类的差异性,不同种类的硅胶处理油在特征吸收峰(1 703 /1 570 cm-1)处有不同的吸光度(图3),因而造成基底效应,影响模型的通用性。二维相关振动光谱技术是由Noda于1986年提出,1993年对原有理论进行改进发展而来的,到目前为止,该技术已经被广泛应用于红外、近红外、拉曼、紫外等光谱分析[12,18-22]。本研究利用该技术寻找特征吸收峰(1 703 cm-1)的相关吸收峰[22]。利用Wang Yan等[23]所建立的方法将二维光谱区域选择为羰基的特征吸收峰范围1 900~1 650 cm-1与红外光谱其他区域范围4 000~1 900 cm-1和1 650~400 cm-1进行二维相关分析,先在不同种类的硅胶处理油中寻找特征吸收峰与相关吸收峰的线性关系(相关系数(R)大于0.95),后在不同羰基值食用油(羰基值在0~60 mmol/kg之间)中验证所选相关吸收峰的可行性,并校正模型以消除基底效应。
1.3.6验证模型
配制验证油量,即添加不同含量茴香醛的油脂,并采用涂膜法扫描其红外光谱,统一光程为0.1 mm。根据特征吸收峰(1 703/1 570 cm-1)和相关吸收峰(3 472/3 348 cm-1)关系及基底效应校正后的模型预测油量中羰基值。同时利用国标法进行检测,并建立其检测值与模型预测值的关系,验证模型预测值与国标法测定值的一致性。
1.3.7盲量验证
为验证模型的可靠性和茴香醛作为标准物质表示油脂自然氧化所产生羰基物质的可行性,从市面上采集7 种不同氧化程度的油脂作为盲量油量(不同自然氧化程度的菜籽油、大豆油、亚麻籽油、调和油、以上油脂混合油),分别用模型预测和国标法测定,比较两种方法测定结果的相关性。
1.4数据分析
通过建立模型预测值与国标法测定值间的线性关系判断所建方法的可行性。采用相关系数(R)和标准偏差(s)判断二者相关性和一致性。
2 结果与分析
2.1光谱分析结果
茴香醛在油脂中有较好的溶解性,具有一定的香味、无毒,且分子质量较大,便于配制量品,茴香醛中的C=O基团在1 700 cm-1附近有较强的特征吸收峰[24]。以茴香醛为羰基值标准物质,其与零羰基菜籽油混合油量光谱见图1。

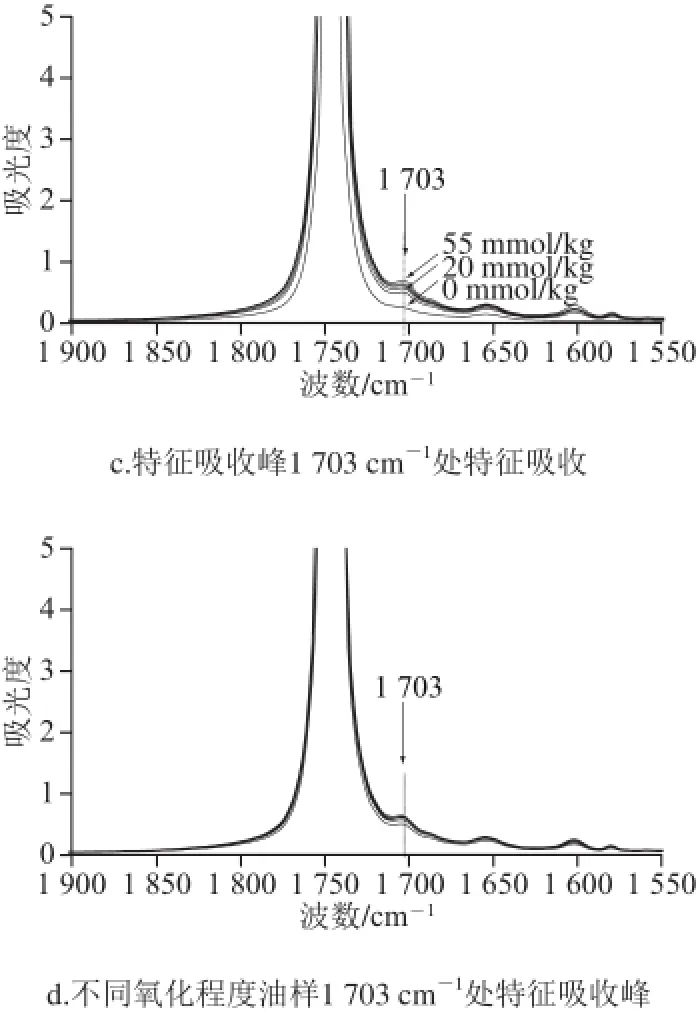
图1 不同含量茴香醛和零羰基菜籽油及不同氧化程度油样光谱Fig.1 Spectra of carbonyl-free rapeseed oils spiked with anisaldehyde and differently oxidized oils
图1a为油量在4 000~400 cm-1范围内的光谱,光谱各吸收峰明显清晰,且光谱范围1 720~1 470 cm-1的RSN值为0.122 3,可满足检测需求。由图1b可以看出,零羰基菜籽油和添加茴香醛的混合油在C=O振动区域有共同的吸收峰,分别在1 652 cm-1和1 703 cm-1处。茴香醛为对羟基苯甲醛,官能团有苯环、醛基和甲氧基,其中苯环、C—H、C—O、C=O振动区域分别在1 675~1 500、3 300~2 700、1 300~1 000 cm-1和1 900~1 650 cm-1。茴香醛中C=O振动区域与茴香醛其他官能团振动区域重合较少,对羰基值测定影响较小;苯环和羰基在1 652 cm-1可能有重合吸收,影响羰基值的测定;食用油本身在1 745 cm-1处即有较高吸收,其吸光度均大于5,无法实现定量分析;零羰基食用油在1 703 cm-1处无明显的吸收,添加茴香醛后有明显的特征吸收峰(图1c),且存在明显的量效关系。由图1d可以看出,不同氧化程度的食用油光谱在1 720~1 470 cm-1有明显吸收峰,在1 703 cm-1处有较为明显的吸收峰,这与C=O振动吸收有关。由此,可选用1 703 cm-1作为羰基值测定的特征吸收峰。
2.2建立模型
油量在1 703 /1 570 cm-1峰高处的吸光度与其羰基值的关系见图2。油量在1 703/1 570 cm-1处的吸光度与其羰基值线性高度相关,所得模型为y=0.005 4x+0.449 9(其中,x为油量的羰基值/(mmol/kg);y为油量在1 703 cm-1处的吸光度)。模型的R为0.991 8,且标准偏差为0.013 9 mmol/kg,表明模型可行。
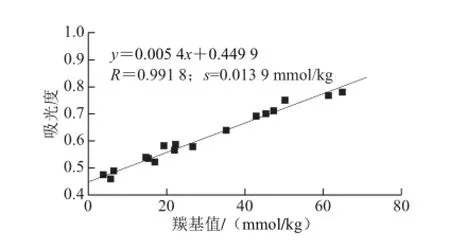
图2 羰基值检测模型Fig.2 Linear model for the determination of carbonyl value
2.3校正基底效应
利用二维光谱技术寻找特征吸收峰(1 703 cm-1)的相关吸收峰,后在不同羰基值的油量中进行验证,表明3 472 cm-1受羰基值的影响较小。7 种不同种类硅胶处理油在特征吸收峰(1 703 cm-1)和相关吸收峰(3 472 cm-1)处的光谱见图3以及其关系见图4。

图3 7 种不同种类的零羰基油脂在1 715~1 690 cm-1(a)和3 500~3 440 cm-1(b)的光谱Fig.3 Spectra in different absorption regions (1 715-1 690 cm-1) and(3 500-3 440 cm-1) of 7 different carbonyl-free oils

图4 特征吸收峰(1 703/1 570 cm-1)和相关吸收峰(3 472/3 348 cm-1)的关系Fig.4 Relationship between characteristic absorption peak (1 703/ 1 570 cm-1) and relevant absorption peak (3 472/3 348 cm-1)
由图3a可知,7 种零羰基值的油量在特征吸收峰1 703 cm-1处的吸收强度不同,可能与食用油中脂肪酸组成和碳链长度有关,基于菜籽油所建模型不具有通用性,需校正基底效应。利用二维相关振动光谱技术寻找到特征吸收峰(1 703 /1 570 cm-1)的相关吸收峰(3 472/3 348 cm-1),此处吸光度与羰基吸收不相关且几乎不因羰基值的不同而变化,如图3b所示,可用于校正模型。图4为特征吸收峰(1 703/1 570 cm-1)和相关吸收峰(3 472/3 348 cm-1)的线性关系。校正基底效应后所得模型为y=0.005 4x+0.090 9,R=0.991 9,s=0.013 mmol/kg。
2.4验证模型
分别用国标法和所建方法测定同一组添加不同含量茴香醛的油量,国标法测定值与模型预测值的关系见图5。

图5 模型验证Fig.5 Model validation with nisaldehyde spiked sample
由图5可知,国标法测定值与模型预测值相关方程的斜率接近于1,截距接近于0,R值大于0.99,说明模型预测值与国标测定值相一致,表明基于涂膜法FTIR技术建立的模型可行。
2.5盲量验证
分别用模型预测和国标法测定7 种采集的不同种类、不同氧化程度的油脂,涂膜法FTIR建立的检测方法与国标法测定结果关系如图6所示。

图6 盲样验证Fig.6 Model validation with blind samples
由图6可知,盲量验证中国标法测定值与模型预测值相关方程的斜率接近于1,截距接近于0,R值大于0.99,表明模型预测值与国标测定值十分接近。通过相对偏差计算,其值均小于5%,测定结果符合有关国标规定,进一步表明方法可行性。
2.6准确度和精密度分析
随机取5 个量品测定其平均相对误差,相对误差范围为0.4%~4.6%,均小于5%,表明模型具有较高的准确度;采用模型法平行测定量品羰基值6 次,测得羰基值分别为15.75、15.73、15.91、15.80、15.60、16.16 mmol/kg,其相对标准偏差为1.23%,表明模型具有较高的精密度,方法的稳定性较好。
3 结 论
茴香醛和菜籽油混合油量在1 703 cm-1处吸光度与羰基值高度线性相关,同时利用二维相关振动光谱技术检测到特征吸收峰(1 703 cm-1)的相关吸收峰(3 472 cm-1),并建立相关关系以校正模型基底效应。校正后的模型方程为y=0.005 4x+0.090 9;R为0.991 9,s为0.013 mmol/kg;
模型预测值与国标法测定值高度线性相关,所得方程的斜率接近于1,R均在0.99以上,两种方法测定结果十分接近。表明基于涂膜法FTIR的食用油羰基值模型可行,检测速度快,其推广应用前景广阔。
[1] 王莹辉, 刘玉兰, 李时军, 等. 米糠油在油条煎炸过程中的品质变化研究[J]. 中国油脂, 2013, 38(12): 28-32.
[2] 王继强, 龙强, 李爱琴, 等. 油脂氧化的因素、危害和预防措施[J].饲料广角, 2014(5): 29-31.
[3] 徐嘉杰, 邵亮亮, 李晔, 等. 食用油高温煎炸后的指纹标记研究[J].食品科学, 2013, 34(1): 127-130.
[4] 黄锦燕, 张全美, 王守卿, 等. 采用甲醇提取-气相色谱法检测食用油中两种抗氧化剂的研究[J]. 化学分析计量, 2011, 20(5): 89-91. DOI:10.3969/j.issn.1008-6145.2011.05.027.
[5] FARHOOSH R, MOOSAVI S M. Carbonyl value in monitoring of the quality of used frying oils[J]. Analytica Chimica Acta, 2008, 617(1/2): 18-21. DOI:10.1016/j.aca.2007.11.049.
[6] DU Rui, LAI Keqiang, XIAO Zhuqing, et al. Evaluation of the quality of deep frying oils with Fourier transform near-infrared and midinfrared spectroscopy[J]. Journal of Food Science, 2012, 77(3): 261-266. DOI:10.1111/j.1750-3841.2011.02551.X.
[7] 周婷, 李志健. 不同介质热处理对油脂酸值和羰基值的影响[J] . 粮油食品科技, 2015, 23(2): 40-43.
[8] KUMAZAWA H, OYAMA T. Estimation of total carbonyl content in oxidized oil by 2,4-dinitrophenylhydrazine[J]. Journal of the American Oil Chemists, 1965, 14: 167-171. DOI:10.5650/jos1956.14.167.
[9] ENDO Y, LI C M, TAGIRI-ENDO M, et al. A modified method for the estimation of total carbonyl compounds in heated and frying oils using 2-propanol as a solvent[J]. Journal of the American Oil Chemists Society, 2001, 78(10): 1021-1024. DOI:10.1007/s11746-001-0381-1.
[10] ENDO Y, TOMINAGA M, TAGIRI-ENDO M, et al. A modified method to estimate total carbonyl compounds in frying oils using 1-butanol as a solvent[J]. Journal of Oleo Science, 2003, 52: 353-358. DOI:10.5650/jos.52.353.
[11] 李昌模. 使用正丁醇作溶剂测定高温氧化油脂羰基值[J]. 中国油脂,2006, 31(6): 78-79.
[12] 王亚鸽, 张静亚, 于修烛, 等. 近红外光谱的煎炸油羰基值检测及监控研究[J]. 中国粮油学报, 2014, 29(2): 105-109; 114.
[13] HOCEVAR H, SOARES V, OLIVEIRA F, et al. Application of multivariate analysis in mid-infrared spectroscopy as a tool for the evaluation of waste frying oil blends[J]. Journal of the American Oil Chemists Society, 2012, 89: 781-786. DOI:10.1007/s11746-011-1968-8.
[14] ZHANG Qing, LIU Cheng, SUN Zhijian, et al. Authentication of edible vegetable oils adulterated with used frying oil by Fourier transform Infrared spectroscopy[J]. Food Chemistry, 2012, 132: 1607-1613. DOI:10.1016/j.foodchem.2011.11.129.
[15] ZHANG Han, MA Jinkui, MIAO Yelian, et al. Analysis of carbonyl value of frying oil by Fourier transform infrared spectroscopy[J]. Journal of Oleo Science, 2015, 64(4): 375-380. DOI:10.5650/jos. ess14201.
[16] YU Xiuzhu, LI Qinghua, SUN Daijun, et al. Determination of the peroxide value of edible oils by FTIR spectroscopy using polyethylene films[J]. Analytical Methods, 2015, 7(5): 1727-1731. DOI:10.1039/ C4AY02718C.
[17] DONG Xiaobin, LI Qinghua, SUN Daijun, et al. Direct FTIR analysis of free fatty acids in edible oils using disposable polyethylene films[J]. Food Analytical Methods, 2015, 8(4): 857-863. DOI:10.1007/s12161-014-9963-y.
[18] 陈瑶, 安铁梅, 刘冬蕊, 等. 固相比色快速检测油炸食品中油脂过氧化值[J]. 粮油食品科技, 2012, 20(5): 33-35.
[19] 范璐, 王美美, 杨红卫, 等. 傅里叶变换红外吸收光谱识别五种植物油的研究[J]. 分析化学, 2007, 35(3): 390-392. DOI:10.3321/ j.issn:0253-3820.2007.03.016.
[20] 孙黛君, 朱旭菲, 董晓斌, 等. 基于涂膜法FTIR光谱的地沟油掺伪定性分析[J]. 中国粮油学报, 2014, 29(5): 120-124.
[21] 张雯, 曹玉珍, 刘蓉, 等. 基于二维相关中红外光谱技术的无创血糖检测特异性研究[J]. 光谱学与光谱分析, 2012, 32(6): 1507-1511.
[22] 于修烛, 杜双奎, 李志西, 等. 基于傅里叶红外光谱重组技术的食用油检测改进研究[J]. 农业机械学报, 2009, 40(10): 129-134.
[23] WANG Yan, MURAYAMA K, MYOJO Y, et al. Two-dimensional Fourier transform near-infrared spectroscopy study of heat denaturation of ovalbumin in aqueous solutions[J]. Journal of Physical Chemistry B, 1998, 102(34): 6655-6662. DOI:10.1021/jp9816115.
[24] 林葵, 刘培杰, 杨少凡, 等. 大茴香醛质量标准研究[J]. 香料香精化妆品, 2012(6): 1-4. DOI:10.3969/j.issn.1000-4475.2012.06.001.
Rapid Fourier Transform Infrared Spectroscopic (FTIR) Determination of Carbonyl Value in Edible Oils Using Polyethylene Film
LI Yiwen, CHEN Qian, ZHANG Peng, LI Jing, ZHANG Rui, YU Xiuzhu*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
This study aimed to develop a rapid method for the detection of carbonyl value (CV) in edible oils. Anisaldehyde was used as carbonyl reference and gravimetrically added to carbonyl-free rapeseed oil. A series of CV (0-60 mmol/kg)oil samples were determined using polyethylene (PE) film as a spectrum acquisition accessory. A linear relationship between CV and absorbance at the characteristic absorption peak (1 703/1 570 cm-1, peak at 1 703 cm-1and two base points at 1 570 cm-1) was established. However, different types of edible oils exhibited substrate effect, which showed that 1 703 cm-1had variability even among their carbonyl-free samples. To correct the substrate effect, peak absorption at 3 472 cm-1,as evaluated by the 2-D correlation spectroscopy technique, was used as the relevant absorption peak to 1 703 cm-1. Subsequently, a liner relationship between both peak heights was established. Results indicated that there was a highly linear correlation between CV and the absorbance at 1 703 cm-1. The corrected model was y = 0.005 4 x + 0.090 9. with a correlation coefficient (R) of 0.991 9 and standard deviation of 0.013 mmol/kg. Moreover, there was a good relationship between the values obtained from the national standard method and the corrected model, with a slope close to 1, and correlation coefficient of more than 0.99. Thus the PE film-based FTIR method for determination CV in edible oils is workable.
edible oils; Fourier transform infrared spectroscopy (FTIR); carbonyl value; determination
10.7506/spkx1002-6630-201608041
TS227
A
1002-6630(2016)08-0226-05
2015-07-15
西北农林科技大学国家级大学生创新训练项目(201410712076)
李易文(1993—),女,本科,主要从事食品质量与安全研究。E-mail:bing96@nwsuaf.edu.cn
于修烛(1974—),男,副教授,博士,主要从事功能性油脂及其安全检测研究。E-mail:xiuzhuyu1004@hotmail.com
引文格式:

