乳酸菌对喹诺酮类耐药性主动外排机制的研究
李 贞,李少英,*,宋晓敏,马春艳,李淑芬,贺文英,曹英华
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018;3.内蒙古农业大学理学院,内蒙古 呼和浩特 010018)
乳酸菌对喹诺酮类耐药性主动外排机制的研究
李 贞1,李少英1,*,宋晓敏1,马春艳1,李淑芬2,贺文英3,曹英华1
(1.内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018;2.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018;3.内蒙古农业大学理学院,内蒙古 呼和浩特 010018)
目的:为使分离自具有民族特色和特殊功效的内蒙古牧区马奶及其制品中的乳酸菌更好地应用于发酵工业,对乳酸菌进行耐药性实验并研究其中是否存在由主动外排蛋白介导的喹诺酮类耐药机制。方法:采用二倍稀释法测定乳酸菌对临床常用喹诺酮类药物的最小抑菌浓度(minimum inhibitory concentration,MIC),利用质子泵抑制剂(利血平)结合荧光分光光度法检测耐药菌株和对照菌株对环丙沙星的摄取情况。结果:菌株HZ18、HZ28、NN3、NN4具有耐药性并在加入利血平后菌体内环丙沙星累积量明显增加。结论:乳酸菌中存在主动外排蛋白介导的喹诺酮类耐药机制。
乳酸菌;喹诺酮类药物;最小抑菌浓度;荧光分光光度法;主动外排
乳酸菌在人体内具有防治肠道功能紊乱、维持肠道菌群平衡,延缓衰老,抑菌、抗感染等益生功能[1-3]。通常人们认为乳酸菌是安全的、可以放心食用的,但是作为一种进入人体的外源性活菌,在应用过程中益生乳酸菌的安全性隐患被逐渐重视。2001年联合国粮食及农业组织(Food and Agriculture Organization,FAO)与世界卫生组织(World Health Organization,WHO)联合专家委员会在《食品益生菌评价指南》中把益生乳酸菌的耐药性问题提到十分重要的位置[4]。乳酸菌出现耐药性并不可怕,可使其更好地适应环境发挥功效;但如果耐药基因可以在乳酸菌和致病菌之间进行传递,使致病菌获得耐药性,后果将不堪设想[5]。
近年来,喹诺酮类药物因其良好的药动力学和广谱杀菌活性被广泛用于尿路感染、呼吸道感染、腹腔感染等的治疗[6-7]。但随着临床应用的增多,细菌对喹诺酮类药物的耐药性问题逐渐凸显。研究发现,主动外排蛋白介导的细菌胞内药物积聚减少在细菌对喹诺酮类药物耐药中发挥重要作用[8-9]。在多数细菌中已经发现各种各样的具有主动外排功能的蛋白质,如大肠埃希氏菌中的AcrAB-TolC,铜绿假单胞菌中的 MexAB-OprM 和金黄色葡萄球菌中的NorA蛋白[10-12],而对乳酸菌中主动外排蛋白的研究报道较少。
本实验利用能量抑制剂——利血平,结合荧光分光光度法研究乳酸菌中是否存在主动外排蛋白介导的喹诺酮类耐药性。其理论依据为利血平可以阻断菌株主动外排药物过程中的能量供应,从而减少菌株对药物的泵出量。同时,喹诺酮类药物在一定的激发波长下可以发射荧光,其荧光强度与药物浓度呈函数关系。通过对比加入利血平前后菌体对药物摄取量的变化,从而确证乳酸菌主动外排系统的有无。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
实验菌株:分离自内蒙古牧区马奶及其制品中的10 株乳酸菌,分别为HZ9、HZ18、HZ22、HZ23、HZ28、NN、NN1、NN3、NN4、M22,由内蒙古农业大学微生物实验室提供。其中菌株HZ9、HZ28、M22属于坚强肠球菌(Enterococcus durans);菌株NN、NN1属于Enterococcus villorum;菌株NN3、NN4属于异肠球菌(Enterococcus dispar);菌株HZ18、HZ22、HZ23分别归属于棉籽糖肠球菌(Enterococcus raffinosus)、鸡肠球菌(Enterococcus gilvus)、假鸟肠球菌(Enterococcus pseudoavium)。
标准菌株:植物乳杆菌(Lactobacillus plantarum CICC6238)购于中国工业微生物菌种保藏管理中心。
质控菌株:粪肠球菌(Enterococcus faecalis CICC23658)购于中国工业微生物菌种保藏管理中心;大肠埃希氏菌(Escherichia coli ATCC 25922)购于美国模式菌种保藏中心。
1.1.2 试剂与药品
MRS(man rogosa sharpe)肉汤培养基、双料MRS肉汤培养基、MRS琼脂培养基按照参考文献[13]中的方法配制;CAMHB(cation adjusted mueller-hinton broth)肉汤培养基 青岛高科园海博生物技术有限公司;脱脂乳培养基(100 mL蒸馏水,10 g脱脂乳粉,110 ℃,高压灭菌10 min)、TPY(trypticase peptone yeast broth)液体培养基、磷酸缓冲盐溶液(phosphate buffer saline,PBS;50 mmol/L) 赛默飞世尔科技公司;盐酸甘氨酸缓冲液(0.1mol/L pH 3.0) 内蒙古农业大学微生物实验室自制。
抗生素标准品:环丙沙星((ciprofloxacin),生产批号130451-201203)、诺氟沙星((norfloxacin),生产批号130450-201206) 中国食品药品检定研究院;利血平((reserpine),生产批号V900834) 美国Sigma公司。
1.1.3 仪器与设备
RF-5301PC荧光分光光度计 日本岛津公司;分光光度计 北京普析通用仪器有限责任公司;SX-500全自动高压蒸汽灭菌锅 日本Tomy公司;OLYMPUS BX50型光学显微镜 日本Olympus公司;TGL-16G高速冷冻离心机 上海安亭科学仪器厂;FLC-3型超净工作台哈尔滨市东联公司;SPX-1500型恒温恒湿培养箱 上海博讯实业有限公司。
1.2 方法
1.2.1 药敏实验最适培养基的选择
选取3 株实验菌株HZ9、NN1、M22和1 株质控菌株Enterococcus faecalis,将其冻干菌粉接种于脱脂乳培养基,37 ℃培养24 h后,于4℃进行穿刺保存,同时将每株菌分别接种于MRS液体培养基和CAMHB肉汤培养基。37 ℃条件下活化24 h至第2、3代时,观察菌株生长情况并在600 nm波长处测定光密度(optical density,OD)值,依照GB 4789.35—2010《食品安全国家标准 食品微生物学检验 乳酸菌检验》进行活菌计数,并记录实验结果。
1.2.2 供试菌液的制备
在无菌条件下将实验菌株接种于MRS液体培养基中传代培养3 代,并用空培养基稀释菌液至活菌数为107CFU/mL。按体积分数为6%的接种量接种于双料MRS液体培养基中混匀,待用[14]。
1.2.3 实验菌株对喹诺酮类药物耐药性的测定
采用试管二倍稀释法将环丙沙星和诺氟沙星溶液的质量浓度稀释为1、2、4、8、16、32、64、128、256、512、1 024 µg/mL。将供试菌液和药物等体积混合,同时设置药物空白、菌株空白和培养基空白对照,并置于37 ℃恒温恒湿培养箱中培养18 h后,釆用目视比浊法观察,并以美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)(M100-S26)解释标准(表1)为依据记录结果。每实验重复3 次。参照CLSI(M100-S26)药敏解释标准中肠球菌属最小抑菌浓度(minimum inhibitory concentration,MIC)解释标准对结果进行判读。

1.2.4 实验菌株主动外排系统的测定
以环丙沙星为代表,利用质子泵抑制剂——利血平,结合荧光分光光度法检测耐药菌株和对照菌株对环丙沙星的摄取情况。通过对比利血平存在与否的情况下,菌体对药物摄取量的变化,从而确证实验菌株主动外排系统是否存在。
标准曲线的绘制:利用荧光分光光度计在251 nm/583 nm波长处测定不同质量浓度环丙沙星的荧光强度并绘制标准曲线。
供试菌液的制备:将实验菌株分别接种于TPY液体培养基中,37 ℃摇床培养至活菌数达107CFU/mL,5 000 r/min、4 ℃ 离心 20 min后,收集菌体,PBS缓冲液洗涤3 次。最后将菌体分为2 份重悬于PBS中,使菌体质量浓度达到40 mg/mL,37 ℃振荡温浴10 min[15]。
加抑制剂前环丙沙星荧光强度的测定:向其中一份供试菌液加环丙沙星,使其最终质量浓度达1 000 μg/mL。分别在加环丙沙星后的0.5、1、3、5、7、9、12、15、25 min取样,每管取0.5 mL到预冷的3 mL PBS缓冲液中,4 ℃、4 000r/min离心8 min,弃去上清液。同样条件下洗涤3 次并沉淀菌体。沉淀物加盐酸-甘氨酸缓冲液4 mL,26 ℃水浴2 h,离心沉淀,取上清液于251 nm/583 nm波长处测定荧光强度。
加抑制剂后环丙沙星荧光强度的测定:另一份供试菌液在加环丙沙星前加利血平,使其最终质量浓度为50 µg/mL。同样条件下测定荧光强度。
2 结果与分析
2.1 培养基的选择
3 株实验菌株在MRS培养基中均长势旺盛,培养3 代后在试管底部有大量白色菌泥沉淀,振荡后试管明显混浊;而在CAMHB肉汤培养基中培养的实验菌株均长势微弱,试管底部无菌泥出现,混匀后与空白培养基对比无明显差别。实验菌株在MRS培养基和CAMHB培养基中的OD600nm值及对应活菌数见表2。
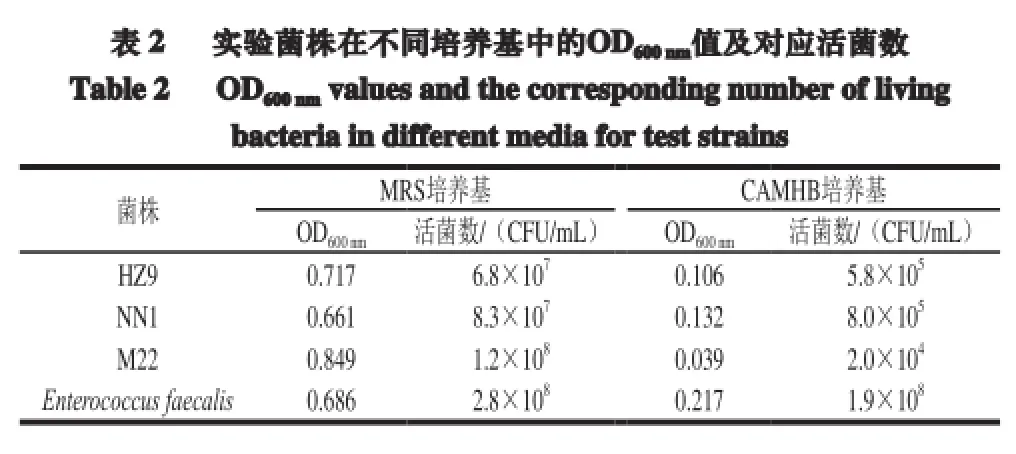
由表2可知,菌株Enterococcus faecalis在2 种培养基中生长情况差别不大,活菌数均大于108CFU/mL。实验菌株在MRS培养基中培养后的活菌数均大于107CFU/mL,符合CLSI在药敏实验中对活菌数的要求(106~108CFU/mL)[16],而在CAMHB培养基中培养的菌株其活菌数均小于106CFU/mL,无法满足CLSI对药敏实验的要求。
2.2 实验菌株的最小抑菌质量浓度
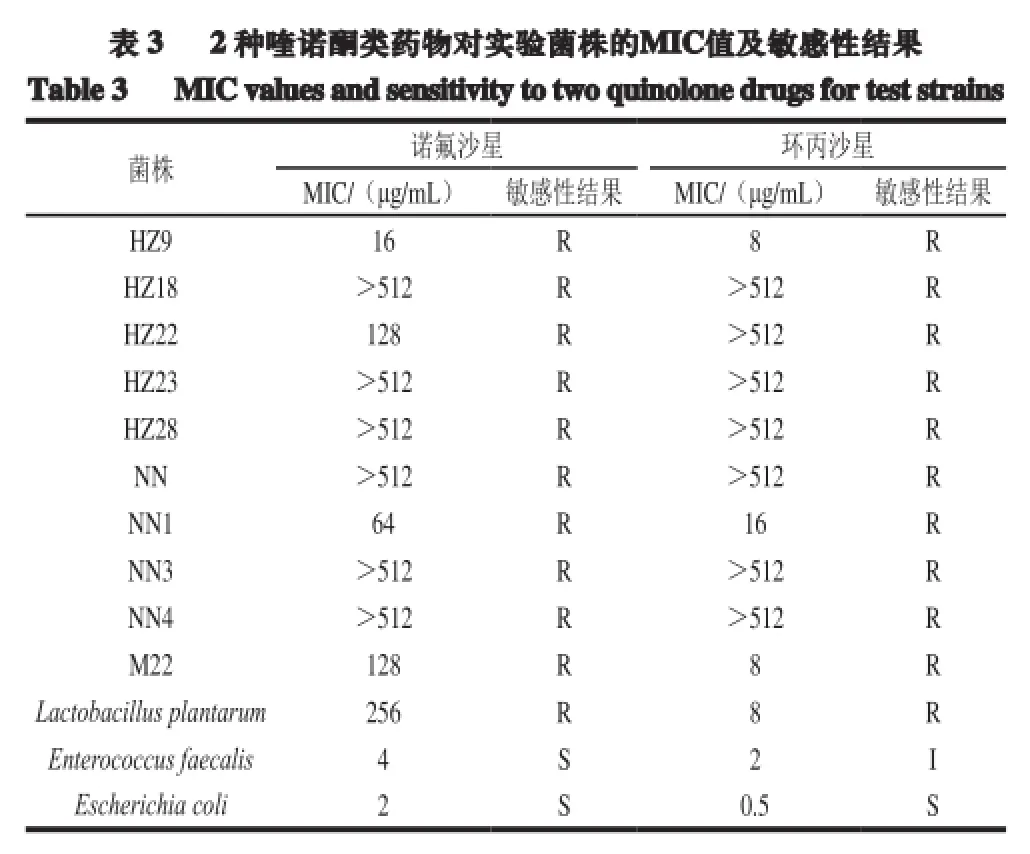
由表3可知,实验菌株HZ18、HZ23、HZ28、NN、NN3、NN4对诺氟沙星和环丙沙星的MIC值均大于512 μg/mL,此值远大于诺氟沙星和环丙沙星耐药标准的界限质量浓度。菌株HZ9、NN1、M22、Lactobacillus plantarum对诺氟沙星和环丙沙星的MIC值也均高于CLSI耐药标准,且对诺氟沙星的MIC值均大于对环丙沙星的MIC值,其原因可能是环丙沙星是合成的第3 代喹诺酮类药物,其临床应用时间较诺氟沙星短。实验菌株如此高的MIC值可能是由于近年来喹诺酮类药物应用的增多,导致许多乳酸菌对喹诺酮类药物产生耐药性。
2.3 实验菌株对2 种喹诺酮类药物的敏感性判定
由表3可知,质控菌株Escherichia coli对诺氟沙星和环丙沙星均表现为敏感,而菌株Enterococcus faecalis对诺氟沙星表现为敏感,对环丙沙星表现为中介。10 株实验菌株经MIC法检测对诺氟沙星和环丙沙星表现为不同程度的耐药,耐药率高达100%。其中6 株乳酸菌的MIC值均高于512 μg/mL,属于高度耐药。可见乳酸菌对喹诺酮类药物的耐药性较为普遍,这与细菌对喹诺酮类药物耐药性呈上升趋势结论一致[17-18]。
2.4 主动外排系统证实实验结果
环丙沙星质量浓度(x,μg/mL)与荧光强度(y)的回归方程为:y=-0.001 7x3-0.069 1x2+5.400 7x+ 0.672 9(R2=0.998 7),根据回归方程计算各菌株对环丙沙星的摄入量。
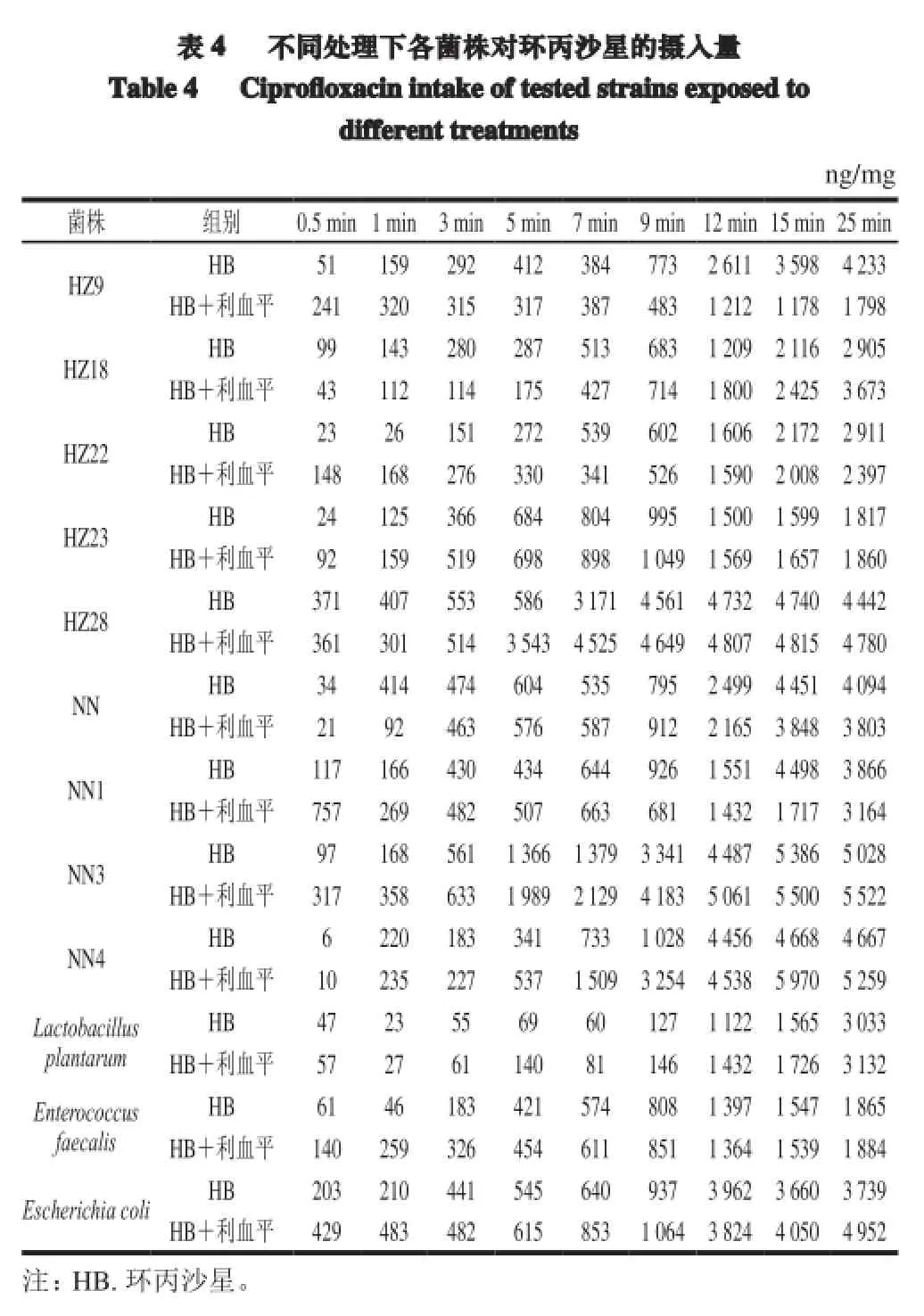
由表4可知,对照菌株Enterococcus faecalis及实验菌株HZ9、HZ22、HZ23、NN、NN1在加入利血平前后菌体内环丙沙星累积量无明显变化。而耐药菌株HZ18、HZ28、NN3、NN4、标准菌株Lactobacillus plantarum及质控菌株Escherichia coli在加入利血平后菌体内药物累积量明显高于不加抑制剂组。以25 min为例,菌株HZ18、HZ28、NN3、NN4加入抑制剂后菌体内药物累积量分别增加768、338、494、592 ng/mg,增加百分比分别为26.4%、7.6%、9.8%、12.7%。另外,由表4可知,各菌株菌体内药物累积量存在一个随时间延长,先缓慢增长,在9~12 min时快速增长,然后随时间又略降低的过程。值得注意的是,经最小抑菌浓度实验判定为高度耐药的菌株HZ18、HZ28、NN3、NN4,在加入利血平后其菌体内环丙沙星的累积量明显高于其他菌株。
3 结 论
CLSI的抗微生物药物敏感性实验操作方法和判断标准是国内临床细菌检验遵循的标准。CLSI是针对临床致病菌设立的,它要求肠球菌和肠杆菌在进行药物敏感性实验时选用CAMHB培养基。但对于乳酸菌来说,CAMHB培养基营养成分过于简单,乳酸菌在其中不能很好的生长,活菌数达不到进行药敏实验的要求(106~108CFU/mL)。另外,研究者Danielsen等[19]发现MRS培养基的成分对抗生素活性并无明显影响,所以本实验选择MRS培养基进行喹诺酮类药物敏感性实验。这与2007年Hummel等[20]在研究作为发酵剂的乳酸菌的耐药性时所选用的培养基一致。
利血平是一种吲哚生物碱,常用作细菌主动外排作用的能量抑制剂。已有文献报道,利血平可增加某些耐药菌株对喹诺酮类药物的敏感性。Markham等[21-23]于1996年和1999年先后证实了利血平可抑制金黄色葡萄球菌对诺氟沙星的诱导耐药以及肺炎链球菌对环丙沙星的耐药性。Jonas等[24]于2001年证实了利血平可以抑制肠球菌对喹诺酮类药物的外排作用。
本实验中对照菌株Enterococcus faecalis及实验菌株HZ9、HZ22、HZ23、NN、NN1在加入利血平前后菌体内环丙沙星累积量无明显变化。而耐药菌株HZ18、HZ28、NN3、NN4、标准菌株Lactobacillus plantarum及质控菌株Escherichia coli在加入利血平后菌体内药物累积量明显增加。这可能是由于主动外排作用在这些菌株的耐药机制中发挥主要作用,导致对喹诺酮类药物的外排增加。但并非所有的耐药菌株药物累积量都有所增加,有的还略有降低,推测在这些菌株中可能同时存在其他耐药机制,如拓扑异构酶基因gyrA和parC发生突变。探讨这些乳酸菌的耐药机制及其转移性将为这些特性优良的菌株在发酵工业中的应用提供安全方面的数据。
[1] LI S Y, LI Z, WEI W, et al. Association of mutation patterns in GyrA and ParC genes with quinolone resistance levels in lactic acid bacteria[J]. The Journal of Antibiotics, 2015, 68(2): 81-87. DOI:10.1038/ja.2014.113.
[2] 王梦姣, 李少英, 郝苗苗, 等. 分离自马奶及其制品中7株乳酸菌的安全性初步评价[J]. 微生物学通报, 2014, 41(5): 871-880. DOI:10.13344/j.microbiol.china.130830.
[3] 李少英, 乌尼. 马奶酒中乳酸菌的分离及其生物学特性的研究[J]. 内蒙古农业大学学报(自然科学版), 2002, 23(4): 59-66. DOI:10.3969/j.issn.1009-3575.2002.04.014.
[4] FAO/WHO Working Group. Guidelines for the evaluation of probiotics in food[R]. London Ontario: FAO/WHO, 2002.
[5] 王梦姣, 李少英, 李淑芬, 等. 马奶及其制品中肠球菌属乳酸菌的安全性评价[J]. 食品科学, 2014, 35(17): 204-208. DOI:10.7506/ spkx1002-6630-201417039.
[6] 王玉宝, 宋诗铎. 肠球菌对氟喹诺酮类抗菌药物耐药机制研究进展[J]. 医学综述, 2006, 12(10): 621-624. DOI:10.3969/ j.issn.1006-2084.2006.10.020.
[7] 夏培元. 细菌体内药物蓄积浓度减少与氟喹诺酮耐药性的研究进展[J]. 国外医药(抗生素分册), 2001, 22(1): 24-27. DOI:10.3969/ j.issn.1001-8751.2001.01.004.
[8] OYAMADA Y, ITO H, INOUE M, et al. Topoisomerase mutations and efflux are associated with fluoroquinolone resistance in Enterococcus faecalis[J]. Journal of Medical Microbiology, 2006,55(10): 1395-1401. DOI:10.1099/jmm.0.46636-0.
[9] 吴英. 肠球菌对氟喹诺酮类药物外排机制及主动外排泵 EmeA 与耐药关系的研究[D]. 衡阳: 南华大学, 2006: 30.
[10] 姚明晓, 苑广盈, 闻新棉. 主动外排系统介导细菌多重耐药的研究进展[J]. 现代预防医学, 2014, 41(1): 118-121.
[11] 衣美英, 王鹏远, 黄汉菊, 等. 外排泵高表达和外膜蛋白缺失在铜绿假单胞菌对碳青霉烯耐药中的作用[J]. 中华医学杂志, 2006, 86(7):457-462. DOI:10.3760/j:issn:0376-2491.2006.07.008.
[12] 王春梅, 何启盖, 操继跃. 细菌多重耐药泵的研究进展[J]. 畜牧兽医学报, 2011, 42(4): 455-467.
[13] 张刚. 乳酸细菌基础技术和应用[M]. 北京: 化学工业出版社, 2007: 421.
[14] 宋晓敏, 李少英, 马春艳, 等. 内蒙古牧区乳酸球菌的分离鉴定及耐药表型分析[J]. 中国酿造, 2014, 33(5): 44-48. DOI:10.11882/ j.issn.0254-5071.2014.05.011.
[15] 于录, 邓旭明, 李乾学, 等. 外输泵介导的金黄色葡萄球菌对环丙沙星耐药性的确证[J]. 吉林农业大学学报, 2005, 27(3): 335-338. DOI:10.3969/j.issn.1000-5684.2005.03.025.
[16] RICHARD B T, JOHN H R. Performance standards for antimicrobial susceptibility testing, 26th Edition[EB/OL]. Pennsylvania: Clinicale and Laboratory Standards Institute, 2016. http://em100.edaptivedocs. com/GetDoc.aspx?doc=CLSI%20M100%20S26:2016&scope=user.
[17] PULIDO R P, OMAR N B, LUCAS R, et al. Resistance to antimicrobial agents in lactobacilli isolated from caper fermentations[J]. Antonie van Leeuwenhoek, 2005, 88(3/4): 277-281. DOI:10.1007/s10482-005-6964-2.
[18] ZHOU J S, PILLIDGE C J, GOPAL P K, et al. Antibiotic susceptibility profiles of new probiotic Lactobacillus and Bifidobacterium strains[J]. International Journal of Food Microbiology, 2005, 98(2): 211-217. DOI:10.1016/j.ijfoodmicro.2004.05.011.
[19] DANIELSEN M, WIND A. Susceptibility of Lactobacillus spp. to antimicrobial agents[J]. International Journal of Food Microbiology,2003, 82(1): 1-11. DOI:10.1016/S0168-1605(02)00254-4.
[20] HUMMEL A S, HERTELC, HOLZAPFEL W H, et al. Antibiotic resistances of starter and probiotic strains of lactic acid bacteria[J]. Applied and Environmental Microbiology, 2007, 73(3): 730-739. DOI:10.1128/AEM.02105-06.
[21] MARKHAM P N, NEYFAKH A A. Inhibition of the multidrug transporter NorA prevents emergence of norfloxacin resistance in Staphylococcus aureus[J]. Antimicrobial Agents and Chemotherapy,1996, 40(11): 2673-2674.
[22] MARKHAM P N. Inhibition of the emergence of ciprofloxacin resistance in Streptococcus pneumoniae by the multidrug efflux inhibitor reserpine[J]. Antimicrobial Agents and Chemotherapy, 1999,43(4): 988-989.
[23] MARKHAM P N, WESTHAUS E, KLYACHKO K, et al. Multiple novel inhibitors of the NorA multidrug transporter of Staphylococcus aureus[J]. Antimicrobial Agents and Chemotherapy, 1999, 43(10):2404-2408.
[24] JONAS B M, MURRAY B E, WEINSTOCK G M. Characterization of emeA, a norA homolog and multidrug resistance efflux pump in Enterococcus faecalis[J]. Antimicrobial Agents and Chemotherapy,2001, 45(12): 3574-3579. DOI:10.1128/AAC.45.12.3574-3579.2001.
Corroboration of Quinolone Resistance Mediated by Active Efflux System in Lactic Acid Bacteria
LI Zhen1, LI Shaoying1,*, SONG Xiaomin1, MA Chunyan1, LI Shufen2, HE Wenying3, CAO Yinghua1
(1. College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China;2. College of Life Sciences, Inner Mongolia Agricultural University, Hohhot 010018, China;3. College of Science, Inner Mongolia Agricultural University, Hohhot 010018, China)
Purpose: In this study, lactic acid bacteria (LAB) were separated from horse milk and horse milk products with national characteristics and special functions in pastoral areas of Inner Mongolia. In order to ensure better application of the isolated strains in the fermentation industry, it is necessary to test their drug resistance and explore if LAB possess an active efflux system mediating quinolone resistance. Methods: Double dilution method was used to determine the minimum inhibitory concentration (MIC) of quinolone. The proton pump inhibitor reserpine was combined with fluorescence spectrophotometry to detect the ciprofloxacin intakes of drug-resistant strains and control strains. Results: The accumulation of ciprofloxacin increased significantly in drug-resistant strains HZ18, HZ28, NN3 and NN4 after adding reserpine. Conclusion: Lactic acid bacteria may possess an active efflux system mediating quinolone resistance.
lactic acid bacteria; quinolone; minimum inhibitory concentration (MIC); fluorescence spectrophotometry;active efflux system
10.7506/spkx1002-6630-201609028
R965
A
1002-6630(2016)09-0150-05
李贞, 李少英, 宋晓敏, 等. 乳酸菌对喹诺酮类耐药性主动外排机制的研究[J]. 食品科学, 2016, 37(9): 150-154. DOI:10.7506/spkx1002-6630-201609028. http://www.spkx.net.cn
LI Zhen, LI Shaoying, SONG Xiaomin, et al. Corroboration of quinolone resistance mediated by active efflux system in lactic acid bacteria[J]. Food Science, 2016, 37(9): 150-154. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609028. http://www.spkx.net.cn
2015-04-29
国家自然科学基金地区科学基金项目(31060014);内蒙古自治区高等学校科学研究项目(NJ09059)
李贞(1990—),女,硕士研究生,研究方向为食品微生物。E-mail:15248045663@163.com
*通信作者:李少英(1961—),女,教授,博士,研究方向为食品质量与安全。E-mail:nmglshy@126.com

