荧光光谱法研究杆菌肽与溶菌酶的相互作用
倪志华,张玉明*,邓传怀周艳芬
(1.河北大学生命科学学院,河北 保定 071002;2.河北省生物工程技术研究中心,河北 保定 071002)
荧光光谱法研究杆菌肽与溶菌酶的相互作用
倪志华1,2,张玉明1,*,邓传怀1,周艳芬1,2
(1.河北大学生命科学学院,河北 保定 071002;2.河北省生物工程技术研究中心,河北 保定 071002)
利用荧光光谱法研究了杆菌肽与溶菌酶的相互作用。结果表明:杆菌肽能使溶菌酶的内源荧光发生猝灭。在不同温度下研究杆菌肽对溶菌酶的荧光猝灭作用,证明荧光猝灭机理属于二者形成复合物所引起的静态猝灭。利用Stern-Volmer方程处理实验数据,发现杆菌肽与溶菌酶具有1 个结合位点,并计算得到了不同温度下杆菌肽与溶菌酶的结合常数(KA):3.60×105(298 K)、1.90×105(308 K)、4.51×104L/mol(318 K)。通过计算热力学参数,可知杆菌肽与溶菌酶的相互作用是一个吉布斯自由能降低的自发过程,且二者之间的主要作用力类型是静电作用。三维荧光光谱实验显示,杆菌肽的加入引起溶菌酶构象的变化,表现为蛋白质内部色氨酸残基所处微环境的疏水性降低。
杆菌肽;溶菌酶;相互作用;荧光光谱
杆菌肽是一种应用广泛的畜禽专用抗生素饲料添加剂,对多种革兰氏阳性病原菌、放线菌以及部分革兰氏阴性菌均有较强抑制作用[1]。并且,杆菌肽还具有促进动物生长、提高机体免疫能力方面的作用,被誉为“绿色饲料添加剂”。随着我国畜牧养殖业的快速发展,杆菌肽的市场需求与日俱增。溶菌酶是一种广泛分布于生物体内的小分子碱性蛋白,具有抗菌、消炎、抗病毒等诸多的生物功能[2]。作为血浆中的小分子蛋白,溶菌酶在白细胞中含量高,是生物体内不可或缺的非特异性体液免疫因子。并且,溶菌酶能够作为一种选择性载体蛋白和很多的外源和内源性物质结合,从而行使其生物学功能[3]。因此,溶菌酶是一种用来研究小分子物质与蛋白质相互作用的良好模型[4-6]。当前对杆菌肽的研究大多集中于发酵生产和畜牧养殖应用方面,对其与生物大分子相互作用方面的研究未见报道。因此,开展杆菌肽与溶菌酶的相互作用研究很有意义。
光谱法是研究蛋白质与各种有机小分子相互作用的重要手段[7-8]。本实验应用荧光光谱法研究溶菌酶与杆菌肽的作用,重点考察二者相互作用的结合常数、结合位点数以及结合热力学参数,并利用三维荧光光谱研究杆菌肽对溶菌酶结构的影响。
1 材料与方法
1.1 材料与试剂
杆菌肽 上海金穗生物科技有限公司;溶菌酶北京索莱宝科技有限公司;磷酸二氢钠和磷酸氢二钠西陇化工股份有限公司;其他试剂均为分析纯。
1.2 仪器与设备
1.3 方法
以0.1 mol/L pH 7.4磷酸盐缓冲液(phosphate buffered saline,PBS)为溶剂配制1.0×10-3mol/L的溶菌酶标准溶液备用,杆菌肽使用超纯水配成1.0×10-3mol/L的标准溶液备用。准确移取一定量的杆菌肽标准溶液于10 mL具塞玻璃试管中,再加入溶菌酶标准溶液,以0.1 mol/L pH 7.4 PBS定容,使体系中溶菌酶浓度达到1.0×10-3mol/L,然后分别在298、308、318 K条件下恒温1 h。在激发和发射光栅狭缝均为5 nm,激发波长为280 nm条件下,扫描一定波长范围内溶菌酶和溶菌酶-杆菌肽的荧光光谱。在激发波长为250~400 nm和发射波长为250~400 nm范围内进行三维荧光扫描,比较溶菌酶与杆菌肽-溶菌酶体系的荧光等高线图。
2 结果与分析
2.1 荧光猝灭光谱
蛋白质的荧光特性主要取决于结构中的3 种氨基酸,即色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)。上述3 种氨基酸的荧光强度比通常为100∶9∶0.5,即大多数情况下可以认为蛋白质的荧光主要来自色氨酸残基的贡献[9-10]。溶菌酶是由129 个氨基酸残基组成的蛋白质,分子内部含有2 个色氨酸残基[11],因而在280 nm激发波长处能发射较强的内源荧光。
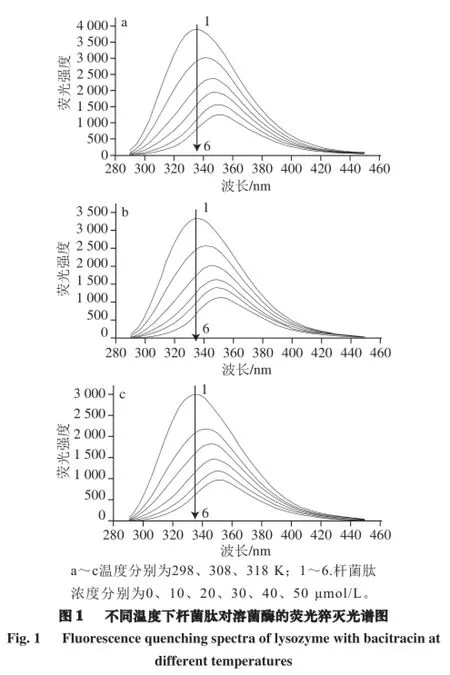
由图1可知,激发波长为280 nm时,不同温度下溶菌酶的最大荧光强度位置分别为335.4(298 K)、335.3 nm(308 K)和335.6 nm(318 K)。结果说明,在不同温度下溶菌酶的最大荧光强度位置变化不大,但是其最大荧光强度的绝对值呈现随着温度升高而降低的趋势。加入杆菌肽后,不同温度下溶菌酶的内源性荧光强度均出现逐渐降低现象,溶菌酶的荧光明显被猝灭,这说明杆菌肽与溶菌酶发生了相互作用。并且,杆菌肽的加入使溶菌酶最大荧光强度位置发生变化:当加入杆菌肽浓度为50 nmol/L时溶菌酶在298、308、318 K的最大荧光强度位置变为350.9、351.6、351.3 nm,分别红移了15.5、16.3、15.7 nm。这说明加入杆菌肽后,溶菌酶中Trp残基的微环境发生了变化,使其变得更加亲水,从而猝灭了溶菌酶所发射的内源荧光,这也印证了杆菌肽与溶菌酶发生了相互作用。
2.2 杆菌肽对溶菌酶的荧光猝灭机理
荧光猝灭主要分为动态猝灭和静态猝灭[12],动态猝灭是荧光体与猝灭剂之间因相互碰撞而使荧光体的荧光被猝灭,温度升高可增加分子碰撞的机会,能够提高猝灭效率[13];而静态猝灭是荧光体与猝灭剂之间形成了不发荧光的复合物引起的,温度升高将引起配合物的稳定度下降,从而减小静态猝灭的程度。可以使用Stern-Volmer方程分析荧光猝灭数据[14]。

式中:F0和F分别表示不加入和加入猝灭剂时体系的相对荧光强度;[Q]为猝灭剂的浓度/(μmol/L);K在静态猝灭时为配合物的形成常数/(L/mol),在动态猝灭时为动态猝灭常数Ksv/(L/mol)。
路灯数据的上报分为两大类:主动上报,触发型上报。其中主动型包括定时路灯状态上报,心跳上报用以链路保活;触发型上报为事件触发弄的,如主动查询,远程控制等。

式中:Kq为荧光猝灭速率常数/(L/(mol·s));T0为不存在猝灭剂时荧光物质的平均寿命/s,一般为10-8s。由式(1)作图,得到Stern-Volmer猝灭曲线,结果如图2所示。根据曲线斜率计算得到杆菌肽和溶菌酶之间相互作用的荧光猝灭速率常数Kq及猝灭常数Ksv,结果见表1。


由图2可知,F0/F对[Q]线性良好,相关系数r值都大于0.99,表明杆菌肽与溶菌酶之间相互作用时只存在一种猝灭机制。由图2中直线的斜率可求出Ksv值,动态和静态猝灭可根据猝灭常数Ksv随温度变化关系来判断。由表1可知,随着温度的升高,溶菌酶的猝灭曲线斜率下降,Ksv值降低,说明杆菌肽对溶菌酶荧光的猝灭作用随温度升高而降低,符合静态猝灭规律[11]。杆菌肽对溶菌酶的Kq值在1012数量级,大于各类猝灭剂对生物大分子最大扩散控制的碰撞猝灭速率常数2.0×1010L/(mol·s)[15],也说明杆菌肽对溶菌酶的荧光猝灭作用不是动态猝灭。
2.3 杆菌肽与溶菌酶的结合常数及结合位点数
对于静态猝灭过程,蛋白质与小分子的结合位点数可由式(3)导出[16]。
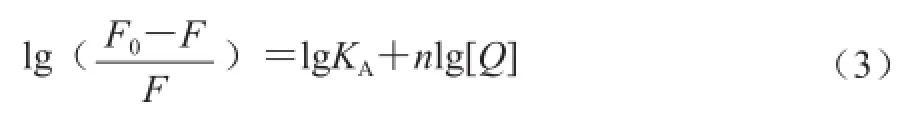
式中:F0和F分别表示不加入和加入猝灭剂时体系的相对荧光强度;[Q]为猝灭剂的浓度/(μmol/L);KA和n分别为杆菌肽与溶菌酶的结合常数和结合位点数。
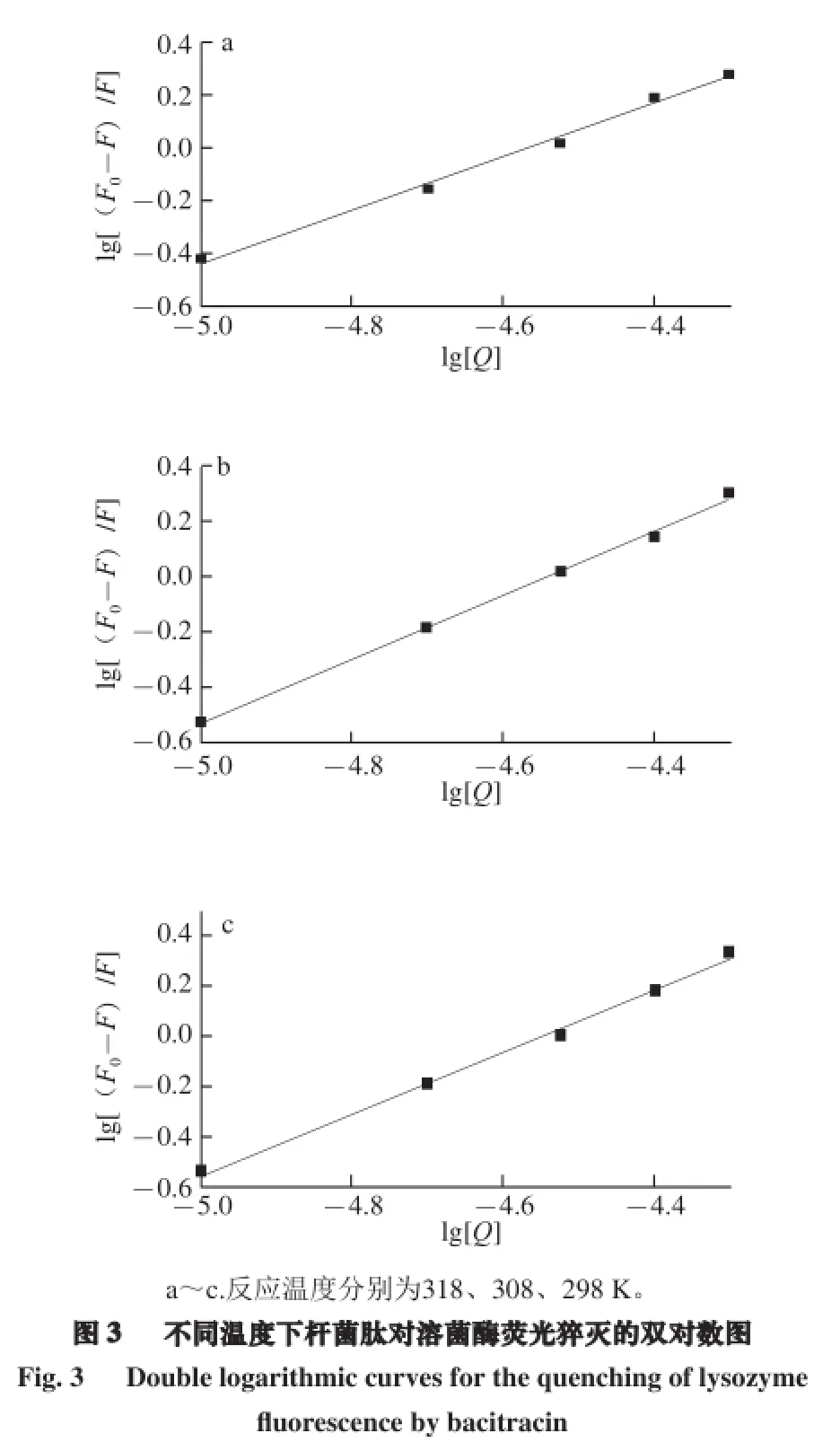
以不同温度下杆菌肽对溶菌酶的荧光猝灭结果,将lg[(F0-F)/F]对lg[Q]作图,并进行线性回归。从图3中回归直线的斜率和截距可求得溶菌酶与杆菌肽的结合位点数n和结合常数KA。如表2所示,温度分别为298、308、318 K时,lg[(F0-F)/F]对lg[Q]的线性关系良好,r值都达到0.99以上。杆菌肽与溶菌酶的结合位点数均接近于1,表明二者近似的以1∶1形式结合而生成复合物,温度对二者之间结合比例影响不大。本研究中,杆菌肽与溶菌酶在各温度的结合常数KA值均达到或超过104数量级,表明二者之间的结合作用较强。

2.4 杆菌肽与溶菌酶结合热力学参数及结合力类型
小分子物质和蛋白质之间的相互作用力主要有疏水作用力、氢键、范德华力和静电引力等[17]。在温度变化范围不大时,可以近似认为作用过程的焓变ΔH是一个常数。根据公式(4)~(6),可分别求得焓变ΔH、熵变ΔS和生成自由能变ΔG。Ross等[18]总结了小分子间与生物大分子反应的热力学参数与主要作用力类型的关系,即当ΔH>0、ΔS>0为典型的疏水作用力;ΔH<0、ΔS<0为氢键和范德华力;当ΔH<0、ΔS>0时,主要存在静电作用。根据热力学公式(4)、(5)、(6)及不同温度下的结合常数,可求得相应的热力学参数(表3)。

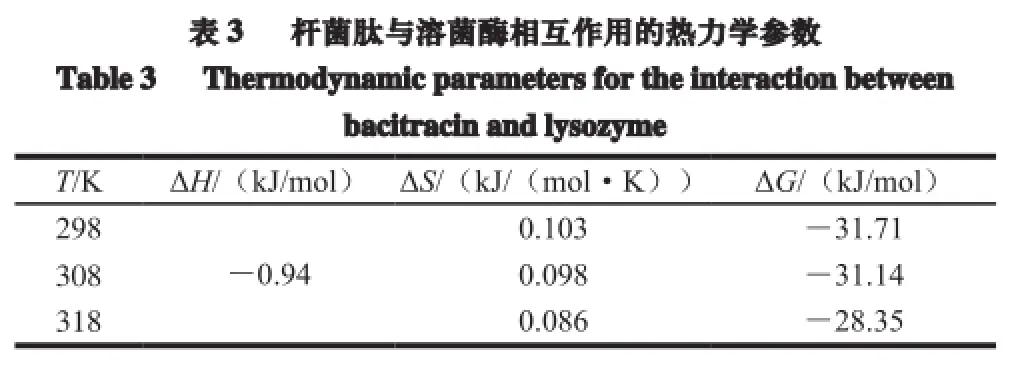
由表3可知,杆菌肽与溶菌酶相互作用时热力学参数ΔH<0、ΔS>0,可以认为二者之间的作用力主要为静电相互作用。反应的自由能变ΔG<0,说明杆菌肽与溶菌酶的相互作用是自发进行的。反应的ΔH<0,说明反应为放热反应。并且,升高温度将不利于反应的进行,这也符合前文所述的杆菌肽对溶菌酶的猝灭机制为静态猝灭。
2.5 杆菌肽与溶菌酶的三维荧光光谱
三维荧光光谱是以激发波长、发射波长和荧光强度3 个参数分别为坐标的荧光矩阵光谱[19-20]。同时,三维图谱可用强度等高线代替以更为直观地描述被测组分的荧光信息,是一种有价值的光谱指纹技术[21]。研究溶液状态下蛋白质-药物小分子相互作用中蛋白质的构象变化时,三维荧光光谱能提供比常规荧光光谱更完整的光谱信息。本实验在激发波长250~400 nm和发射波长250~400 nm范围内进行三维荧光扫描,得到溶菌酶和杆菌肽-溶菌酶复合物的荧光等高线图(图4)。其中,使用的溶菌酶和杆菌肽浓度分别为100、20 μmol/L,实验温度为298 K。
从峰的类别看,图4a、b中都存在两条“铅笔”形纹线,它们的共同特征是激发波长(λex)等同于发射波长(λem),是典型的瑞利散射峰[22]。并且,图4a、b中瑞利散射线左上方λex=300 nm左右都存在“指纹”形纹线,λem分别是340 nm和350 nm左右。上述“指纹”形纹线符合λex<λem的规律,是荧光峰的典型特征。从峰的位置看,加入杆菌肽后,溶菌酶的瑞利散射峰起始位置及荧光峰位置均无显著变化。从峰的强度看,图4b中的“铅笔”形和“指纹”形纹线变得稀疏,“指纹”形纹线的变化趋势尤为明显。也就是说,加入杆菌肽后瑞利散射峰和荧光峰的相对强度均有不同程度的降低。
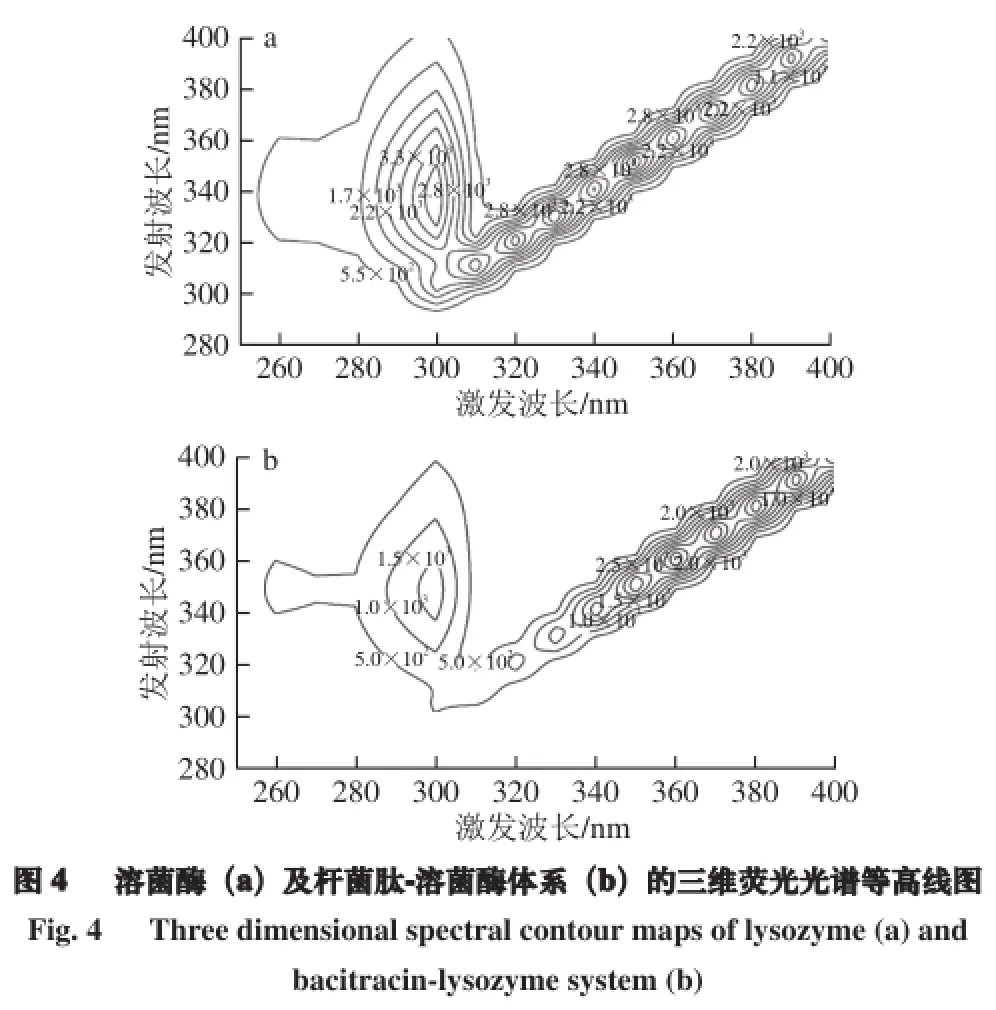
溶菌酶是椭圆形的分子,在其表面有一个深陷而狭长的凹槽。它的活性中心位于溶菌酶分子表面葡萄糖(Glu)35、天冬氨酸(Asp)52和Trp 62两个结构域之间的沟槽内。大多数的非极性和极性侧链分别埋藏在分子内部和分布在分子表面上[23]。据此推断出杆菌肽可能在溶菌酶的非极性凹槽内与之结合发生作用,诱导了溶菌酶构象的变化。分析认为,杆菌肽的加入使水溶液中溶菌酶疏水腔体内微环境的极性和疏水效应发生改变,从而导致溶菌酶构象的变化[24],表明溶菌酶和杆菌肽发生反应而生成了一种新的复合物,这也印证了杆菌肽对溶菌酶的荧光猝灭机制为静态猝灭。
3 结 论
利用荧光光谱法研究了杆菌肽与溶菌酶的相互作用。杆菌肽对溶菌酶的内源荧光具有较强的猝灭作用,原因是杆菌肽与溶菌酶分子发生结合形成复合物。测定了不同温度下杆菌肽与溶菌酶的结合常数、结合位点和热力学参数,结果表明杆菌肽对于溶菌酶的荧光猝灭机制为静态猝灭,二者的结合主要是基于静电作用,大约形成1 个结合位点。三维荧光光谱研究表明,杆菌肽和溶菌酶之间结合导致了蛋白质分子内部疏水微环境极性的改变,进而导致了溶菌酶构象的变化。上述结果均说明溶菌酶是杆菌肽在机体内的有效载体。
[1] 张玉明, 倪志华, 李宝库. 杆菌肽产生菌的分离鉴定及其发酵条件初步研究[J]. 生物技术通报, 2015, 31(5): 153-157. DOI:10.13560/ j.cnki.biotech.bull.1985.2015.05.024.
[2] 张国文, 陈秀霞, 郭金保, 等. 荧光法研究橙皮苷、淫羊藿苷与溶菌酶的相互作用[J]. 光谱学与光谱分析, 2009, 29(1): 184-187. DOI:10.3964/j.issn.1000-0593(2009)01-0184-04.
[3] 冯棋琴, 周立梅, 高文功, 等. 溶菌酶在食品工业中的研究进展[J]. 食品研究与开发, 2015, 36(5): 134-136. DOI:10.3969/ j.issn.1005-6521.2015.05.032.
[4] 倪志华, 张玉明, 赵晓辉, 等. XeCl准分子激光辐照能量变化对溶菌酶结构与活力的影响[J]. 科学技术与工程, 2014, 14(26): 26-31. DOI:10.3969/j.issn.1671-1815.2014.26.005.
[5] 崔力剑, 渠玲玲, 杨文月, 等. 卢丁与溶菌酶相互作用的光谱研究[J].现代食品科技, 2014, 30(6): 30-35.
[6] 杨冉, 屈凌波, 陈晓岚, 等. 柚皮素、柚皮苷与溶菌酶相互作用的荧光光谱法研究[J]. 化学学报, 2006, 64(13): 1349-1354. DOI:10.3321/ j.issn:0567-7351.2006.13.010.
[7] 刘志栋, 韩德权, 杨卫卫, 等. 荧光光谱法研究牛血清白蛋白与柠檬黄和日落黄的相互作用[J]. 食品科学, 2014, 35(9): 128-131. DOI:10.7506/spkx1002-6630-201409026.
[8] 李玉琴, 贾宝秀, 冀海伟, 等. 左旋紫草素与溶菌酶相互作用的研究[J]. 分析测试学报, 2009, 28(5): 544-549. DOI:10.3969/ j.issn.1004-4957.2009.05.008.
[9] 刘硕, 王萌, 朱少华, 等. 紫甘薯花色素与与胰蛋白酶相互作用特性[J].食品科学, 2014, 35(23): 232-237. DOI:10.7506/spkx1002-6630-201423045.
[10] YAN X N, LIU B S, CHONG B H, et al. Interaction of cefpiramide sodium with bovine hemoglobin and effect of the coexistent metal ion on the protein: drug association[J]. Journal of Luminescence, 2013,142: 155-162. DOI:10.1016/j.jlumin.2013.04.009.
[11] BI S, PANG B, WANG T, et al. Investigation on the interactions of clenbuterol to bovine serum albumin and lysozyme by molecular fluorescence technique[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 120: 456-461. DOI:10.1016/ j.saa.2013.09.137.
[12] 张蕊, 吴超仪, 刘宇, 等. 分子对接和荧光光谱法研究麦角甾醇与牛血清白蛋白的相互作用[J]. 食品科学, 2015, 36(23): 38-42. DOI:10.7506/spkx1002-6630-201523008.
[13] HU X X, DENG Z W, WANG Y, et al. Study on the interaction between bovine serum albumin and terbium complex containing polymer[J]. Soft Materials, 2014, 12(3): 277-283. DOI:10.1080/15394 45x.2014.89682.
[14] 马贵斌, 高飞, 任斌知, 等. 荧光法研究药物分子与人血清白蛋白的结合作用[J]. 化学学报, 1995, 53(12): 1193-1197.
[15] 刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J].食品科学, 2015, 36(17): 43-47. DOI:10.7506/spkx1002-6630-201517009.
[16] 范志飞, 曾维才, 戴吉领, 等. 表没食子儿茶素没食子酸酯与猪胰脂肪酶的相互作用[J]. 食品科学, 2013, 34(7): 20-23.
[17] 周瑞, 董学艳, 景浩. 不同溶液中牛血清白蛋白与花青素相互作用特性及抗氧化性[J]. 食品科学, 2013, 34(15): 11-16. DOI:10.7506/ spkx1002-6630-201315003.
[18] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry,1981, 20(11): 3096-3102. DOI:10.1021/bi00514a017.
[19] 邹华, 周享春, 鲍翠. 食用色素苋菜红与牛血清白蛋白的相互作用研究[J]. 中国食品添加剂, 2015(5): 61-66. DOI:10.3969/ j.issn.1006-2513.2015.05.002.
[20] 颜承农, 谢泽珏, 梅平, 等. 荧光光谱法研究萘酚绿B与牛血清白蛋白相互作用特征[J]. 光谱学与光谱分析, 2007, 27(12): 2542-2545.
[21] 徐冬兰, 周莉, 胡冰, 等. 苦丁冬青苦丁茶中咖啡酰奎尼酸类物质与牛血清白蛋白的相互作用研究[J]. 食品科学, 2015, 36(11): 6-12. DOI:10.7506/spkx1002-6630-201511002.
[22] 陈晨, 张洪峰, 王乐, 等. 光谱法研究顺铂与溶菌酶的相互作用[J].中国药房, 2012, 23(30): 2847-2849.
[23] 叶丹, 连宾. 溶菌酶及其应用[J]. 贵州科学, 2003, 21(3): 67-70. DOI:10.3969/j.issn.1003-6563.2003.03.016.
[24] HAN R, LIU B, LI G, et al. Investigation on the interaction of cefpirome sulfate with lysozyme by fluorescence quenching spectroscopy and synchronous fluorescence spectroscopy[J]. Luminescence, 2016, 31(2): 580-586. DOI:10.1002/bio.2998.
Fluorescence Spectroscopic Study of the Interaction of Lysozyme with Bacitracin
NI Zhihua1,2, ZHANG Yuming1,*, DENG Chuanhuai1, ZHOU Yanfen1,2
(1. College of Life Sciences, Hebei University, Baoding 071002, China;2. Research Center of Bioengineering of Hebei Province, Baoding 071002, China)
The interactions between bacitracin and lysozyme were studied by fluorescence spectroscopy. The results showed that the intrinsic fluorescence of lysozyme could be quenched by bacitracin. The fluorescence quenching of lysozyme was analyzed at different temperatures. The quenching mechanism was accomplished in a static manner by forming a bacitracin-lysozyme complex. The binding parameters were determined according to Stern-Volmer equation, and the thermodynamic parameters were calculated. The results showed that there was only one binding site between bacitracin and lysozyme. The binding constants (KA) between bacitracin and lysozyme at different temperatures were 3.60 × 105(298 K),1.90 × 105(308 K), and 4.51 × 104L/mol (318 K), respectively. Thermodynamic analysis indicated that the interaction process was spontaneous, and electrostatic force might be primarily responsible for the interaction. In addition, the effect of bacitracin on the conformation of lysozyme was analyzed by three-dimensional fluorescence spectroscopy. The result indicated that the polarity of the microenvironment around Trp residues decreased.
bacitracin; lysozyme; interaction; fluorescence spectroscopy
10.7506/spkx1002-6630-201609026
TS201.2
A
1002-6630(2016)09-0139-05
倪志华, 张玉明, 邓传怀, 等. 荧光光谱法研究杆菌肽与溶菌酶的相互作用[J]. 食品科学, 2016, 37(9): 139-143. DOI:10.7506/spkx1002-6630-201609026. http://www.spkx.net.cn
NI Zhihua, ZHANG Yuming, DENG Chuanhuai, et al. Fluorescence spectroscopic study of the interaction of lysozyme with bacitracin[J]. Food Science, 2016, 37(9): 139-143. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609026. http://www.spkx.net.cn
2015-07-30
保定市科学技术研究与发展指导计划项目(15ZN001);河北省高等学校科学技术研究项目(QN2015174);河北大学中西部提升综合实力专项资金资助项目
倪志华(1979—),女,讲师,硕士,研究方向为应用生物化学。E-mail:nizhihua@hbu.edu.cn
*通信作者:张玉明(1979—),男,讲师,博士,研究方向为生物化工。E-mail:zhangyuming@hbu.edu.cn

