氧气对涡流空化降解壳聚糖的影响
张伟伟,任仙娥*,杨 锋,黄永春,何 仁
(广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西高校糖资源加工重点实验室,广西 柳州 545006)
氧气对涡流空化降解壳聚糖的影响
张伟伟,任仙娥*,杨 锋,黄永春,何 仁
(广西科技大学生物与化学工程学院,广西糖资源绿色加工重点实验室,广西高校糖资源加工重点实验室,广西 柳州 545006)
研究了氧气在不同壳聚糖溶液初始质量浓度、pH值、温度、进口压力、空化时间等条件下,对壳聚糖涡流空化降解的影响。结果表明:壳聚糖溶液的初始质量浓度越低涡流空化降解效果越好,当溶液pH值为4.4、温度为70 ℃、进口压力为0.4 MPa、空化时间为3 h时,壳聚糖的特性黏度下降率最高;在不同涡流空化降解条件下,连续通入氧气均可显著促进壳聚糖降解产物特性黏度下降率的提高,在本实验中最大可提高35.36%;氧气对高质量浓度壳聚糖降解的促进作用更显著;氧气的通入减弱了pH值对壳聚糖降解的影响、在反应的初期大大加快了反应速率;降解后的壳聚糖主链结构及官能团基本没发生变化。
氧气;涡流空化;降解;壳聚糖
张伟伟, 任仙娥, 杨锋, 等. 氧气对涡流空化降解壳聚糖的影响[J]. 食品科学, 2016, 37(9): 45-49. DOI:10.7506/spkx1002-6630-201609009. http://www.spkx.net.cn
ZHANG Weiwei, REN Xiane, YANG Feng, et al. Effect of oxygen on degradation of chitosan with swirling cavitation[J]. Food Science, 2016, 37(9): 45-49. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609009. http://www.spkx.net.cn
低分子质量聚壳聚糖因具有较好的生物相容性及生物活性,在食品、医学、日化等领域的应用前景广阔。目前主要制备方法有物理降解[1]、化学降解[2]、生物降解[3]等。刘石生等[4]研究了超声空化降解壳聚糖,获得了较好的效果。与超声空化相比,水力空化具有能量利用率高、空化场范围大且均匀的优点,更易于实现工业化应用。近年来,Huang Yongchun[5]和Wu Yu[6]等研究了孔板水力空化、涡流空化等对壳聚糖的降解的作用,结果表明:不同的水力空化设备及结构参数对壳聚糖降解效果不同;在相同的设备条件下,较低的初始浓度和pH值、较高的温度和压力、较长的处理时间等有利于壳聚糖的水力空化降解;降解产物的红外光谱、X射线衍射分析表明水力空化没有破坏壳聚糖的结构单元和基本官能团。超声空化降解聚苯乙烯、挥发性脂肪酸等有机物的研究表明液体中气体含量、气体溶解度及气体的热导性等会影响空化效应的强弱及对有机物的降解效果[7-10]。为了解气体对涡流空化降解壳聚糖的影响,杨锋等[11]进行了空气、氧气、氮气对涡流空化降解壳聚糖的研究,表明氧气对涡流空化降解壳聚糖具有显著的促进作用。在此基础上,本实验研究了不同壳聚糖溶液初始质量浓度、pH值、温度、压力、处理时间等条件下,氧气对涡流空化降解壳聚糖的强化作用,以期获得更好的降解效果。
1 材料与方法
1.1 材料与试剂
壳聚糖(工业级) 上海卡博工贸有限公司;三水合醋酸钠(分析纯) 台山市粤侨试剂塑料有限公司;冰醋酸(化学纯) 成都市科龙化工试剂厂;盐酸、NaOH(均为分析纯) 西陇化工股份有限公司。
1.2 仪器与设备
GM-0.33隔膜真空泵 天津市腾达过滤器件厂;乌氏黏度计(毛细管内径0.57 mm) 上海良晶玻璃仪器厂;20NPD047涡流泵 上海尼可尼泵业有限公司;HK-1D型恒温水浴槽 南京物化智能设备有限公司;JS-510机械秒表 上海星钻秒表有限公司;NICOLET 6700红外光谱仪 美国Thermo Fisher Scientific公司。
涡流空化装置,广西科技大学生物与化学工程实验室自制,如图1所示。
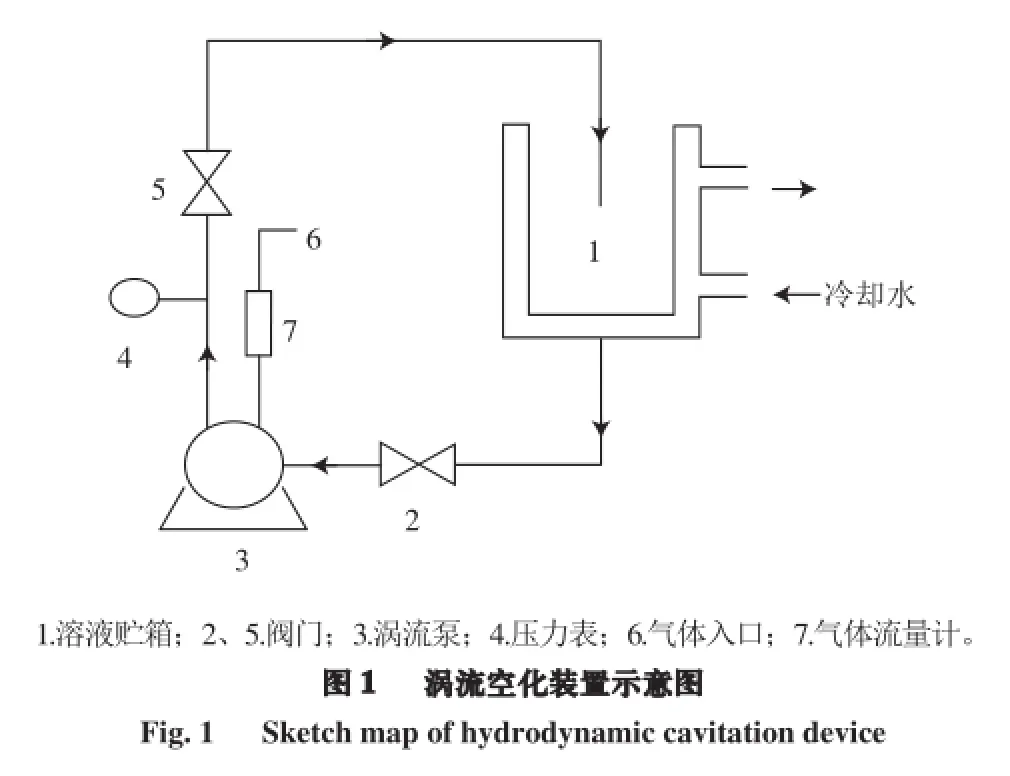
1.3 方法
1.3.1 氧气对不同初始质量浓度壳聚糖溶液涡流空化降解效果的影响
以乙酸-乙酸钠缓冲液为溶剂,分别配制不同质量浓度(0.5、1、3、5、7 g/L)的壳聚糖溶液3 L,调节pH值为4.4,在溶液温度为50 ℃,进口压力为0.3 MPa条件下将溶液在空化装置中降解3 h,测定空化处理前后壳聚糖溶液的特性黏度。其他条件不变的情况下,在空化过程中连续通入1 276.03 mL/min的氧气,测定空化处理前后壳聚糖溶液的特性黏度。通过对比两种条件下壳聚糖溶液的特性黏度下降率,来评价氧气对不同初始质量浓度壳聚糖涡流空化降解的作用。
固定其他条件,分别研究在不同pH值、温度、压力、空化时间等条件下氧气对壳聚糖降解效果的影响。
1.3.2 不同pH值下氧气对壳聚糖涡流空化降解效果的影响
固定初始壳聚糖质量浓度为3 g/L、温度50 ℃、压力0.3 MPa、处理时间3 h,分别研究不同的溶液pH值对涡流空化降解壳聚糖效果的影响。
1.3.3 不同温度下氧气对壳聚糖涡流空化降解效果的影响
固定初始壳聚糖质量浓度为3 g/L、pH 4.4、压力0.3 MPa、处理时间3 h,探究不同的溶液温度在条件下对涡流空化降解壳聚糖效果的影响。
1.3.4 不同压力下氧气对壳聚糖涡流空化降解效果的影响
固定初始壳聚糖质量浓度为3 g/L、pH 4.4、温度50 ℃、处理时间3 h,探究不同压力条件下对涡流空化降解壳聚糖效果的影响。
1.3.5 不同空化时间下氧气对壳聚糖涡流空化降解效果的影响
固定初始壳聚糖质量浓度为3 g/L、温度50 ℃、pH 4.4、压力0.3 MPa,探究不同的空化时间条件下对涡流空化降解壳聚糖效果的影响。
1.3.6 特性黏度下降率的计算
特性黏度的测定在(30.0±0.1)℃条件下进行,用机械秒表及乌式黏度计测定壳聚糖溶液的流出时间(t)和溶剂流出时间(t0),由一点法经验公式(1),计算出特性黏度η[12]。
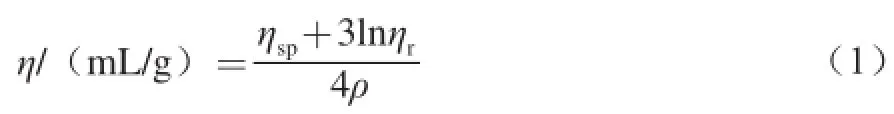
式中:ηsp为增比黏度,ηsp=ηr-1;ηr为相对黏度,ηr=t/t0;ρ为壳聚糖溶液质量浓度/(g/mL)。
由于公式使用的最佳条件是ηr在1.1~2.0之间,故测定黏度时,对样品进行适当稀释。
特性黏度下降率的计算如下:
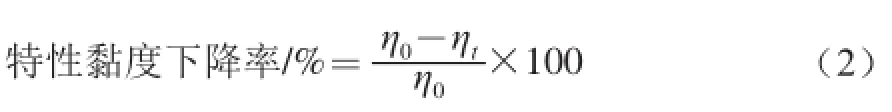
式中:η0、ηt分别为未降解的和空化降解t时间后溶液的特性黏度/(mL/g)。
1.3.7 脱乙酰度(degree of deacetylation,DD)的测定
脱乙酰度的测定采用酸碱滴定法[13]。精确称取干燥后的壳聚糖样品0.1 g,加入过量的0.1 mol/L盐酸标准溶液30 mL,搅拌使其完全溶解。滴入2~3 滴甲基橙指示剂,然后用0.1 mol/L NaOH标准溶液滴定混合溶液至终点[14]。脱乙酰度的计算公式如下。
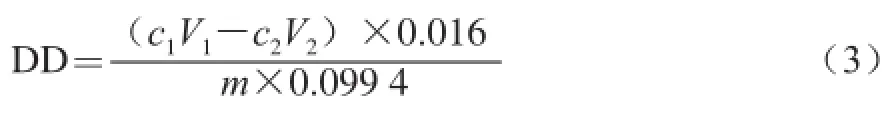
式中:c1为盐酸标准溶液浓度/(mol/L);c2为NaOH标准溶液浓度/(mol/L);V1为加入盐酸标准溶液的体积/mL;V2为消耗NaOH标准溶液的体积/mL;m为样品质量/g;0.016为与1 mL 1 mol/L 盐酸溶液相当的氨基量/g;0.099 4为理论氨基含量。
1.3.8 红外光谱分析
对壳聚糖原料及通入氧气进行涡流空化降解后的产物进行红外光谱分析,红外光谱测定范围4 000~400 cm-1[15]。运用溴化钾片法进行样品的制备:将KBr与壳聚糖样品干燥后放入研钵内一起研磨至完全混匀,压片,置于仪器中进行测试。
2 结果与分析
2.1 不同初始壳聚糖质量浓度下氧气对壳聚糖涡流空化降解效果的影响

由图2可知,壳聚糖溶液质量浓度对特性黏度下降率的影响显著,随着质量浓度从0.5 g/L升高到7 g/L,不通气时壳聚糖降解产物的特性黏度下降率由59.86%降至23.94%;通入氧气时壳聚糖降解产物的特性黏度下降率的变化趋势与不通气时相同,且特性黏度下降率大幅提高,尤其是质量浓度为0.5 g/L时,壳聚糖降解产物的特性黏度下降率可提高至79.98%;可见,氧气的持续通入明显促进了壳聚糖的涡流空化降解;达到相同的降解效果,通入氧气可大大提高溶液降解时的质量浓度。这可能与气体的通入增加了空核的形成、降低了空化阈值[16],氧气在空化泡溃灭是更容易形成O3及·OH有关。另外,在高质量浓度下(7 g/L)氧气对壳聚糖降解效果的促进作用更显著。但氧气的通入并不能阻止随着溶液质量浓度增大、表面张力及黏度增大等导致的空化阈值增大、空化数[17]增大、空化效应减弱的趋势。
2.2 不同pH值下氧气对壳聚糖涡流空化降解效果的影响
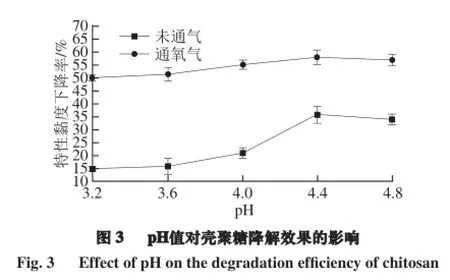
由图3可知,pH值在3.2到4.8之间,通气和不通气壳聚糖降解产物特性黏度下降率均呈先增加后减小的趋势,pH值为4.4时均达到最大值;当pH值大于4.4时,特性黏度下降率降低。这可能与高体积分数醋酸中的阴离子使壳聚糖分子形成更多的盐键有关[18],而较高的pH值又会影响壳聚糖的溶解。通入氧气时,各pH值条件下的降解效果都得到了提高,尤其是在pH值为4.4时,特性黏度下降率从不通气时的35.98%增加到57.88%。在pH 3.2~4.4范围内,通入氧气的壳聚糖特性黏度降解率较不通气时增加缓慢,可见,氧气的通入减弱了pH值对壳聚糖涡流空化降解的影响,其作用机理有待进一步研究。
2.3 不同温度下氧气对壳聚糖涡流空化降解效果的影响
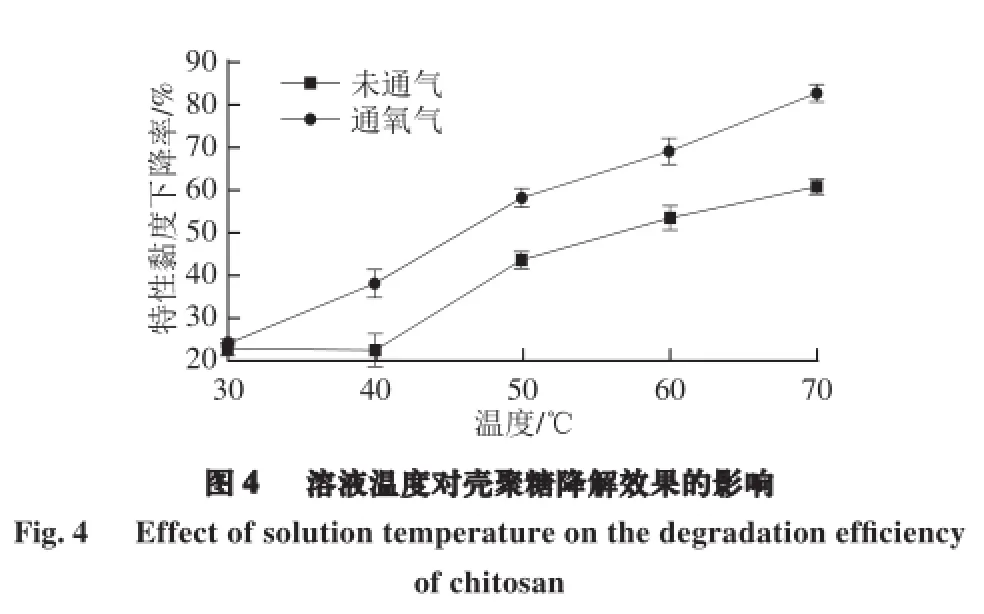
由图4可知,溶液温度对壳聚糖降解产物特性黏度下降率影响显著,在30~70 ℃范围内,随着温度的升高,降解产物特性黏度下降率急剧升高;氧气的通入大大增强了壳聚糖的涡流空化降解。这是因为温度升高,空化阈值下降、空核更容易产生,且随着温度升高壳聚糖与溶液中的阴离子形成的盐键更易破坏,糖苷键更易断裂。尤其是在70 ℃,通入氧气可使壳聚糖降解产物的特性黏度下降率从60.66%提高到82.48%。实验发现当温度超过70 ℃后,降解产物的颜色加深,这可能与壳聚糖降解产物发生了Maillard反应[19]等有关。
2.4 不同压力下氧气对壳聚糖降解效果的影响
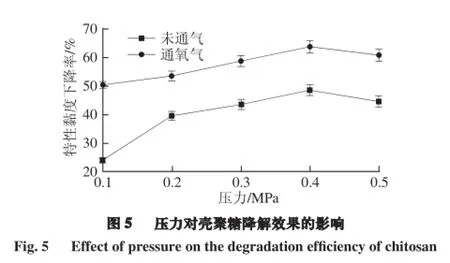
由图5可知,随着压力的增大壳聚糖降解产物特性黏度下降率先逐渐升高,超过0.4 MPa后下降;氧气的通入提高了各压力条件下的降解效果。这是由于随着压力增大,液体流速加快,空化数下降,空化效应增强,从而提高了降解效果;但随着压力的增大到一定程度,空泡溃灭困难,减弱了空化效果。在0.4 MPa时,壳聚糖降解产物的特性黏度下降率达到了62.72%,比不通气时提高了15.35%。
2.5 不同空化时间下氧气对壳聚糖涡流空化降解效果的影响

由图6可知,壳聚糖降解产物的特性黏度下降率随着处理时间的延长而增加,且前期的增速快、后期的增速缓慢;氧气的通入提高了壳聚糖涡流空化降解的效果,尤其是在反应的初期大大加快了反应的速率。在反应开始2 h后,可将特性黏度下降率从39.88%提高到57.58%。这是因为开始时壳聚糖分子质量大,总分子数少,在降解初期相同分子数的壳聚糖降解产物占总分子数的比例较大,后期因总分子数增大而比例减少;另外,与壳聚糖分子质量与特性黏度的关系以及降解反应过程的产物抑制也可能相关。
2.6 降解前后脱乙酰度的变化
在降解效果较好、黏度较低、不影响测定的情况下选择在初始质量浓度3 g/L、pH 4.4、温度50 ℃、压力0.3 MPa、反应时间3 h,通气量1 276.03 mL/min条件下测定通入氧气前后的涡流空化降解后壳聚糖原料的脱乙酰度,结果分别为90.17%和89.54%,无明显变化。可见,降解过程中壳聚糖分子链上的氨基没有被破坏,氨基和它的相邻键没有发生断裂。
2.7 红外光谱分析
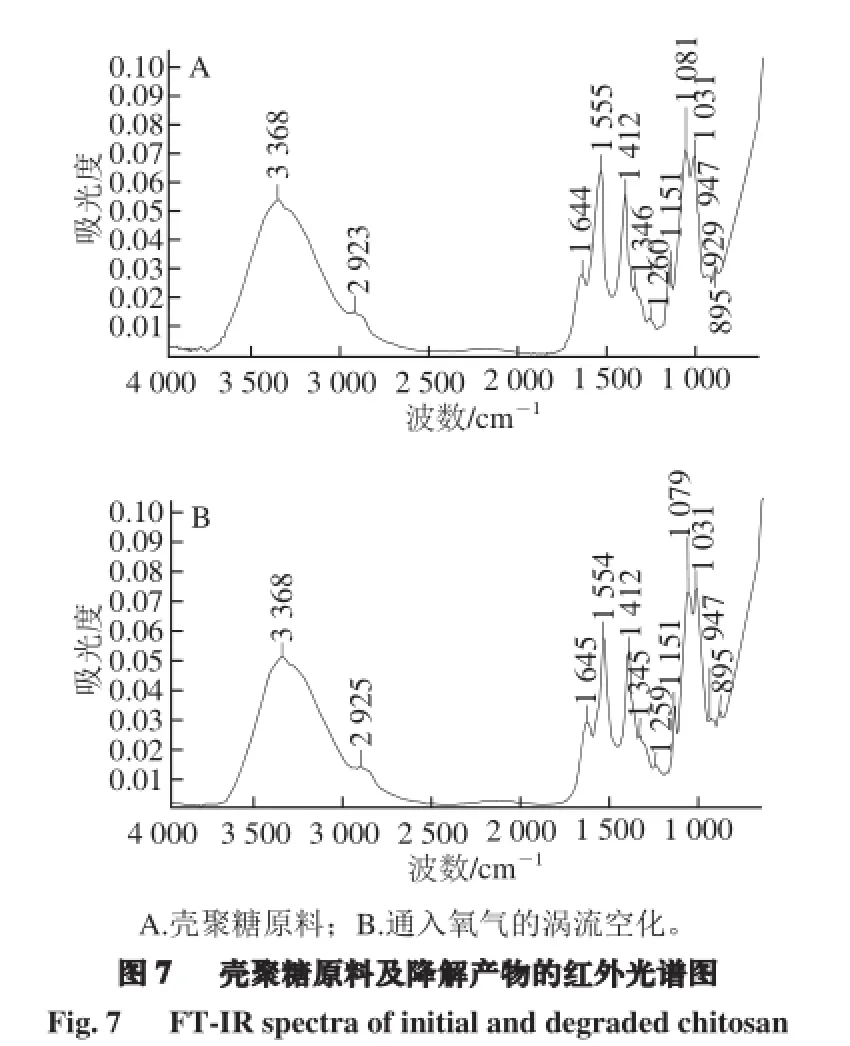
3 368 cm-1是O-H和N-H的强吸收峰[20];2 923 cm-1是-CH2、-CH3伸缩振动;1 644 cm-1和1 554 cm-1是酰胺I带和酰胺II带[14];1 345 cm-1为酰胺III带[21-22];1 150、1 079 cm-1和1 031 cm-1分别为C-O-C、C-O(C3-OH)、C-O(C6-OH)伸缩振动[23];895 cm-1附近的吸收峰为β-糖苷键的特征吸收峰[24]。由图7可以看出,壳聚糖原料与降解后产物的红外光谱图基本一致,没有出现或消失新的吸收峰,这说明降解后壳聚糖主链结构及官能团基本没变,空化降解主要作用于壳聚糖分子的β-(1,4)糖苷键上。壳聚糖-NH2的N-H面内变形振动谱带强度与脱乙酰度有关,1 644、1 345、1 554 cm-1的强度几乎没有变化,这说明壳聚糖降解前后的-NH2数量几乎没变,脱乙酰度也没有发生改变[25]。
3 结 论
在不同pH值、温度、压力、空化时间等条件下,氧气对壳聚糖的涡流空化降解均具有明显的促进作用。在质量浓度为0.5 g/L时,壳聚糖降解产物的特性黏度下降率可提高至79.98%,在起到相同的降解效果时,与不通气体时相比,通入氧气可大大提高溶液的质量浓度,在质量浓度为5~7 g/L时氧气的作用尤为显著。氧气的通入减弱了pH值对壳聚糖涡流空化降解的影响、在反应的初期大大加快了反应的速率;其作用机理有待进一步研究。
降解前后脱乙酰度的测定及红外光谱分析表明,经过降解的壳聚糖,其主链结构及官能团基本没变,降解过程中空化作用主要发生在壳聚糖分子的β-(1,4)糖苷键上。
[1] 罗平, 何波兵, 周宗华, 等. 水溶性低分子壳聚糖的制备[J]. 化学研究与应用, 2000, 12(6): 677-679.
[2] 陈巍, 罗志刚, 李忠彦, 等. 物理方法在壳聚糖降解中的应用[J]. 粮油食品科技, 2006, 14(3): 56-57.
[3] 黄永春, 李琳, 郭祀远, 等. 木瓜蛋白酶对壳聚糖的降解特性[J]. 华南理工大学学报(自然科学版), 2003, 31(6): 71-75.
[4] 刘石生, 丘泰球, 蔡纯, 等. 超声对壳聚糖降解作用的研究[J]. 广东工业大学学报, 2002, 19(3): 83-86.
[5] HUANG Y C, WU Y, YANG F. Numerical simulation on the dynamics for the ultrasonic cavitation bubble in chitosan solution[J]. Applied Mechanics and Materials, 2013, 275/277: 628-634. DOI:10.4028/ www.scientific.net/AMM.275-277.628
[6] WU Y, HUANG Y C, ZHOU Y, et al. Degradation of chitosan by swirling cavitation[J]. Innovative Food Science & Emerging Technologies, 2014, 23: 188-193.
[7] YOO Y E, TAKENAKA N, BANDOW H, et al. Characteristics of volatile fatty acids degradation in aqueous solution by the action of ultrasound[J]. Water Research, 1997, 31(6): 1532-1535.
[8] 李翠颖, 卞华松. 超声波降解水溶液中甲醛的研究[J]. 上海环境科学, 2002, 21(1): 12-14.
[9] 孙红杰, 赵明举, 张志群. 超声降解十二烷基苯磺酸钠的实验研究[J].环境科学学报, 2003, 23(3): 386-390.
[10] 王宏青, 夏黎明. 灭多威的超声降解研究[J]. 应用声学, 2001, 20(2):35-37.
[11] 杨锋, 刘婷, 黄永春, 等. 气体对涡流空化降解壳聚糖的影响[J]. 食品与机械, 2015, 31(2): 47-51.
[12] 陈鲁生, 周武. 壳聚糖粘均分子量的测定[J]. 化学通报, 1996(4): 57.
[13] HUANG Q Z, LI H Z, YING C G. Heterogeneous degradation of chitosan with H2O2catalysed by phosphotungstate[J]. Carbohydrate Polymers, 2008, 72(3): 500-505.
[14] WANG W P, DU Y M, QIU Y L, et al. A new green technology for direct production of low molecular weight chitosan[J]. Carbohydrate Polymers, 2008, 74(1): 127-132.
[15] 邵晓虹. 壳聚糖的功能化修饰及其在药物释放系统上的应用研究[D].广州: 暨南大学, 2013.
[16] 张涛. 声化学反应器中声场及空化场研究[D]. 西安: 陕西师范大学,2004.
[17] 余冬梅. 水力空化发生的影响因素及评价[D]. 天津: 天津科技大学,2010.
[18] 张卫国, 周永国, 杨越冬, 等. 有机酸及降解条件对壳聚糖降解速度的影响[J]. 河北科技师范学院学报, 2006, 20(1): 32-34.
[19] 于淑娟, 马菲, 徐献兵. Maillard反应体系中亚硫酸根对2-氨基-2-脱氧葡萄糖降解的影响[J]. 华南理工大学学报(自然科学版),2013(10): 34-39; 46.
[20] 梁燕. 壳聚糖降解及高分子溶液特性黏度测定方法的研究[D]. 上海: 华东师范大学, 2007.
[21] GU Z M, CAI Q Y, HE Y, et al. Degradation of hyaluronan by an electrochemical process[J]. Carbohydrate Polymers, 2010, 82(2):521-523.
[22] 耿晓东. 壳聚糖衍生物的制备及其抑菌性能研究[D]. 杭州: 浙江工商大学, 2013.
[23] YUE W, HE R, YAO P J, et al. Ultraviolet radiation-induced accelerated degradation of chitosan by ozone treatment[J]. Carbohydrate Polymers, 2009, 77(3): 639-642.
[24] 李海浪. 壳聚糖衍生物的制备及其在药物载体中的应用研究[D]. 上海: 中国科学院研究生院, 2014.
[25] 胡伟. 氨基酸离子液体体系下电催化降解壳聚糖研究[D]. 南京: 南京理工大学, 2012.
Effect of Oxygen on Degradation of Chitosan with Swirling Cavitation
ZHANG Weiwei, REN Xiane*, YANG Feng, HUANG Yongchun, HE Ren
(Key Laboratory for Processing of Sugar Resources of Guangxi Higher Education Institutes, Guangxi Key Laboratory of Green Processing of Sugar Resources, College of Biological and Chemical Engineering,Guangxi University of Science and Technology, Liuzhou 545006, China)
In this research, the effect of oxygen on the degradation of chitosan by swirling cavitation under different conditions of initial concentration of chitosan solution, pH, temperature, inlet pressure and cavitation time was studied. The results showed that low initial concentration of chitosan solution resulted in better degradation efficiency of swirling cavitation. When the following conditions were used: solution pH, 4.4; temperature, 70 ℃; inlet pressure, 0.4 MPa; and cavitation time 3 h, chitosan solution showed the largest decline in intrinsic viscosity. Under each of the tested conditions,continuous feeding of oxygen significantly augmented the decrease in intrinsic viscosity, which could result in the maximum improvement of 35.36%. The effect of oxygen on the degradation of high chitosan concentration was more significant. pH impact on the degradation of chitosan was weakened, and the reaction rate was greatly accelerated in the early stage of the reaction as a result of increased oxygen supply. The major chain structure and functional groups of chitosan after degradation were not changed.
oxygen; swirling cavitation; degradation; chitosan
10.7506/spkx1002-6630-201609009
TS244
A
1002-6630(2016)09-0045-05
2015-06-29
国家自然科学基金地区科学基金项目(31160348);广西高等学校高水平创新团队及卓越学者计划资助项目(桂教人[2014]7号)
张伟伟(1990—),女,硕士研究生,研究方向为生物资源化工。E-mail:1279848659@qq.com
*通信作者:任仙娥(1979—),女,高级实验师,硕士,研究方向为食品生物技术。E-mail:rxe12@sina.com

