发热患者降钙素原水平与血培养阳性检出时间相关性
王新元,周 宁,祝 峰,张 惠
发热患者降钙素原水平与血培养阳性检出时间相关性
王新元,周宁,祝峰,张惠
目的探讨降钙素原(procalcitonin ,PCT)与血培养阳性时间(time to blood culture positivity ,TTP),对发热患者菌血症感染严重程度的判断及指导临床诊治价值。方法选择2014-05至2016-04住院患者173例,血培养均为阳性,同时进行PCT水平的检测。将患者按其是否发热分为,发热组139例与非发热组34例,按发热程度分低、中等、高热及超高热组,统计各组PCT和TTP,比较各组间PCT和TTP相关性。结果发热组与非发热组PCT、TTP两项指标平均值分别为3.41 ng/ml,13.81 h和1.83 ng/ml、22.79 h。发热组血清PCT水平高于非发热组,TTP低于非发热组。两组间比较差异均有统计学意义(P<0.05)。发热各组平均PCT分别为2.16 ng/ml、2.41 ng/ml、3.65 ng/ml、4.03 ng/ml。从低热组到超高热组PCT的变化结果表明,随着发热程度的加重,TCT含量呈逐渐上升趋势,两组间比较差异有统计学意义(P<0.05)。TTP结果表明,从低热组到超高热组TTP呈逐渐下降趋势。差异有统计学意义(P<0.01)。结论PCT与发热患者菌血症感染程度呈正相关,表明菌血症越严重,PCT结果越高。TTP与发热患者菌血症感染程度呈负相关,表明菌血症越严重,TTP结果越短。将PCT与TTP两者结合检测,对临床预测感染程度有重要的参考价值。
降钙素原;血培养阳性时间;发热
目前,发热现象是临床血液感染常见症状之一。尽早明确细菌感染是赢得治疗的关键,可对何时选择使用抗菌药提供重要依据。文献[1]报道,每提前1 h使用有效抗菌药物可增加7%~10%的生存率,感染患者如果得不到及时有效的诊断和治疗,容易导致病情恶化,甚至引发严重败血病,导致病死率快速增高,因此,高病死率与诊断延误有重要的关联[2-4]。本研究通过对发热患者降钙素原(procalcitonin ,PCT)、血培养阳性时间(time to blood culture positivity ,TTP)进行相关性分析,旨在评价患者血液感染严重程度,对临床预测感染程度提供参考。
1 对象与方法
1.1对象选择2014-05至2016-04我院治疗血培养阳性患者173例,同时检测PCT。年龄11~89岁,平均(48.5±18.8)岁,男143例,女30例。根据临床是否发热及发热程度将其分为发热组139例与非发热组34例。各组间性别差异无统计学意义,具有可比性。
1.2仪器与方法患者入院1 d内进行PCT的测定及血培养。抽取静脉血3.0 ml,分离血清,2 h内测定完毕,采用北京Hotgen上传发光免疫分析仪及其配套试剂,采用上传发光法测量PCT。同时抽取各5.0 ml血样,进行需氧、厌氧双瓶血培养,应用美国产BACTEC 9120型全自动血培养仪及其专用血培养瓶,严格按仪器及方法学操作。将139例发热患者按发热程度从低到高分为4组,低热指体温在37.5 ℃~38.0 ℃;中等发热体温在38.1 ℃~39.0 ℃;高热指体温在39.1 ℃~40.4 ℃;超高热体温在40.5 ℃以上。统计各组血清PCT和TTP,比较各组间PCT和TTP相关性。
1.3检测标准通常认为健康人群PCT含量不高于0.30 ng/ml。而健康人群TTP应该60 h以上培养不生长细菌。
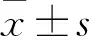
2 结 果
2.1有无发热PCT、TTP组统计发热组与非发热组两组PCT和TTP。发热组PCT为(3.41±1.72) ng/ml,非发热组PCT为(1.83±1.88) ng/ml,明显低于发热组,差异有统计学意义(P<0.01)。发热组TTP为(13.81±6.33) h,非发热组TTP为(22.79±5.37) h,非发热组TTP明显高于发热组,两组比较差异有统计学意义(P<0.01)。
2.2PCT和TTP发热程度分组低热组到超高热组患者的结果为2.16±1.32 ng/ml逐渐增加到4.03±2.91 ng/ml,差异有统计学意义(P<0.05)。TTP低热组到超高热组患者的结果为27.35 h逐渐下降到10.46 h,差异有统计学意义(P<0.01,表1)。
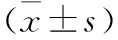

组别例数PCT(ng/ml)TTP(h)低热组312.16±1.3227.35±8.89中等热组452.41±1.1822.60±7.71①高热组333.65±2.32①13.27±5.33①超高热组304.03±2.91①10.46±6.68①
注:与低热组比较,①P<0.05
3 讨 论
3.1PCT应用价值PCT是降钙素的前体物质,是近几年发现的新型炎性反应因子,是一种具有激素活性的糖蛋白,由116个氨基酸组成。在正常情况下,无激素活性的降钙素原是甲状腺C细胞产生的,并由特殊蛋白酶分解降钙素原成降钙素。正常人的血液PCT浓度非常低,细菌感染后由炎性反应刺激后在全身多个器官组织产生,导致外周血液中PCT浓度升高。正常情况下血清PCT小于0.25 ng/ml,无细菌感染,不建议使用抗生素。 当PCT达0.25 ng/ml~2.0 ng/ml时,为多种疾病感染诊断临界值[5],也可作为肺部感染等多种疾病提供辅助诊断[6],且于感染程度呈正相关。当PCT大于2.0 ng/ml时为脓毒血症高危险状态[7]。当PCT大于5.34 ng/ml时,严重败血症患者死亡危险性增高,所以PCT作为血液细菌感染的辅助诊断有很高的灵敏度。同时,在一些meta分析中,PCT作为预后的指标之一,可预测严重患者的预后[8-12]。本研究结果表明,发热组与非发热组PCT平均值分别为3.41 mg/ml和1.83 mg/ml,结果显示发热组PCT明显高于非发热组,两组间差异有统计学意义。从低到高发热各组平均PCT分别为2.16 ng/ml、2.41 ng/ml、3.65 ng/ml、4.03 ng/ml。表明随着患者体温不断升高,PCT水平也随之升高,呈正相关,患者感染程度不断加重,PCT结果则越来越高,提示病情越严重。测定血清PCT水平,可以提示临床医师及时有效使用抗菌药物,进行相应对症治疗,加快危险病情的转归。并且可以随着抗菌药物的有效应用,炎性反应的控制和病情的缓解,确定继续使用抗生素的治疗方案。如果PCT在治疗3 d内下降30%,表明抗生素治疗有效,可长期使用逐渐降至正常水平。因此,定量测定血清PCT水平,可作为细菌感染和早期预测、治疗监控及预后的理想指标。
3.2全自动血培养仪的优势血培养是临床上最基础也是普遍的血行感染病原体检测方法之一[13]。发热患者血培养阳性是血液感染诊断的金标准。因此,发热患者在未使用抗菌药物之前,均应进行血培养及细菌鉴定,以利于合理、有针对性的用药[14]。TTP判断是血液菌血症、败血症诊断的最直接和重要指标检测依据。与人工培养箱和普通血培养鉴定仪相比,BACTEC9120型全自动血培养仪有降低污染率,提高阳性检出率的优势,它是一种专门设计用于快速培养和检测血液中细菌的自动化报警仪器。其工作原理是利用培养瓶中的营养液,供应适应环境中,针对大多数细菌的营养要求和生长特性,对受检者血液中细菌进行繁殖。存在于培养瓶中的微生物会在培养液中进行新陈代谢,分解糖类产生CO2,瓶底的底物与CO2发生作用,经光照后可激发出荧光, CO2浓度的高低直接调控受激荧光强度的大小,仪器的光电探测系统测量荧光强度的水平,荧光的强弱与CO2浓度有关,而CO2的高低代表了微生物存在量的多少,仪器的电脑系统每10 min对检测到的原始数据进行1次分析,判断被测样本是否有微生物的存在,遇有阳性判断即会在第一时间自动报警提示。
3.3TTP应用TTP检出时间长短主要取决于细菌代谢中产生和释放的CO2的量及其增加的变化速度[3]。细菌繁殖含量呈几何倍数增长,短时间内产生的大量CO2,血培养瓶底部产生荧光变化越快,TTP检出时间越短,菌血症患者的血液中细菌生长繁殖,可导致败血症的发生,释放内毒素、外毒素也随之不断增加。因此,TTP反映感染患者血中细菌含量,也反映体内的内、外毒素的含量,导致PCT物质的释放,使的血液中PCT含量进一步升高。有文献报道,败血症患者以感染金黄色葡萄球菌和大肠埃希菌最为常见,金黄色葡萄球菌检出时间TTP≤12 h,而大肠埃希菌检出时间则TTP≤7 h,血培养金黄色葡萄球菌和大肠埃希菌检出率分别为42.5%和25.5%,TTP检出时间越短表示病情越重,风险越高[15,16]。本研究结果显示,发热组与非发热组TTP检出时间平均为13.81 h和22.79 h,发热组TTP检出时间明显短于非发热组,差异均有统计学意义(P<0.01)。比较发热组从低热、中等热、高热及超高热平均TTP,各组间差异均有统计学意义。表明随着发热程度的增加,PCT水平逐渐上升,而TTP下降明显,PCT与TTP呈负相关性变化趋势。表明感染细菌总量越多,临床症状越严重,所以临床医师应密切关注患者体温及病情变化。与文献[15]报道相关,患者体征、病情的严重程度呈负相关基本一致。PCT物质的释放及TTP检出时间,可用于呼吸、消化、神经系统及术后感染等多系统、多病种的监测。TTP大于7.4 h可认为患者死亡危险性低,这时使用有效、对细菌的抗菌治疗,有利于患者的预后[17]。TTP具有对感染患者辅助诊断、提示病情的风险程度和指导临床用药的作用。有文献报道,可用血培养阳性检出时间评分(PCTTs)来判断,PCTTs是建立在PCT及TTP基础之上的综合评定,可对于菌血症及败血症患者的危险性早期预测,有高灵敏度的特点[3,15]。
综上所述,TCT水平结合TTP变化,可应用于菌血症患者危险性预测和判断疾病严重程度。具有高敏感度,可以为临床医师提供辅助诊断及药物使用的疗效监测。由于本研究受样本量的限制,未统计分析TTP血液感染的不同病原体之间的差异,以及PCT变化及抗菌药物疗效间的相关性,还有待下一步进行研究。
[1]Kumar A,Roberts D,Wood K F,etal.Duration of hypotension hefore initiation of effectiveantimicroial therapy is the critical derminant of survival in human septic shock[J].Crit Care Med,2006,34(6):1589-1596.
[2]张青,王东浩,张文芳,等.血培养阳性时间差法对重症患者导管相关性血流感染诊断的应用价值[J].中华危重病急救医学,2015 ,27(6):489-493.
[3]叶晓涛,马焕丽,陈日炳,等.降钙素原检测联合血培养阳性时间评分用于严重败血症患者的预后判断[J].国际检验医学,2013,34(8):1932-1934.
[4]由继君.血清降钙素原与血流感染患者相关性及意义评价[J].中国现代药物应用,2016,10(2):32-33.
[5]王世瑜,谭广群,穆红.血清降钙素原定量检测在呼吸道感染中的应用[J].广东医学, 2013,34(1):42.
[6]李玉华,朱正林,贾宁宁,等.降钙素原在肺部感染疾病中的应用[J].武警医学,2014,25(2):186-187.
[7]Reinhart K,Meisner M,Brunkhorst F M.Markers for sepsis diugnosis:what is useful[J].Crit Care Clin,2006,22(3):503-519.
[8]Hillas G,Vassilakopoulos T,Plantza P,etalCjreactive protein and pProcalcitonion as predictor of survival and septic shock in ventilator-associated pneuminia [J].Eur Respir J,2010,35(4):805-811.[9]赵立杰,王翠霞,郭军英.血清降钙素原和C反应蛋白联合检测对发热患者的诊断价值[J].现代中西医结合杂志, 2015, 24(3):269-271.
[10]Azevdeo J R,Torres O J,Czwczko N G ,etal.Procalcitonin as a prognositic biomarker of severe sepsis and septic shock[J].RevCol Bras Cir ,2012,39(6):456-461.
[11]崔晓莉,王忠勇,赵宏胜,等.血清降钙素原对重症患者细菌感染预后的预测价值[J].中华急诊医学杂志,2013,22(6):630-633.
[12]姚明媚,汤凤珍,胡英华,等.血培养联合降钙素原对血流感染患者的诊断价值分析[J].国际检验医学杂志, 2015,36(9):1292-1293.
[13]赵红丽,许立,马玉国,等.305株手工法血培养病原菌分布情况及耐药性分析[J].武警医学,2012,23(4):290-295.
[14]王凯飞,沈定霞,刘朝军,等.血清降钙素原定量分析与血培养结果的比较[J].中华检验医学杂志,2012,3(35):243-246.
[15]段京京,宁永忠,赵雪,等.血培养阳性报警时间的临床应用 [J].中华检验医学杂志,2015,12(1):67-69.
[16]Bo S N,Bo J,Ning Y Z,etalRelationship between time to positivity of blood culture with clinical characteristics and hospital mortality in patients with Escherichia coli bacteremia [J].Chin Med J(Engl),2011,124(3):330-334.
[17]Bafadhel M,Clark T W,Reid C,etal.Procalcitonin and C-reactive protein in hospitalized adult patients with community acquired pneumonia or exacerbation of asthma or COPD[J].Chest,2011,139(6):1410-1418.
(2016-05-31收稿2016-07-18修回)
(责任编辑郭青)
Correlations between procalcitonin level and time to blood culture positivity of febrile patients
WANG Xinyuan, ZHOU Ning, ZHU Feng,and Zhang hui.
Departmant of Clinical Laboratory, Jiangsu Provincial Corps Hospital,Chinese People’s Armed Police Force,Yangzhou 225003,China
ObjectiveTo explore the role of procalcitonin(PCT) and time to blood culture positivity (TTP) in evaluating the severity of bacteremia among febrile patients and the clinical implications. Methods173 hospitalized patients who were positive in bacterial culture and treated between May 2014 and April 2016, were enrolled in this study and detected with PCT . These patients were divided into two groups: fever group(n=139) and non-fever group (n=34); The fever group was further divided into low, medium, high and ultra-high fever groups. PCT and TTP were statistically analyzed and compared between the two groups.ResultsThe mean values of PCT and TTP were 3.41 ng/ml and13.81 h, respectively, in fever group, but 1.83 ng/ml and 22.79 h, respectively, in non-fever group. Serum PCT level of fever group was higher than that of non-fever group, but TTP of fever group was lower. PCT and TTP were significantly different between fever and non-fever groups (P<0.05). The mean values of PCT in four fever groups were 2.16 ng/ml, 2.41 ng/ml, 3.65 ng/ml and 4.03 ng/ml respectively. PCT level tended to increase from low fever to ultra-high fever groups. There was significant difference between these fever groups (P<0.05). The mean values of TTP in four fever groups were 27.35 h, 22.60 h, 13.27 h and 10.46 h respectively.There was significant difference between these fever groups (P<0.01).ConclusionsPCT is positively associated with bacteremia infection levels of febrile patients, while TTP is negatively associated. PCT and TTP values can play an important role in predicting the level of bacteremia infection .
procalcitonin;time to blood culture positivity; febrile
王新元,本科学历,主管技师。
225003扬州, 武警江苏总队医院检验科
周宁,E-mail:15052520202@sina.cn
R446.5;R446.11

