自水解预处理对杨木聚木糖分布的影响
耿星月 刘 苇 侯庆喜 陈 威
(天津科技大学天津市制浆造纸重点实验室,天津,300457)
·聚木糖分布·
自水解预处理对杨木聚木糖分布的影响
耿星月刘苇侯庆喜*陈威
(天津科技大学天津市制浆造纸重点实验室,天津,300457)
采用免疫荧光标记法结合共聚焦显微镜(CLSM)研究了自水解强度对杨木聚木糖分布的影响。结果表明,聚木糖荧光信号较均匀地分布于杨木纤维细胞壁中,随强度因子的增大细胞壁中心部位荧光信号下降逐渐增多,细胞壁边缘荧光信号下降较少,有些部位甚至会稍许增加。采用高效液相色谱(HPLC)检测法测得强度因子增强到3.72时,聚木糖含量从原料的14.64%下降到7.33%;对聚木糖荧光图谱进行区域强度统计,可得出与HPLC检测法结果相同的变化趋势。
自水解预处理;杨木聚木糖;免疫荧光标记法;共聚焦显微镜
(*E-mail: qingxihou@tust.edu.cn)
由于现代社会对生物质能源需求量不断增长,生物质精炼与制浆造纸技术相结合的概念受到了人们的广泛关注。为使生物质精炼过程更具经济性,不但要有广泛适用于生物质精炼的原料,对生物质原料预处理过程的深入理解也十分必要[1]。在制浆造纸前将生物质原料进行预处理,可使原料中的半纤维素和木素等组分部分溶出,有利于后续对其高值化利用。目前关于木质纤维原料预处理方面大量的报道中[2-3],自水解有望成为一种简洁高效、对环境友好、成本又低的预处理技术[4]。
植物纤维主要由纤维素、半纤维素及木素三大组分构成,另外也含有一些少量组分。半纤维素中的聚木糖降解成的低聚木糖可作为一种功能性低聚糖与饮料、食品、乳制品、保健品及药品配合使用以增加产品功能性。如在饮料中,低聚木糖以其良好的耐热、耐酸及储藏稳定性,增加了饮料的稳定性,是蔗糖的良好替代物[5]。在纤维细胞壁的形成阶段,半纤维素的合成和沉积始终与纤维素有着紧密联系,如部分半纤维素可以通过增加氢键结合吸附在纤维素的表面来提高纤维网络之间的强度[6-8]。目前,为了更有效地利用生物质原料中各组分对其进行酶水解是最常用的方法之一,而在酶水解的过程中,为了提高酶水解效率,关键是要提高纤维素酶对纤维素降解的可及性[9]。作为纤维细胞壁的重要组成部分,聚木糖和果胶质也为细胞壁中纤维素晶体的结合提供了基质,从而使纤维细胞壁内各种物质更加紧密地结合在一起。正因为如此,聚木糖在某种程度上阻碍了纤维素酶对纤维素的降解作用[10-11]。为了使酶解过程更加有效,必须对聚木糖进行去除。
杨木以其生长迅速、适应性强、易繁殖、砍伐期短、经济价值高等特点,已成为我国北方,特别是平原地区栽培面积最大、木材产量最高的重要树种之一。阔叶木纤维细胞壁中半纤维素的含量一般为18%~23%[12],其主要成分是4-O-甲基葡萄糖醛酸木糖,由(1- 4)-β-D-木糖构成主链,主链的C-2位被4-O-甲基-α-D-葡萄糖醛酸取代,C-2或C-3位发生乙酰基取代[13-15]。为了更好地了解杨木在自水解过程中细胞壁内聚木糖的分布及变化情况,本实验采用免疫荧光标记法结合共聚焦显微镜(CLSM)对其进行了研究,以共聚焦图谱中各处荧光信号的强弱来表征该处聚木糖浓度的大小;随机选取多段细胞壁对其荧光强度进行积分,所得结果来表征细胞壁中聚木糖总量。同时采用高效液相色谱(HPLC)检测法来测定细胞壁中聚木糖总量随自水解预处理强度变化的情况。
1 实 验
1.1实验原料
杨木片由山东某造纸厂提供。杨木片经筛选、洗涤、风干后,装入密封袋中备用。参照美国能源实验室标准NREL/TP-510- 42618[16]和NERL/TP-510- 42619[17]分析杨木片的化学组分,结果见表1。

表1 杨木的化学组分
1.2主要实验仪器及设备
M/K双缸蒸煮锅(CN3000,EOMEGA);高效液相色谱仪(1200Series,美国Agilent Technologies);立式压力蒸汽灭菌器(LDZX-30FB,上海申安医疗器械厂);冷冻切片机(cco944c1403 Thermo Scientific);共聚焦扫描显微镜(CLSM)(Olympus IX81,美国奥林巴斯公司)。
1.3实验方法
按:冠,指古代帝王、官员所带的帽子。秩,俸禄。《周礼·天官·宫伯》:“行其秩叙”,郑玄注:“秩,禄禀也。”《左传·庄公十九年》:“王夺子禽、祝跪与詹父田,而收膳夫之秩。”杜预注:“秩,禄也。”《晏子春秋·杂上八》:“今请求老弱之不养,鳏寡之无室者,论而共秩焉”。张纯一校注:“秩,禄也。所以为养也。”故“冠秩”用来比喻仕宦。“冠秩”一词,《汉语大词典》未收。
1.3.1自水解预处理
自水解预处理在M/K双缸蒸煮锅中进行。取150 g绝干杨木置于双缸蒸煮锅中,设定液比为1∶10;先使蒸煮锅内蒸馏水升温至100℃再放入事先准备好的杨木,之后使其升至所需温度并保温一定时间。自水解预处理结束后使自水解液迅速冷却,水解后的杨木用自来水充分洗涤以减少溶出物的粘附。
1.3.2聚木糖含量的测定
采用高效液相色谱(HPLC)检测法测定自水解液中聚木糖及自水解预处理后杨木中剩余聚木糖的含量。自水解液中聚木糖含量的测定:25℃下取一定量自水解液,将其用4%稀硫酸在高压灭菌锅内水解1 h,之后迅速冷却;然后用G4漏斗过滤水解液,取若干液体经过0.22 μm微孔水性滤膜后进行HPLC分析。测得木糖含量,再经系数换算得到自水解液中聚木糖的含量(相对于原料中聚木糖含量)[17]。本实验使用型号为Biorad Aminex HPX-87H的高压液相色谱柱。
自水解后杨木中剩余聚木糖的测定:自水解后的杨木风干后磨粉,取40~60目木粉,经乙醇抽提后,取相当于0.3 g绝干质量的木粉,用72%硫酸在30℃下水解1 h,再将水解液稀释至硫酸浓度为4%,然后在高压灭菌锅内水解1 h,之后迅速冷却;用G4漏斗过滤水解液,取若干自水解液经0.22 μm微孔水性滤膜后进行HPLC分析。测得木糖含量,再经系数换算得到自水解后杨木中剩余聚木糖含量(相对于原料中聚木糖含量)[18]。
1.3.3自水解后杨木中剩余聚木糖分布的测定
采用免疫荧光标记法对聚木糖在杨木细胞壁中分布进行测定。杨木中聚木糖对抗体LM11具有特异的结合性能[18],用抗体LM11对聚木糖进行标记,并用能显示荧光的二抗 Alexa Fluor 488抗体进行染色,使其能在共聚焦显微镜下显示荧光。具体实验样品制备过程如下:随机从自水解预处理后的杨木片中挑出几片,将其裁剪成10 mm(长) × 1 mm(宽) × 1 mm(厚)的小木条数根;将小木条在2.5%的戊二醛溶液中浸泡10 h,以使植物组织固定;固定后用自来水冲洗12 h,之后风干,再经NEG50树脂包埋后进行冷冻切片,切出厚度为5 μm的薄片。用蒸馏水对切片进行脱树脂,3%的牛血清蛋白磷酸盐缓液(BSA)孵育 30 min,去除非特异性结合位点。之后用磷酸盐缓冲液稀释一抗大鼠单克隆抗体(聚木糖-杂交瘤细胞上清液)LM11拟糖蛋白,稀释5倍后于室温下孵育1 h(可根据样品具体情况延长孵育时间),用磷酸盐缓冲液冲洗3遍,每遍 5 min;再经磷酸盐缓冲液稀释100倍的二抗 Alexa Fluor 488继续孵育切片1 h,之后磷酸盐缓冲液洗 3 遍,每遍5 min,封片。采用CLSM对杨木切片进行观察、拍照。激光波长选为488 nm。
2 结果与讨论
2.1自水解预处理对杨木得率及聚木糖含量的影响
本实验主要研究自水解预处理过程中自水解温度和保温时间对水解效果的影响,因此引入了强度因子这一概念来综合评价自水解预处理强度对杨木细胞壁中聚木糖分布的影响。强度因子(R0)首先由R. P. Overend等人[19]提出,其计算公式见式(1)。
(1)
自水解预处理条件和相应的强度因子如表2所示。

表2 自水解预处理条件与相应的强度因子
按照所选定的条件对杨木进行自水解预处理,自水解后测定杨木的得率及杨木中剩余聚木糖含量,结果如图1所示。自水解过程中,杨木中的糖类、木素等成分都会有不同程度的溶出,造成杨木得率的下降。随着自水解强度的增加,杨木得率和聚木糖的含量都呈不断下降的趋势。当自水解强度因子增加到3.72(即自水解温度160℃、保温时间90 min)时,杨木得率下降到了84.85%,杨木中有15.15%的组分被溶出;在此预处理条件下,杨木中聚木糖含量只有7.33%,相比原料中的14.64%约有50%的聚木糖被溶出。
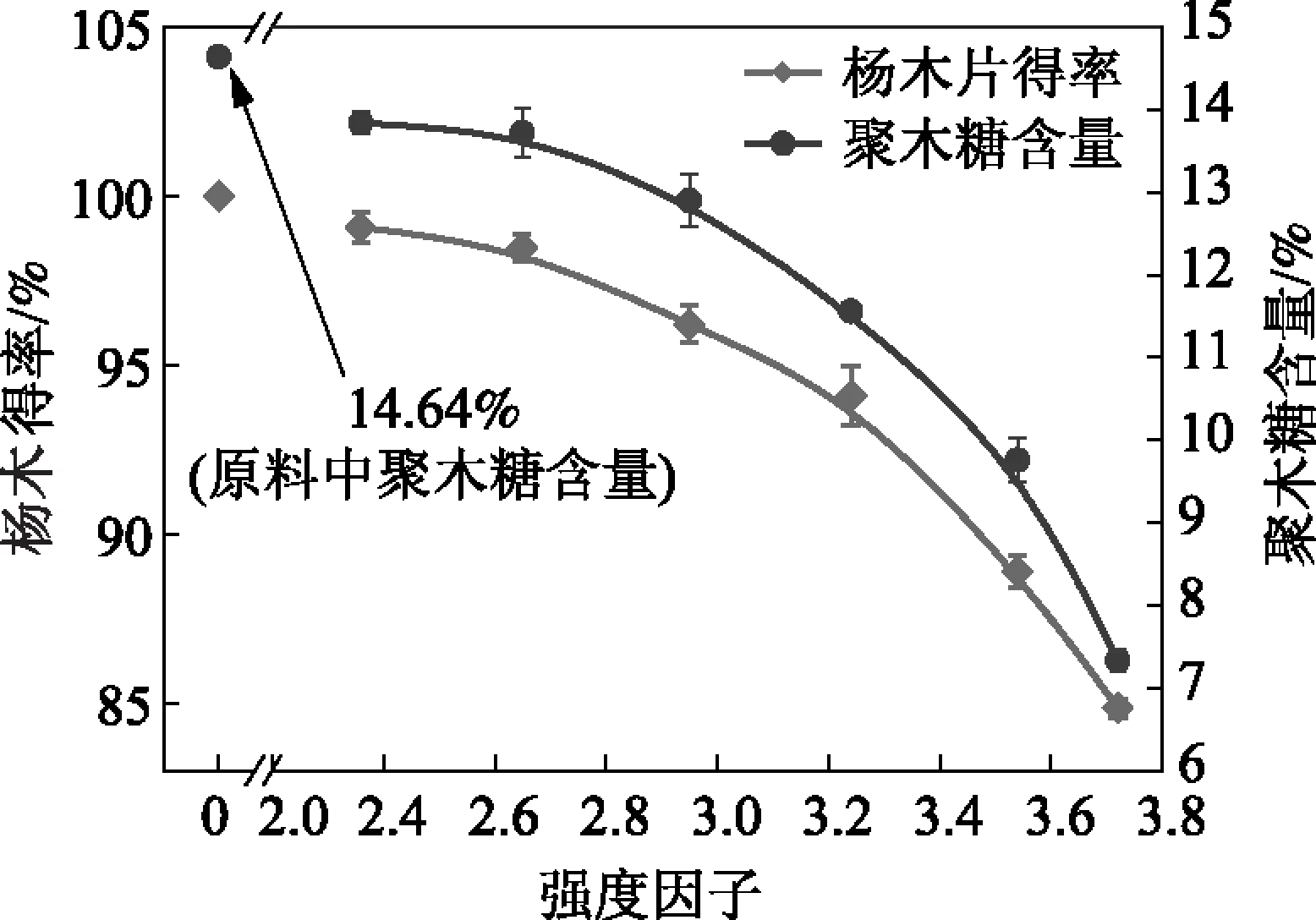
图1 自水解强度对杨木得率及聚木糖含量的影响
2.2自水解预处理对固液两相中聚木糖含量的影响
自水解预处理后,对自水解液中的聚木糖占原料中总聚木糖的百分比(即聚木糖含量)及杨木中的聚木糖减少量占原料中聚木糖的百分比(即聚木糖溶出率)进行了测定,结果如图2所示。由图2可以看出,预处理后杨木中聚木糖的溶出率总是高于水解液中聚木糖的含量,但两者变化趋势一致。当自水解强度因子为3.24时,杨木中聚木糖溶出率为17.8%,而水解液中检测到聚木糖含量仅有6.8%,这很可能是由于水解液中的部分溶出物在自水解结束后迅速冷却的过程中重新吸附在自水解预处理后的杨木上所致。Wen Jialong等人[20]在对预处理后木片进行扫描电子显微镜(SEM)观察时发现,水解后木片纤维表面形成很多球形颗粒物质,这可能是在高温酸性条件下从木片中溶解出的木素·碳水化合物复合体(LCC)遇冷重新沉积到纤维表面所致,经洗涤使部分粘附于木片上的这些物质流失,从而使木片中聚木糖的溶出率大于水解液中聚木糖的含量。另一方面,在自水解预处理过程中随着自水解强度因子的增加,部分溶解在水解液中的聚木糖降解成糠醛等副产物,也减少水解液中聚木糖的含量[21],使实际测得的水解液中聚木糖含量低于预处理后杨木中聚木糖的溶出率。

图2 自水解强度对固液两相聚木糖含量的影响
2.3自水解预处理对杨木纤维细胞壁中聚木糖分布的影响
采用免疫荧光标记法结合共聚焦显微镜对自水解预处理后杨木中聚木糖的分布进行拍照观察,并用Fluoviewer Viewer软件对所得图像进行处理,结果如图3~图5所示。图3、图4、图5中,A为CLSM拍摄得到图片;B为A中1、2处细胞壁放大图,C为图片A中1、2处两条测量线所对应的荧光信号强度,此信号的强弱表征该处聚木糖浓度的大小。由图3可以看到,未经自水解预处理的杨木中聚木糖荧光信号强度虽然在不同地方有所波动,但其波动幅度很小,相对均匀地分布于细胞壁内。由此可以推断,在未经自水解预处理的杨木纤维细胞壁内聚木糖的浓度相对均匀。这一点与Jong Sik Kim等人[22]在用荧光标记及金标记法观察不同生长状况的杨木时所得到的结果相一致,并且他们在其研究中指出,正常生长的杨木纤维细胞次生壁内的聚木糖呈现较强且相对均匀的分布趋势。
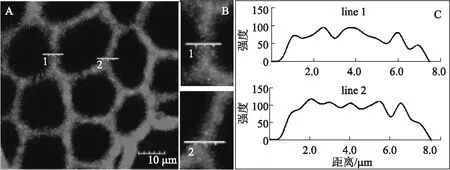
图3 未经自水解预处理的杨木中聚木糖分布的CLSM图
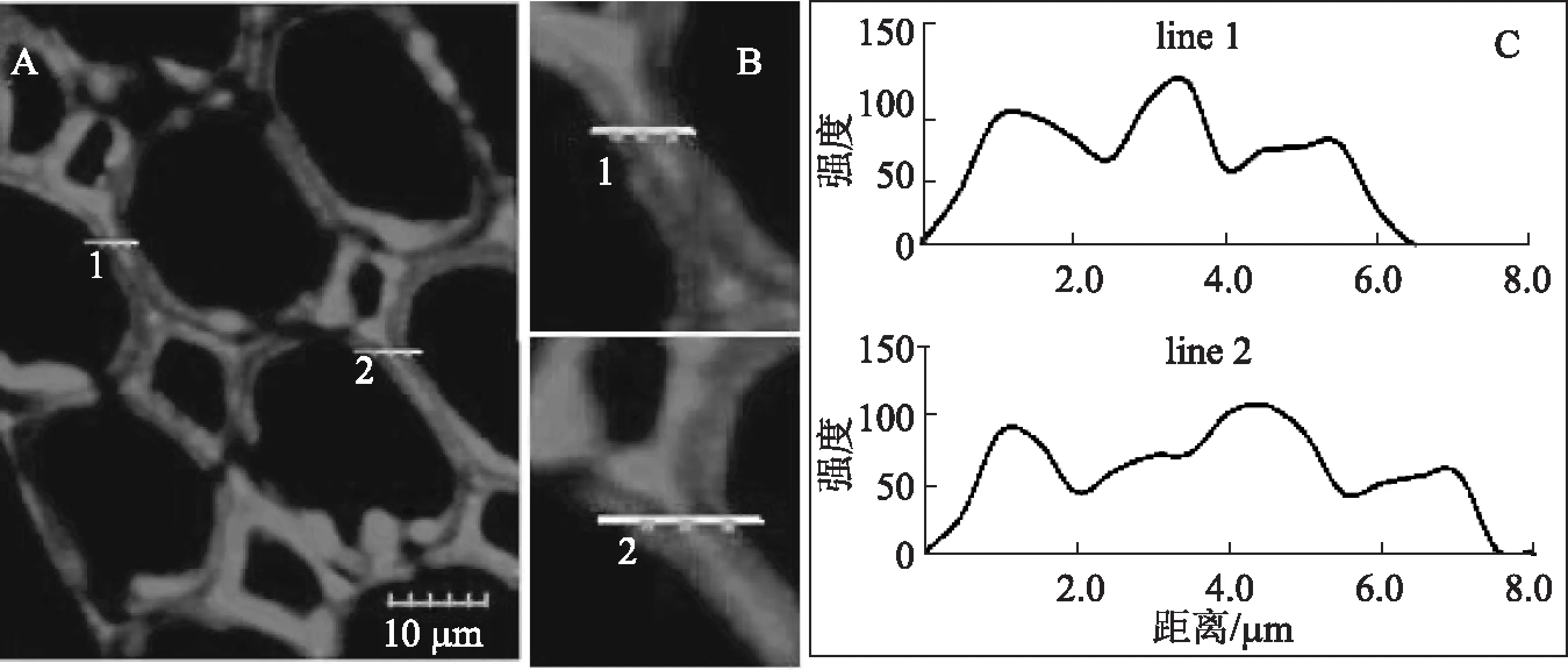
图4 自水解预处理后杨木中聚木糖分布的CLSM图(强度因子2.65)
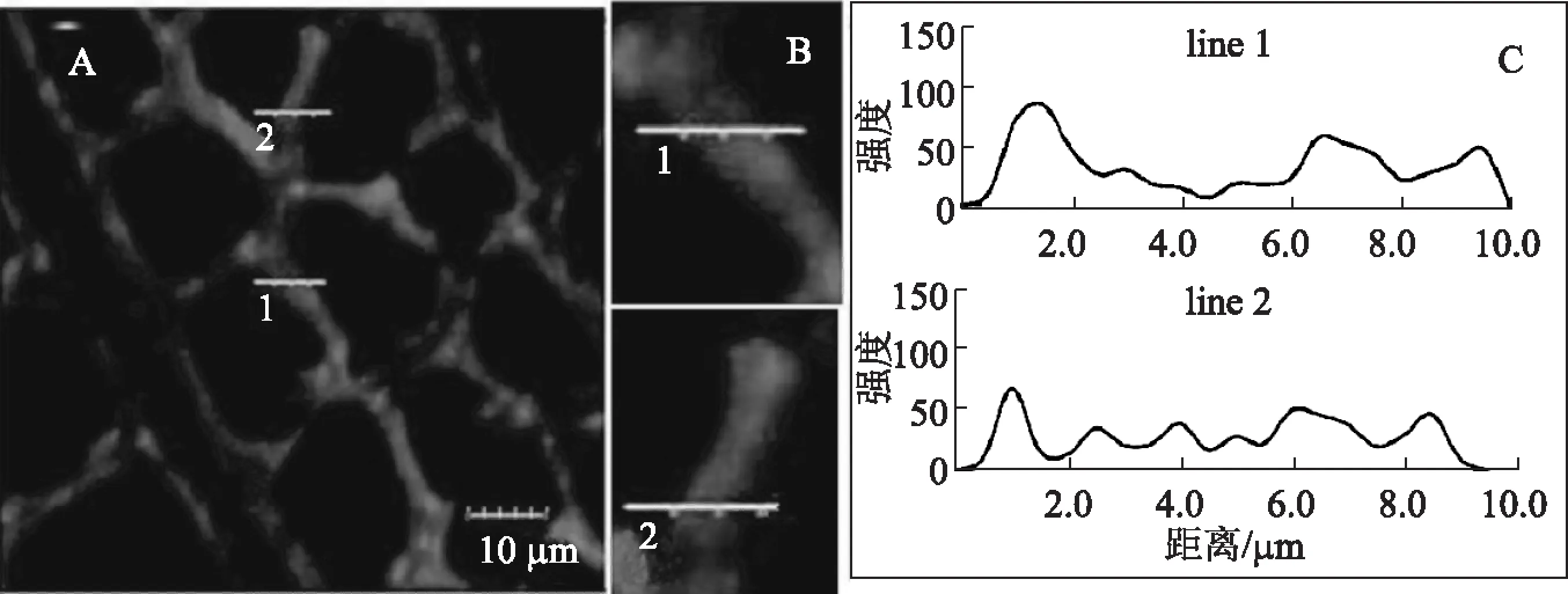
图5 自水解预处理后杨木中聚木糖分布的CLSM图(强度因子3.54)
经自水解预处理后部分聚木糖从纤维细胞壁中溶出,从图4可以看到经强度因子为2.65(即自水解温度140℃、保温时间30 min)的自水解预处理后,杨木纤维细胞壁中心部位的荧光信号比未经处理杨木的略有下降(line 1中2.0~3.0 μm之间及4.0 μm前后,line 2中2.0 μm前后和4.0 μm前后),而靠近纤维细胞腔周围及胞间层的荧光信号几乎没有减弱,有些细胞壁中甚至还有少许增加,如图4 C中1.0 μm左右处。从HPLC检测结果可知在此条件下聚木糖溶出率较少,仅为6.35%(相对原料中聚木糖),另外90%以上的聚木糖还存在于纤维细胞壁内。从图4中也可看出,杨木次生壁部分的荧光信号虽有所下降,但下降幅度不大,说明聚木糖的溶出量也较小。这一点与HPLC测得的结果(见图2)相吻合。
采用HPLC对强度因子为3.54(即自水解温度160℃、保温时间60 min)的自水解预处理后的杨木进行了聚木糖含量的测定。从分析结果(图2)可知,在此条件下杨木中的聚木糖溶出率较大,有34.22%的聚木糖被溶出。图5为经强度因子3.54自水解预处理后的杨木在共聚焦显微镜下得到的荧光谱图。从图5中可以看出,相邻两个纤维细胞的细胞壁靠近胞腔部分信号最强(C部分中1.0 μm 左右)。与未经自水解预处理的杨木相比,表征聚木糖浓度的荧光信号强度下降程度较低,而纤维细胞壁中心部位荧光信号的强度相对未处理的杨木有明显的下降。
在自水解预处理的过程中,杨木中的聚木糖随着自水解强度的增加而不断的溶出,且强度因子越大,聚木糖溶出率越大。由CLSM测定的结果可看出,在同一预处理条件下杨木中聚木糖不断溶出的过程中,纤维细胞壁中心部位的荧光信号降低程度较胞间层及细胞腔附近部位要大;同一预处理条件下细胞腔附近及胞间层部分聚木糖荧光信号减少很小;在自水解预处理强度因子较小的条件下,有些细胞的胞腔附近及胞间层聚木糖荧光信号甚至还会有所增加。这可能是由于在自水解预处理结束时,温度的下降导致尺寸较大的低聚木糖的溶解度减小,之后低聚木糖又重新沉积在细胞壁外表面所造成。Gray M. C.等人[23]在对玉米秸秆进行自水解预处理时,观察到当温度从80℃下降到25℃时聚合度较大的低聚木糖溶解度有明显的降低。导致上述结果的另一种可能原因是:经自水解后杨木表面会沉积很多木素或LCC的球形颗粒[24],该球形颗粒中可能包含有水解过程中溶出的聚木糖,从而使纤维细胞壁表面及胞腔附近的聚木糖荧光信号比其内部强。也可以说,在自水解预处理过程中纤维细胞壁内的聚木糖发生了再分布。
2.4CLSM分析法与HPLC检测法的比较
利用HPLC测定杨木中的聚木糖含量,可以得知聚木糖含量在自水解过程中的整体变化趋势(见图2)。通过CLSM拍摄得到各强度因子下自水解预处理后杨木中聚木糖的分布图,对每个自水解条件下CLSM图中多个区域进行荧光强度的统计并求其平均值。假设未经自水解预处理的空白样中平均荧光强度为1,计算其余各处理条件下样品中荧光强度与空白样荧光强度的比值,这样也可以表征整个纤维细胞壁内聚木糖含量的变化趋势。将上述两种方法测定的结果进行对比,得到的结果如图6所示。从图6中可以看出,采用CLSM的荧光强度检测结果与采用HPLC检测法测定的结果相比较,两者的变化趋势完全一致。
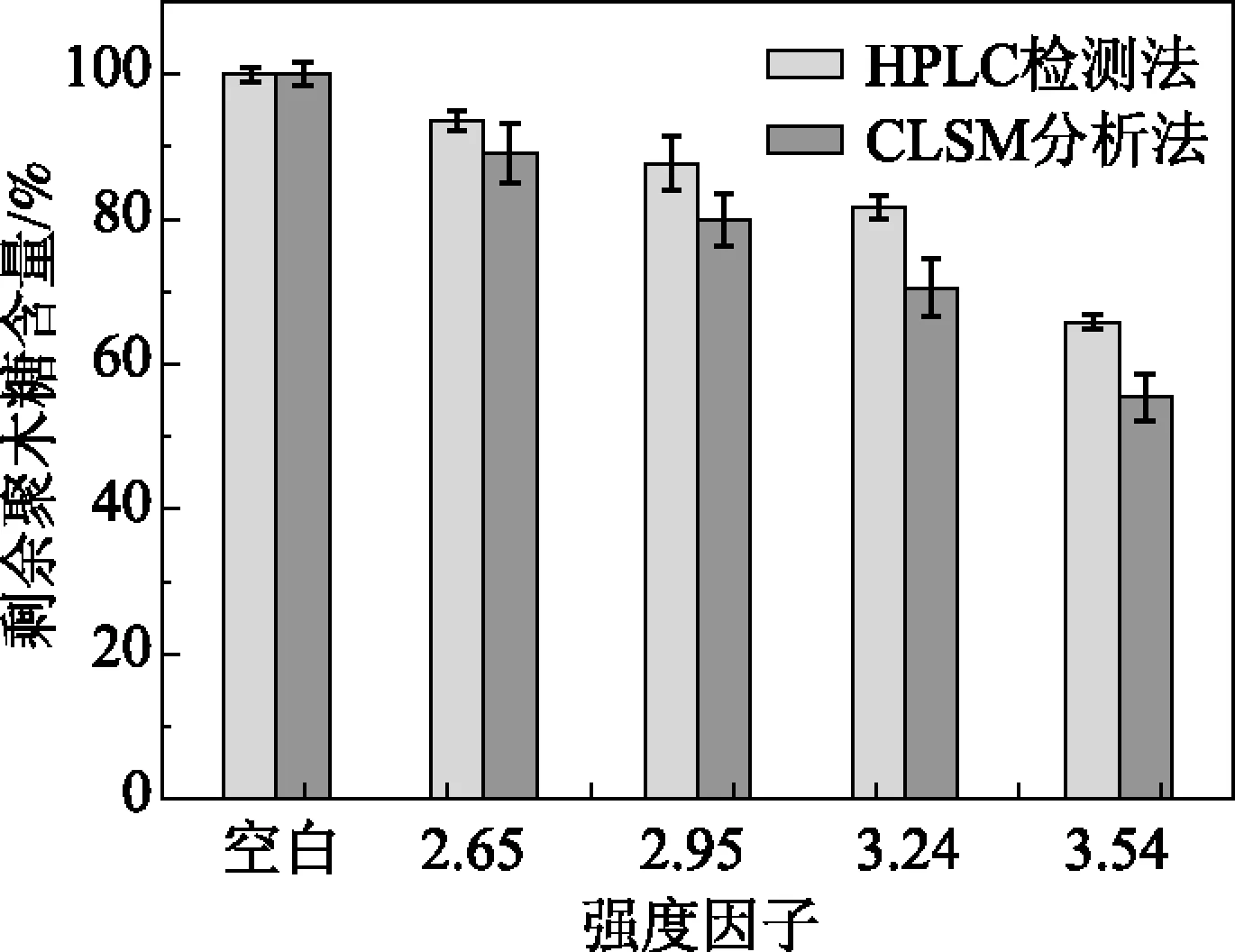
图6 CLSM分析法与HPLC检测法比较
3 结 论
3.1杨木自水解预处理过程中杨木得率随着自水解强度因子的增大而减小,聚木糖溶出率随自水解强度因子增大而增大。溶出的聚木糖一部分分布于自水解液中,一部分在水解过程中不断降解成糠醛等副产物,还有一部分在自水解预处理结束后的冷却过程中沉积在细胞壁表面,在木片洗涤过程中这部分聚木糖会有所流失。
3.2未经自水解预处理的杨木中的聚木糖较均匀地分布于纤维细胞壁中;而经自水解预处理后细胞壁中心部位的聚木糖含量减少较多,细胞腔附近及胞间层内的聚木糖减少量较小。
3.3采用共聚焦显微镜(CLSM)的荧光强度分析法与高效液相色谱(HPLC)检测法测定杨木中剩余聚木糖含量,结果两种检测法有相同的变化趋势。
[1]Lynd L, Laser M, Bransby D, et al. How biotech can transform biofuels[J]. Nature Biotechnology, 2008, 26(2): 169.
[2]Zhang Yong-chao, Fu Ying-juan, Wang Zhao-jiang, et al. Dissolution of poplar hemicelluloses during pre-hydrolysis in acetic acid-sodium acetate buffer[J]. Transactions of China Pulp and Paper, 2015, 30(2): 1.
张永超, 傅英娟, 王兆江, 等. 杨木半纤维素在乙酸-乙酸钠缓冲体系预水解过程中的溶出规律[J]. 中国造纸学报, 2015, 30(2): 1.
[3]Jing Lei. Studies on Pretreatment and Enzymatic Saccharification for Ethanol Conversion from Rice Straw[D]. Nanjing: Nanjing Forestry University, 2010.
荆磊. 稻草转化乙醇的预处理及酶解性能研究[D]. 南京: 南京林业大学, 2010.
[4]Yuan Mei-ting, Zhai Hua-min, Feng Nian-jie, et al. Characterization of hemicelluloses and lignin change of wheat straw in autohydrolysis process[J]. Journal of Cellulose Science and Technology, 2015, 23(2): 55.
袁梅婷, 翟华敏, 冯年捷, 等. 麦草自水解过程中半纤维素和木质素的变化特性[J]. 纤维素科学与技术, 2015, 23(2): 55.
[5]Yang Shu-yan. Studies on Preparation and Physiological Functions of Xylooligosacchrides from Corncob with Acid-xylanase Hydrplysis[D]. Wuxi: Jiangnan University, 2007.
杨书艳. 玉米芯酸酶法制备低聚木糖及其生理功能研究[D]. 无锡: 江南大学, 2007.
[6]Schonberg C, Oksanen T, Suurnakki A, et al. The importance of xylan for the strength properties of spruce kraft pulp fibres [J]. Holzforschung, 2001, 55(6): 639.
[7]Taylor J G, Haigler C H. Patterned secondary cell-wall assembly in tracheary elements occurs in a self-perpetuating cascade[J]. Acta Botanica Neerlandica, 1993, 42(2): 153.
[8]Chen Qing-qing. Isolation and application of hemicellulose from residues of hybrid poplar[D]. Nanjing: Nanjing Forestry University, 2013.
陈清清. 速生杨木剩余物中半纤维素的分离及应用[D]. 南京: 南京林业大学, 2013.
[9]Tina J, Claudia I, Michael H, et al. Cellulase digestibility of pretreated biomass limited by cellulose accessibility[J]. Biotechnology and Bioengineering, 2007, 98(1): 112.
[10]Irwin D, Cheng M, Xiang B, et al. Cloning, expression and characterization of a family-74 xyloglucanase from Thermobifidafusca[J]. FEBS Journal, 2003, 270(14): 3083.
[11]Yu Zi-ping, Peng Hong, Lin Da, et al. The Structure Characteristic of Hemicellulose: A Review[J]. Polymer Bulletin, 2011, 6: 48.
余紫萍, 彭红, 林妲, 等. 植物半纤维素结构研究进展[J]. 高分子通报, 2011, 6: 48.
[12]WANG Xu, ZHANG Yun-zhang, YANG Ru-nan. Study on the Mechanism of Mixed Hard Wood Alkaline Peroxide Mechanical Pulping[J]. China Pulp & Paper, 2001, 20(4): 5.
王旭, 张运展, 杨汝男. 混合阔叶木APMP制浆机理[J]. 中国造纸, 2001, 20(4): 5.
[13]Naran R, Black S, Decker S R, et al. Extraction and characterization of native heteroxylans from delignified corn stover and aspen[J]. Cellulose, 2009, 16(4): 661.
[14]Teleman A, Tenkanen M, Jacobs A, et al. Isolation and characterization of O-acetylated glucomannans from aspen and birch wood[J]. Carbohydr Research, 2002, 337(4): 373.
[15]Gabrielii I, Gatenholm P, Glasser W G, et al. Separation, characterization and hydrogel formation of hemicellulose from aspen wood[J]. Carbohydr Polymers, 2000, 43(4): 367.
[16]Sluiter A, Hames B, Ruiz R, et al. Determination of structural carbohydrates and lignin in biomass[S]. Laboratory Analytical Procedure, 2012, NREL-510- 42618.
[17]Sluiter A, Ruiz R, Scarlata C, et al. Determination of extractives in biomass[S]. Laboratory Analytical Procedure, 2008, NREL-510- 42619.
[18]McCartney L, Marcus S, Knox J P. Monoclonal antibodies to plant cell wall xylans and arabinoxylans[J]. Journal of Histochemistry and Cytochemistry, 2005, 53(4): 543.
[19]Overend R P, Chornet E. Fractionation of lignocellulosic by steam-aqueous pretreatments[J]. Philosophical Transactions of the Royal Society of London a Mathematical Physical and Engineering Science, 1987, 321(1561): 523.
[20]Wen J L, Yuan T Q, Sun R C. Quantitative structures of lignins obtain by multiple NMR techniques[C]//Proceeding of the 4thInternational Conference on Pulping, Papermaking and Biotechnology. Nanjing, 2012.
[21]CHI Congcong, ZHANG Zeng, LIU Xuan. The Reaction Course of High Temperature Prehydrolysis of Eucalyptus Chips[J]. China Pulp & Paper, 2008, 27(12): 6.
迟聪聪, 张曾, 刘轩. 桉木木片高温预水解反应历程的研究[J]. 中国造纸, 2008, 27(12): 6.
[22]Jong S K, Geoffrey D. Distribution of glucomannans and xylans in poplar xylem and their changes under tension stress[J]. Planta, 2012, 236(1): 35.
[23]Gray M C, Converse A O, Wyman C E. Solubilities of oligomer mixtures produced by the hydrolysis of xylans and corn stover in water at 180℃[J]. Industrial and Engineering Chemistry Research, 2007, 46(8): 2383.
[24]DUAN Chao, FENG Wen-ying, ZHANG Yan-ling, et al. Impacts ofP-factor on the Properties of Poplar Chips[J]. China Pulp & Paper, 2013, 32(5): 1.

(责任编辑:董凤霞)
Effect of Auto-hydrolysis Pretreatment on Xylan Distribution in the Cell Walls of Poplar Chips
GENG Xing-yueLIU WeiHOU Qing-xi*CHEN Wei
(TianjinKeyLabofPulp&Paper,TianjinUniversityofScience&Technology,Tianjin, 300457)
The change of xylan distribution in the cell wall of poplar chips caused by auto-hydrolysis pretreatment was studied by using immunofluorescence combined with confocal laser scanning microscopy (CLSM). A gradual loss of xylan antibody signals in the center of the poplar cell wall was observed but only a slight loss at the edge or even a slight increase at some places of the cell walls were found as the intensity factor of auto-hydrolysis pretreatment increased. HPLC analysis was also conducted to measure the overall change of xylan content. As the intensity factor increased to 3.72, xylan content decreased from 14.64% to 7.33%. The change of the xylan signal intensity from spectra of the CLSM had the same trend as that of the xylan content determined by using the HPLC analysis.
auto-hydrolysis pretreatment; xylan in poplar chips; immunofluorescence; confocal laser scanning microscopy
耿星月女士,在读硕士研究生;主要研究方向:清洁制浆技术与机理,生物质资源利用。
2015-11-29(修改稿)
本课题得到国家自然科学基金项目(31270630)的资助。
侯庆喜先生,E-mail:qingxihou@tust.edu.cn。
TS721+.1
ADOI:10.11980/j.issn.0254- 508X.2016.07.001

