山药黏液质及其酶解物的微观结构及免疫活性
任国艳,吴婷婷,张 凡,郭金英,崔国庭,吴 影,王 萍,曹 利(河南科技大学食品与生物工程学院,河南 洛阳 471003)
山药黏液质及其酶解物的微观结构及免疫活性
任国艳,吴婷婷,张 凡,郭金英,崔国庭,吴 影,王 萍,曹 利
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
从铁棍山药中提取黏液质,选取不同酶(胰蛋白酶、纤维素酶、复合蛋白酶)对其进行酶解,得到不同酶解产物,采用红外光谱和扫描电子显微镜技术,对黏液质及其酶解物的微观结构进行分析,同时采用体外细胞培养和实时荧光定量聚合酶链式反应方法,研究黏液质及其酶解物对脾淋巴细胞增殖转化及细胞因子mRNA相对表达量的影响。结果显示:黏液质及其酶解物,在微观结构上呈现很大差别;黏液质及其酶解物均能促进脾淋巴细胞增殖转化,但酶解物的促进作 用强于黏液质;黏液质及其酶解物对Th1族细胞因子的mRNA表达促进作用显著高于对Th2族细胞因子的mRNA表达促进作用,使细胞中Th1/Th2平衡向Th1方向偏移。
山药黏液质;酶解物;淋巴细胞转化;细胞因子;mRNA表达
山药(Dioscorea opposita)是一种医食同源的植物,具有较高的营养价值、药用价值和经济价值,而铁棍山药更是被认为山药中的极品[1]。山药中含有多种营养成分,其中黏液质被认为是山药的主要有效成分,是糖和蛋白质复合的大分子物质,对山药加工性能和药理作用产生很大的影响[2]。现代研究发现山药黏液质具有多种生物活性,能够清除机体内的自由基,具有抗氧化能力[3];能够抑制血管紧张肽转化酶(angiotensin converting enzyme,ACE)的活性,具有降血压的作用[4];能够抑制肿瘤细胞的增长[5]和增强机体免疫力[6]等活性。因此,黏液质的功能活性已引起越来越多的关注。
山药黏液质的理化性质及生物活性与其化学组成、分子链构象等因素密切相关,有人用不同的酶酶解山药黏液质,发现其理化性质(如黏度)和生物活性均会发生相应的变化[7],但对酶解后黏液质微观结构发生的变化研究较少;故本实验从铁棍山药中提取黏液质,用3 种酶对山药黏液质进行酶解,得到不同酶解产物,并对酶解产物的微观结构进行分析比较,然后通过体外细胞培养实验,研究山药黏液质及其酶解产物对T淋巴细胞增殖转化及细胞因子mRNA表达水平的影响,为山药黏液质的开发应用提供理论基础。
1 材料与方法
1.1 材料与试剂
铁棍山药(新鲜,未做任何处理),2015年6月10日购于洛阳盛德美超市。
胰蛋白酶(250 U/mg)、纤维素酶(400 U/mg)、复合蛋白酶(100 U/mg) 上海瑞永生物科技有限公司。
1.2 仪器与设备
LG-0.2真空冷冻干燥机 沈阳新阳速冻设备制造公司;SW-CJ-1F型单人双面净化工作台 苏州净化设备有限公司;Gel DocXR+凝胶成像仪 美国伯乐公司;UV-2550紫外-可见分光光度计 日本Shimadzu公司;Vertex 70/80傅里叶交换红外光谱仪 布鲁克(北京)科技有限公司;JSM-5610LV扫描电子显微镜 日本电子株式会社。
1.3 方法
1.3.1 山药黏液质的制备
新鲜铁棍山药→清洗、去皮→组织捣碎机进行破碎→加入10 倍体积0.5 mol/L氯化钠溶液浸提→过滤、离心→浓缩→乙醇分级沉淀→透析→低温冷冻干燥→山药黏液质
乙醇分级沉淀,将无水乙醇缓慢加入浓缩液中,使其乙醇体积分数分别达到30%、50%、75%,收集乙醇体积分数为75%时溶液中的沉淀,进行后续处理。
1.3.2 山药黏液质基本组成测定
总糖含量测定采用苯酚-硫酸法;蛋白质含量测定采用凯氏定氮法;氨基酸组成测定采用氨基酸分析仪[8];单糖组成分析测定采用气相色谱法[9]。
1.3.3 山药黏液质酶解物的制备
1.3.3.1 复合蛋白酶酶解物的制备
[10],稍加改动。复合蛋白酶酶解山药黏液质的酶解条件为酶解温度45 ℃、酶解时间2 h、加酶量25 mg/g、pH 7.0,水解度为52.36%,酶解后将酶解液煮沸5 min,2 000 r/min离心10 min,旋转蒸发浓缩上清液后冷冻干燥,即得山药黏液复合酶酶解物。
1.3.3.2 纤维素酶酶解物的制备
参考文献[11],稍加改动。纤维素酶酶解山药黏液质的酶解条件为酶解温度50 ℃、加酶量15 mg/g、酶解时间3 h、pH 5.0,还原糖含量最高为30.49%,酶解后将酶解液煮沸5 min,2 000 r/min离心10 min,旋转蒸发浓缩上清液后冷冻干燥,即得山药黏液质纤维素酶酶解物。
1.3.3.3 胰蛋白酶酶解物的制备
参考文献[12],稍加改动。胰蛋白酶酶解山药黏液质的酶解条件 为pH 7.5、酶解时间4 h、温度45 ℃、加酶量20 mg/g,水解度为48.79%,酶解后将酶解液煮沸5 min,2 000 r/min离心10 min,旋转蒸发浓缩上清液后冷冻干燥,即得山药黏液质胰蛋白酶酶解物。
1.3.4 山药黏液质及其酶解物电泳图谱
参考文献[13]方法电泳,稍有改动。配制电泳试剂→制备5%浓缩胶、12%分离胶、电泳缓冲液→样品变性处理→点样→恒压电泳→考马斯亮蓝染色→脱色→图像分析。
1.3.5 山药黏液质及其酶解物红外图谱
将干燥的样品与KBr压制成片(待测样品粉末与KBr粉末质量比为1∶100),用Nicolet-Nexus470傅里叶变换红外光谱仪在400~4 000 cm-1波数范围内进行扫描。
1.3.6 山药黏液质及其酶解物紫外扫描图谱
参考文献[14]的方法,取5 mg待测样品溶于3 mL蒸馏水中,分成2 等份,其中一份加入1.5 mL蒸馏水,另一份加入1.5 mL 0.4 mol/L NaOH溶液,测反应开始和结束(2.0 h)时的紫外光谱。
1.3.7 山药黏液质及其酶解物扫描电子显微镜图谱
用导电胶带将山药黏液质及其冻干粉末固定在样品台上,用JFC-1600型离子溅射仪在高真空镀膜机内给样品表面溅射喷金,用JSM-5610LV扫描电子显微镜观察样品的微观结构并照相。
1.3.8 山药黏液质及其酶解物对T淋巴细胞转化的影响
参考文献[15]方法稍有改动,将无菌获得的活的脾脏淋巴细胞浓度,用含10%胎牛血清的RPMI1640培养液调整细胞浓度为5×106个/mL,加入96 孔细胞培养板,每孔加入细胞悬液100 μL,加入10 μg/mL的ConA溶液20 μL,设置空白对照组(在细胞培养液里只加ConA)和实验组(分别加入不同体积的山药黏液质及其酶解物,使其浓度达到实验要求),在37 ℃、5% CO2条件下在CO2培养箱中培养48 h后,采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)法,用酶标仪测其在570 nm波长处的吸光度,每组设置6 个重复孔。
1.3.9 山药黏液质及其酶解物对T淋巴细胞因子mRNA表达水平的影响
选取1.3.7节中效果最好的组分,向淋巴细胞中加入l mLRNAiso Plus,按试剂盒说明书提取脾脏淋巴细胞中的总RNA,然后将RNA逆转录为cDNA(按照PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书操作);再通过荧光定量聚合酶链式反应(polymerase chain reaction,PCR)法,定量检测细胞因子mRNA相对表达量(按照SYBR Premix Ex Taq(Tli RNaseH Plus)试剂盒说明书进行操作)。实验所需引物,由宝生物工程(大连)有限公司设计合成,其引物序列见表1。

表1 细胞因子引物序列Table 1 Primer sequences for cytokines
1.4 统计学处理
应用SPSS 19.0软件对所有数据进行统计学处理,结果以±s表示,两组间均数比较用t检验,多组间均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果与分析
2.1 山药黏液质的基本组成
山药黏液质中总糖含量占40.87%,蛋白质含量约占56.93%。氨基酸组成如表2所示,其中谷氨酸、亮氨酸和天冬氨酸含量较高;检测到7 种人体必需氨基酸,含量占总氨基酸含量的39.543%。铁棍山药黏液中检测到9 种单糖(表3),其中氨基葡萄糖和甘露糖含量较高,占总糖含量的66.422%。这一检测结果与之前报道的结果不同,Koocheki等[16]研究山药(Nagaimo)的黏液质发现,其单糖主要由甘露糖、果糖、半乳糖、木糖、葡萄糖组成;Huang等[17]报道山药黏液中主要含有半乳糖、阿拉伯糖、葡萄糖和鼠李糖等中性糖;而丁青芝等[18]报道,山药黏液质中含有L-半乳糖、D-葡萄糖、D-甘露糖,其中D-葡萄糖含量最高。这可能是不同来源的山药黏液质中单糖含量和种类有很大区别。
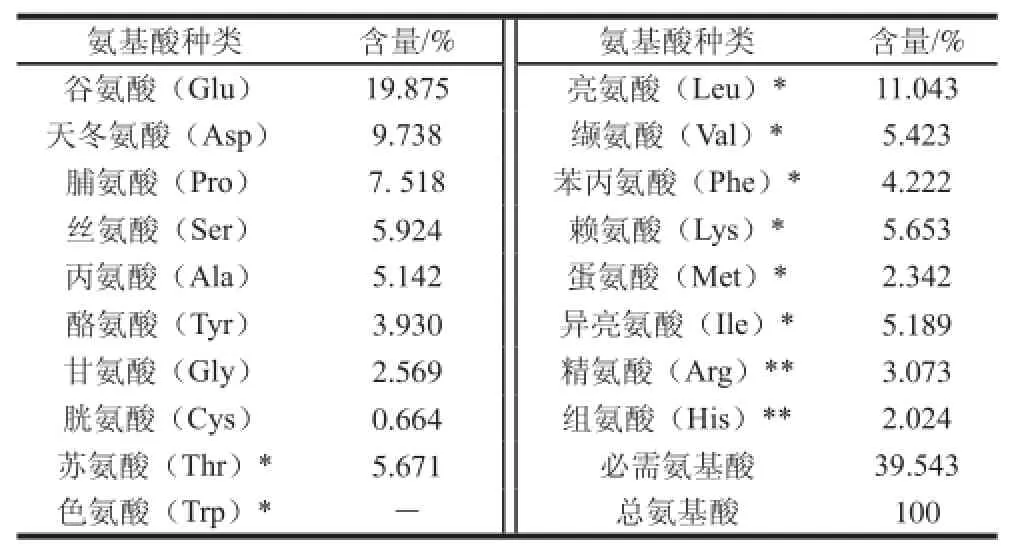
表2 铁棍山药黏液质的氨基酸含量Table 2 Contents of amino acids in mucilage from “Tieegguunn” yam tubers
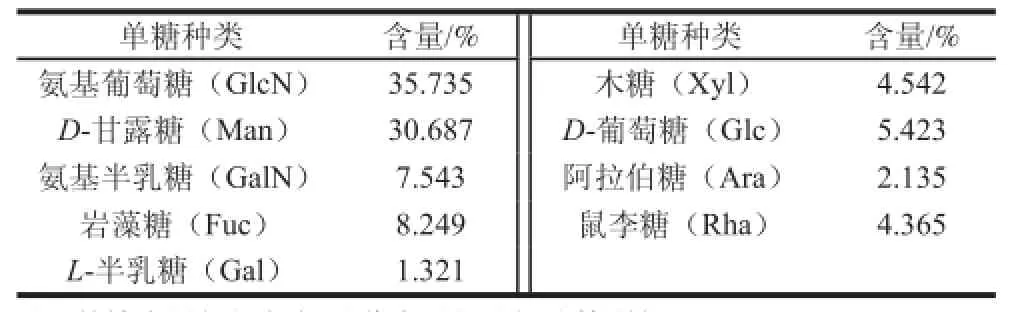
表3 铁棍山药黏液质单糖组成Table 3 Contents of monosaccharides in mucilage from “Tieegguunn” yam tubers
2.2 山药黏液质及其酶解液的电泳图谱
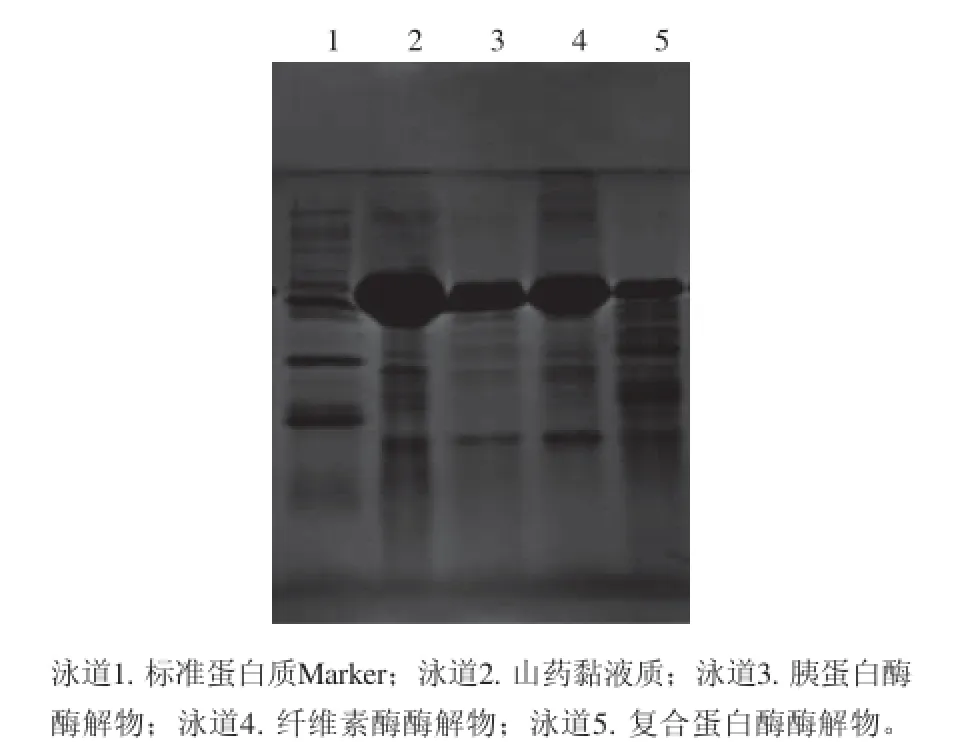
图1 铁棍山药黏液质及其酶解物的电泳图谱Fig. 1 SDS-PAGE profi le of mucilage from “Tieegguunn” yam tubeerrss and its hydrolysates
由图1可知,山药黏液质经不同的酶酶解以后,电泳图谱发生明显的变化。在上样量相同的条件下,酶解以后的黏液质显现的 条带明显变细,其中复合蛋白酶酶解物所显现的条带最细,其次是胰蛋白酶酶解物,再次是纤维素酶酶解物,这表明3 种酶均对黏液质发生了部分酶解;而3 种酶解物电泳谱带与黏液质比较,也发生了变化,这可能与所选取的酶的不同酶解程度有关,复合蛋白酶是由几种蛋白酶组成,酶切位点较多,水解度最高,因此黏液质被复合蛋白酶酶解后,酶解物的电泳图谱上呈现较多谱带;而胰蛋白酶酶切位点是在赖氨酸和精氨酸的前面,相对酶切位点较少,水解度较复合蛋白酶的低,黏液质经胰蛋白酶酶切以后,在电泳图谱上呈现 的条带虽然多于黏液质,但却少于复合蛋白酶酶解物;纤维素酶酶解物的电泳谱带,最接近于黏液质的谱带,这可能与纤维素酶只水解β-(1,4)糖苷键连接的葡萄糖残基[19],因此在蛋白染色的电泳图谱上,看不到谱带的明显变化。
2.3 山药黏液质及其酶解物的紫外扫描图谱
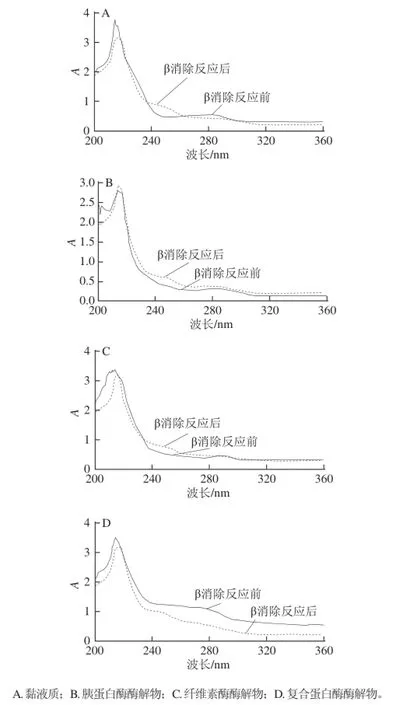
图2 铁棍山药黏液质及其酶解物的紫外光谱Fig. 2 Ultraviolet absorption spectra of mucilage from “Tiegun”egun yam yam tubersubers and its hydrolysates
由图2的紫外光谱分析发现,在β消除反应之前,山药黏液质、胰蛋白酶酶解物、纤维素酶酶解物和复合蛋白酶酶解物在波长280 nm左 右均有一明显的吸收峰,这是蛋白质的紫外吸收峰;当β消除反应之后,4 种物质在240 nm波长处均出现了明显的吸收峰,说明4 种物质中均含有O-连接的糖苷键,这一结果表明实验所用的3 种酶对O-糖苷键并未起到破坏作用。
2.4 山药黏液质及其酶解物的红外光谱分析
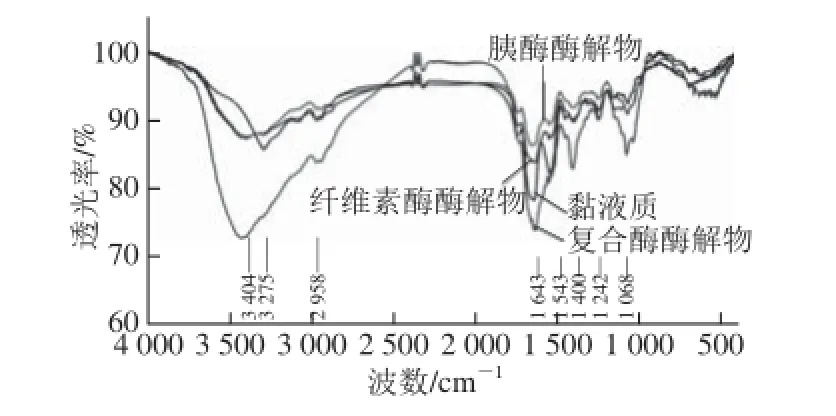
图3 山药黏液质及其酶解物的红外谱Fig. 3 IR spetra of mucilage from “Tieegguunn” yam tubeerrss and its hydrolysates
3 500~3 100 cm-1范围内是伯酰胺以及缔合—OH的吸收峰,此峰较宽,也被认为是糖类的特征峰[20],由图3可知,复合酶、纤维素酶、胰酶酶解产物在此处的吸收峰位于3 404 cm-1处,而黏液质的位于3 275 cm-1处,这可能是由于酶解后氢键打开,缔合—OH能力减弱造成的;2 958 cm-1处为—CH吸收峰,为伸缩振动;1 643 cm-1处为乙酰氨基中C=O的吸收峰,振动方式为伸缩振动,且蛋白质的二级结构为α-螺旋结构;1 543 cm-1为—NH2吸收峰,振动方式为变角振动,这两个峰被认为是蛋白的特征吸收峰,1 400 cm-1为—CH面内弯曲振动吸收峰,主要是蛋白分子肽键的特征吸收峰[21],复合蛋白酶酶解物中,1 543 cm-1为—NH2吸收峰明显发生变化,表明复合酶作用后黏液质分子的空间结构发生了变化;1 240 cm-1是S=O伸缩振动特征峰;1 068 cm-1为C—O—C伸缩振动吸收峰,是多糖的特征吸收峰,且为吡喃糖环中的醚键和羟基的吸收峰,有报道认为1 068 cm-1处是β-(1,4)糖苷键产生的吸收峰[22],纤维素酶酶解物中,1 068 cm-1为C—O—C伸缩振动吸收峰的峰型与其他3 种物质明显不同,而纤维素酶的作用位点正是β-(1,4)糖苷键,因此验证了这一说法。
2.5 山药黏液质及其酶解物的扫描电子显微镜图谱


图4 山药黏液质及其酶解物的扫描电子显微镜图谱(×1 000)Fig. 4 Scanning electron microscopic (SEM) images of mucilage from“Tieegguunn” yam tubers
由图4可知,在扫描电子显微镜下,山药黏液质的微观结构呈现相互联通的网状多孔结构,孔的形状不规则但清晰可见,多数孔径大于10 μm;经胰蛋白酶、纤维素酶、复合蛋白酶处理后,得到的酶解物与黏液质的微观结构相比均发生明显改变。黏液质经胰蛋白酶和复合蛋白酶酶解后,形成了较 小的颗粒状物质,直径均小于10 μm,聚集在孔径周围,使孔径变得模糊不清。而黏液质经纤维素酶酶解后,形成了碎片状物质,碎片有大有小,但已经看不到孔状结构。有人用不同的酶酶解胶原蛋白,观察其微观结构也发生了很大变化,这种变化与酶的种类和水解程度有关[23];Jin Wengang等[24]认为用蛋白酶酶解蛋白质,一方面可以降低蛋白质的分子质量,增加蛋白质的亲水性(通过带电基团的介入);另一方面可以使蛋白质的非极性基团暴露,蛋白的疏水性增强,形成凝聚状态。本实验山药黏液质用胰蛋白酶和复合蛋白酶酶解后,观察到的微观结构符合这一说法,但用纤维素酶酶解后的酶解产物微观结构与蛋白酶酶解物的微观结构相差很大,其原因还有待进一步研究。
2.6 山药黏液质及其酶解物对淋巴细胞转化的影响
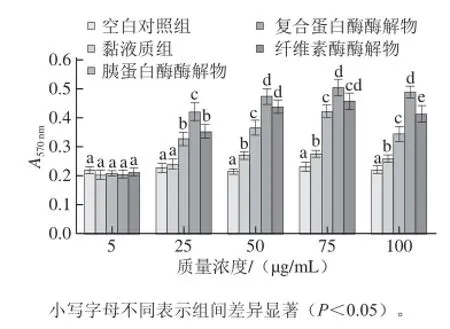
图5 山药黏液质及其酶解物对淋巴细胞转化的影响( =6)Fig. 5 Effects of mucilage from “Tiegun” yam tubers and its hydrolysates on lymphocyte transformat ion (n = 6)
由图5可知,山药黏液质及其酶解物在一定剂量范围内能显著提高脾淋巴细胞增殖转化能力,但不同组分之间的影响存在一定差异。当加入各组分的质量浓度为5 μg/mL时,与空白对照组相比,均未出现显著性差异;当质量浓度达到25 μg/mL时,除黏液质组与空白对照组相比无显著性差异外,其他3 组均呈现显著促进作用;当质量浓度在50 μg/ mL时,4 个组分对淋巴细胞的增殖转化均呈现显著的促进作用;在质量浓度为75 μg/mL时,各组分促脾淋巴细胞转化能力达到最大值;随着质量浓度的进一步增加,各组分对脾淋巴细胞转化能力也呈下降趋势;表明各组分对脾淋巴细胞转化能力的促进作用表现出一定的剂量效应关系。总体上看,4 个组分中,山药黏液质促进淋巴细胞增殖转化能力最弱,其他3 种酶解物促进淋 巴细胞增殖转化能力显著强于山药黏液质,其中复合蛋白酶酶解物的最强。Chalamaiah等[25]研究鲤鱼卵蛋白的不同酶解物对淋巴细胞增殖作用,发现不同的酶解物均促进淋巴细胞增殖作用,但增殖效果不同,而Agyei等[26]认为不同酶解物对淋巴细胞增殖效果不同,是由于酶解后产物的结构不同造成的。
2.7 山药黏液质及其酶解物对细胞因子mRNA表达的影响

图6 山药黏液质及其酶解物对细胞因子mRNA表达水平的影响Fig. 6 Effects of mucilage from “Tieegguunn” yam tubers and its hydrolysates on mRNA expression of cytokines
由图6A可知,4 个组分对淋巴细胞Th1型细胞因子(白细胞介素-2(interl eukin-2,IL-2)、IL-12和干扰素-γ(interferon-γ,IFN-γ))的mRNA表达均有促进作用,但对每种细胞因子mRNA表达量影响不同;由图6B可知,4 个组分对淋巴细胞Th2型细胞因子(IL-4、IL-6和IL-10)的mRNA表达也均有促进作用,但对每种细胞因子mRNA表达量影响也不同;比较图6A与图6B发现,4 个组分对Th1型细胞因子(IL-2、IL-12和IFN-γ)的mRNA表达的促进作用要高于对Th2型细胞因子(IL-4、IL-6和IL-10)的mRNA表达的促进作用,这将会使脾淋巴细胞由Th0向Th1分化[27]。Priyankar等[28]研究山药乙醇提取物对脾淋巴细胞因子的影响,发现山药乙醇提取物能促进Th1细胞因子mRNA表达,而抑制Th2细胞因子mRNA表达。在本实验中,4 种物质对Th2族细胞因子的mRNA表达也有促进作用,这可能是由于细胞的大量增殖分化引起的量上的增加。但由于4 种物质对Th1族细胞因子的mRNA的表达促进作用远远高于对Th2族细胞因子mRNA表达的促进作用,表明4 种物质均会使Th1/Th2平衡向Th1偏移。
3 结 论
山药黏液质中总糖含量占40.87%,蛋白质含量约占56.93%。检测到17 种氨基酸,其中谷氨酸、亮氨酸和天冬氨酸含量较高,必需氨基酸含量占总氨基酸含量的39.543%;铁棍山药黏液中含有7 种单糖,其中氨基葡萄糖和甘露糖含量较高,占总糖含量的66.422%。
选取不同的酶对山药黏液质进行酶解,获得3 种山药黏液质的酶解产物。通过电泳、红外光谱、紫外光谱及电子显微镜扫描技术,对山药黏液质及其酶解物的微观结构进行比较,结果表明山药黏液质及其不同酶解产物在微观结构上存在差别。
研究了山药黏液质及其酶解物的免疫活性,发现山药黏液质及其酶解物对脾淋巴细胞增殖转化均有促进作用,其中山药黏液质促进作用最弱,复合酶酶解物促进作用最强;山药黏液质及其酶解产物均能促进Th1型细胞因子(IL-2、IL-12和IFN-γ)的mRNA表达和Th2型细胞因子(IL-4、IL-6和IL-10)的mRNA表达,但对Th1型细胞因子(IL-2、IL-12和IFN-γ)mRNA表达的促进作用要高于对Th2型细胞因子(IL-4、IL-6和IL-10)mRNA表达的促进作用。
参考文献:
[1] 李敏. 山药活性成分提取技术及药理功能的研究进展[J]. 南方农业学报, 2013, 44(7): 1184-1189. DOI:10.3969/j:issn.2095-1191.2013.7.1184.
[2] YEH A I, CHAN T Y, GEORGE C C. Effect of water content and mucilage on physico-chemical characteristics of Yam (Discorea alata Purpurea) starch[J]. Journal of Food Engineering, 2009, 95(1): 106-114. DOI:10.1016/j.jfoodeng.2009.04.014.
[3] 王阳, 霍秀文, 周翼虎, 等. 不同品种山药块茎多糖和黏液质多糖对自由基清除能力的研究[J]. 辽宁大学学报, 2012, 39(4): 354-360. DOI:10.3969/j.issn.1000-5846.2012.04.016.
[4] NAGAI T, NAGASHIMA T. Functional properties of dioscorin, a soluble viscous protein from Japanese Yam (Dioscorea opposita Thunb.) tuber mucilage Tororo[J]. Zeitschrift für Naturforschung C, 2006, 61(11/12): 792-798. DOI:10.1108/02634509810224428.
[5] 戴榕, 孔得信, 李宗羽, 等. 山药黏蛋白的两种提取工艺及其对食道癌细胞的抑制[J]. 食品工业科技, 2015, 36(13): 371-375. DOI:10.13386/j.issn1002-0306.2015.13.070.
[6] CHOI E M, KOO S J, HWANG J K. Immune cell stimulating activity of mucopolysaccharide isolated from Yam (Dioscorea batatas)[J]. Journal of Ethnopharmacology, 2004, 91(1): 1-6. DOI:10.1016/ j.jep.2003.11.006.
[7] 朱运平, 李大为, 李秀婷, 等. 双酶法处理对淮山药抗氧化及α-葡萄糖苷酶抑制活性的影响[J]. 中国食品学报, 2015, 15(4): 110-115. DOI:10.16429/j.1009-7848.2015.04.015.
[8] ZHANG Y, LIU W T, LI G Y, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp(Ctenopharyngodon idella)[J]. Food Chemistry, 2007, 103(3): 906-912. DOI:10.1016/j.foodchem.2006.09.053.
[9] ZHU K X, ZHOU H M. Purification and characterization of a novel glycoprotein from wheat germ water-soluble extracts[J]. Process Biochemistry, 2005, 40(3/4): 1469-1474. DOI:10.1016/ j.procbio.2004.06.030.
[10] 李伟, 于新莹, 佟长青, 等. 大鲵黏液酶解产物的制备及其抗疲劳作用研究[J]. 食品工业科技, 2011, 32(6): 146-151. DOI:10.13386/ j.issn1002-0306.2011.06.023.
[11] 张娇娇, 许学勤. 复合酶解降低山药黏液质黏度的工艺[J]. 食品与发酵工业, 2014, 40(1): 96-100. DOI:10.13995/j.cnki.11-1802/ ts.2014.01.016.
[12] 赵谋明, 肖如武, 崔春, 等. 超滤对马氏珍珠贝肉蛋白酶解液特性的影响牢[J]. 华南理工大学学报(自然科学版), 2009, 37(10): 124-128. DOI:10.3321/j.issn:1000-565X.2009.10.024.
[13] 任国艳, 梁旺春, 詹永献, 等. 海蜇头糖蛋白分离纯化及免疫活性研究[J]. 食品科学, 2011, 32(17): 147-151.
[14] MAGALHAES A, MAGALHAES H P B, RICHARDSON M, et al. Purifi cation and properties of a coagulant thrombin-like enzyme from the venom of Bothrops leucurus[J]. Comparative Biochemistry and Physiology, 2007, 146(4): 565-575. DOI:10.1016/j.cbpa.2005.12.033.
[15] 任国艳, 刘志龙, 郭金英, 等. 海蜇糖蛋白及其糖肽的体外免疫活性[J].食品科学, 2013, 34(17): 250-255. DOI:10.7506/spkx1002-6630-201317053.
[16] KOOCHEKI A, MORTAZAVI S A, SHAHIDI F, et al. Rheological properties of mucilage extracted from Alyssum homolocarpum seed as a new source of thickening agent[J]. Journal of Food Engineering, 2009, 91(3): 490-496. DOI:10.1016/j.jfoodeng.2008.09.028.
[17] HUANG C C, LAI P, CHEN I H, et al. Effects of mucilage on the thermal and pasting properties of yam, taro, and sweet potato starches[J]. LWT-Food Science and Technology, 2010, 43(6): 849-855. DOI:10.1016/j.lwt.2009.11.009.
[18] 丁青芝, 马海乐, 骆琳, 等. 山药糖蛋白的分离纯化与鉴定[J]. 食品科学, 2008, 29(7): 217-221. DOI:10.3321/ j.issn:1002-6630.2008.07.045.
[19] AL-GHAZZEWI F H, TESTER R F. Efficacy of cellulase and mannanase hydrolysates of konjac glucomannan to promote the growth of lactic acid bacteria[J]. Journal of the Science of Food and Agriculture, 2012, 92(11): 2394-2396. DOI:10.1002/jsfa.5678.
[20] CHEN C, YOU L J, ABBASI A M, et al. Optimization for ultrasound extraction of polysaccharides from mulberry fruits with antioxidant and hyperglycemic activity in vitro[J]. Carbohydrate Polymers, 2015, 130: 122-132. DOI:10.1016/j.carbpol.2015.05.003.
[21] LUIS ARIAS-MOSCOSO J, MALDONADO-ARCE A, ROUZAUDSANDEZ O, et al. Physicochemical characterization of protein hydrolysates produced by autolysis of Jumbo Squid (Dosidicus gigas) byproducts[J]. Food Biophysics, 2015, 10(2): 145-154. DOI:10.1007/ s11483-014-9374-z.
[22] PINTO M, COELHO E, NUNES A, et al. Valuation of brewers spent yeast polysaccharides: a structural characterization approach[J]. Carbohydrate Polymers, 2015, 116: 15-22. DOI:10.1016/ j.carbpol.2014.03.010.
[23] CHI C F, CAO Z H, WANG B, et al. Antioxidant and functional properties of collagen hydrolysates from Spanish Mackerel skin as Infl uenced by average molecular weight[J]. Molecules, 2014, 19(8): 11211-11230. DOI:10.3390/molecules190811211.
[24] JIN W G, WU H T, ZHU B W, et al. Functional properties of gelationlike protein hydrolysates from scallop (Patinopecten yessoensis) male gonad[J]. European Food Research and Technology, 2012, 234(5): 863-872. DOI:10.1007/s00217-012-1700-4.
[25] CHALAMAIAH M, HEMALATHA R, JYOTHIRMAYI T, et al. Chemical composition and immunomodulatory effects of enzymatic protein hydrolysates from common carp (Cyprinus carpio) egg[J]. Nutrition, 2015, 31(2): 388-398. DOI:10.1016/j.nut.2014.08.006.
[26] AGYEI D, DANQUAH M K. Rethinking food-derived bioactive peptides for antimicrobial and immunomodulatory activities[J]. Trends in Food Science & Technology, 2012, 23(2): 62-69. DOI:10.1016/ j.tifs.2011.08.010.
[27] GAUTAM M, SAHA S, BANI S, et al. Immunomodulatory activity of Asparagus racemosus on systemic Th1/Th2 immunity: implications for immunoadjuvant potential[J]. Journal of Ethnopharmacology, 2009, 121(2): 241-247. DOI:10.1016/j.jep.2008.10.028.
[28] PRIYANKAR D, TAPAS K C. In vitro modulation of Th1 and Th2 cytokine expression by edible tuber of Dioscorea alata and study of correlation patterns of the cytokine expression[J]. Food Science and Human Wellness, 2014, 3(1): 1-8. DOI:10.1016/j.fshw.2014.01.001.
Microstructure and Immunomodulating Activity of Mucilage from “Tiegun” Yam Tubers (Dioscorea opposita Thunb. cv. Tsukune) and Its Hydrolysates
REN Guoyan, WU Tingting, ZHANG Fan, GUO Jinying, CUI Guoting, WU Ying, WA NG Ping, CAO Li
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China)
Mucilage was extracted from “Tiegun” yam tubers (Dioscorea opposita T hunb. cv. Tsukune), and its hydrolysates were obtained by hydrolysis with different enzymes (trypsin, cellulase and complex protease). The microstructure of mucilage and its hydrolysates were detected by infrared spectroscopy and scanning electron microscopy. Meanwhile, their effects on the pr oliferati on of spleen lymphocytes and the relative expression levels of cytokine mRNA were explored by cel l culture in vitro and quantitative real-time polymerase chain reaction (RT-PCR) methods, respectively. The results showed that mucil age and its hydrolysates were different in microstructure. Mucilage and its hydrolysates could promote the proliferation and transformation of spleen lymphocytes, but the promoting effect of mucilage was weaker than that of its hydrolysates. Promoting effects of mucilage and its hydrolysates on the mRNA expression of Th1 cytokines were signifi cantly higher than that of Th2 cytokines. These results showed that yam mucilage and its hydrolysates had potential function to shift the Th1/Th2 balance to relative Th1 dominance.
yam mucilage; hydrolysates; lymphocyte transformation; cytokine; mRNA expression
10.7506/spkx1002- 6630-201611011
TS201.4
A
1002-6630(2016)11-0058-07
任国艳, 吴婷婷, 张凡, 等. 山药黏液质及其酶解物的微观结构及免疫活性[J]. 食品科学, 2016, 37(11): 58-64.
DOI:10.7506/spkx1002-6630-201611011. http://www.spkx.net.cn REN Guoyan, WU Tingting, ZHANG Fan, et al. Microstructure and immun omodula ting activity of mucilage from “Tiegun”yam tubers (Dioscorea opposita Thunb. cv. Tsukune) and its hydrolysates[J]. Food Science, 2016, 37(11): 58-64. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611011. http://www.spkx.net.cn
2015-08-31
河南科技大学研究培育基金项目(400913480019)
任国艳(1976—),女,副教授,博士,研究方向为生物活性物质及功能制品。E-mail:renguoyan@163.com

