苹果生长素输入载体MdAUX1的基因克隆及在拟南芥和烟草中的遗传转化
安建平 王小非 刘 鑫 李浩浩 由春香 郝玉金
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,泰安 271018)
苹果生长素输入载体MdAUX1的基因克隆及在拟南芥和烟草中的遗传转化
安建平 王小非 刘 鑫 李浩浩 由春香 郝玉金*
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,泰安 271018)
生长素的极性运输对调节植物生长发育起重要作用。生长素转运蛋白调控生长素的极性运输。本研究从‘嘎啦’(Malus×domestic‘Royal Gala’)苹果中克隆了生长素输入载体基因MdAUX1(基因序列号:MDP0000384437)。序列分析表明,该基因包含长为1 443 bp完整的开放阅读框,编码含有480个氨基酸的蛋白。氨基酸序列比对和系统进化树分析表明,AUX1在不同物种间具有高度的序列保守性,其中,苹果MdAUX1与欧洲甜樱桃PaAUX1亲缘关系最近。半定量PCR分析显示,MdAUX1在苹果的茎中表达量较高。通过农杆菌介导的遗传转化获得转MdAUX1基因的拟南芥和烟草。转基因拟南芥根系表型观察结果显示,MdAUX1基因在拟南芥中异位表达后,会抑制主根伸长,促进侧根形成;在外源NAA处理下,转基因拟南芥对主根伸长的抑制作用得到部分恢复。在烟草中过量表达MdAUX1基因能够显著促进植株地上部分生长。以上结果说明苹果MdAUX1基因在调节植物生长发育中发挥重要作用。
苹果;生长素输入载体;MdAUX1;遗传转化
生长素是最早发现的植物激素,在植物生长发育过程中发挥重要作用。生长素的极性运输是生长素区别于其他激素的重要特性,即生长素只能从植物体形态学的上端向下端运输[1]。生长素的极性运输存在于高等植物的茎,根和叶中,其运输方向由转运蛋白控制[2]。其中,生长素输入载体在生长素浓度梯度的调控及维持中具有重要作用[3]。
AUX/LAX蛋白家族是目前已知的最主要的生长素输入载体[4],其中,AtAUX1是从拟南芥中分离到的第一个生长素输入载体基因[5]。AtAUX1含有11个跨膜螺旋,是由485个氨基酸残基组成的跨膜蛋白[6]。Muller等[7]通过根向地性的恢复实验,有力地证明了AtAUX1作为生长素输入载体在生长素运输过程中具有重要作用。此外,对花生、毛白杨以及水稻中生长素输入载体功能也进行了研究。任怡怡[8]克隆了花生生长素载体基因PNAUX1,证实PNAUX1在植物体内生长素的重新分配中发挥关键作用;闫辉[9]发现毛白杨生长素生长素输入载体基因PeAUX1参与毛白杨根、茎、叶和花的发育;Zhao等[10]和Yu等[11]证明水稻生长素输入载体基因OsAUX1在根系发育中发挥重要作用,超量表达OsAUX1抑制主根伸长,促进侧根发育。此外,最新研究结果也显示,AUX1在植物盐碱和重金属胁迫中发挥重要作用[12~14]。
我国是全球苹果最大的生产消费国,苹果栽培无论是在面积、产量或是出口量方面多年均居世界首位,苹果产业对于提高农民收入、解决剩余劳动力以及带动下游附加产业的发展起到了关键作用。当今苹果生产过程中,为减少劳动力,节约成本,通常选用矮化砧木进行嫁接。但是矮化砧木有一个缺点,就是根系不发达,容易受到风雨冲击。这影响了苹果的生产,而生长素在调控根系发育过程中起着关键的作用[15]。为探明生长素输入载体在苹果生长发育中的作用,本实验采用同源克隆的方法克隆了苹果生长素输入载体基因MdAUX1,成功构建了MdAUX1过量表达载体,并通过农杆菌介导的遗传转化获得了转MdAUX1基因拟南芥和烟草。通过分析转基因拟南芥根系表型以及转基因烟草地上部分生长情况,初步揭示MdAUX1在植株生长发育中的作用。
1 材料与方法
1.1 试验材料与处理
本实验所用到的植物材料有嘎拉(Malus×domestic‘Royal Gala’),拟南芥(ColumbiaCol-0)烟草(Nicotianatabacum)。嘎啦幼苗取自山东农业大学南校区果树试验站,取样时间为2015年7月至9月。检测MdAUX1基因表达所用的组织包括生长根、幼茎、新生叶、初花时的花和花后30 d的幼果,取样后用液氮速冻保存备用。
1.2 MdAUX1的克隆和生物信息学分析
从苹果基因组数据库(https://www.rosaceae.org/)中下载苹果基因组信息。设计引物,MdAUX1-F:5′-CCACTCAATCTCTCTGCCAAT-3′,MdAUX1-R:5′-GACTGGTGAGAGGGAGAGT-3′,以从‘嘎啦’组培苗获得的cDNA为模板进行PCR扩增。PCR反应程序为:94℃预变性10 min,94℃变性30 s,56℃退火30 s,72℃延伸90 s,72℃后延伸10 min,32个循环。PCR产物用1.25%的琼脂糖凝胶进行电泳并回收目的条带,连接pMD18-T克隆载体进行测序。利用NCBI数据库的BLASTp程序搜索同源基因。多序列比对分析采用DNAMAN软件,系统进化树用MEGA5.0软件构建。
1.3 半定量PCR分析
利用TRIZOL法分别提取‘嘎啦’根、茎、叶、花及果实的总RNA,根据大连宝生物公司PrimeScriptTMRT reagent Kit试剂盒说明书合成cDNA。根据MdAUX1序列设计RT-PCR引物。MdAUX1(RT)-F:5′-ATGGACGACAGGGAGGAC-3′,MdAUX1(RT)-R:5′-GGAGGAGGAAGAGTCCAC-3′。选取18s(GenBank accession number CN938024)为内参基因。PCR反应程序为:94℃预变性10 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,32个循环;每个处理的样品设3个生物学重复,1.2%琼脂糖凝胶电泳分析。
1.4 农杆菌介导的拟南芥的转化
转基因拟南芥通过侵染拟南芥花序的方法获得[16]。将MdAUX1全长连接到改造过的过量表达载体pCAMBIA 1300:35S载体上。利用农杆菌介导法,将重组过量表达载体pCAMBIA 1300-MdAUX1转入拟南芥中,经过50 mg·L-1潮霉素Hyg抗性筛选后,PCR检测得到阳性转基因植株,经过连续3代筛选得到T3代纯合体,收取种子,进行表型分析。
1.5 转基因烟草的获得
转基因烟草通过侵染烟草叶片的方法获得。将野生型烟草叶片切成小块,放置在预培养培养基(MS培养基+3 mg·L-16-BA+0.2 mg·L-1NAA)上培养1~2 d。通过农杆菌介导的遗传转化侵染烟草叶片;随后,将叶片转移至筛选培养基(MS培养基+3 mg·L-16-BA+0.2 mg·L-1NAA+100 mg·L-1潮霉素+500 mg·L-1头孢霉素)。PCR检测得到阳性转基因植株,收取种子,进行表型观察。
2 结果与分析
2.1苹果生长素输入载体基因MdAUX1的克隆及基因组结构分析
以苹果cDNA为模板,MdAUX1-F/R为引物,进行PCR扩增:获得1 443 bp的特异条带(图1)。该基因编码一个含480个氨基酸的蛋白质。
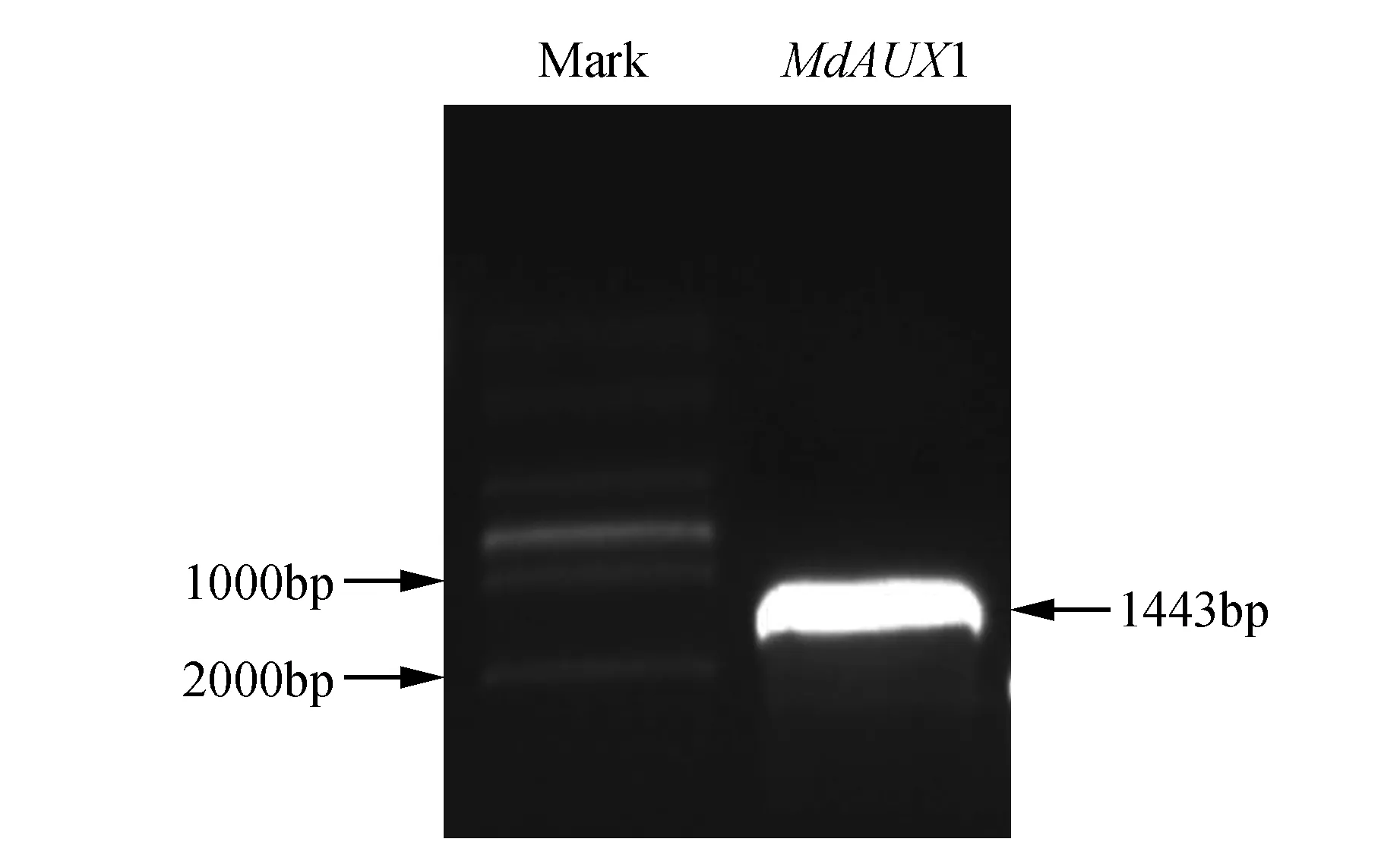
图1 苹果MdAUX1基因PCR扩增产物电泳 MdAUX1. MdAUX1基因扩增产物;Mark:分子量标记DM2000Fig.1 Electrophoresis of PCR products for cloning of MdAUX1 MdAUX1. PCR products of MdAUX1; Mark. DM2000
利用GDR数据库(http://www.rosaceae.org/)分析MdAUX1基因的染色体位置和基因组结构。如图2所示,MdAUX1定位于苹果基因组的第6号染色体上,由6个外显子和5个内含子构成。
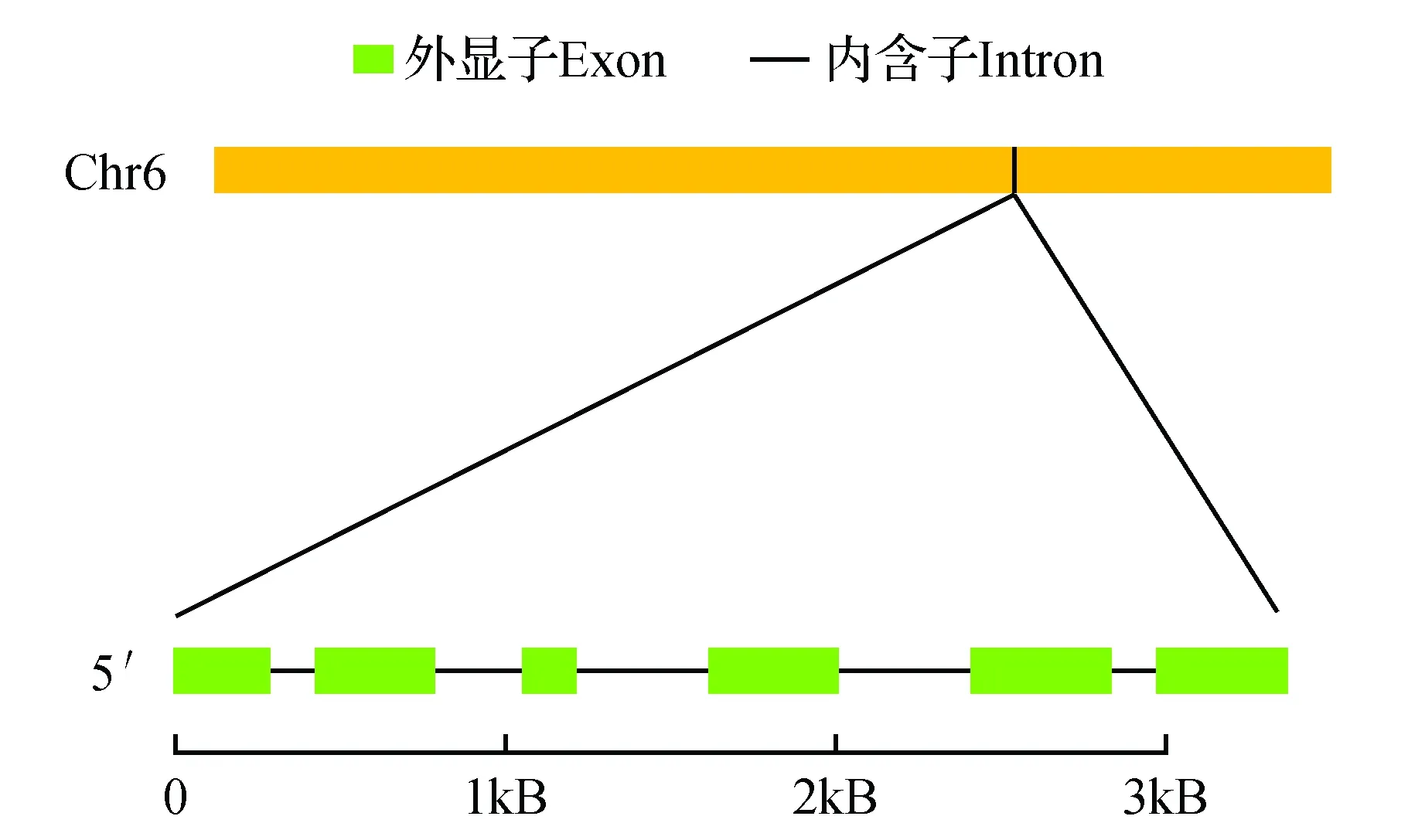
图2 苹果MdAUX1基因的染色体定位和基因组结构Fig.2 Chromosomal location and genomic structure of MdAUX1
2.2MdAUX1及其同源基因氨基酸序列比对和系统进化树分析
利用DNAMAN软件和MEGA5.0软件将苹果MdAUX1蛋白序列(Malus×domestica,MDP0000384437)与拟南芥AtAUX1(Arabidopsisthaliana,NP_565882.1)、芜菁BrAUX1(Brassicarapa,XP_009143423.1)、木麻黄CgAUX1(Casuarinaglauca,ABN81349.1)、水稻OsAUX1(Oryzasativa,EAY76542.1)、欧洲甜樱桃PaAUX1(Prunusavium,CAI05895.1)、碧桃PpAUX1(Prunuspersica,XP_007205126.1)、豌豆PsAUX1(Pisumsativum,BAC98948.1)、蓖麻RcAUX1(Ricinuscommunis,XP_002526879.1)、醉蝶花ThAUX1(Tarenayahassleriana,XP_010529889.1)、葡萄VvAUX1(Vitisviniferal,XP_002279219.1)、梅花ZmAUX1(Prunusmume,XP_008233733.1)、百日草ZvAUX1(Zinniaviolacea,BAH47613.1)的蛋白序列进行比对并构建系统进化树。氨基酸序列比对结果(图3)显示,MdAUX1与其他AUX1蛋白在结构域上保守性很高,MdAUX1蛋白含有典型的跨膜结构域(42-436 aa)。进化树分析结果(图4)显示,苹果MdAUX1与欧洲甜樱桃PaAUX1亲缘关系最近,具有同源性。

图3 苹果生长素输入基因MdAUX1及其同源基因的氨基酸序列比对分析结果 跨膜结构域用红线标注。Fig.3 Sequence alignment of auxin influx transporter gene MdAUX1 in apple and its homologous The transmembrane domain is indicated with red marks.
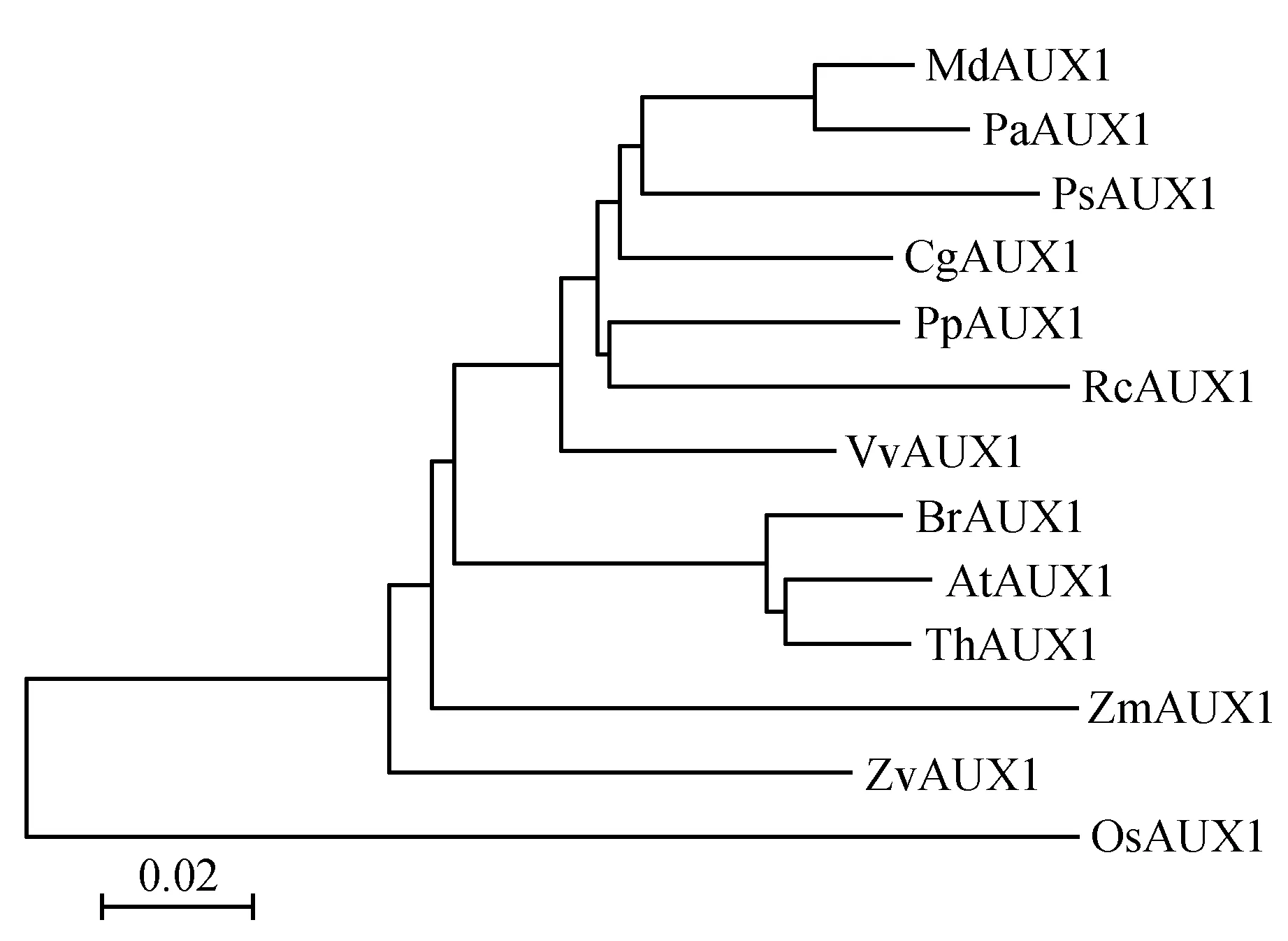
图4 苹果生长素输入基因MdAUX1及其同源基因的进化分析Fig.4 Evolution analysis of auxin influx transporter gene MdAUX1 in apple and its homologous
2.3 苹果中MdAUX1基因表达模式分析
为探讨苹果MdAUX1基因在不同组织中的表达特性,在同一时间获取各种苹果组织,提取总RNA后反转录为cDNA第一链作为模板进行半定量PCR分析。结果(图5)显示,MdAUX1基因存在与苹果所有的组织,在茎中表达量最高。
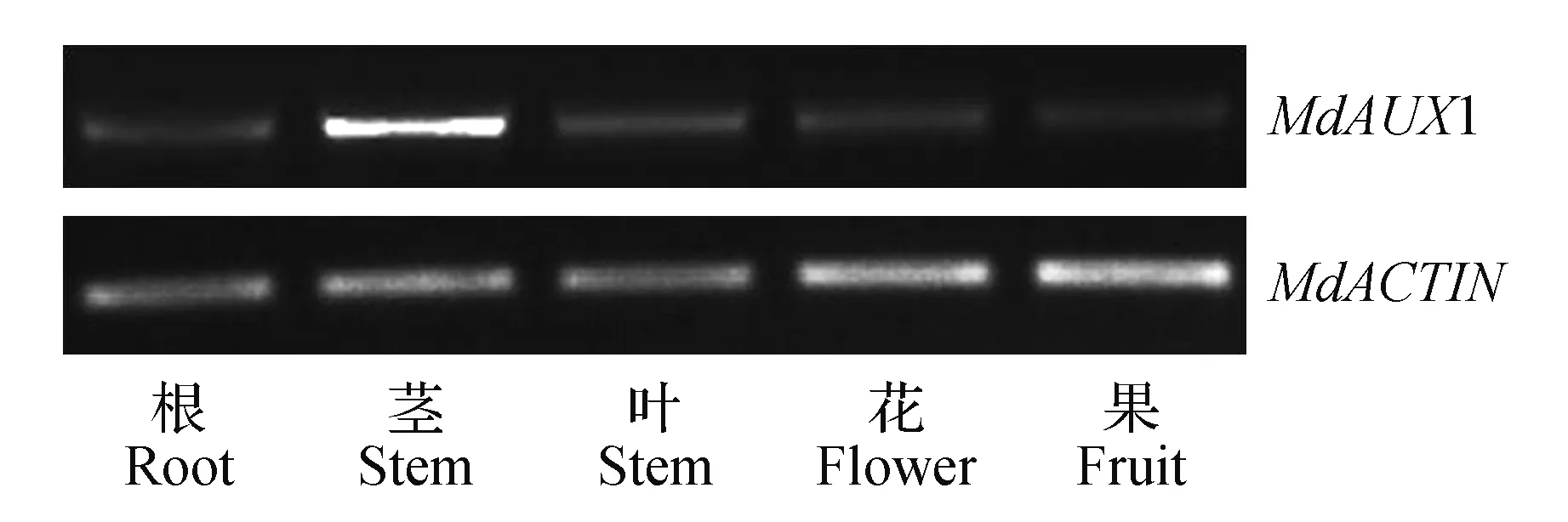
图5 MdAUX1基因在苹果不同组织中的表达分析Fig.5 Analysis of the expression of MdAUX1 gene in different tissues of apple
2.4MdAUX1过量表达载体的构建及获得转基因拟南芥和烟草
利用引物中引入的BamHⅠ和PstⅠ酶切位点,将MdAUX1基因从pMD18-T载体切出回收,并对pCAMBIA 1300进行同样酶切,将两者在16℃连接,转化大肠杆菌,鉴定阳性单菌落。成功构建pCAMBIA-1300-MdAUX1植物过量表达载体(图6)。
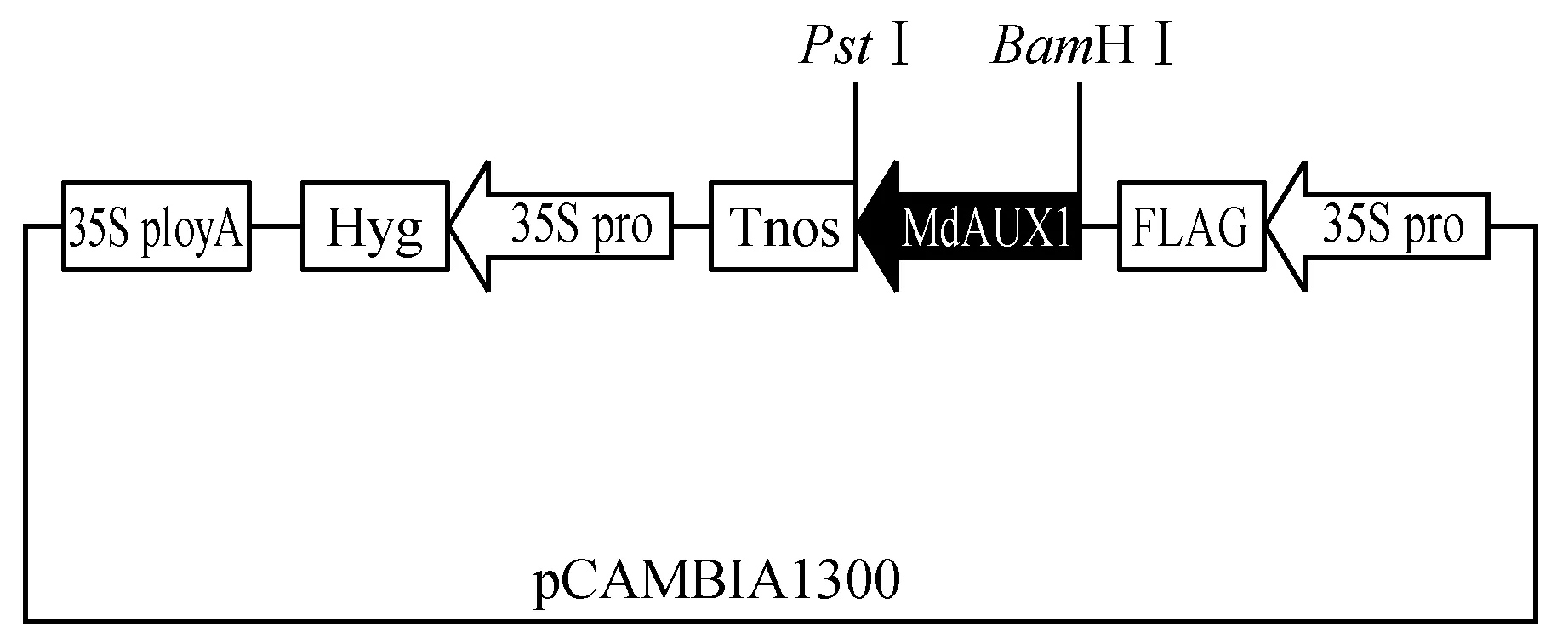
图6 35S:MdAUX1结构示意图Fig.6 Schematic diagram of the 35S promoter:MdAUX1 construct
将构建的MdAUX1过量表达载体转化农杆菌LBA4404,通过侵染拟南芥花序和烟草叶片的方法进行基因的遗传转化。半定量PCR分析检测转基因株系MdAUX1基因表达量。拟南芥L1,L2和L3转基因株系以及烟草#1,#2和#3(图7)被鉴定出来。
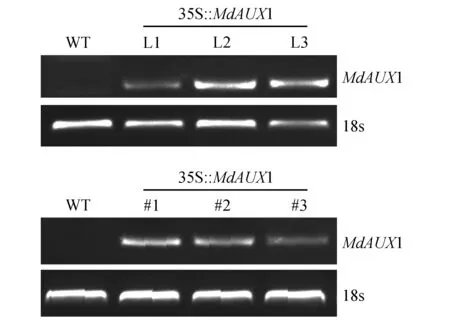
图7 RT-PCR分析MdAUX1基因在转基因拟南芥L1,L2,L3株系和转基因烟草#1,#2,#3株系中的表达水平Fig.7 RT-PCR analysis of the expression level of MdAUX1 in L1,L2 and L3 transgenic Arabidopsis and #1,#2 and #3 transgenic tobacco
2.5拟南芥中异位表达MdAUX1基因影响植株根系发育
对获得的MdAUX1转基因拟南芥根系表型进行观察。将萌发4天左右、长势一致的拟南芥幼苗放置到同一培养基上竖直培养,继续生长6天后,观察根系表型。结果如图8~9,相比于野生型拟南芥,转基因拟南芥主根长度明显受到抑制,侧根数目显著增加。说明MdAUX1基因在拟南芥中异位表达可以影响植株根系发育。

图8 观察生长10 d的野生型和转基因拟南芥生长情况Fig.8 Comparison of 10-day-old seedlings between the WT and transgenic lines
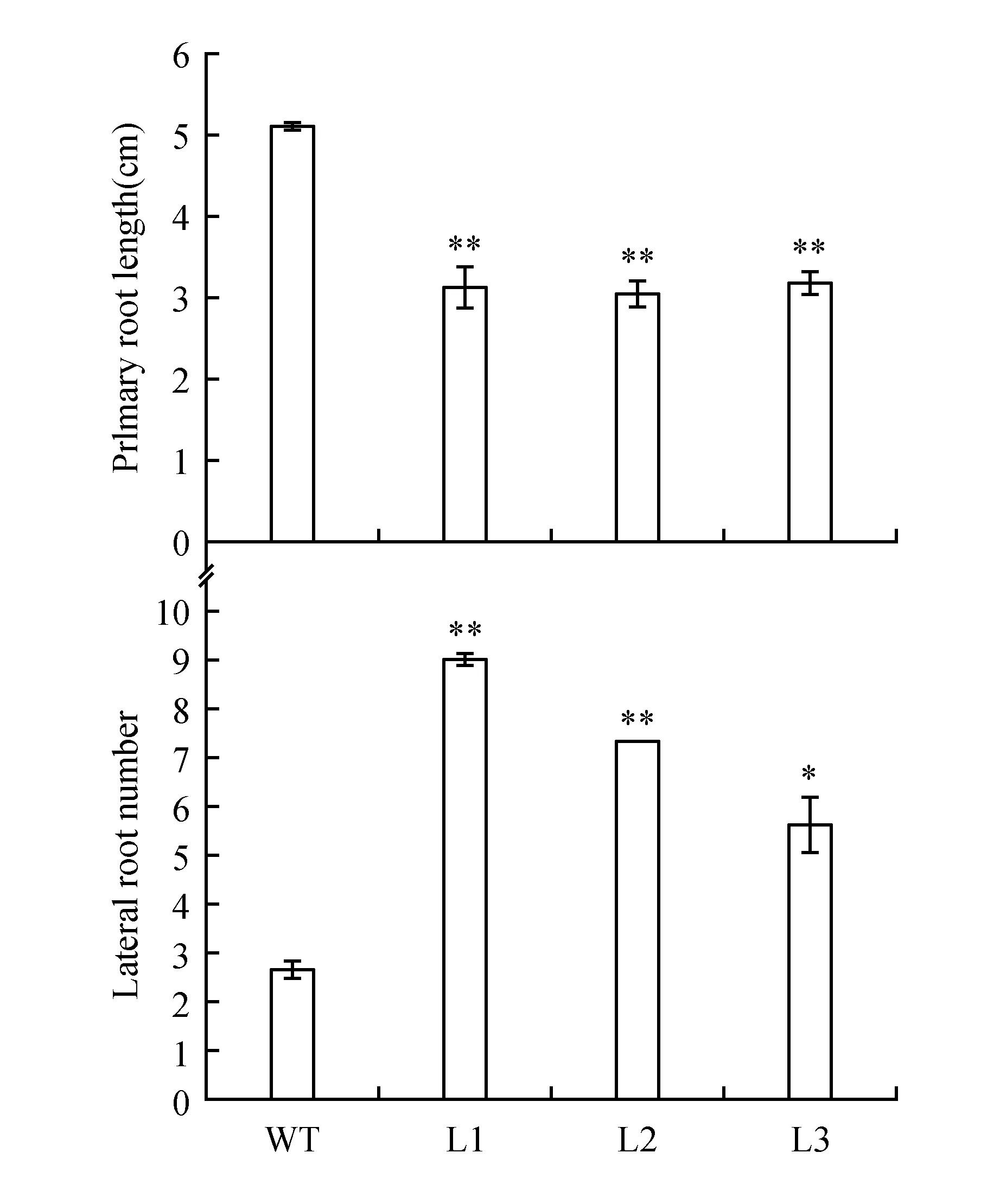
图9 分析野生型和转基因拟南芥主根长度和侧根数目 *P<0.05,**P<0.01 下同。Fig.9 Analysis of primary roots length and lateral root number between the WT and transgenic lines *P<0.05,**P<0.01 The same as below.
生长素NAA可以通过扩散的方式进入植物细胞内,而不依赖于生长素输入载体。对野生型和转基因拟南芥进行NAA处理,结果(图10~11)发现,转基因拟南芥抑制主根伸长的表型变得不显著。以上结果说明,苹果生长素输入载体基因MdAUX1在根系发育中发挥重要作用,超量表达MdAUX1抑制主根伸长,促进侧根发育。
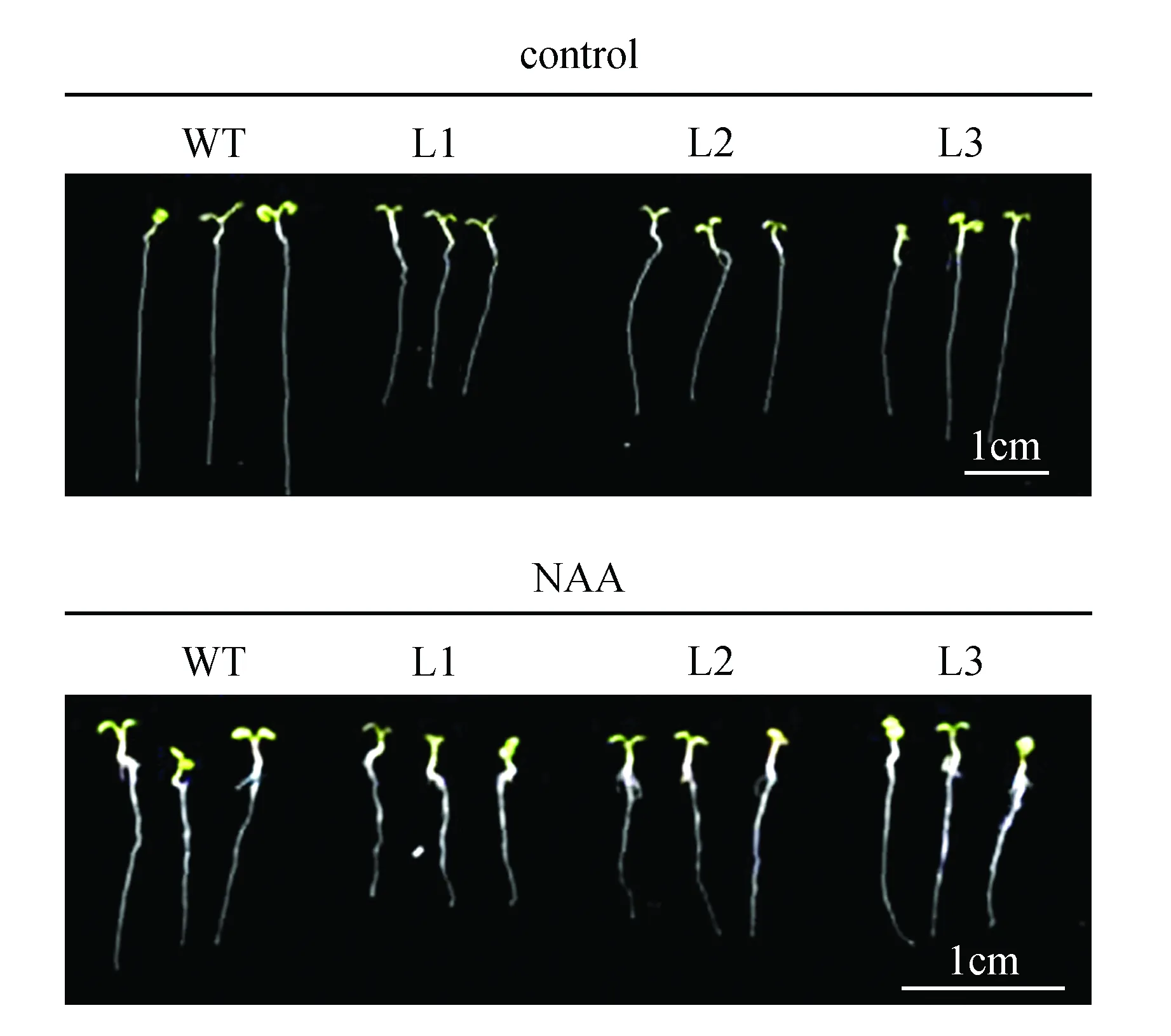
图10 野生型和转基因拟南芥在对照和NAA处理下根系表型观察Fig.10 Phenotypic characterization of WT and transgenic lines under control and NAA treatments
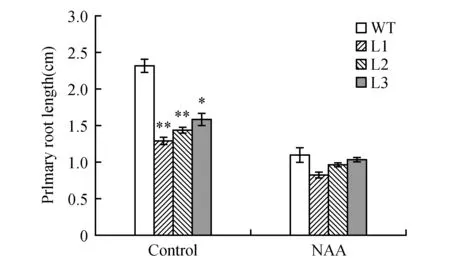
图11 分析野生型和转基因拟南芥在对照和NAA处理下主根长度Fig.11 Analysis of primary roots length between the WT and transgenic lines under control and NAA treatments
2.6 烟草中异位表达MdAUX1基因影响植株生长
对获得的MdAUX1转基因烟草植株生长状况进行观察。结果(图12)发现,转基因烟草生长状况明显优于野生型。说明MdAUX1基因在烟草中异位表达可以影响植株地上部分的生长发育。

图12 观察野生型和转基因烟草生长情况Fig.12 Analysis of the growth conditions between the WT and transgenic tobacco
3 讨论
生长素的梯度分布影响植物生长发育和植株形态[17~18],生长素输入载体是形成生长素浓度梯度的基本条件。因此,研究生长素输入载体的功能就显得尤为重要。AUX1/LAX1蛋白是最主要的生长素输入载体,编码其蛋白的基因主要包括AUX1基因和类AUX1基因(LAX1、LAX2、LAX3)[18]。它们广泛分布在植物体的韧皮部、维管柱及根细胞中。生长素输入载体系统的存在,使得生长素在植物体内高效运输,从而调节植物体的生长发育[19~20]。
近些年来,在毛杨树、水稻、花生、豌豆、樱桃等植物中也发现了生长素输入载体基因的存在。本研究中克隆得到了苹果生长素输入载体基因MdAUX1,基因组结构分析结果显示,MdAUX1定位于苹果基因组的第6号染色体上,由6个外显子和5个内含子构成。氨基酸序列比对表明,苹果MdAUX1基因与拟南芥、芜菁、木麻黄、水稻、欧洲甜樱桃、碧桃、豌豆、蓖麻、醉蝶花、葡萄、梅花、百日草的AUX1基因具有高度同源性,初步推测该基因片段为存在于苹果中的生长素输入载体AUX/LAX类基因家族成员。MdAUX1蛋白功能域分析结果表明其在42-436 aa存在一个保守的跨膜结构域,表明MdAUX1能够将生长素运输进入细胞膜。进化树分析进一步表明,苹果MdAUX1与欧洲甜樱桃PaAUX1亲缘关系最近,推测二者功能相近。同时,组织表达分析结果显示,该基因在苹果各组织中为组成型表达,且在茎部的表达强度最高,推测MdAUX1在植物体内生长素极性运输和重新分配中发挥关键作用。
为了进一步研究MdAUX1在苹果生长发育中的功能,我们构建了MdAUX1基因的过量表达载体,并通过农杆菌介导遗传转化拟南芥和烟草。根系表型观察结果显示,在拟南芥中量表达MdAUX1抑制了主根伸长,促进了侧根发育。一般认为,当生长素在根系中积累到一定水平时,就会抑制主根伸长;同时,又会激活侧根原基,诱导侧根不断生长并伸长[21]。据此推测苹果MdAUX1作为生长素输入载体,能够调控生长素极性运输,促进生长素在根系部位的积累。生长素NAA可以通过扩散的方式进入植物细胞内,而不依赖于生长素输入载体[22]。用NAA处理植株,转基因植株抑制主根伸长的表型变得不显著,推测苹果MdAUX1在生长素运输中具有饱和性。此外,转基因烟草的地上部分生长状况明显优于野生型,表明MdAUX1在促进植株生长也发挥重要作用。这些研究结果表明MdAUX1基因为生长素运输载体AUX/LAX类基因家族成员,在促进植物根系发育和植株生长中发挥重要作用,这为苹果生长发育调控及新品种培育提供了理论依据。
1.倪为民,陈晓亚,许智宏,等.生长素极性运输研究进展[J].植物学报,2000,42(3):221-228.
Ni W M,Chen X Y,Xu Z H,et al.Advances in study of polar auxin transport[J].Acta Botanica Sinica,2000,42(3):221-228.
2.Kepinski S,Leyser O.Plant development:auxin in loops[J].Current Biology,2005,15(6):R208-R210.
3.刘进平.生长素受体与信号转导机制研究进展[J].生物技术通报,2007,3:22.
Liu J P.Advances in research on auxin receptors and auxin signaling mechanism[J].Biotechnology Bulletin,2007,3:22.
4.王凤娇,宋晓婕,王万军.植物生长素的极性运输[J].现代农业科技,2009,3:11-14.
Wang F J,Song X J,Wang W J.Auxin polar transport [J].Modern Agricultural Science and Technology,2009,3:11-14
5.Parry G,Marchant A,May S,et al.Quick on the uptake:characterization of a family of plant auxin influx carriers[J].Journal of Plant Growth Regulation,2001,20(3):217-225.
6.董秀春.毛白杨生长素信号转导因子基因的分离与功能的初步分析[D]. 泰安:山东农业大学,2008.
Dong X C.Isolation and functional characterization of gene encoding auxin signaling components inPopulustomentosaCarr.[D].Tai’an:Shandong Agricultural University,2008.
7.Muller A,Guan C,Gaweiler L,et al.AtPIN2 defines a locus ofArabidopsisfor root gravitropism control[J].EMBO Journal,1998,17:6903-6911.
8.任怡怡,戴绍军,刘炜.花生生长素输入载体基因PNAUX1的克隆及表达模式分析[J].山东农业科学,2012,03:1-6.
Ren Y Y,Dai S J,Liu W.Cloning of auxin influx carrier genePNAUX1 from peanut and analysis of its expression pattern[J].Shandong Agricultural Sciences,2012,03:1-6.
9.闫辉.毛白杨PtAUX1和PtPIN1基因的克隆及遗传转化[D].泰安:山东农业大学,2013.
Yan H.Cloning ofPtAUX1 andPtPIN1 from Populus tomentosa Carr and transformation.[D].Tai’an:Shandong Agricultural University,2013.
10.Zhao H,Ma T,Wang X,et al.OsAUX1 controls lateral root initiation in rice(OryzasativaL.)[J].Plant,Cell & Environment,2015,38(11):2208-2222.
11.Yu C,Sun C,Shen C,et al.The auxin transporter,OsAUX1,is involved in primary root and root hair elongation and in Cd stress responses in rice(OryzasativaL.)[J].The Plant Journal,2015,83(5):818-830.
12.Liu W,Li R J,Han T T,et al.Salt stress reduces root meristem size by nitric oxide-mediated modulation of auxin accumulation and signaling inArabidopsis[J].Plant Physiology,2015,168(1):343-356.
13.Li J,Xu H H,Liu W C,et al.Ethylene inhibits root elongation during alkaline stress through AUXIN1 and associated changes in auxin accumulation[J].Plant Physiology,2015,168(4):1777-1791.
14.Li G,Song H,Li B,et al.Auxin resistant1 and PIN-FORMED2 protect lateral root formation inArabidopsisunder iron stress[J].Plant Physiology,2015,169(4):2608-2623.
15.Guilfoyle T J,Hagen G.Auxin response factors[J].Current Opinion in Plant Biology,2007,10(5):453-460.
16.Clough S J,Bent A F.Floral dip:a simplified method forAgrobacterium-mediated transformation ofArabidopsisthaliana[J].The Plant Journal,1998,16(6):735-743.
17.李运合,孙光明,吴蓓.植物生长素的极性运输载体研究进展[J].西北植物学报,2009,08:1714-1722.
Li Y H,Sun G M,Wu B.Advances on carriers of plant polar auxin transport[J].Acta Botanica Boreali-Occidentalia,2009,08:1714-1722.
18.曲桂芹,张贤泽,霍俊伟.影响大豆体细胞胚诱导因素的研究[J].植物研究,2001,21:210-214.
Qu G Q,Zhang X Z,Huo J W.Study on somatic embryos induction in soybean(GlycineMax L.)[J].Bulletin of Botanical Research,2001,21:210-214.
19.Reed J W.Roles and activities of Aux/IAA proteins inArabidopsis[J].Trends in Plant Science,2001,6(9):420-425.
20.Yang Y,Hammes U Z,Taylor C G,et al.High-affinity auxin transport by the AUX1 influx carrier protein[J].Current Biology,2006,16(11):1123-1127.
21.张碧玉,苏良辰,孙叙卓.拟南芥生长素输入载体AUX1研究[J].亚热带植物科学,2010,39(1):88 -91.
Zhang B Y,Su L C,Sun X Z.Research on auxin influx transporterAUX1 of Arabidopsis[J].Subtropical Plant Science,2010,39(1):88-91.
22.Nemhauser J L,Mockler T C,Chory J.Interdependency of brassinosteroid and auxin signaling inArabidopsis[J].PLoS Biology,2004,2(9):e258.
23.Carrier D J,Bakar N T A,Swarup R,et al.The binding of auxin to theArabidopsisauxin influx transporter AUX1[J].Plant Physiology,2008,148(1):529-535.
The National Natural Science Foundation of China(31430074);Shandong Agricultural Engineering and industrial System(SDAIT-03-033-03)
introduction:AN Jian-Ping(1990—),male,Master,Mainly engaged in the study of fruit tree molecular biology.
date:2016-09-05
MolecularCloningandGeneticTransformationAnalysisofanAppleAuxinInfluxTransporterGeneMdAUX1inArabidopsisthalianaandTobacco
AN Jian-Ping WANG Xiao-Fei LIU Xin LI Hao-Hao YOU Chun-Xiang HAO Yu-Jin*
(College of Horticulture Science and Engineering,Shandong Agricultural University,State Key Laboratory of Crop Biology,Tai’an 271018)
Auxin has been identified to play critical roles in regulating plant growth and development. The polar transport of auxin is regulated by auxin transporters. In this study, an auxin influx transporter gene namedMdAUX1 was cloned fromMalus×domestic‘Royal Gala’. Sequence analysis showed that the length ofMdAUX1 gene was 1 443 bp, which encoded 480 amino acids. Amino acid sequence alignment and phylogenetic tree analysis showed that the AUX1 had a high sequence conservation among different species, and apple MdAUX1 exhibited the highest sequence similarity withPrunusaviumPaAUX1. RT-PCR analysis demonstrated theMdAUX1 gene was mainly expressed in stem. We generated transgenicArabidopsisand tobacco plants expressing the appleMdAUX1 byAgrobacterium-mediated genetic transformation. Ectopic expression ofMdAUX1 inArabidopsisexhibited the phenotype of inhibition of primary root elongation and increase lateral root number. Furthermore, there was no significant inhibition on primary root elongation phenotype when treated with the NAA. OverexpressingMdAUX1 in tobacco could significantly promote the growth of aerial parts of plant. These results suggested that MdAUX1 played a vital role in plant growth and development.
apple;auxin influx transporters;MdAUX1;genetic transformation
国家自然科学基金(31430074);山东省农业工程和产业体系(SDAIT-03-033-03)
安建平(1990—),男,硕士研究生,主要从事果树生物技术的研究。
* 通信作者:E-mail:haoyujin@sdau.edu.cn
2016-09-05
* Corresponding author:E-mail:haoyujin@sdau.edu.cn
S661.1
A
10.7525/j.issn.1673-5102.2016.06.014

