低温胁迫下外源脱落酸对高山离子芥抗氧化酶和渗透调节物质的影响
何文平 王新霞 张旭强 杨鹏军 仇奕之 杨 宁
(西北师范大学生命科学学院,兰州 730070)
低温胁迫下外源脱落酸对高山离子芥抗氧化酶和渗透调节物质的影响
何文平 王新霞 张旭强 杨鹏军 仇奕之 杨 宁*
(西北师范大学生命科学学院,兰州 730070)
以高山离子芥(Chorisporabungeana)试管苗为实验材料,研究了低温冷害(4℃)、低温冻害(-4℃)和临界温度(0℃)胁迫下外源ABA对抗氧化酶及渗透调节物质的影响。结果表明在4和-4℃胁迫下阴性对照组中SOD和CAT活性高于空白对照组;POD活性在4℃胁迫下高于空白对照组;APX活性在4和-4℃胁迫的晚期升高。与此同时,阴性对照组中膜的相对电导率增加、脯氨酸、可溶性糖含量降低。0℃胁迫下阴性对照组中POD活性降低;APX活性呈波动式变化;脯氨酸和可溶性糖含量分别在72和48 h时高于空白对照组;而可溶性蛋白含量低于空白对照组。添加外源ABA处理后4、-4和0℃胁迫下POD、SOD、CAT和APX活性较阴性对照组均得到不同程度增加;ABA的处理显著降低了细胞膜的相对电导率,提高脯氨酸,可溶性糖和可溶性蛋白的含量。
低温胁迫;高山离子芥;脱落酸;抗氧化酶;渗透调节物
在我国西北地区极端低温是其气候变化的主要特征之一。低温冷害和冻害对农作物正常生长产生了极大的危害[1]。据统计,全球每年因低温伤害造成的农林作物损失高达数千亿元[2]。除此之外,低温往往与环境中其它的胁迫因子如干旱,紫外辐射等结合起来形成复杂的胁迫条件进而加剧了对农林作物的伤害。因此研究在低温环境中如何提高植物的抗寒性,预防低温对植物造成伤害具有重要的意义。在很早的时候人们发现植物激素与植物的抗寒性可能存在某种联系,因为在低温锻炼过程中油菜、玉米等作物中游离ABA含量增加,进而有人提出低温引起植物中ABA含量的积累[3]。随后的研究表明,植物在感知非生物胁迫的过程中,ABA的生物合成是其早期事件中的一个[4],然后产生的ABA被转运到植物体中的各个地方并激活一些列的生理过程促使植物适应环境的胁迫[5]。植物遭受低温胁迫时往往伴随着ROS的过量产生并且影响植物的渗透调节作用,ROS对细胞中生物大分子如蛋白质,DNA,生物膜造成氧化损伤,进而危害细胞正常的新陈代谢;当渗透调节受到破坏后,会改变细胞膨压及细胞浓度,进而影响细胞水分的正常供给[6~8]。而在植物中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(APX)是抗氧化酶系统的主要组成部分[9~10]。抗氧化酶在逆境中清除过量的ROS,使植物体中的ROS含量维持在正常生理平衡中。渗透调节物质与植物抗寒性关系密切,脯氨酸、可溶性蛋白和可溶性糖作为渗透调节的主要物质,在一定胁迫下维持植物细胞的正常膨压和生理代谢,并且对细胞无毒,对代谢无抑制作用[11]。因此在低温胁迫下抗氧化酶活性及渗透调节物质含量的变化在一定程度上能反应植物抗寒性的高低。在前人的研究中关于在低温胁迫下ABA对植物中抗氧化酶及渗透调节物质的影响的研究比较多,但是对生长在高山冰缘极端环境中相关植物抗逆性的研究较少。高山冰缘多年生草本植物高山离子芥生境温度寒冷是研究植物抵抗低温机制的理想材料[12~13]。
本研究中,以高山离子芥试管苗为材料,以低温为胁迫因子,研究在低温冷害(4℃),低温冻害(-4℃)及两者的临界温度(0℃)胁迫下外源ABA对高山离子芥抗氧化系统及渗透调节物质的影响,以期揭示植物激素ABA对高山离子芥抗寒性的作用机制,进而为深入了解ABA参与植物抗寒性响应的低温信号转导铺垫实验依据。
1 材料与方法
材料的培养:高山离子芥试管苗的培养参照杨宁等方法[14],将高山离子芥(Chorasporabungeana)试管苗接种于培养基(MS+0.2 mg·L-16-BA+30 g·L-1蔗糖+7.8 g·L-1琼脂,pH5.8)中,于25℃,2 000 lx,12 h光周期胁迫下培养。ABA的处理:选取生长旺盛,长势良好一致的高山离子芥试管苗接种于含50 μmol·L-1ABA的MS培养基中,每瓶至少接种3株,每处理3个平行。以上处理的材料均置于人工培养箱中,分别在4、0和-4℃中低温培养6、24、48、72 h,然后在各胁迫时间点取材实验。实验设置0 h作为空白对照组,设置未添加ABA处理的处理组作为阴性对照组,设置添加ABA处理的处理组为实验组。
2 测定方法
SOD活性的测定参照Dhindsa氮蓝四锉(NBT)光照化学合成还原法[15];用愈创木酚显色法测定POD活性[16];CAT活性测定参照李仕飞等的方法[17];APX活性的测定参照李忠光等的方法[18]。细胞膜透性采用电导率法测定[19],可溶性糖含量的测定参照张宪政蒽酮比色法[20],可溶性蛋白含量的测定参照考马斯亮蓝G-250法[21],脯氨酸含量的测定,参照Bates磺基水杨酸法[22]。
本实验数据利用SPSS 17.0对组间随时间变化的差异性多重比较采用LSD法分析,作图在origin pro9.0中进行。
3 结果与分析
3.1低温胁迫下,ABA对高山离子芥试管苗叶片中保护酶活性的影响
用50 μmol·L-1ABA处理高山离子芥试管苗并置于4、0和-4℃条件下培养,SOD活性变化如图1所示。在4、0和-4℃胁迫下阴性对照组中SOD活性较空白对照组均得到不同程度的提高。当添加ABA处理后SOD活性与阴性对照组相比进一步提高。在4℃胁迫下,ABA处理组SOD活性在6~72 h过程中分别较阴性对照组上升663.42%、312.26%、341.31%和328.08%;在0℃胁迫下ABA处理组SOD活性较阴性对照组上升1 532.26%、1 882.12%、1 786.72%和320.89%;在-4℃胁迫下ABA处理组SOD活性较阴性对照组上升4 502.35%、8 997.09%、5 687.96%和2 337.39%。
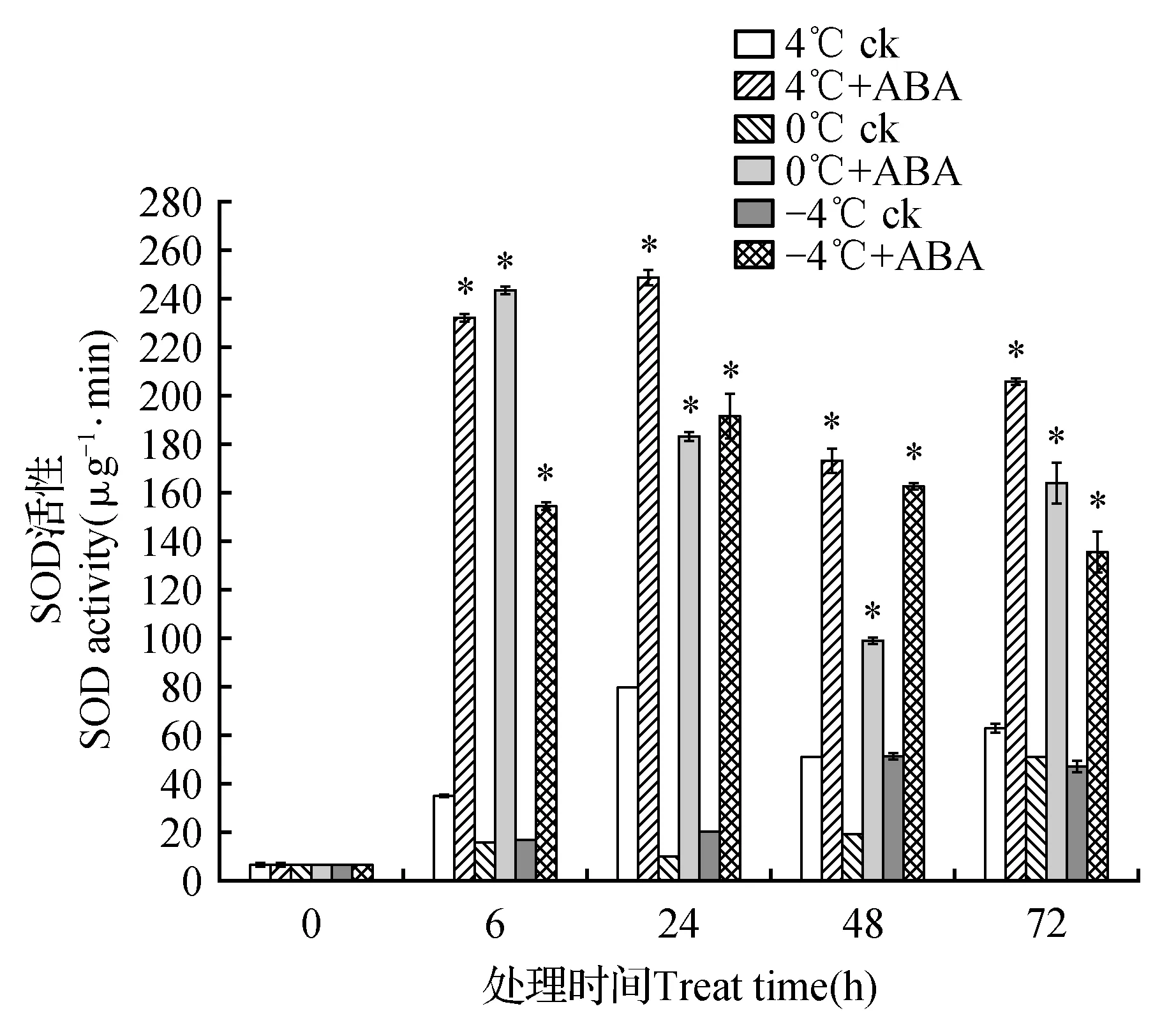
图1 4、0和-4℃胁迫下50 μmol·L-1ABA对高山离子芥试管苗中SOD活性的影响 “*”表示在同一温度胁迫下阴性对照组与实验组在P<0.05水平上具有差异显著性,下同。Fig.1 The effects of 50 μmol·L-1 exogenous ABA on SOD activity in C.bungeana plantlets under 4,0 and -4℃ The“*” at the same temperature indicated the significant differences between the negative control group and the experimental group at P<0.05 level,the same as below.
POD活性变化如图2所示。在4℃胁迫下阴性对照组中POD活性在6~72 h过程中较0 h处理组升高。在0℃胁迫下阴性对照组POD活性除48 h处理组与空白对照组无显著差异外,其余均显著低于空白对照组POD活性。在-4℃胁迫下阴性对照组POD活性在0~72 h过程中,表现出降低—增加—降低—增加的波动变化。添加ABA处理后,在4、0和-4℃胁迫下POD活性较阴性对照组表现出不同程度的提高。在4℃胁迫下ABA处理组POD活性在6~72 h过程中分别较阴性对照组POD活性上升154.68%、210.98%、317.57%和116.33%;0℃胁迫下ABA处理组POD活性较阴性对照组POD活性上升669.51%、399.68%、371.76%和370.19%;-4℃胁迫下ABA处理组POD活较阴性对照组POD活性上升187.18%、105.73%、259.65%和169.04%。
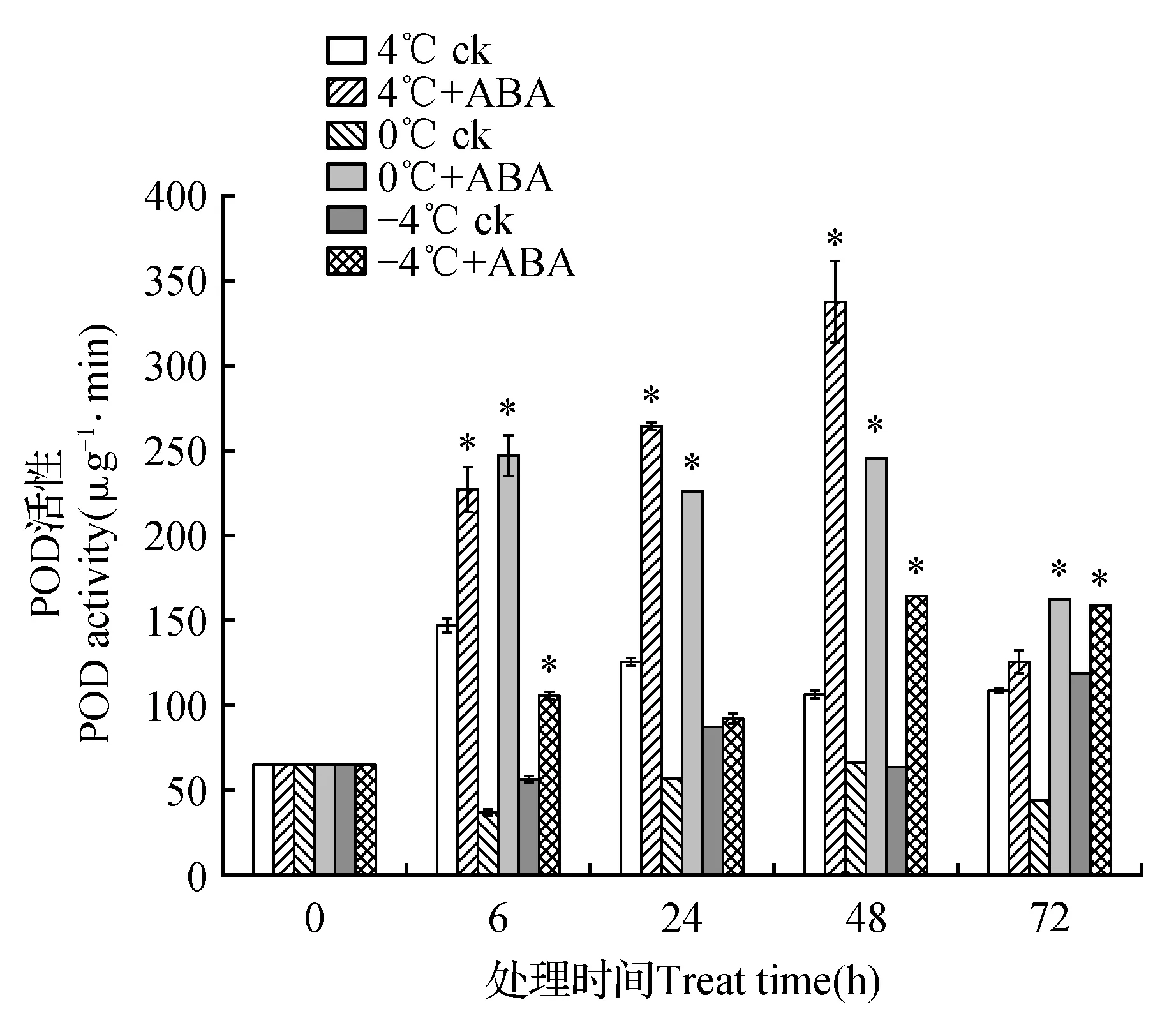
图2 4、0和-4℃胁迫下高山离子芥试管苗中POD活性的变化Fig.2 The effects of 50 μmol·L-1 exogenous ABA on POD activity in C.bungeana plantlets under 4,0 and -4℃
CAT活性的变化如图3所示。在4、0和-4℃胁迫下6~72 h过程中,阴性对照组CAT活性均较空白对照组CAT活性升高。当添加ABA处理后3个温度胁迫下的CAT活性高于阴性对照组中CAT活性。在4℃胁迫下ABA处理组CAT活性在6~72 h过程较阴性对照组CAT活性分别上升237.25%、975.44%、221.70%和115.32%;0℃胁迫下ABA处理组CAT活性较阴性对照组CAT活性上升177.93%、291.56%、214.77%和172.98%;-4℃胁迫下ABA处理组CAT活性较阴性对照组CAT活性上升209.82%、129.37%、399.43%和272.84%。
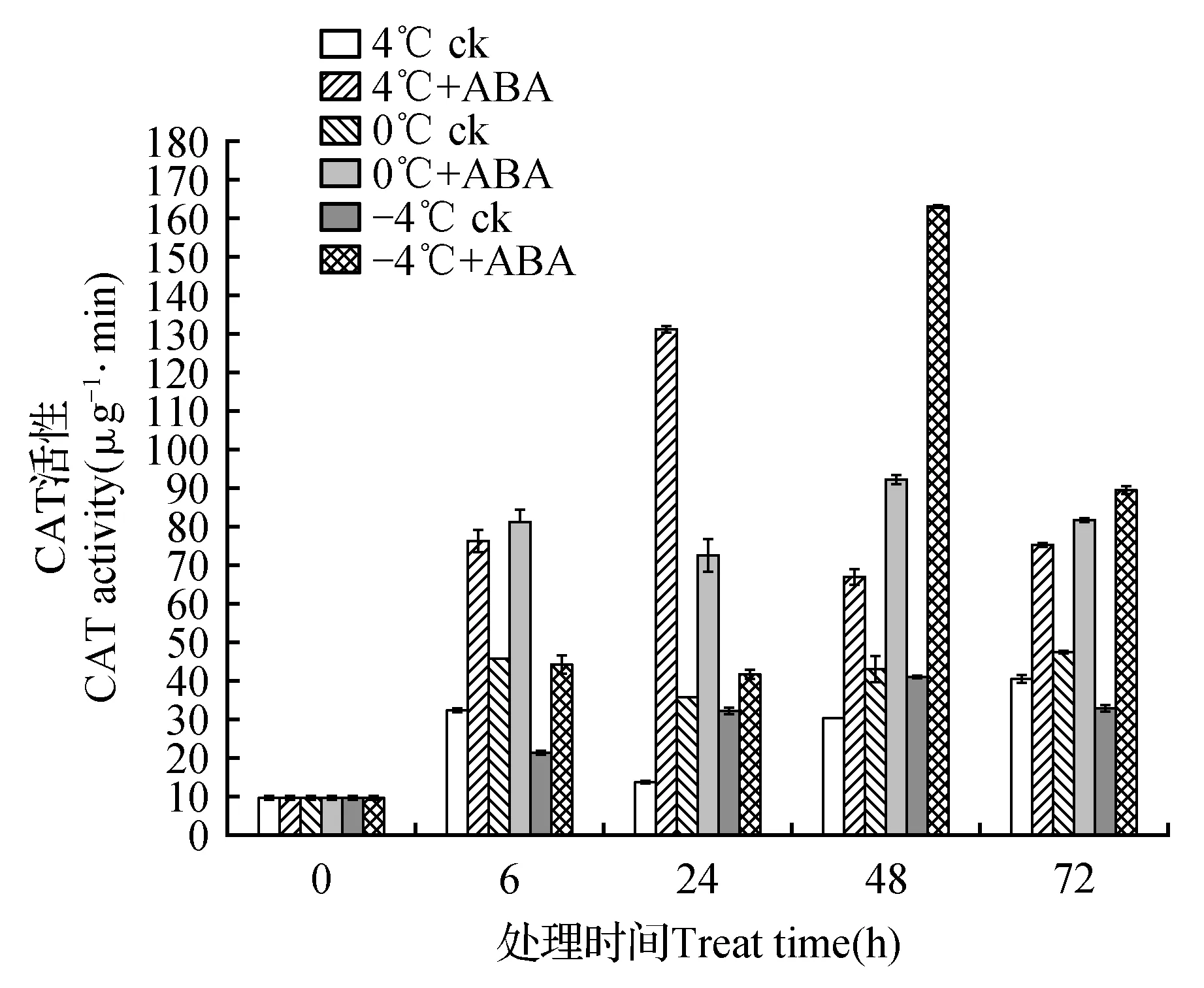
图3 4、0和-4℃胁迫下高山离子芥试管苗中CAT活性的变化Fig.3 The effects of 50 μmol·L-1 exogenous ABA on CAT activity in C.bungeana plantlets under 4,0 and -4℃
APX活性变化如图4所示。在4和-4℃胁迫下阴性对照组APX活性在6、24和48 h时低于空白对照组,到72 h活性升高。在0℃胁迫下阴性对照组APX活性在6~72 h过程中表现出升高—降低—升高的趋势。添加ABA处理后3个温度胁迫下APX活性在6~72 h过程中均较阴性对照组APX活性均升高。4℃胁迫下ABA处理组APX活性在6~72 h过程中较阴性对照组APX活性升高172.08%、135.86%、132.77%和129.81%;0℃胁迫下ABA处理组APX活性较阴性对照组APX活性升高108.88%、186.17%、139.23%和109.67%;-4℃胁迫下ABA处理组APX活性较阴性对照组APX活性上升108.10%、429.14%、205.12%和196.04%。
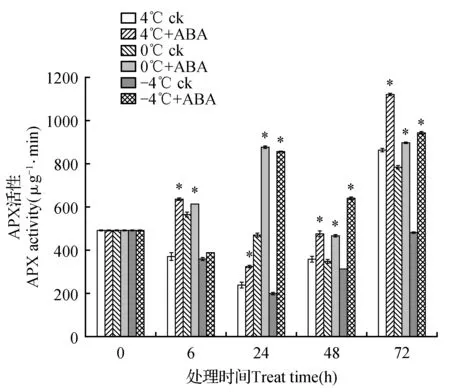
图4 4、0和-4℃胁迫下高山离子芥试管苗中CAT活性的变化Fig.4 The effects of 50 μmol·L-1 exogenous ABA on APX activity in C.bungeana plantlets under 4,0 and -4℃
3.2低温胁迫下ABA对高山离子芥试管苗叶片细胞膜相对透性和渗透调节物质含量的影响
50 μmol·L-1ABA处理高山离子芥试管苗并置于4、0和-4℃胁迫下培养,相对电导率的变化如图5所示。在4、0和-4℃胁迫下阴性对照组中相对电导率成增—降—增的变化趋势。阴性对照组中在6 h时3个温度胁迫下相对电导率均增加,随后4和0℃胁迫下相对电导率均在24 h后降低;-4℃胁迫下电导率下降出现在6 h。添加ABA处理后3个温度胁迫下相对电导率较阴性对照组出现不同程度降低。在4℃胁迫下ABA处理组相对电导率较阴性对照组在6~72 h过程中下降6.45%、37.14%、33.33%和15.56%。0℃胁迫下ABA处理组相对电导率较阴性对照组下降26.15%、34.72%、9.38%和36.00%。-4℃胁迫下ABA处理组相对电导率较阴性对照组下降31.34%、24.39%、60.22%和7.86%。
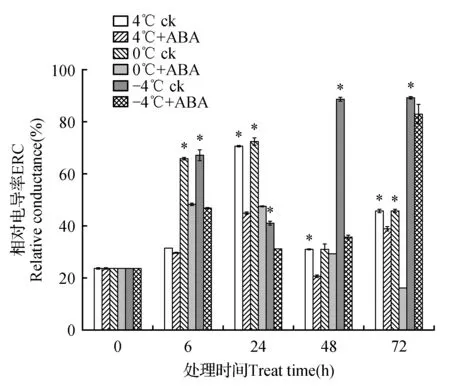
图5 4、0和-4℃胁迫下高山离子芥试管苗中相对电导率的变化Fig.5 The effects of 50 μmol·L-1 exogenous ABA on relative conductivity in C.bungeana plantlets under 4,0 and -4℃
脯氨酸含量变化如图6所示。4和-4℃胁迫下,阴性对照组中脯氨酸含量与空白对照组相比均表现出不同程度的降低,而0℃胁迫下脯氨酸含量表现出降—增的趋势。当添加ABA处理后,在4、0和-4℃胁迫下脯氨酸含量较阴性对照组出现不同程度的升高。其中在4℃胁迫下ABA处理组较阴性对照组在6~72 h过程中分别升高了261.50%、221.19%、309.68%和218.68%;0℃胁迫下ABA处理组较阴性对照组升高了134.64%、123.00%、117.26%和103.40%;-4℃胁迫下ABA处理组较阴性对照组升高了146.28%、111.38%、63.66%和118.64%。
可溶性糖含量变化如图7所示。阴性对照组中可溶性糖含量在4℃胁迫下呈降—增的趋势,到72 h时与空白对照组相比没有显著差异。0℃胁迫下,阴性对照组中除48 h时可溶性糖含量高于空白对照组外,其余时间点均低于空白对照组。在-4℃胁迫下可溶性糖含量均低于空白对照组。添加ABA处理后3个温度下可溶性糖含量均较阴性对照组升高。在4℃胁迫下ABA处理组与阴性对照组相比在6~72 h过程中分别升高了151.50%、169.79%、150.61%和153.50%;0℃胁迫下ABA处理组较阴性对照组升高了146.01%、168.95%、108.35%和105.09%;-4℃胁迫下ABA处理组较阴性对照组升高了141.91%、146.01%、194.38%和144.96%。
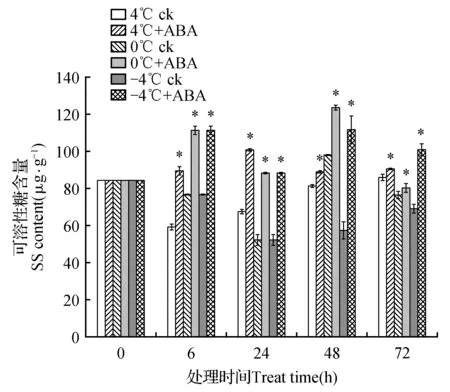
图7 4、0和-4℃胁迫下高山离子芥试管苗中可溶性糖含量的变化Fig.7 The effects of 50 μmol·L-1 exogenous ABA on soluble sugar in C.bungeana plantlets under 4,0 and -4℃
可溶性蛋白含量的变化如图8所示。在4和-4℃胁迫下6 h时阴性对照组中可溶性蛋白含量增加随后降低;但在4℃胁迫6~72 h过程中可溶性蛋白含量均高于空白对照组。而0℃胁迫下,阴性对照组中可溶性蛋白含量在6~72 h过程中均低于空白对照组。添加ABA处理后在3个温度胁迫下各时间点上可溶性蛋白含量均增加且高于阴性对照组中可溶性蛋白含量。4℃胁迫下ABA处理组较阴性对照组在6~72 h过程中分别升高了138.56%、130.53%、115.14%和129.78%;0℃胁迫下ABA处理组较阴性对照组升高了151.18%、125.45%、118.26%和129.67%;-4℃胁迫下ABA处理组较阴性对照组升高了112.69%、204.81%、327.41%和425.35%。
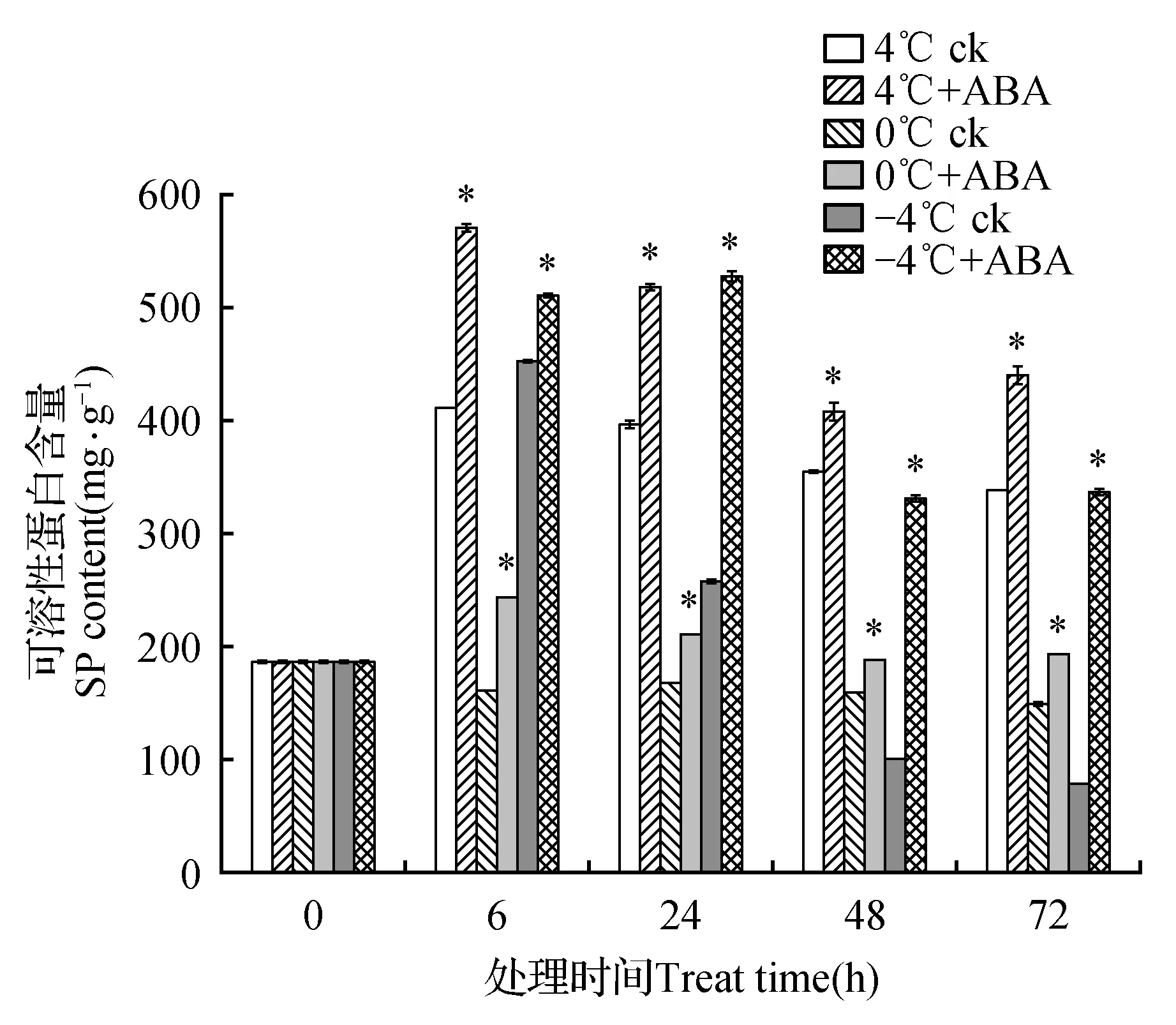
图8 4、0和-4℃胁迫下高山离子芥试管苗中可溶性蛋白含量的变化Fig.8 The effects of 50 μmol·L-1 exogenous ABA on soluble proteinin C.bungeana plantlets under 4,0 and -4℃
4 讨论
4.1低温胁迫下ABA对高山离子芥试管苗抗氧化酶活性的影响
POD,SOD,CAT和APX是抗氧化过程中重要的酶,SOD作为第一道防线来清除细胞中多余的超氧阴离子。而POD、CAT和APX清除H2O2生成水和氧气[23~24]。在本研究中,阴性对照组SOD活性和CAT活性在4和-4℃胁迫下与空白对照相比均升高,说明4和-4℃激活了植物抗氧化的第一道防线,引发下游清除H2O2的反应(图1和3)。抗氧化酶之间的作用具有协同性[23]。阴性对照组中4℃胁迫下POD活性高于空白对照组,-4℃胁迫下活性围绕空白对照组上下波动(图2);APX在4和-4℃胁迫下的早期和中期(6~48 h)时活性被抑制,低于空白对照组,之后在72 h活性升高(图4)。说明POD、CAT和APX作用中,CAT发挥主要作用,POD随着低温胁迫强度增加作用降低或者不稳定,APX主要在胁迫晚期发挥作用。在阴性对照组中,0℃胁迫下POD活性低于空白对照组;APX活性随着胁迫时间的持续呈现波动式变化;CAT和SOD活性高于空白对照组(图1~4)。表明在0℃胁迫下CAT和SOD发挥主要抗氧化作用。添加ABA处理后,在4、0和-4℃胁迫下SOD、POD、CAT和APX活性均较阴性对照组出现不同程度升高(图1~4),表明ABA促进了SOD、POD、CAT和APX活性,外源ABA提高了高山离子芥试管苗的抗氧化能力。这与李雪梅等[25]研究中得出ABA能够不同程度的提高抗氧化酶CAT、POD和SOD活性的结论相似。同时也和黄杏等[26]研究中得出低温胁迫下ABA能够提高甘蔗幼苗中CAT、POD、SOD和APX活性的结论相同。罗立津等[27]研究也表明ABA对甜椒幼苗的抗寒性具有诱导作用。刘祖祺等认为[28]ABA通过诱导抗寒特异性蛋白的合成提高柑橘的抗寒能力。Chen等[29]认为ABA激活植物的抗寒锻炼且可以代替低温对植物的抗寒性进行诱导,从而增加植物的抗寒能力。在本研究中ABA诱导SOD、POD、CAT和APX活性增加,说明ABA提高了高山离子芥试管苗的抗寒性。
4.2低温胁迫下ABA对高山离子芥试管苗渗透调节物的影响
渗透调节作用是植物适应环境,增强抗逆性的基础。人们认为植物对低温胁迫主要的适应机制可能是渗透调节[30]。脯氨酸参与渗透调节,保护生物大分子;可溶性糖作为渗透调节物质稳定细胞膜和原生质胶体;可溶性蛋白可维持较低的渗透势[31~33]。在本研究中,阴性对照组中脯氨酸含量在4和-4℃胁迫下较空白对照组表现为降低(图6),表明4和-4℃引起高山离子芥试管苗水合能力降低可能出现了低温脱水。阴性对照组中可溶性糖在4℃胁迫晚期(72 h)时较空白对照组相当而在-4℃胁迫下低于空白对照组(图7),说明这两个胁迫温度引起了可溶性糖的分解,也可能降低了可溶性糖的生物合成速率。阴性对照组中可溶性蛋白在4℃胁迫下含量高于空白对照组,在-4℃胁迫的早期和中期(6和24 h)高于空白对照组之后含量下降,而相对电导率高于空白对照组(图5和8)。表明可溶性蛋白发挥作用是建立在一定的温度范围上,而4和-4℃胁迫引起了细胞膜的损伤。在0℃胁迫下阴性对照组中脯氨酸和可溶性糖含量分别在72和48 h高于空白对照组;可溶性蛋白含量低于空白对照组;相对电导率增加并高于空白对照组(图5~8)。表明在0℃胁迫下,高山离子芥试管苗的渗透调节作用中可溶性蛋白的作用被抑制而脯氨酸和可溶性糖在胁迫晚期发挥作用,并引起了细胞膜的损伤。植物细胞中电导率的变化,能反映细胞膜的伤害程度[34],在本研究中,添加外源ABA后,4、-4和0℃胁迫下降低了细胞膜的电导率(图5),而说明ABA缓解了低温引起的细胞膜损伤。同时在4、-4和0℃胁迫下外源ABA促进了脯氨酸、可溶性糖和可溶性蛋白含量增加(图6~8),表明植物激素ABA能够提高高山离子芥试管苗的渗透调节作用,从而保证细胞代谢的正常进行。低温胁迫ABA可以启动植物固有抗冻性基因的表达,在维持植物渗透调节过程中ABA发挥作用的途径有多种。例如促进气孔关闭、增加渗透调节物质的含量等[35~36]。本研究结果表明外源ABA通过调节渗透调节物质含量参与了植物抗低温信号转导。
综上所述,低温冷害(4℃)、低温冻害(-4℃)和临界温度(0℃)胁迫下ABA通过促进抗氧化酶活性提高高山离子芥试管苗的抗氧化能力同时缓解细胞膜的损伤程度并增加渗透调节物质的含量提高渗透调节作用进而提高了高山离子芥试管苗的抗寒性。但是0℃作为临界温度,来自物理和化学的影响因素较多并且在植物抗寒性的研究中有关0℃的报道极为少见。因此关于0℃胁迫下细胞响应的机制还需进一步研究。
1.王向辉.西北地区环境变迁与农业可持续发展研究[D].杨凌:西北农林科技大学,2012.
Wang X H.Environmental change and sustainabal development of agriculturalin northwestern china[D].Yangling:Northwest A&F University,2012.
2.曹慧明,史作民,周晓波,等.植物对低温环境的响应及其抗寒性研究综述[J].中国农业气象,2010,31(2):310-314.
Cao H M,Shi Z M,Zhou X B,et al.A review on response of plant to low temperature and it scold resistance[J].Chinese Journal of agrometeorolog,2010,31(2):310-314.
3.罗正荣.植物激素与抗寒力的关系[J].植物生理学通讯,1989(3):1-5.
Luo Z R.Relationship between plant hormones and cold resistance[J].Plant Physiology Communications,1989(3):1-5.
4.Jonesa M.A new look at stress:abscisic acid patterns and dynamics at high-resolution[J].New Phytologist,2016,210(1):38-44.
5.de Zelicourt,Colcombet J,Hirt H.The Role of MAPK Modules and ABA during Abiotic Stress Signaling[J].Trends in plant science,2016,21(8):677-685.
6.Prasad T K,Anderson M D,Martin B A,et al.Stewart R.Evidence for chilling-induced oxidative stress in maize seedlings and a regulatory role for hydrogen-peroxide[J].Plant Cell,1994,6(1):65-74.
7.Tajeddine N.How do reactive oxygen species and calcium trigger mitochondrial membrane permeabilisation?[J].Biochimica et Biophysica Acta,2016,1860(6):1079-1088.
8.Mittova V,Tal M,Mvolokita M,et al.Salt stress induces up-regulation of an effect chloroplast antioxidant system in the salt-toler wild tomato speciesLycopersiconpennelliibut not in the cultivated species[J].Physiologia Plantarum,2002,115(3):393-400.
9.Mittler R,Vanderauwera S,Gollery M,et al.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9(10):490-498.
10.Singh S,Anjum Na,Khan Na,et al.Metal-binding peptides and anti-oxidant defence system in plants:significance in cadmium tolerance[M].//Khan,Singh S.Abiotic Stress and Plant Responses.New Delhi:IK International,2008:159-189.
11.王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
Wang J,Li D Q.The accumulation of Plant osmoticum and activated oxygen metabolism under stress[J].Chinese Bulletin of Botany,2001,18(4):459-465.
12.杨宁,王程亮,陈霞,等.干旱胁迫对高山离子芥试管苗抗氧化系统及其活性氧代谢的影响[J].西北植物学报,2014,34(12):2483-2490.
Yang N,Wang C L,Chen X,et al.Effect of drought stress on antioxidant system and reactive oxygen inChorisporabungeanaplantlets in vitro[J].Acta Bot.Boreal.-Occident.Sin,2014,34(12):2483-2490.
13.白慕群.高山离子芥低温诱导蛋白的鉴定和功能研究[D].兰州:兰州大学,2012.
Bai M Q.Identification and characterization of low temperature induced proteins inChorisporabungeana[J].Lanzhou:Lanzhou university,2012.
14.杨宁,丁芳霞,王程亮,等.低温胁迫对高山离子芥试管苗渗透调节物质及保护酶系的影响[J].四川大学学报:自然科学版,2014,51(2):368-390.
Yang N,Ding F X,Wang C L,et al.Effect of low temperature stress onosmotica and protective enzyme system in chorispora bunggeana plantlets in vitro[J].Journal of Sichuan University:Natural Science,2014,51(2):368-390.
15.Rajinder S.Leaf senescence,cor-related with increased levels of membrane permeability and lipid peroxidation,and decreased levels of superoxide,dismutase and catalase[J].Jonrnal of Experimental botany,1981,32(126):93-101.
16.Amako,Katsumi,Chen G X,et al.Separare assays specific for ascordate peroxidase and guaiacol peroxidase and for the chloroplastic and cytosolic isozymse of ascarbate peroxidase in plants[J].Plants & Cell Physiology,1994,35(3):497-504.
17.李仕飞,刘世同,周建平,等.分光光度法测定植物过氧化氢酶活性的研究[J].安徽农学通报,2007,13(2):72-73.
Li S F,Liu S T,Zhou J P,et al.Measuration of catalase vigor in plants with spectrophotometry[J].Anhui Agricultural Science Bulletin,2007,13(2):72-73.
18.李忠光,李江鸿,杜朝昆,等.在单一提取系统中同时测定五种植物抗氧化酶[J].云南师范大学学报,2002,22(6):44-48.
Li Z G,Li J H,Du C K,et al.Simultaneous measurement of five antioxidant enzyme activities using a single extraction system[J].Journal of Yunnan Normal University,2002,22(6):44-48.
19.郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社,2006.
Hao J J,Kang Z L,Yu Y.plant physiology Experimental technology [M].Beijing:Chemical industry Press,2006.
20.张宪政.植物生理学实验技术[M].沈阳:辽宁科技出版社,1989.
Zhang X Z.plant physiology Experimental technology [M].Shenyang:Liaoning science and technology publishing house,1989.
21.杨颖丽,杨宁,王莱,等.盐胁迫对小麦幼苗生理指标的影响[J].兰州大学学报:自然科学版,2007,43(2):29-34.
Yang Y L,Yang N,Wang L,et al.Effect of salinity on the physiological characteristics in two wheat cultivars[J].Journal of Lanzhou University:Natural Science,2007,43(2):29-34.
22.Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water stress studies[J].Plant and Soil,1973,39(1):205-207.
23.李璇,岳红,王升,等.影响植物抗氧化酶活性的因素及其研究热点和现状[J].中国中药杂志,2013,38(7):973-978.
Li X,Yue H,Wang S,et al.Research of different effects on activity of plant antioxidant enzymes[J].China Journal of Chinese Material Medica,2013,38(7):973-978.
24.李泽琴,李静晓,张根发.植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J].遗传,2013,35(1):45-54.
Li Z Q,Li J X,Zhang G F.Expression regulation of plant ascorbate peroxidase and its tolerance to abiotic stresses[J].Hereditas,2013,35(1):45-54.
25.李雪梅,陈强,王兰兰,等.脱落酸对小麦幼苗光合及抗氧化酶的影响[J].沈阳师范大学学报:自然科学版,2006,24(2:):221-223.
Li X M,Chen Q,Wang L L,et al.Effects of abscisic acid on photosynthesis and antioxidant enzymes in wheat seedling[J].Journal of S henyang Normal University:Natural Science,2006,24(2):221-113.
26.黄杏,梁勇生,杨丽涛,等.低温胁迫下脱落酸及合成抑制剂对甘蔗幼苗抗氧化系统的影响[J].华南农业大学学报,2013,34(3):356-361.
Huang X,Liang Y S,Yang L T,et al.Effects of abscisic acid and its biosynthesis inhibitor on the activities of antioxidant system of sugarcanes treated by cold stress[J].Journal of South China agricultural university,2013,34(3):356-361.
27.罗立津,徐福乐,翁华钦,等.脱落酸对甜椒幼苗抗寒性的诱导效应极其机理研究[J].西北植物学报,2011,31(1):94-100.
Luo L J,Xu F L,Weng H Q,et al.Inducing effects and its biological mechanisms of ABA on the chilling resistance of sweet pepper seedlings[J].Acta Bot.Boreal.-Occident.Sin,2011,31(1):94-100.
28.刘祖祺,张石城.植物抗性生理学[M].北京:中国农业出版社,1994.
Liu Z Q,Zhang S C.Plant resistance physiology[M].Beijing:China Agriculture Press,1994.
29.Chen T H H,Gusta L V.Abscisic acid-induced freezing resistance in cultured plant cells[J].Plant Physiology,1983,73(1):71-5.
30.罗焕亮,徐位力,李建忠,等.马占相思对低温胁迫适应性的研究[J].华南农业大学学报:自然科学版,2002,23(2):51-53.
Luo H L,Xu W L,Li J Z,et al.Study on the acceptation of acacia mangium to low temperature stress[J].Journal of South China Agricultural University:Natural Science Edition,2002,23(2):51-53.
31.Kishor P B K,Sangam S,Amrntha R,et al.Regulation of proline biosynthesis,degradation,uptake and transport in higher plants:Its impli-cations in plant growth and abiotic stress tolerance[J].Current Science,2004,65(8):2145-2156.
32.邵红雨,孔广超,齐军仓,等.植物耐盐生理生化特性的研究进展[J].安徽农学通报,2006,12(9):51-53.
Shao H Y,Kong G C,Qi J C,et al.Advances in research on physiological and characteristics of salt tolerance in plant[J].Anhui Agricultural Science Bulletin,2006,22(9):51-53.
33.汤章成.现代植物生理学实验指南[M].北京:科学出版社,2004.
Tang Z C.Guide of modern plant physiology experiment[M].Beijing:Science Press,2004.
34.Schaff T,Levin L,Blair N,et al.Spatial heterogeneity of benthos on the Carolina continental slope:large(100k) scalbnvv b e variation[J].Marine Ecology progress,1992,88(2-3):143-160.
35.孙庆玲,李培英,孙宗玖,等.外施脱落酸对不同抗寒性狗牙根品种的渗透调节物质响应研究[J].新疆农业大学学报,2012,35(2):87-92.
Sun Q L,Li P Y,Sun Z J,et al.studies on re sponse of spraying exogenous ABA to osmotic adjustment substance of bermudagrass varieties with different cold resistan ce[J].Journal of Xinjiang Agricultural University,2012,35(2):87-92.
36.李冬梅,韩小强,于俊华,等.外源脱落酸缓解低温胁迫研究进展[J].现代农药,2016,15(4):1-5.
Li D M,Han X Q,Yu J H,et al.Research advances in chilling resistance of exogenous abscisic acid[J].Modern Agrochemicals,2016,15(4):1-5.
Supported by National Natural Science Foundation of China(31360061,31660116)
introduction:HE Wen-Ping(1987—),male,Master,mainly engages in research of plant cell signal transduction.
date:2016-09-06
ExogenousABAAffectedonAntioxidantEnzymesandOsmoticAdjustmentinChorasporabungeanaUnderLowTemperatureStress
HE Wen-Ping WANG Xin-Xia ZHANG Xu-Qiang YANG Peng-Jun QIU Yi-Zhi YANG Ning*
(College of Life Sciences,Northwest Normal University,Lanzhou 730070)
Using plantlets ofChorasporabungeanaas material, researched the effect of exogenous ABA on antioxidant enzyme and osmotic regulation substances under chilling(4℃), freezing(-4℃) and critical temperature(0℃) were studied. The results showed the activities of SOD and CAT in negative control group were higher than blank control group under 4℃ and -4℃. In negative control group the POD activity was higher than blank control group under 4℃. The APX activity increased at the late period of 4℃ and -4℃ treatment in negative control group. Meanwhile the relative conductivity increased but proline and soluble sugar decreased in negative control group. At 0℃, in negative control group the POD activity decreased and the APX activity changed with fluctuation. The content of proline and soluble sugar was higher than blank control group at 72 h and 48h respectively and soluble protein was lower than blank control group under 0℃. Exogenous ABA treatment, increased the antioxidant enzymes activities with different extent under low temperature stress. For the osmotic regulation substances, exogenous ABA treatment decreased the relative conductivity and increased the content of proline, soluble sugar and soluble protein.
low temperature stress;Chorasporabungeana;abscisic acid;antioxidant enzymes;osmotic regulation substances
国家自然科学基金(31360061、31660116)
何文平(1987—),男,硕士研究生,主要从事植物细胞信号转导方面的研究。
* 通信作者:E-mail:xbsd-yn@163.com
2016-09-06
* Corresponding author:E-mail:xbsd-yn@163.com
Q949.748.3
A
10.7525/j.issn.1673-5102.2016.06.010

