负载纳米银EVA复合发泡材料的制备及其抗菌性能
郑辉东,邱洪峰,郑玉婴,刘 艺,连汉青,陈志杰
(1 福州大学 石油化工学院, 福州 350108;2 福州大学 材料科学与工程学院, 福州 350108)
负载纳米银EVA复合发泡材料的制备及其抗菌性能
郑辉东1,邱洪峰2,郑玉婴2,刘艺2,连汉青2,陈志杰2
(1 福州大学 石油化工学院, 福州 350108;2 福州大学 材料科学与工程学院, 福州 350108)
采用原位还原法在EVA复合发泡材料表面负载银纳米颗粒,制备具有抗菌性能的负载纳米银EVA复合发泡材料,通过场发射扫描电镜、X射线光电子能谱、电感耦合等离子体发射光谱以及X射线衍射等表征其形貌及结构,并分别采用热失重和抗菌实验对所制备复合发泡材料的热稳定性和抗菌性进行评价。结果表明:EVA复合发泡材料表面均匀分布的颗粒状物质为单质银,其直径约为20nm;负载纳米银后EVA复合发泡材料在600℃时残炭率提高到3.22%;抗菌实验分析表明样品具有良好的抗菌持久性,在洗涤50次后对大肠杆菌、金黄色葡萄球菌抗菌率分别可达到98%和99%以上。
EVA;纳米银;复合发泡材料;原位还原;抗菌性能
乙烯-醋酸乙烯酯共聚物(EVA)具有良好的成型加工性、柔软性、发泡后质量轻、力学性能良好、耐绕曲等优异性能,其复合发泡材料被广泛应用于包装、防护套、鞋材等材料中[1-3]。随着人们对环境安全以及抗菌卫生等方面给予的高度重视,同时为了进一步拓宽EVA复合发泡材料的应用领域,因此其抗菌性能的研究具有重要的现实意义和应用价值。
抗菌剂作为一种功能性添加剂,被广泛应用于塑料工业当中[4-6]。抗菌剂种类繁多,可分为无机抗菌剂和有机抗菌剂。无机抗菌剂安全性高、耐热性能好、不产生抗药性,但是具有抗菌迟效性,价格高昂等缺点[7-9];有机抗菌剂杀菌能力强、价格相对低廉、容易加工,但是耐热性较差、抗菌持久性较差、细菌容易产生耐药性[10]。而银作为一种无机粒子,当与细菌接触时能够破坏细菌结构[11],产生抑菌或杀菌效果,因此被广泛应用在抗菌工业上。但是传统工艺生产的银粒子容易团聚、比表面积降低、抗菌性能下降,严重影响了材料的使用性能[12]。有相关研究[13,14]表明,由于纳米化作用,银粒子的比表面积迅速增加,能够更好地接触微生物从而提高材料的抗菌性能。
因此,为了使银粒子能够以纳米级均匀分散在EVA复合发泡材料表面,本工作采用原位还原法,先在材料表面用多巴胺原位聚合生成一层聚多巴胺薄膜,利用聚多巴胺的还原性将硝酸银原位还原生成纳米级银粒子,从而得到负载纳米银EVA复合发泡材料(如图1所示),并对其形貌及结构、热稳定性和抗菌性能进行研究。

图1 原位还原法制备负载纳米银EVA复合发泡材料示意图Fig.1 Preparation of EVA composite foams supported by nano-silver through in-situ reduction method
1 实验
1.1实验原料
EVA复合发泡材料:自制;盐酸多巴胺、三羟甲基氨基甲烷:分析纯,阿拉丁试剂有限公司;乙酸:分析纯,国药集团化学试剂有限公司;硝酸银:分析纯,国药集团化学试剂有限公司。
1.2试样制备
为去除表面杂质,称取一定质量的EVA复合发泡材料,浸渍于蒸馏水中超声振荡10min,用蒸馏水多次冲洗后60℃烘干6h,备用。
(1)负载多巴胺
称取一定质量的三羟甲基氨基甲烷,溶于一定量的去离子水和乙醇中,配制成一定浓度的缓冲溶液,然后将精确称取的盐酸多巴胺溶于缓冲溶液中,迅速用乙酸调节溶液pH值至8.5,制成盐酸多巴胺缓冲溶液;将一定质量的EVA复合发泡材料浸渍于盐酸多巴胺溶于缓冲溶液中,25℃振荡反应24h,反应结束后用蒸馏水多次振荡洗涤除去残余物,60℃烘干6h得到负载多巴胺EVA复合发泡材料。
(2)负载纳米银
称取一定质量的硝酸银颗粒配置成各种浓度硝酸银溶液,将负载多巴胺EVA复合发泡材料浸渍于硝酸银溶液中,25℃下避光反应12h,反应结束后用蒸馏水多次洗涤后至溶液变澄清,60℃烘干6h得到负载纳米银EVA复合发泡材料。
1.3测试表征
采用SUPRA 55型场发射扫描电子显微镜和XSERIES 2型X射线能谱仪,对复合泡沫材料断面进行FESEM和EDS分析,试样表面喷金处理,加速电压10kV。
采用ESCALAB 250型X射线光电子能谱对复合泡沫材料表面进行XPS分析,圆薄片状试样,Al/Mg双阳极靶,0.6eV能量分辨率,空间分辨率<3μm,元素检测限为0.1%(原子分数)。
采用电感耦合等离子体发射光谱(ICP)测定复合发泡材料中银含量,ICP源采用固体晶体稳频RF发生器,频率为27.12MHz。
采用Ultima III型多晶X射线衍射仪进行XRD测定,Cu靶,管电压为40kV,管电流为40mA,扫描范围2θ=2°~80°,扫描速率8(°)/min。
采用SDT Q600型同步热分析仪进行TG分析,温度范围25~600℃,升温速率10℃/min,N2氛围。
抗菌实验:参照GB/T 12490—1990对复合发泡材料进行洗涤,依据QB/T 2881—2013中的菌液吸收法测定复合发泡材料的抗菌率,菌株为革兰氏阴性大肠杆菌(ATCC 6538)和革兰氏阳性金黄色葡萄球菌(ATCC 8099),均由福建省纤维检验局鞋类检验部提供。实验时将菌株接种在营养琼脂培养基(5.0g牛肉膏、10.0g蛋白胨、5.0g氯化钠、15.0g琼脂以及1000mL无菌蒸馏水)上,对菌液稀释至(2.5~10.0)×108cfu/mL作为实验所用的菌悬液。将已灭菌的待测样品放入灭菌的培养皿中,用移液枪准确移取0.9~1.1mL菌悬液进行接种,样品移入无菌广口瓶并固定于振荡摇床,在29~31℃以200r/min振荡1min后移取0.9~1.1mL经磷酸盐缓冲液稀释作为参照样液;类似的,在36~38℃以200r/min振荡培养24h后移取0.9~1.1mL经磷酸盐缓冲液稀释作为实验样液。用菌落计数器记录稀释倍数并算出相应的菌落数量,选取菌落数为30~300cfu之间、无蔓延菌落生长情况的平板计数菌落总数,每个稀释度的菌落数应该使用两个平板计数的平均值。复合发泡材料的抗菌率计算式如下:
(1)
式中:R为抗菌率,%;A为参照样液活菌数的平均值,cfu/mL;B为实验样液活菌数的平均值,cfu/mL。
2 结果与讨论
2.1硝酸银浓度对复合发泡材料银含量影响
图2为不同硝酸银浓度对复合发泡材料含银量的影响。从总体趋势来看,复合发泡材料含银量随着硝酸银浓度增加而增加。当硝酸银浓度较低时,复合发泡材料含银量随浓度升高迅速增加,当达到一定浓度后,含银量随硝酸银浓度升高增长缓慢。这可能是由于当硝酸银浓度较低时,银离子被还原成银单质后,由于聚多巴胺薄膜的良好黏附性,使得银单质被牢固地吸附在聚多巴胺薄膜表面,因此含银量随浓度升高迅速增加。当硝酸银浓度升高后,在聚多巴胺薄膜表面还原的银单质含量增加,由于聚多巴胺薄膜表面积不变,则聚多巴胺薄膜对银单质的吸附量有限,从而导致复合发泡材料含银量随硝酸银浓度升高增长缓慢。

图2 硝酸银浓度对复合发泡材料银含量影响Fig.2 The influence of the concentration of AgNO3 on the content of silver in the composite foams
2.2形貌及结构
2.2.1FESEM及EDS分析
图3为EVA复合发泡材料未负载以及负载多巴胺、纳米银时的断面扫描电镜图。如图3(a)所示,未负载的EVA复合发泡材料表面较为光滑,没有任何裂纹存在。从图3(b)可以看出,经多巴胺改性后EVA复合发泡材料表面形成一层均匀薄膜,薄膜在反应和干燥过程中由于收缩作用产生很多细小裂纹,此时裂纹的存在有利于多巴胺与硝酸银反应生成纳米银以及材料掳获银单质。由图3(c)可见,经过硝酸银处理后纳米银单质在EVA复合发泡材料表面分布均匀,其直径在20nm左右。

图4 负载纳米银EVA复合发泡材料EDS谱图Fig.4 EDS spectrum of EVA composite foams supported by nano-silver
图4为负载纳米银EVA复合发泡材料的X射线能谱(EDS)。由EDS谱可以清楚看到,材料表面出现了C,O,Ag 3种元素峰,其中C,O主要来自EVA材料,而Ag则是材料表面多巴胺和硝酸银所反应生成的,这有利于提高EVA复合发泡材料的抗菌性能。
2.2.2XPS分析
采用X射线光电子能谱(XPS)对EVA复合发泡材料表面进一步分析,图5为未负载以及负载多巴胺、纳米银EVA复合发泡材料的XPS谱图,表1则是EVA复合发泡材料表面元素成分。
如图5(a)中曲线1所示,未负载EVA复合发泡材料存在C1s和O1s两个峰值,并没有出现N1s峰,而曲线2显示负载多巴胺EVA复合发泡材料在399.66 eV结合能处出现了一个弱N1s峰值,表明材料表面元素成分发生了变化。结合表1可知,在负载多巴胺EVA复合发泡材料中出现了N元素,这是由材料表面负载的多巴胺分子中存在的氨基所引起。
由图5(b)可见,负载纳米银EVA复合发泡材料在结合能368.4eV处出现了一个较强的Ag3d峰,而文献[15]中银单质的结合能峰值为368.2eV,两者基本一致;图5(c)中显示Ag3d3/2和Ag3d5/2结合能峰值相差6eV,与银单质标准样一致[16-18],表明EVA复合发泡材料表面所负载的纳米银是以单质形式存在的。

图5 未负载以及负载多巴胺(a)、纳米银(b),(c)EVA复合发泡材料XPS谱图Fig.5 XPS of EVA composite foams supported by nothing,dopamine(a) and nano-silver(b),(c)表1 EVA复合发泡材料表面元素成分(原子分数/%)Table 1 Surface composition of EVA composite foams(atom fraction/%)

MaterialCONAgEVAcompositefoamssupportedbynothing90.379.6300EVAcompositefoamssupportedbydopamine77.8917.514.60EVAcompositefoamssupportedbynano-silver76.8217.194.251.74
2.2.3XRD分析
图6为负载纳米银、多巴胺EVA复合发泡材料X射线衍射谱图。如图6所示,2θ=22°左右出现的较宽且强衍射峰为EVA分子链中PE链段典型的衍射结晶峰。比较图6中曲线a和b,两者衍射峰差别不大,但是EVA复合发泡材料负载纳米银后(曲线a)在2θ=38.1°出现了强度较弱的Ag(111)晶面的衍射峰[19],表明负载纳米银EVA复合发泡材料中形成了粒径较小的纳米银晶体。这与FESEM,EDS以及XPS分析结果相符合。

图6 负载纳米银(a)、多巴胺(b)EVA复合发泡材料XRD谱图Fig.6 XRD of EVA composite foams supported by nano-silver(a) and dopamine(b)
2.3TG分析
图7为未负载EVA复合发泡材料以及负载纳米银EVA复合发泡材料热失重曲线。如图7所示,EVA复合发泡材料负载纳米银后热分解趋势没有改变,但起始热分解温度(T5%)降低了15.6℃,约为287.8℃,这是由于EVA复合发泡材料表面的多巴胺热分解造成的。负载纳米银EVA复合发泡材料在600℃时热分解残炭率可达到3.22%,而未负载时只有0.82%,相比提高了2.4%,热分解完全后剩余物质为单质银[20],这说明了负载纳米银能够在一定程度上对EVA复合发泡材料成炭有促进作用。

图7 未负载及负载纳米银EVA复合发泡材料TG曲线Fig.7 TG curves of EVA composite foams supported by nothing and nano-silver
2.4抗菌性
图8,9分别为EVA复合发泡材料在大肠杆菌、金黄色葡萄球菌下的抗菌性能测试结果,表2则是负载纳米银EVA复合发泡材料的耐水持效抗菌率。
从图8,9可发现,在振荡培养24h后,未负载EVA复合发泡材料的菌落数下降幅度很小,表明材料不具有抗菌性能;负载多巴胺EVA复合发泡材料菌落数有一定程度的下降,说明材料具有一定的抗菌作用,其中对金黄色葡萄球菌的抑菌作用相对较好,这可能是因为多巴胺结构中所含有的儿茶酚和氨基具有一定程度抑菌作用;而负载纳米银EVA复合发泡材料菌落数下降程度显著,表明该材料具有良好的抗菌性能,这是由于负载纳米银具有良好的抑菌作用。
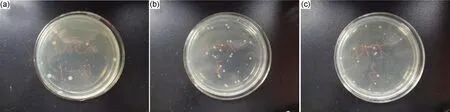
图8 未负载(a)以及负载多巴胺(b)、纳米银(c)EVA复合发泡材料在大肠杆菌下的抗菌性能测试Fig.8 Antibacterial performance test of EVA composite foams supported by nothing(a), dopamine(b) and nano-silver(c) under escherichia coli

图9 未负载(a)以及负载多巴胺(b)、纳米银(c)EVA复合发泡材料在金黄色葡萄球菌下的抗菌性能测试Fig.9 Antibacterial performance test of EVA composite foams supported by nothing (a), dopamine (b) and nano-silver (c) under staphylococcus aureus
从表2的测试结果可以看出:与未洗涤试样相比,试样洗涤20次、50次后对大肠杆菌和金黄色葡萄球菌的抗菌效果只是出现了轻微的下降,洗涤50次后负载纳米银EVA复合发泡材料对大肠杆菌和金黄色葡萄球菌的抗菌率分别达到98.0%和99.2%,因此,该材料具备良好的抗菌持久性。

表2 负载纳米银EVA复合发泡材料的耐水持效抗菌率Table 2 The water-tolerant antibacterial rate of EVA composite foams supported by nano-silver
3 结论
(1)均匀分布在EVA复合发泡材料表面的颗粒状物质为单质银粒子,其直径约为20nm。
(2)负载纳米银后EVA复合发泡材料残炭率提高了2.4%,表明负载纳米银可提高EVA复合发泡材料的热稳定性;负载纳米银后EVA复合发泡材料菌落数下降显著,洗涤50次后对大肠杆菌、金黄色葡萄球菌抗菌率可分别达到98.0%和99.2%。
[1]郑玉婴. 功能化氧化石墨烯纳米带/EVA复合材料薄膜的制备及表征[J]. 材料工程, 2015, 43(2): 96-102.
ZHENG Y Y. Preparation and characterization of functionalized graphene oxide nanoribbons/EVA composite films[J]. Journal of Materials Engineering, 2015, 43(2): 96-102.
[2]WANG B, WANG M H, XING Z, et al. Preparation of radiation crosslinked foams from low-density polyethylene/ethylene-vinyl acetate (LDPE/EVA) copolymer blend with a supercritical carbon dioxide approach[J]. Journal of Applied Polymer Science, 2013, 127(2): 912-918.
[3]MAITI M, JASRA R V, KUSUM S K, et al. Microcellular foam from ethylene vinyl acetate/polybutadiene rubber (EVA/BR) based thermoplastic elastomers for footwear applications[J]. Industrial & Engineering Chemistry Research, 2012, 51(32): 10607-10612.
[4]杨中文. 塑料用抗菌剂的研究进展[J]. 国外塑料, 2010, 28(9): 45-48.
YANG Z W. Research progress on antibacterial agent for plastic at home and abroad[J]. World Plastics, 2010, 28(9): 45-48.
[5]高党鸽, 陈琛, 吕斌, 等. 原位制备季铵盐聚合物/纳米ZnO复合抗菌剂[J]. 材料工程, 2015, 43(6): 38-45.
GAO D G, CHEN C, LYU B, et al. Synthesis polymer quaternary ammonium salt/nano-ZnO composite antibacterial agent via in-situ method[J]. Journal of Materials Engineering, 2015, 43(6): 38-45.
[6]CHERNOUSOVA S, EPPLE M. Silver as antibacterial agent: ion, nanoparticle, and metal[J]. Angewandte Chemie International Edition, 2013, 52(6): 1636-1653.
[7]LI T, ZHANG Y Y, SONG Z Y, et al. Preparation and characterization of antibacterial silver loaded montmorillonite under microwave irradiation[J]. Science and Engineering of Composite Materials, 2013, 20(1): 15-22.
[8]TSIAGGALI M A, ANDREADOU E G, HATZIDIMITRIOU A G, et al. Copper (I) halide complexes of N-methylbenzothiazole-2-thione: synthesis, structure, luminescence, antibacterial activity and interaction with DNA[J]. Journal of Inorganic Biochemistry, 2013, 121: 121-128.
[9]马威, 拓婷婷, 张淑芬. 抗菌剂研究进展[J]. 精细化工, 2012, 29(6): 521-525.
MA W, TUO T T, ZHANG S F. Research development of antibacterial agents[J]. Fine Chemicals, 2012, 29(6): 521-525.
[10]李淳, 孙蓉, 曾秋苑, 等. 有机高分子抗菌剂的制备及抗菌机理[J]. 高分子通报, 2011, (3): 79-85.
LI C, SUN R, ZENG Q Y, et al. Preparation and antimicrobial mechanism of organic polymeric biocides[J]. Polymer Bulletin, 2011, (3): 79-85.
[11]谢小保, 李文茹, 曾海燕, 等. 纳米银对大肠杆菌的抗菌作用及其机制[J]. 材料工程, 2008,(10): 106-109.
XIE X B, LI W R, ZENG H Y, et al. Activity and mechanism of silver nanoparticles on escherichia coli[J]. Journal of Materials Engineering, 2008,(10): 106-109.
[12]MAO H, WANG C, WANG K. Gelation performance of cationic gemini silica sol with inorganic salts and its antibacterial property analysis[J]. Journal of Dispersion Science and Technology, 2014, 35(9): 1208-1213.
[13]RAO R, SHILPA-CHAKRA C, RAO K V. Eco-friendly synthesis of silver nanoparticles using carica papaya extract for anti bacterial applications[J]. Advanced Materials Research, 2013, 629: 279-283.
[14]VIJAY-KUMAR P P N, PAMMI S V N, KOLLU P, et al. Green synthesis and characterization of silver nanoparticles using Boerhaavia diffusa plant extract and their anti bacterial activity[J]. Industrial Crops and Products, 2014, 52: 562-566.
[15]LEE H, LEE Y, STATZ A R, et al. Substrate-independent layer-by-layer assembly by using mussel-adhesive-inspired polymers[J]. Advanced Materials, 2008, 20(9): 1619-1623.
[16]HAN S W, KIM Y, KIM K. Dodecanethiol-derivatized Au/Ag bimetallic nanoparticles: TEM, UV/VIS, XPS,and FTIR analysis[J]. Journal of Colloid and Interface Science, 1998, 208(1): 272-278.
[17]WAGNER C D. Handbook of X-ray Photoelectron Spectroscopy: A Reference Book of Standard Data for Use in X-ray Photoelectron Spectroscopy[M]. Eden Prairie, MN:Perkin-Elmer Corp, Physical Electronics Division, 1979.
[18]AKHAVAN O, ABDOLAHAD M, ASADI R. Storage of Ag nanoparticles in pore-arrays of SU-8 matrix for antibacterial applications[J]. Journal of Physics D: Applied Physics, 2009, 42(13): 135416-135422.
[19]WANG H E, QIAN D. Synthesis and electrochemical properties of α-MnO2microspheres[J]. Materials Chemistry and Physics, 2008, 109(2-3): 399-403.
[20]黄雯, 王宇轩, 崔菲菲, 等. 化学法合成过氧化银及其电化学性能[J]. 电源技术研究与设计, 2013, 37(6): 993-996.
HUANG W, WANG Y X, CUI F F, et al. Electrochemical performance of chemically prepared AgO[J]. Chinese Journal of Power Sources, 2013, 37(6): 993-996.
Preparation and Antibacterial Property of EVA Composite Foams Supported by Nano-silver
ZHENG Hui-dong1,QIU Hong-feng2,ZHENG Yu-ying2,LIU Yi2,LIAN Han-qing2,CHEN Zhi-jie2
(1 School of Chemical Engineering,Fuzhou University,Fuzhou 350108,China;2 College of Materials Science and Engineering,Fuzhou University,Fuzhou 350108,China)
Throughin-situreduction method, Ag nanoparticles were loaded on the surfaces of EVA composite foams. A series of investigations, including field emission scanning electron microscopy, X-ray photoelectron spectroscopy and X-ray diffraction, were carried out to characterize the samples. Thermal stability and antibacterial properties of the products were evaluated by thermo gravimetric analysis and antibacterial test, respectively. Results show that nanoparticles, with an average particle size of 20nm, are elemental silver and decorated on the surface of EVA composite foams in uniform and regular stacks; after the presence of Ag nanoparticles, char yield of the products at 600℃ could increase to 3.22%; the samples have good persistent antibacterial effects and after 50 washing cycles, the antibacterial rate reaches above 98% and 99% against escherichia coli and staphylococcus aureus, respectively.
ethylene-vinyl acetate copolymer; nano-silver; composite foam;in-situreduction; antibacterial property
10.11868/j.issn.1001-4381.2016.07.018
TB332
A
1001-4381(2016)07-0107-06
福建省高校产学合作科技重大关键资助项目(2012H6008);福州市科技计划资助项目(2013-G-92)
2015-03-24;
2015-08-15
郑玉婴(1959-),女,教授,博士,研究方向:功能高分子复合材料,联系地址:福建省福州市闽侯县上街镇大学城学园路2号福州大学新校区材料科学与工程学院(350108),E-mail:yyzheng@fzu.edu.cn

