靶向血管内皮生长因子受体2超声分子成像在小鼠原位胶质瘤血管新生和边界识别中的应用
张海娴,李一鸣,汪晓虹,邵 洁,王 怡
复旦大学附属华山医院超声医学科,上海 200040
靶向血管内皮生长因子受体2超声分子成像在小鼠原位胶质瘤血管新生和边界识别中的应用
张海娴,李一鸣,汪晓虹,邵 洁,王 怡
复旦大学附属华山医院超声医学科,上海 200040
目的:探讨携带抗血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)单克隆抗体的超声微泡造影剂(microbubble,MB)在评价小鼠原位胶质瘤血管新生和边界识别中的作用。方法:以生物素-亲和素桥接法构建靶向微泡(MBv),体外鉴定其性质。建立小鼠GL261胶质瘤模型,分别注射MBv和普通微泡(MBc)进行超声造影检查。结果:成功构建偶联抗小鼠VEGFR2单克隆抗体的MBv,造影结果表明MBv较MBc能更好地评价小鼠胶质瘤血管新生和肿瘤边界。结论:MBv是良好的肿瘤靶向造影剂,应用MBv可较好地实现术中评价小鼠胶质瘤血管新生,更好地辅助术中超声导航。
血管内皮生长因子受体2;原位胶质瘤;超声
脑胶质瘤是最常见的中枢神经系统肿瘤,占全部颅内肿瘤的35.26%~60.96%[1]。随着神经外科学微创、精确理念的不断深入,如何最大限度地切除肿瘤同时又不损伤重要的神经功能成为当今手术医师的难题[2-4]。研究表明,实体肿瘤在生长与转移过程中均依赖新生血管形成,血管系统在肿瘤发生、发展过程中具有至关重要的作用[5]。由于肿瘤血管发育不成熟,内部存在缺氧微环境,从而刺激肿瘤内皮细胞处于持续高度增殖状态,诱导一系列特异性分子表达上调,包括血管内皮生长因子受体2 (vascular endothelial growth factor receptor 2,VEGFR2)[6-7]、整合素αvβ3 (αvβ3-integrin)[8]等。VEGF通过与VEGFR2结合,促进血管内皮细胞分裂、增殖,促使细胞浸润,诱导血管新生[9-11]。
本研究利用生物素-亲和素桥接方法,将抗VEGFR2抗体与生物素化的脂质微泡 (microbubble,MB)偶联构建靶向微泡 (MBv),利用VEGFR2靶向作用将微泡主动靶向至肿瘤新生血管,通过高频超声成像术中实时显示胶质瘤的血管新生,从而实现准确、便捷的术中胶质瘤切除实时导航技术。
1 资料和方法
1.1普通微泡(MBc)与MBv的制备
将一定比例的二硬脂酰磷酯酰胆碱(distearoyl phosphatidylcholine,DSPC)、二硬脂酰磷酯酰乙醇胺(distearoyl phosphoethanolamine,DSPE)-聚乙二醇2000 [poly(ethylene glycol) 2000,PEG 2000]和生物素酰化聚乙二醇2000修饰二硬脂酰磷酯酰乙醇胺(DSPEPEG2000-Biotin)溶解于三氯甲烷中,并在涡旋混合器上混匀。使用干燥的N2流除去溶剂使其在试管壁上形成一层均匀的薄膜,真空烘箱中干燥2 h以上。然后加入一定体积脱气的Tris缓冲溶液(含10%甘油和10%丙二醇,pH 7.4),得到一定浓度的磷脂溶液。加热磷脂溶液至其相转变温度(55~60 ℃)以上,并用水浴超声制成磷脂溶液,分装入2 mL西林瓶中(1 mL/瓶),将瓶中空气置换成全氟丙烷,机械震荡器震荡45 s获得生物素化的超声微泡。另以DSPE取代DSPE-PEG2000-Biotin,按实验室常规方法制备MBc造影剂作为对照。
1.2小鼠GL261胶质瘤模型的建立
C57小鼠,雄性,体重18~20 g,6~8周龄,由复旦大学上海医学院动物房提供。GL261小鼠胶质瘤细胞系由复旦大学附属华山医院神经外科研究所提供。复苏GL261细胞,选用DMEM培养基(含15%胎牛血清、100 U/mL青霉素及100 μg/mL链霉素),于37 ℃,5% CO2孵箱中培养,当细胞生长至90%融合时传代,用胰酶消化培养的细胞,制成1×108个/mL悬液备用。小鼠取俯卧位固定于立体定位仪上,术者用75%乙醇行穿刺点消毒,以前囟为原点,向右2 mm,向前1.3 mm,垂直进针3.5 mm,注射备好的细胞悬液2 μL。
1.3微泡体外黏附实验
将人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)在24孔板内培养过夜,将两种微泡分别与HUVEC孵育30 min后充分洗涤,在光镜下观察两种微泡的黏附。
1.4超声造影实验
麻醉并绑定动物,用Vevo 2100超声仪MS-250高频线阵探头,先行二维超声检查肿瘤,选择最大切面后转入超声分子成像模式。探头发射频率18 MHz,机械指数0.16,记录帧频41 Hz。行外科手术去除小鼠颅顶骨,暴露荷瘤大脑,完成一次造影后切除部分瘤体,再次进行造影。每只小鼠均经尾静脉先后注射MBv和MBc各6×107个。两种造影剂注射顺序随机,两次造影之间间隔1 h。从注入造影剂即刻起全程记录动态影像,直至造影剂廓清为止。所有声学造影图像自动保存,以备分析。
1.5造影图像分析
应用仪器自带的Vevo CQ软件进行图像分析,选择Target模式,仪器自动选择造影前及造影后的图像进行扣除并生成伪彩。
2 结 果
2.1MBc和MBv体外黏附实验
光镜下观察HUVEC周边偶有MBc黏附,平均值为(1.5±0.3)个(图1);而MBv在HUVEC周边大量黏附,平均值为(9.5±0.5)个(图2),差异有统计学意义(P<0.01)。
2.2肿瘤超声造影情况及图像分析
10只小鼠原位肿瘤模型均建模成功(图3)。在分子造影模式下,可见注入MBc或MBv即刻造影剂从肿瘤周围逐渐向中央部充填,直至整个瘤体明显增强。与MBc造影(图4)比较,MBv(图5)能更好地显示肿瘤组织的血管新生。挖除部分肿瘤后(图6),再次注入MBc或MBv,MBv(图7)仍较MBc(图8)能更好地显示肿瘤组织的血管新生。
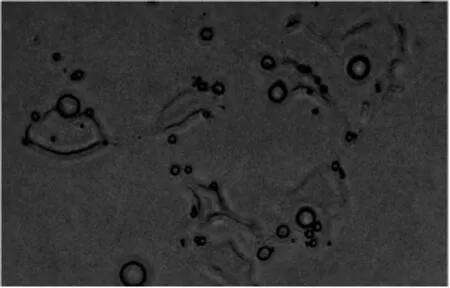
图1 普通微泡体外黏附HUVEC实验结果
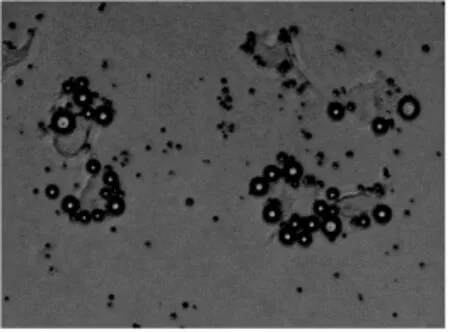
图2 VEGFR2靶向微泡体外黏附HUVEC实验结果
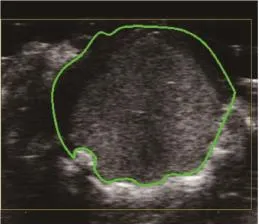
图3 小鼠GL261原位胶质瘤模型二维超声图
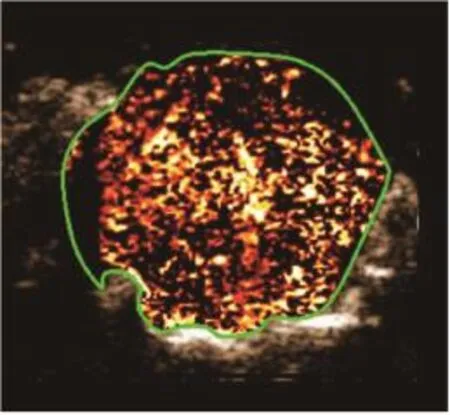
图4 肿瘤挖除前小鼠原位胶质瘤超声分子成像(一)
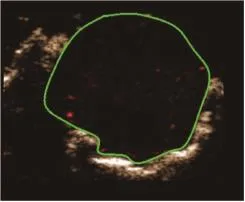
图5 肿瘤挖除前小鼠原位胶质瘤超声分子成像(二)
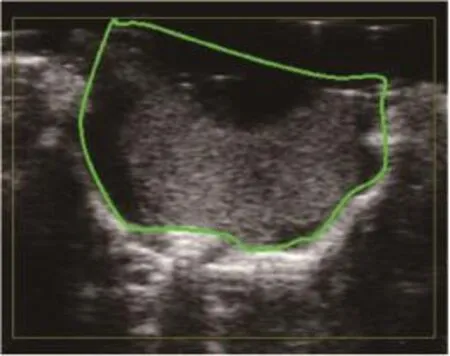
图6 肿瘤部分挖除后小鼠GL261原位胶质瘤二维超声图(一)
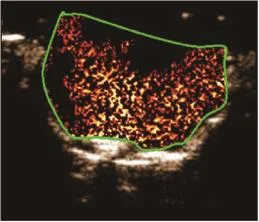
图7 肿瘤部分挖除后小鼠原位胶质瘤超声分子成像(二)
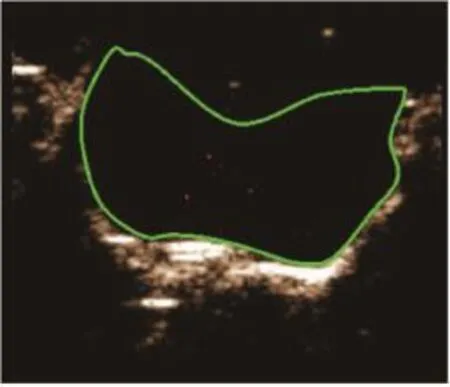
图8 肿瘤部分挖除后小鼠原位胶质瘤超声分子成像(三)
3 讨 论
超声分子影像学是应用超声影像学方法,将靶向超声造影剂注入体内,通过受体与配体结合特异性停留于靶组织,从而观察靶组织在组织、细胞及亚细胞水平的成像,反映病变组织在分子基础上的变化[12]。
实体肿瘤的生长均依赖新生血管生成,肿瘤内部的缺氧微环境致使肿瘤血管内皮细胞持续高特异性表达某些促生长受体,其中最重要之一为VEGFR2,而该受体在正常血管表达极低[5,8-9]。本研究采用生物素-亲和素桥接法构建了携带抗VEGFR2单克隆抗体的MBv,用体外黏附实验鉴定其性质,并结合超声造影检查评价活体肿瘤新生血管的情况。体外鉴定结果表明,本实验制备的生物素化微泡对亲和素具有很好的结合力。而通过生物素-亲和素桥接法构建的MBv,其所偶联的抗体在体外亦有很好的活性,可与相应二抗特异性结合。
体内实验中,肿瘤挖除前利用超声分子成像评价小鼠原位胶质瘤血管新生情况,显示胶质瘤的边界以引导胶质瘤切除,术中仍可再次进行靶向成像,不受术中水肿伪像或脑漂移的影响,可多次重复进行,良好地实现胶质瘤切除术中超声导航。
综上所述,本研究应用生物素-亲和素桥接法构建了MBv,可与新生血管内皮细胞表面的靶分子特异性结合,并产生显著的主动性靶向超声分子显像,为无创性评价组织内血管新生提供了一种新的方法,更好地实现了胶质瘤术中超声导航。
[1] SOLHEIM O, SELBEKK T, JAKOLA A S, et al. Ultrasound-guided operations in unselected highgrade gliomas-overall results, impact of image quality and patient selection [J]. Acta Neurochir (Wien), 2010,152(11): 1873-1886.
[2] LACROIX M, ABI-SAID D, FOURNEY D R, et al. A multivariate analysis of 416 patients with glioblastoma multiforme: prognosis, extent of resection, and survival [J]. J Neurosurg. 2001, 95(2): 190-198.
[3] SANAI N, POLLEY M Y, MCDERMOTT M W, et al. An extent of resection threshold for newly diagnosed glioblastomas [J]. J Neurosurg, 2011, 115(1): 3-8.
[4] MARKO N F, WEIL R J, SCHROEDER J L, et al. Extent of resection of glioblastoma revisited: personalized survival modeling facilitates more accurate survival prediction and supports a maximum-safe-resection approach to surgery [J]. J Clin Oncol, 2014, 32(8): 774-782.
[5] ABOU-ELKACEM L, BACHAWAL S V, WILLMANN J K. Ultrasound molecular imaging: Moving toward clinical translation [J]. Eur J Radiol, 2015, 84(9): 1685-1693.
[6] WANG H J, KANEKO O F, TIAN L, et al. Threedimensional ultrasound molecular imaging of angiogenesis in colon cancer using a clinical matrix array ultrasound transducer [J]. Invest Radiol, 2015, 50(5): 322-329.
[7] STREETER J E, GESSNER R C, TSURUTA J, et al. Assessment of molecular imaging of angiogenesis with three-dimensional ultrasonography [J]. Mol Imaging,2011, 10(6): 460-468.
[8] KORPANTY G, CARBON J G, GRAYBURN P A, et al. Monitoring response to anticancer therapy by targeting microbubbles to tumor vasculature [J]. Clin Cancer Res,2007, 13(1): 323-330.
[9] PYSZ M A, MACHTALER S B, SEELEY E S, et al. Vascular endothelial growth factor receptor type 2-targeted contrast-enhanced US of pancreatic cancer neovasculature in a genetically engineered mouse model: potential for earlier detection [J]. Radiology, 2015, 274(3): 790.
[10] WILLMANN J K, LUTZ A M, PAULMURUGAN R,et al. Dual-targeted contrast agent for US assessment of tumor angiogenesis in vivo [J]. Radiology, 2008, 248(3): 936-944.
[11] WILLMANN J K, PAULMURUGAN R, CHEN K, et al. US imaging of tumor angiogenesis with microbubbles targeted to vascular endothelial growth factor receptor type 2 in mice [J]. Radiology, 2008, 246(2): 508-518.
[12] DAYTON P A, RYCHAK J J. Molecular ultrasound imaging using microbubble contrast agents [J]. Front Biosci, 2007, 12: 5124-5142.
Application of vascular endothelial growth factor receptor 2-targeted ultrasound molecular imaging in intraoperative assessment of tumor angiogenesis and boundary identification in vivo
ZHANG Haixian, LI Yiming,WANG Xiaohong, SHAO Jie, WANG Yi (Department of Ultrasound, Huashan Hospital, Fudan University, Shanghai 200040, China)
Correspondence to: WANG Yi E-mail: Y_wang1111@hotmail.com
Objective: To develop and validate a targeted ultrasonographic (US) imaging agent with microbubbles (MBs)that binds to vascular endothelial growth factor receptor 2 (VEGFR2) in a murine model for tumor angiogenesis. Methods: Targeted US imaging agent was prepared by bridged avidin biotin through binding anti-VEGFR2 antibody to the shell of perfluorocarbonfilled MBs. The binding specificities of targeted MB (MBv) and with nonlabeled MB (MBc) were tested with VEGFR2-positive cells(human umbilical vein endothelial cells, HUVECs). In vivo imaging signals of contrast-enhanced US by using anti-VEGFR2-targeted MBv and MBc were quantified in 10 mice bearing GL261 cells. Results: Attachment of HUVECs was significantly higher for MBv(mean MBs per cell 9.5±0.5) than MBc (mean MBs per cell 1.5±0.3). The imaging signal in the murine tumor angiogenesis model was significantly higher for MBv than for MBc. Conclusion: Targeted contrast-enhanced US directed at VEGFR2 improves in vivo visualization of tumor angiogenesis and boundary identification in a murine model of orthotopic gliomas.
Vascular endothelial growth factor receptor 2; Orthotopic glioma; Ultrasound
R445.1
A
1008-617X(2016)03-0248-04
王怡 E-mail:Y_wang1111@hotmail.com
(2016-09-03)

