超声促释载紫杉醇纳米复合凝胶系统抑制大鼠C6胶质瘤细胞生长的实验研究
李一鸣,张海娴,汪晓虹,王意达,王 怡
复旦大学附属华山医院超声医学科,上海 200040
超声促释载紫杉醇纳米复合凝胶系统抑制大鼠C6胶质瘤细胞生长的实验研究
李一鸣,张海娴,汪晓虹,王意达,王 怡
复旦大学附属华山医院超声医学科,上海 200040
目的:探究载紫杉醇纳米复合凝胶系统及其结合超声辐照对C6胶质瘤细胞生长的抑制作用。方法:分为对照组、空白纳米复合凝胶组、游离紫杉醇组、载紫杉醇纳米复合凝胶组、超声辐照载紫杉醇纳米复合凝胶组,分别处理C6胶质瘤细胞,利用四唑盐(methyl thiazolyl tetrazolium,MTT)比色法检测C6细胞的相对生长率(relative growth rate,RGR),观察各组细胞生长情况。结果:对照组与空白纳米复合凝胶组比较RGR差异无统计学意义,含药物的游离紫杉醇组、载紫杉醇纳米复合凝胶组、超声辐照载紫杉醇纳米复合凝胶组均有明显的细胞增殖抑制作用(P<0.05)。与游离紫杉醇组比较,载紫杉醇纳米复合凝胶组RGR减低,差异有统计学意义(P<0.05),载紫杉醇纳米复合凝胶组与超声辐照载紫杉醇纳米复合凝胶组之间RGR差异有统计学意义(P<0.05)。结论:载紫杉醇纳米复合凝胶系统的制备材料具有良好的生物相容性,紫杉醇可明显抑制C6胶质瘤细胞生长。载紫杉醇纳米复合凝胶影响紫杉醇对细胞的生长抑制作用,具有缓释作用,超声辐照可促进载紫杉醇纳米复合凝胶内药物释放。
超声;纳米;凝胶;紫杉醇;胶质瘤
脑胶质瘤是最常见的原发性颅脑肿瘤,且恶性者居多,具有浸润性生长的特点,患者5年生存率<5%,手术切除后需联合放疗和化疗杀伤浸润性生长的残留肿瘤细胞[1]。因脑组织受血-脑屏障保护,传统化疗药不仅无法发挥抗胶质瘤作用,反而易引发系统毒性作用,致使脑胶质瘤的化疗受到极大限制[2]。本研究利用纳米生物技术,将紫杉醇(paclitaxel,PTX)制备成由纳米材料包裹修饰的载紫杉醇纳米复合凝胶系统,提高药物的生物稳定性和生物利用率,实现药物的缓释作用[3-4],从而使该载药纳米复合凝胶系统原位稳定聚集于胶质瘤组织周围,成功避开血脑屏障,在减低系统毒性的同时实现特异靶区持续性肿瘤杀伤作用[5]。此外,将超声作为一种触发条件促进载紫杉醇纳米复合凝胶内药物释放,可实现药物在一定程度上的无创控释[6-7]。
1 资料和方法
1.1细胞培养
大鼠C6脑胶质瘤细胞株由上海市肿瘤研究所赠予,用含10%灭活胎牛血清、100 U/mL 青霉素、100 µg/mL链霉素的DMEM细胞培养基,在5% CO2、37 ℃恒温培养箱中培养。待C6细胞处于对数生长期时,用0.25%胰蛋白酶消化,加入适量新鲜培养液制成单细胞悬液,调节细胞悬液密度至5×104个/mL,吸取单细胞悬液180 µL加至96孔细胞培养板,显微镜下观察细胞状态、分布情况、有无污染,并于培养箱中静置培养备用。
1.2载紫杉醇纳米复合凝胶系统的制备与特性
采用超声乳化法制备药物浓度为100 µg/mL的载紫杉醇纳米复合凝胶(PTX-NP-GEL)。设置紫杉醇:聚合物纳米材料多聚乙二醇(mPEG)-聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]投药比为5%,普朗尼克F68:二氯甲烷油水相体积比为10∶1,应用超声波乳化法制备载紫杉醇纳米粒溶液,强度400 W,脉冲超声2 s,15次/min,60次。将溶液充分乳化后,置于西林瓶内机械搅拌使有机溶剂充分挥发,即制成载紫杉醇纳米粒溶液。加入普朗尼克F127粉末后,将溶液置于冰浴中12 h,待充分溶解后搅拌均匀,制成20%载紫杉醇纳米复合凝胶系统[4,8]。用高效液相色谱法检测载紫杉醇纳米粒的包封率,Zetasizer Nano ZS90激光粒度仪检测载紫杉醇纳米粒的粒径和表面电位,转子法检测载紫杉醇纳米复合凝胶的胶凝时间与胶凝温度。同样方法制备无紫杉醇的纳米复合凝胶及药物浓度为100 µg/mL的游离紫杉醇溶液。
1.3超声辐照
选取日本伊藤公司US-750型低频超声波治疗仪。声波频率设为1 MHz,脉冲波占空比为30%,强度设为0.75 W/cm2,时间设为30 s。选取该超声波治疗仪L型探头,表面涂抹耦合剂后直接作用于96孔细胞培养板中载紫杉醇纳米复合凝胶系统[9]。
1.4超声辐照载紫杉醇纳米复合凝胶系统对C6胶质瘤细胞增殖的抑制作用
实验分组:对照组(CONTROL)、空白纳米复合凝胶组(BLANK-NP-GEL)、游离紫杉醇组(PTX)、载紫杉醇纳米复合凝胶组(PTX-NPGEL)、超声辐照载紫杉醇纳米复合凝胶组(PTXNP-GEL-US)。将96孔板划分为4×4个小孔组成的6大板块,每一板块作为一组实验单位。将上述各组溶液用培养液稀释30倍,取20 µL分别加入孔中。并按1.3条件对第5组进行超声辐照一次。分别于24、48、72 h进行四唑盐(methyl thiazolyl tetrazolium,MTT)比色,用酶联免疫检测仪检测各样品在490 nm处的吸光度(optical density,OD),按以下公式计算反映细胞存活情况的指标——细胞相对生长率(relative growth rate,RGR),分析各组实验干预条件对C6胶质瘤细胞增殖抑制作用。
RGR=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%
1.5统计学处理
2 结 果
2.1载紫杉醇纳米复合凝胶系统特性
应用超声乳化法成功制备药物浓度为100 µg/mL的载紫杉醇纳米复合凝胶系统,检测到载紫杉醇纳米粒包封率达86.5%,载紫杉醇纳米粒粒径为(204.2±84.4) nm,分散指数(polydispersition index,PDI)为0.15(图1)。转子法测试胶凝温度为(35.8±2.2) ℃,胶凝时间为(263±8) s。
2.2C6胶质瘤细胞增殖的抑制作用
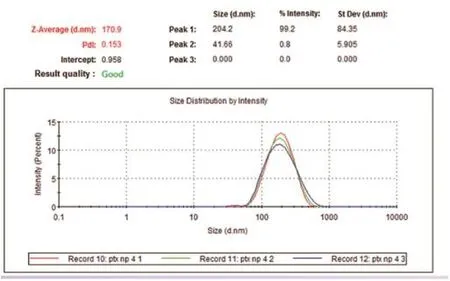
图1 载紫杉醇纳米复合凝胶系统粒径检测图

表1 各组别细胞RGR (%)统计结果
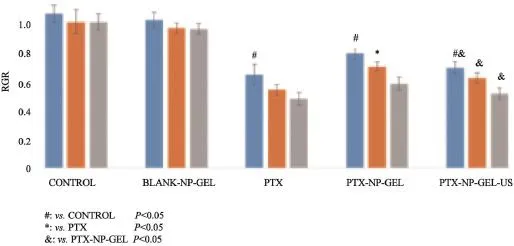
图2 各组别细胞相对生长率(%)统计条形图
各组RGR统计结果见表1、图2。首先比较各组内不同时间的RGR,可分为两类:一类为对照组、空白纳米复合凝胶组,表现为与对照组相比,空白纳米复合凝胶组中细胞RGR随时间延长未发生明显变化,表明细胞稳定生长;一类为游离紫杉醇组、载紫杉醇纳米复合凝胶组、超声辐照载紫杉醇纳米复合凝胶组,表现为随时间延长细胞RGR有逐渐降低趋势,表明细胞生长持续受到抑制。然后比较组间RGR,对照组与空白纳米复合凝胶组细胞RGR无显著差异,均为100%左右。游离紫杉醇组、载紫杉醇纳米复合凝胶组、超声辐照载紫杉醇纳米复合凝胶组细胞RGR比对照组显著减低,差异有统计学意义(P<0.05),RGR为60%~80%。此3组均加入紫杉醇,3组之间RGR也存在差异,其中游离紫杉醇组RGR减低最明显,24 h时RGR为64%,其次为超声辐照载紫杉醇纳米复合凝胶组,RGR为69%,最后为载紫杉醇纳米复合凝胶组,RGR为78%。表明纳米复合凝胶系统对药物的抑制效果产生明显影响,可降低紫杉醇对C6细胞的生长抑制作用;而在载紫杉醇纳米复合凝胶系统基础上结合超声辐照,药物所发挥的细胞生长抑制作用进一步增强。
3 讨 论
传统化疗存在药物溶解度小、生物稳定性差、生物利用率低、不良反应强等缺陷,严重限制了其在抗胶质瘤方面的应用[2]。通过纳米生物技术将抗肿瘤药物制备成载药纳米凝胶复合系统被广泛研究,该系统的优势主要表现在以下几方面:① 本研究制备的载紫杉醇纳米粒粒径为(204.2± 84.4) nm,PDI为0.15,载药纳米粒大小达纳米级别,且粒径均匀,可保证载药纳米粒的均一性。纳米级粒径可使药物在机体微小的空间发挥作用,跨过机体生理屏障或通过残缺的肿瘤血管渗入肿瘤内部,还可根据不同组织需求调节乳化条件从而调节粒径范围[5,10-13]。② 本研究制备的载紫杉醇纳米复合凝胶包封率达86.5%,胶凝温度为(35.8±2.2) ℃,胶凝时间为(263±8) s,高分子聚合物外壳可将抗肿瘤药暂时隔离,提高药物生物稳定性,减低其非特异细胞毒性,从而在实现药物靶区分布的同时减低系统毒性,使药物缓释,在靶区持续发挥作用,提高药物利用率及抗肿瘤疗效[11,14-15]。③ 载药纳米凝胶系统可由温度、压力、pH值、超声等条件触发释放其内部药物。超声波作用于载药纳米复合凝胶可产生空化效应,产生的能量激发生成的自由基断离聚合物连接键,使载药纳米复合凝胶系统释放其内包裹的药物[9]。本研究是将超声波作为体外触发条件来探究药物靶向局部促释。
应用细胞增殖抑制实验测定药物及其他处理方式对体外培养细胞的毒性,并测定细胞增殖情况与活性。应用MTT法处理各组细胞并检测OD值,计算细胞RGR,可反映细胞存活情况,进而反映载紫杉醇纳米复合系统及其在超声辐照后所起的作用。统计组内24、48、72 h时RGR差异发现,对照组与空白纳米复合凝胶组RGR随时间延长无明显差异,表明空白纳米复合凝胶组的细胞生长状态与对照组相仿,两组细胞均处于良好生长状态,纳米复合凝胶对细胞无杀伤作用;游离紫杉醇组、载紫杉醇纳米复合凝胶组、超声辐照载紫杉醇纳米复合凝胶组RGR随时间延长不断下降,差异有统计学意义(P<0.05)。此3组均加入药物紫杉醇,表明紫杉醇抑制细胞生长的作用是持续性的,且随时间延长越发明显。统计组间RGR差异发现,对照组与空白纳米复合组24、48、72 h的RGR均在95%以上,且两组间差异无统计学意义,表明制备纳米复合凝胶所采用的聚合物mPEG-PLGA及普朗尼克F68、F127对细胞无明显杀伤作用,两者有较好的生物相容性;包含药物的游离紫杉醇组、载紫杉醇纳米复合凝胶组、超声辐照载紫杉醇纳米复合凝胶组RGR在47%~78%之间,与对照组有显著统计学差异(P<0.05),表明C6细胞对紫杉醇敏感,紫杉醇可作为抗胶质瘤的化疗药;24、48、72 h时载紫杉醇纳米复合凝胶组与超声辐照载紫杉醇纳米复合凝胶组之间差异有统计学意义(P<0.05);3个时间段内游离紫杉醇对细胞的杀伤作用比载紫杉醇纳米复合凝胶强,表明载药纳米复合凝胶对药物的杀伤作用有影响,载药纳米凝胶对包裹其中的紫杉醇起暂时隔离作用,从而产生相应的缓释作用,故可应用该特征建立靶区特异性持久抗胶质瘤药物模型。在载紫杉醇纳米复合凝胶组基础上进行超声辐照,RGR有所下降,且载紫杉醇纳米复合凝胶组与超声辐照载紫杉醇纳米复合凝胶组24、48、72 h时RGR差异均有统计学意义(P<0.05),表明超声辐照增强了紫杉醇对细胞的生长抑制作用,超声促使载紫杉醇纳米凝胶内药物更快地释放,从而抑制细胞生长。
以上结果表明,C6胶质瘤细胞对紫杉醇敏感,紫杉醇对其杀伤作用明显,因此紫杉醇可作为一种抗胶质瘤的化疗药。制备载紫杉醇纳米复合凝胶系统的主要原料高分子聚合物mPEGPLGA及普朗尼克F127、F68对细胞无明显杀伤作用,有较好的生物相容性。载药纳米复合凝胶形式影响药物对细胞生长的抑制作用,与游离紫杉醇相比,载紫杉醇纳米复合凝胶具有较好的缓释作用,超声辐照能增强载紫杉醇纳米复合凝胶内药物释放速度,从而影响药物对细胞的生长抑制作用。因此,应用超声辐照载紫杉醇纳米复合凝胶系统抑制大鼠C6胶质瘤细胞,可实现药物缓释结合药物促释,为实现胶质瘤体外无创个体化治疗打下基础。
[1] RAIZER J, PARSA A. Current understanding and treatment of gliomas [M]. Springer International Publishing, 2015.
[2] ZIU M, KALKANIS S N, GILBERT M, et al. The role of initial chemotherapy for the treatment of adults with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline [J]. J Neurooncol, 2015, 125(3): 585-607.
[3] MALHI S, GU X. Nanocarrier-mediated drugs targeting cancer stem cells: an emerging delivery approach [J]. Expert Opin Drug Deliv, 2015, 12(7): 1177-1201.
[4] SHEN M, XU Y Y, SUN Y, et al. Preparation of a thermosensitive gel composed of a mPEG-PLGA-PLL-cRGD nanodrug delivery system for pancreatic tumor therapy [J]. ACS Appl Mater Interfaces, 2015, 7(37): 20530-20537.
[5] FORNAGUERA C, DOLS-PEREZ A, CALDERO G, et al. PLGA nanoparticles prepared by nano-emulsion templating using low-energy methods as efficient nanocarriers for drug delivery across the blood-brain barrier [J]. J Control Release, 2015, 211: 134-143.
[6] DERVISHI E, AUBRY J F, DELATTRE J Y, et al. Focused ultrasound therapy: current status and potential applications in neurosurgery [J]. Neurochirurgie, 2013,59(6): 201-209.
[7] MITRA A K, AGRAHARI V, MANDAL A, et al. Novel delivery approaches for cancer therapeutics [J]. J Control Release, 2015, 219: 248-268.
[8] XING L, SHI Q, ZHENG K, et al. Ultrasound-mediated microbubble destruction (UMMD) facilitates the delivery of CA19-9 targeted and paclitaxel loaded mPEG-PLGAPLL nanoparticles in pancreatic cancer [J]. Theranostics,2016, 6(10): 1573-1587.
[9] ASLUND A K, BERG S, HAK S, et al. Nanoparticle delivery to the brain-By focused ultrasound and selfassembled nanoparticle-stabilized microbubbles [J]. J Control Release, 2015, 220(Pt A): 287-294.
[10] BHATNAGAR S, VENUGANTI V V. Cancer targeting: responsive polymers for stimuli-sensitive drug delivery [J]. J Nanosci Nanotechnol, 2015, 15(3): 1925-1945.
[11] SADAT T M F, NEJATI-KOSHKI K, AKBARZADEH A, et al. PLGA-based nanoparticles as cancer drug delivery systems [J]. Asian Pac J Cancer Prev, 2014, 15(2): 517-535.
[12] WONG H L, WU X Y, BENDAYAN R. Nanotechnological advances for the delivery of CNS therapeutics [J]. Adv Drug Deliv Rev, 2012, 64(7): 686-700.
[13] AKASH M S, REHMAN K. Recent progress in biomedical applications of Pluronic (PF127): Pharmaceutical perspectives [J]. J Control Release, 2015,209: 120-138.
[14] CHEN Y, ZHANG W, HUANG Y, et al. Pluronicbased functional polymeric mixed micelles for co-delivery of doxorubicin and paclitaxel to multidrug resistant tumor[J]. Int J Pharm, 2015, 488(1-2): 44-58.
[15] DANHIER F, ANSORENA E, SILVA J M, et al. PLGA-based nanoparticles: an overview of biomedical applications [J]. J Control Release, 2012, 161(2): 505-522.
Paclitaxel-loaded nanoparticle gel system combined with ultrasonic irradiation inhibits growth of rat C6 glioma cells
LI Yiming, ZHANG Haixian, WANG Xiaohong, WANG Yida, WANG Yi (Department of Ultrasound, Huashan Hospital, Fudan University, Shanghai 200040, China)
Correspondence to: WANG Yi E-mail: y_wang1111@hotmail.com
Objective: To observe the inhibitory effects of paclitaxel (PTX)-loaded nanoparticle (NP) gel system combined with ultrasonic irradiation on the growth of C6 glioma cells. Methods: Five groups were set up: Control, BLANK-NP-GEL, PTX,PTX-NP-GEL and PTX-NP-GEL-US. They were administered to C6 glioma cells respectively. The relative growth rate (RGR) of cells was detected by methyl thiazolyl tetrazolium (MTT) method, and the inhibitory effects on the growth of C6 glioma cells were observed. Results: The nano materials had no obvious inhibitory effects on cell proliferation. Paclitaxel could obviously inhibit cell proliferation compared to control group (P<0.05). There were significant differences in RGR among PTX, PTX-NP-GEL and PTXNP-GEL-US groups (P<0.05). Conclusion: The selected nanoparticle gel system materials have fine biocompatibility. Paclitaxel can inhibit the growth of C6 glioma cells. The paclitaxel-loaded nanoparticle gel system has sustained release effect, and ultrasonic irradiation can promote drug release.
Ultrasound; Nano; Gel; Paclitaxel; Glioma
R445.1
A
1008-617X(2016)03-0243-05
王怡 E-mail:y_wang1111@hotmail.com
(2016-09-03)

