人RACK1基因的克隆及原核表达
王向飞,汤静珍,单金帅,刘畅,吴琛
(河北大学生命科学学院,河北保定 071002)
人RACK1基因的克隆及原核表达
王向飞,汤静珍,单金帅,刘畅,吴琛
(河北大学生命科学学院,河北保定 071002)
克隆人RACK1基因,构建原核表达载体pET-30a(+)-RACK1,诱导表达重组蛋白,纯化后Western blot鉴定目的蛋白.根据GeneBank提供的RACK1基因序列及pET-30a(+)载体上的多克隆位点设计引物,以人胎肝cDNA文库为模板,钓取RACK1 cDNA全长序列.将目的片段与原核表达载体pET-30a(+)连接,转入E.coliDH5α感受态细胞,筛选阳性克隆.将测序正确的重组质粒转入E.coliBL21 (DE3)细胞,IPTG诱导表达,利用镍柱对表达的蛋白进行纯化,Western blot法检测纯化的蛋白.结果显示,克隆得到的目的基因序列与GeneBank中已报道的序列完全一致,成功构建了pET-30a(+)-RACK1原核表达载体.重组蛋白主要以包涵体形式存在,经镍离子亲和层析柱纯化后,Western blot检测证实纯化的蛋白能与特异性的抗体发生反应.本研究获得了人RACK1蛋白,为深入研究RACK1的功能奠定基础.
人RACK1;基因克隆;原核表达;蛋白纯化
RACK1(receptor for activated C-kinase 1)蛋白由管家基因RACK1编码合成,它是一种高度保守的细胞内接头蛋白,属于Trp-Asp 40(WD-40)重复序列蛋白家族,并与G蛋白β亚基同源[1].WD-40重复序列蛋白在细胞信号转导、细胞周期调控、细胞骨架聚集等方面发挥重要的作用.RACK1中7个高度保守WD-40重复结构域可与细胞内一些具有特殊结构的蛋白相互作用,募集信号分子形成复合物,如RACK1可与PKC相互作用[2],激活PKC可以诱导RACK1与βIIPKC结合,以改变βIIPKC的细胞定位从而激活其活性[3].在βIIPKC的V5结构域存在RACK1特异性结合位点,该位点可选择性抑制βIIPKC,从而鉴定βIIPKC选择性功能[4].RACK1是Src酪氨酸激酶的一种重要底物,与Src酪氨酸激酶结合,参与Src功能的调节和细胞周期的调控[5].RACK1的WD7结构域与PCBP1相互作用,参与调节人MOR基因的表达[6],而激发或过表达MOR可促进多种细胞的增殖[7-9]及肿瘤细胞的生长[10-11].总之,RACK1通过参与多种信号转导,调控基因的合成和蛋白的表达,进而影响细胞免疫应答,细胞生长、分化、粘附和迁移等活动.
近些年来,越来越多的研究集中于RACK1在肿瘤发生发展中的作用.研究发现,RACK1在包括黑色素瘤[12]、乳腺癌[13]、肺癌[14]、口腔鳞状细胞癌[15-16]在内的多种肿瘤中表达上调,并与这些肿瘤的发生、转移和临床分期密切相关[16].RACK1通过与RhoA相互作用,激活RhoA/Rho激酶通路,促进乳腺癌细胞侵袭迁移[13];通过抑制Fem1b的表达促进结肠癌细胞的生成及增殖[17];通过Gli1介导激活Sonic Hedgehog(SHH)信号通路,促进非小细胞肺癌的致瘤性[18];通过促进MCM7蛋白磷酸化,促进肺癌细胞增殖[19].然而,另外一些研究得到了相反的结果.RACK1通过调节Src和生长因子诱导的E-cadherin内吞作用来维持肠上皮细胞结合稳定,促进上皮细胞的粘附,抑制侵袭[20];通过破坏β-Catenin复合体,对Wnt通路进行负调控,在胃癌中起肿瘤抑制作用[21];通过在细胞周期检测点调节Src活性,抑制结肠细胞的生长[22].
在前期工作中发现RACK1为人胃腺癌标志物Lgr5的候选相互作用蛋白,在本研究中,通过构建RACK1原核表达载体,诱导表达融合蛋白,纯化获得了重组蛋白纯品,并用Western blot方法加以鉴定,从而为进一步研究RACK1和Lgr5的相互作用关系,及其在胃癌发生发展中的作用机制奠定基础.
1 材料与方法
1.1实验材料
原核表达载体pET-30a(+)、感受态细胞E.coliDH5α 和E.coliBL21 (DE3)均由本实验室保存.Pyrobest DNA聚合酶、T4 DNA连接酶和限制性内切酶KpnI、XbaI均购自TaKaRa公司;质粒提取、胶回收试剂盒购自BIOMIGA公司;引物合成及DNA测序均由华大基因公司进行;6×His-Tagged Protein Purification Kit购自康为世纪公司;RACK1 Antibody rabbit polyclonal IgG、Goat anti-rabbit IgG-HRP 购自Santa Cruz Biotechnology公司.
1.2实验方法
1.2.1RACK1基因的PCR扩增
根据pET-30a(+)载体上的多克隆位点和已报道的RACK1基因序列(GenBank Accession number:NM 006098.4),利用Primer Premier 6.0引物设计软件,设计上下游分别含有KpnI和XbaI酶切位点、能特异性扩增RACK1基因编码区全长序列的引物.上游引物RACK1-F:5'- CGGGGTACCATGACTGAGCAGATGACCCTT-3'(下划线为KpnI 酶切位点,前3个为保护碱基);下游引物RACK1-R:5'- GCTCTAGATCACTAGCGTGTGCCAATGGTC-3' (下划线为XbaI酶切位点,前2个为保护碱基).
以胎肝cDNA文库为模板,扩增RACK1全长序列.PCR体系:胎肝文库cDNA模板0.5 μL,上下游引物(10 pmol/μL)各2 μL,dNTP Mixture (2.5 mmol/L each) 2 μL,10×Pyrobest buffer 5 μL,Pyrobest Taq DNA聚合酶 1 μL,加ddH2O至50 μL.PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸90 s,35个循环,72 ℃最后延伸7 min.PCR产物经15 g/L琼脂糖凝胶电泳分离后切胶回收.
1.2.2pET-30a(+)-RACK1原核表达载体的构建
用限制性内切酶KpnI和XbaI对回收后的PCR产物和pET-30a(+)载体分别进行双酶切,酶切的DNA片段和载体片段经15 g/L琼脂糖凝胶电泳分离后切胶回收.回收的DNA和载体片段经T4 DNA连接酶16 ℃连接过夜后,转入E.coliDH5α感受态细胞,挑取卡那霉素筛选的阳性克隆进行扩大培养,最后提取质粒进行双酶切鉴定,酶切鉴定正确的克隆送华大基因公司以通用引物进行全长测序,测序结果与GenBank中公布的序列比对分析,将构建成功的重组载体命名为pET-30a(+)-RACK1.
1.2.3RACK1蛋白的诱导表达
将pET-30a(+)-RACK1转入E.coliBL21 (DE3)感受态细胞,挑取pET-30a(+)-RACK1单菌落于3 mL LB液体选择培养基(卡那霉素质量浓度为120 μg/mL)中,37 ℃,200 r/min过夜培养.将60 μL上述过夜菌液接入6 mL新鲜LB液体选择培养基(卡那霉素质量浓度为120 μg/mL)中,37 ℃,200 r/min培养1.3 h至OD600为0.5~0.6.取出1 mL pET-30a(+)-RACK1诱导前全菌液于1.5 mL EP管中,冰上保存.剩余4 mL菌液加入IPTG(终质量浓度为100 μg/mL),37 ℃,220 r/min诱导2 h.取出1 mL pET-30a(+)-RACK1诱导后全菌液于1.5 mL EP管中,冰上保存.将剩余3 mL诱导后菌液12 000 r/min常温离心2 min,去上清液,收集菌体于1.5 mL EP管中,用400 μL PBS重悬诱导后菌体,超声破碎菌体.随后4 ℃,12 000 r/min离心2 min,分别收集上清和沉淀.同时将诱导前和诱导后的菌液12 000 r/min离心2 min,收集菌体,用50 μL PBS重悬诱导前、后各菌体和超声破碎后的沉淀,然后分别加入等体积上样Buffer,沸水中煮5 min,全部样品12 000 r/min离心2 min,进行120 g/L SDS-PAGE.并以pET-30a(+)诱导前和诱导后产物作对照.
1.2.4pET-30a(+)-RACK1融合蛋白的纯化
按照上述方法大规模诱导表达pET-30a(+)-RACK1融合蛋白,根据康为世纪公司的6×His-Tagged Protein Purification Kit亲和层析法纯化蛋白.5 000 r/min离心15 min,弃上清液后收集菌体.每50 mg pET-30a(+)-RACK1菌体(湿重)加入1 mL细菌裂解液(含1 μL 1 000 U/mL DNase I和2 μL 50 mg/mL溶菌酶),充分重悬,超声破碎.收集沉淀,用变性缓冲液(8 mol/L尿素,0.1 mol/L Na2HPO4, 10 mmol/L Tris-HCl, pH 8.0)重悬沉淀,充分混匀使包涵体溶解充分.4 ℃,12 000 r/min离心20 min,收集上清液,经0.22 μm滤膜过滤后负载上柱,以10倍柱体积/h的流速,收集流穿液.用15倍柱体积的Binding Buffer (8 mol/L尿素,0.5 mol/L NaCl,5 mmol/L咪唑,20 mmol/L Tris-HCl, pH 7.9),以1~2 mL/min的流速冲洗柱子来去除杂蛋白.用适量Elution Buffer(8 mol/L尿素,0.5 mol/L NaCl,500 mmol/L咪唑,20 mmol/L Tris-HCl, pH 7.9)洗脱蛋白,以1~2 mL/min的流速,收集洗脱峰.按照蛋白体积:复性缓冲液体积=1∶3加入超滤管中,4 ℃,5 000 r/min离心1 h,如此反复换液4次,达到蛋白复性的目的.复性处理过的蛋白进行120 g/L SDS-PAGE.
1.2.5Western blot鉴定表达产物的特异性
将纯化的目的蛋白经120 g/L SDS-PAGE分离后电转移至NC膜,50 g/L脱脂奶粉室温封闭1.5 h,以抗人RACK1兔源多克隆抗体(体积比1∶500稀释)为一抗,4 ℃孵育过夜,TBST洗膜3次,最后加入HRP标记的山羊抗兔二抗(体积比1∶5 000稀释),37 ℃孵育1 h,TBST洗膜3次,ECL显影.
2 结果与分析
2.1RACK1基因的PCR扩增
以胎肝cDNA文库为模板,钓取RACK1 cDNA全长序列,目的片段经15 g/L琼脂糖凝胶电泳鉴定,在951 bp左右有明显条带(图1),与预期大小相符.
2.2构建pET-30a(+)-RACK1原核表达载体
重组表达质粒pET-30a(+)-RACK1经KpnI和XbaI双酶切,15 g/L琼脂糖凝胶电泳鉴定,酶切得到约951 bp的片段(图2),与预期相符.测序结果正确,证实pET-30a(+)-RACK1表达载体构建成功.
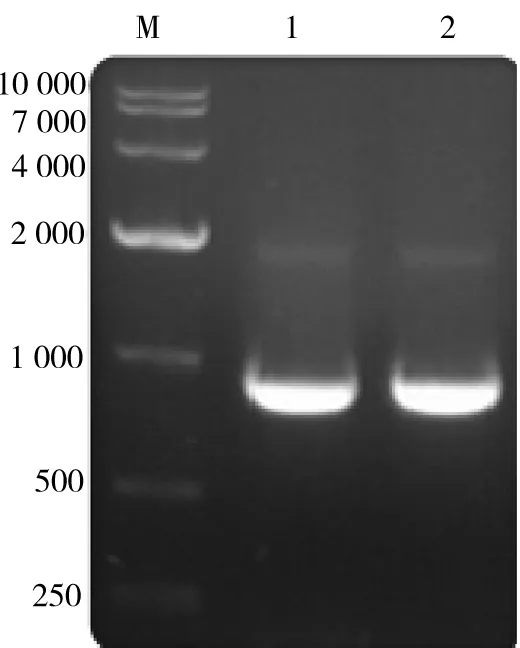
M.DNA Marker(bp);1,2.RACK1基因PCR产物.图1 RACK1基因PCR产物的琼脂糖凝胶电泳结果Fig.1 Analysis of RACK1 PCR product by agarose gel electrophoresis

M.DNA Marker(bp); 1.pET-30a(+)-RACK1 Kpn I/Xba I双酶切产物.图2 重组质粒pET-30a(+)-RACK1双酶切鉴定Fig.2 Digestion of pET-30a(+)-RACK1 vector by Kpn I and Xba I
2.3pET-30a(+)-RACK1原核表达载体的诱导表达
重组表达质粒pET-30a(+)-RACK1和空载体pET-30a(+)分别转化E.coliBL21 (DE3),经100 μg/mL IPTG诱导2 h后,进行120 g/L SDS-PAGE电泳,在诱导沉淀中可见1条相对分子质量约为36 ku的明显诱导表达带(Lane4),而上清液未见明显诱导条带(Lane3),如图3所示,说明目的蛋白在大肠杆菌中以包涵体形式表达.
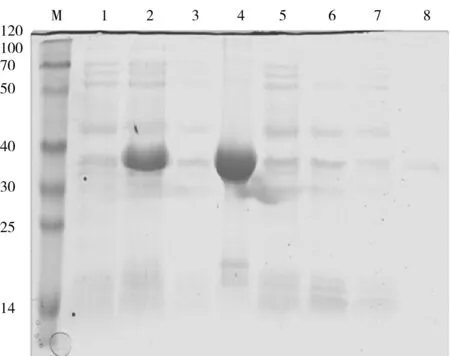
M.蛋白Maker(ku);1.诱导前的pET-30a(+)-RACK1全菌蛋白;2.诱导后的pET-30a(+)-RACK1全菌蛋白;3.诱导后的pET-30a(+)-RACK1上清蛋白;4.诱导后的pET-30a(+)-RACK1沉淀蛋白;5.诱导前的pET-30a(+)空载体全菌蛋白;6.诱导后的pET-30a(+)空载体全菌蛋白;7.诱导后的pET-30a(+)空载体上清蛋白;8.诱导后的pET-30a(+)空载体沉淀蛋白.图3 SDS-PAGE电泳检测RACK1蛋白诱导表达产物Fig.3 Analysis of RACK1 protein expression in E.coli BL21 (DE3) by SDS-PAGE
2.4RACK1融合蛋白的纯化及鉴定
IPTG大量诱导表达pET-30a(+)-RACK1融合蛋白,用6×His-Tagged Protein Purification Kit纯化包涵体蛋白,获得了较高纯度的与预期分子质量一致的His-RACK1融合蛋白(图4).
2.5Western blot鉴定RACK1蛋白
以抗人RACK1兔源多克隆抗体为一抗,HRP标记的山羊抗兔为二抗,进行Western blot鉴定.检测到与预期分子质量大小一致的特异性条带(图5),可见纯化后的融合蛋白具有与特异性抗体结合的能力.
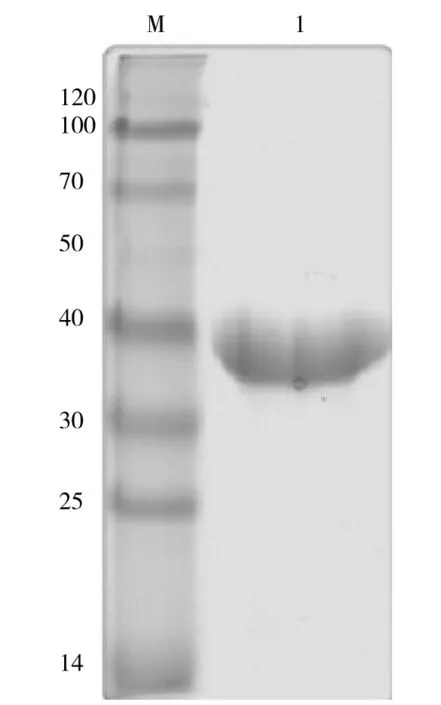
M.蛋白Maker(ku);1.纯化后的目的蛋白.图4 His-RACK1蛋白的纯化结果Fig.4 Purification analysis of target protein by SDS-PAGE

1,2.纯化后RACK1蛋白.图5 Western blot鉴定纯化后RACK1蛋白的特异性Fig.5 Identification of RACK1 protein by Western blot
3 讨论
1991年,RACK1作为蛋白激酶C的胞内受体而被首次发现[2],关于RACK1的研究逐渐增多.RACK1全长951 bp,含有8个外显子和7个内含子,基因定位在染色体5q35.3.看家基因RACK1编码合成RACK1蛋白.RACK1含有317个氨基酸,分子质量为36 ku,是一种高度保守的接头蛋白,细胞质内游离的Gβ样支架蛋白.RACK1可作为潜在的肿瘤标志物,在乳腺癌、结肠癌、肺癌、黑色素瘤、口腔鳞状细胞癌、卵巢癌肝癌、胃癌和前列腺癌中,RACK1表达发生明显变化.RACK1作为框架分子、接头分子和锚定分子,通常募集多种信号分子,形成复合物,参与活性分子胞内转位、受体-配体亲和性、转录翻译活性、细胞发育、运动与生长以及免疫应答等多项细胞功能调控.除了能与PKCs和Src酪氨酸激酶相互作用外,RACK1还可与磷酸二酯酶PDE4D5[23]、整合素β[24]、keratin[25]和spectrin[26]等结合,调节细胞活动.
本课题组在前期研究人胃腺癌肿瘤标志物Lgr5的生物学功能过程中,利用酵母双杂交大规模文库筛选技术,发现RACK1为Lgr5的候选相互作用蛋白,并用生物信息学方法预测了其间有极大相互作用的可能性,究竟RACK1在Lgr5参与的人胃腺癌发生发展过程中起到什么样的作用,目前尚不清楚.为了进一步利用GST-pulldown等实验验证RACK1与Lgr5的相互作用关系,需要获得高纯度的RACK1蛋白用于下一步研究.因而本研究采用基因工程手段,以人胎肝cDNA文库为模板,成功克隆RACK1 cDNA全长序列,构建了pET-30a(+)-RACK1原核表达载体,在体外表达并获得了大量的人RACK1融合蛋白.本实验中选用的载体pET-30a(+)是带有6个组氨酸标签的质粒,诱导表达后形成的融合蛋白可通过方便快捷的镍离子亲和层析法进行纯化,镍离子亲和层析法是利用融合于重组蛋白的组氨酸标记物与Ni2+特异性结合,从而结合于吸附有Ni2+的层析介质上,随后将其洗脱以达到分离的目的.利用此方法获得了纯度较高的RACK1蛋白.本实验结果为进一步研究其在胃腺癌发生发展过程中介导Lrg5的生物学作用奠定了一定的工作基础.
[1]MCCAHILL A, WARWICKER J, BOLGER G B, et al.The RACK1 scaffold protein:a dynamic cog in cell response mechanisms [J].Molecular Pharmacology, 2002,62(6):1261-1273.DOI:10.1124/mol.62.6.1261.
[2]MOCHLY-ROSEN D, KHANER H, LOPEZ J.Identification of intracellular receptor proteins for activated protein kinase C [J].Biochemistry, 1991,88(9):3997-4000.DOI:10.1073/pnas.88.9.3997.
[3]RON D, JIANG Z, YAO L, et al.Coordinated movement of RACK1 with activated βIIPKC [J].The Journal of Biological Chemistry, 1999,274(38):27039-27046.DOI:10.1074/jbc.274.38.27039.
[4]STEBBINS E G, MOCHLY-ROSEN D.Binding specificity for RACK1 resides in the V5 region of βII protein kinase C [J].The Journal of Biological Chemistry, 2001,276(32):29644-29650.DOI:10.1074/jbc.M101044200.
[5]MAMIDIPUDI V, CARTWRIGHT C A.A novel pro-apoptotic function of RACK1:suppression of Src activity in the intrinsic and Akt pathways [J].Oncogene Article, 2009,28(50):4421-4433.DOI:10.1038/onc.2009.293.
[6]NAHAR-GOHAD P, SULTAN H, ESTEBAN Y, et al.RACK1 identified as the PCBP1-interacting protein with a novel functional role on the regulation of human MOR gene expression [J].Journal of Neurochemistry, 2013,124(4):466-477.DOI:10.1111/jnc.12100.
[7]KIM E, CLARK A L, KISS A, et al.μ- and κ-opioids induce the differentiation of embryonic stem cells to neural progenitors [J].The Journal of Biological Chemistry, 2006,281(44):33749-33760.DOI:10.1074/jbc.M603862200.
[8]BRILLET K, DA CONCEICAO M M, PATTUS F, et al.Bioprocess parameters of cell growth and human mu opioid receptor expression in recombinant Drosophila S2 cell cultures in a bioreactor [J].Bioprocess and Biosystems Engineering, 2006,28(5):291-293.DOI:10.1007/s00449-005-0033-0.
[9]HARBURG G C, HALL F S, HARRIST A V, et al.Knockout of the mu opioid receptor enhances the survival of adult-generated hippocampal granule cell neurons [J].Neuroscience, 2007,144(1):77-87.DOI: 10.1016/j.neuroscience.2006.09.018.
[10]LENNON F E, MIRZAPOIAZOVA T, MAMBETSARIEV B, et al.Overexpression of the μ-opioid receptor in human non-small cell lung cancer promotes Akt and mTOR activation, tumor growth, and metastasis [J].Anesthesiology, 2012,116(4):857-867. DOI:10.1097/ALN.0b013e31824babe2.
[11]BORTSOV A V, MILLIKAN R C, BELFER I, et al.μ-Opioid receptor gene A118G polymorphism predicts survival in patients with breast cancer [J].Anesthesiology, 2012,116(4):896-902.DOI:10.1097/ALN.0b013e31824b96a1.
[12]EGIDY G, JULE S, BOSSE P, et al.Transcription analysis in the MeLiM swine model identifies RACK1 as a potential marker of malignancy for human melanocytic proliferation [J].Molecular Cancer,2008,7:34.DOI:10.1186/1476-4598-7-34.
[13]CAO X X, XU J D, XU J W, et al.RACK1 promotes breast carcinoma proliferation and invasion/ metastasis in vitro and in vivo [J].Breast Cancer Research and Treatment, 2010,123(2):375-386.DOI:10.1007/s10549-009-0657-x.
[14]NAGASHIO R, SATO Y, MATSUMOTO T, et al.Expression of RACK1 is a novel biomarker in pulmonary adenocarcinomas [J].Lung Cancer, 2010,69(1):54-59.DOI:10.1016/j.lungcan.2009.09.015.
[15]WANG Z, ZHANG B, JIANG L, et al.RACK1, an excellent predictor for poor clinical outcome in oral squamous carcinoma, similar to Ki67 [J].European Journal of Cancer, 2009,45(3):490-496.DOI:10.1016/j.ejca.2008.11.012.
[16]WANG Z, JIANG L, HUANG C, et al.Comparative proteomics approach to screening of potential diagnostic and therapeutic targets for oral squamous cell carcinoma [J].Molecular & Cellular Proteomics, 2008,7(9):1639-1650.DOI:10.1074/mcp.M700520-MCP200.
[17]SUBAUSTE M C, VENTURA-HOLMAN T, DU L, et al.RACK1 downregulates levels of the pro-apoptotic protein Fem1b in apoptosis-resistant colon cancer cells [J].Cancer Biology & Therapy, 2009,8(23):2297-2305.DOI:10.4161/cbt.8.23.10262.
[18]SHI S, DENG Y Z, ZHAO J S, et al.RACK1 promotes non-small-cell lung cancer tumorigenicity through activating sonic hedgehog signaling pathway [J].The Journal of Biological Chemistry, 2012,287(11):7845-7858.DOI:10.1074/jbc.M111.315416.
[19]ZHANG X Y, TANG L Z, REN B G, et al.Interaction of MCM7 and RACK1 for activation of MCM7 and cell growth [J].The American Journal of Pathology, 2013,182(3):796-805.DOI:10.1016/j.ajpath.2012.11.020.
[20]SWAMINATHAN G, CARTWRIGHT C A.Rack1 promotes epithelial cell-cell adhesion by regulating E-cadherin endocytosis [J].Oncogene, 2012,31(3):376-389.DOI: 10.1038/onc.2011.242.
[21]DENG Y Z, YAO F, LI J J, et al.RACK1 suppresses gastric tumorigenesis by stabilizing the β-catenin destruction complex [J].Gastroenterology,2012,142(4):812-823.DOI:10.1053/j.gastro.2011.12.046.
[22]MAMIDIPUDI V, DHILLON N K, PARMAN T, et al.RACK1 inhibits colonic cell growth by regulating Src activity at cell cycle check points [J].Oncogene, 2007,26(20):2914-2924.DOI: 10.1038/sj.onc.1210091.
[23]BIRD R J, BAILLIE G S, YARWOOD S J.Interaction with receptor for activated C-kinase 1 (RACK1) sensitizes the phosphodiesterase PDE4D5 towards hydrolysis of cAMP and activation by protein kinase C [J].The Biochemical Journal, 2010,432(1):207-216.DOI:10.1042/BJ20101010.
[24]DEEVI R K, COX O T, O'CONNOR R.Essential function for PDLIM2 in cell polarization in three-dimensional cultures by feedback regulation of the β1-integrin-RhoA signaling axis [J].Neoplasia, 2014,16(5):422-431.DOI:10.1016/j.neo.2014.04.006.
[25]KRÖGER C, LOSCHKE F, SCHWARZ N, et al.Keratins control intercellular adhesion involving PKC-α-mediated desmoplakin phosphorylation [J].The Journal of Cell Biology, 2013,201(5):681-692.DOI:10.1083/jcb.201208162.
[26]MYKLEBUST L M, HORVLI O, RAAE A J.RACK1 (receptor for activated C-kinase 1) interactions with spectrin repeat elements [J].Journal of Molecular Recognition, 2015,28(1):49-58.DOI:10.1002/jmr.2411.
(责任编辑:赵藏赏)
Cloning and expression of human RACK1 gene
WANG Xiangfei, TANG Jingzhen, SHAN Jinshuai, LIU Chang, WU Chen
(College of Life Science, Hebei University, Baoding 071002, China)
HumanRACK1 gene was cloned and constructed to pET-30a(+) prokaryotic expression vector.RACK1 protein was expressed and purified and identified by Western blot.A pair of primers was designed according to the digestion sites in pET-30a(+) and theRACK1 gene sequence published on GeneBank.RACK1 cDNA was amplified from a human fetal liver cDNA library and constructed into pET-30a(+) vector.The recombinant expression vector was transformed into the hostE.coliDH5α.The positive clone was identified by double enzyme digestion and sequencing analysis.The recombinant expression vector pET-30a(+)-RACK1 was highly expressed inE.coliBL21 (DE3) under the induction of IPTG.The fusion protein was analyzed by SDS-PAGE and purified by 6×His-Tagged Protein Purification Kit.The purified RACK1 protein was confirmed by Western blot.The results showed that theRACK1 cDNA sequence we cloned was right.The recombinant expression vector pET-30a(+)-RACK1 was successfully constructed.The fusion protein was expressed as inclusion body, which was purified by affinity chromatography.The result of Western blot indicated that the purified RACK1 protein could bind its specific antibody.The obtained human RACK1 protein laid a good foundation for further study on RACK1.
human RACK1; gene cloning; prokaryotic expression; protein purification
10.3969/j.issn.1000-1565.2016.03.012
2015-10-23
国家自然科学基金资助项目(30800180);河北省自然科学基金资助项目(C2009000191; C2013201112);河北省教育厅优秀青年基金(Y2012024)
王向飞(1989-),女,河南洛阳人,河北大学在读硕士研究生.E-mail:18330249598@163.com
吴琛(1977-),女,河北保定人,河北大学教授,主要从事肿瘤分子生物学研究.E-mail:dawnwuchen@163.com
Q78
A
1000-1565(2016)03-0293-07

