生物钟基因Clock对小鼠诱导性多能干细胞分化的影响
赵 冉 杨 羊 徐 晨 陆 超 孙 宁 钱睿哲
(复旦大学基础医学院生理与病理生理学系 上海 200032)
生物钟基因Clock对小鼠诱导性多能干细胞分化的影响
赵冉杨羊徐晨陆超孙宁钱睿哲△
(复旦大学基础医学院生理与病理生理学系上海200032)
目的研究生物钟基因Clock对小鼠诱导性多能干细胞(induced pluripotent stem cell,iPSC)非定向分化的作用。方法将Teto-FUW-OSKM、M2rtTA、PsPAX2 和PMD2.G 4种质粒共转染293FT细胞,收集病毒上清,转染小鼠胚胎成纤维细胞(mouse embryo fibroblast,MEF)获得小鼠iPSC,并通过检测多能性基因表达及其体外分化能力对小鼠iPSC进行鉴定;通过RT-PCR检测小鼠iPSC在非定向分化和拟胚体形成过程中生物钟基因的表达,以及生物钟基因Clock下调后,与野生型细胞相比小鼠iPSC多能性基因的表达和形态学改变。结果通过慢病毒感染MEF的方式获得了小鼠iPSC;小鼠iPSC在非定向分化过程中,生物钟基因Clock、Per2、Rev-erbα表达升高;生物钟基因Clock下调后,小鼠iPSC分化能力下降,多能性基因Sox2、Oct4、Klf4表达升高。结论生物钟基因Clock对小鼠iPSC的非定向分化起到重要作用。
生物钟基因;诱导性多能干细胞;非定向分化;小鼠
昼夜节律是自然界普遍存在的一种生物节律,它使生物体的生理、生化、行为等生命现象表现为近似24 h的节律性[1]。生物钟基因Clock作为第一个被发现和鉴定的生物钟基因,是调节昼夜节律的核心分子,参与维持生物体的多项生命活动[2-3]。近年来研究发现,与分化成熟的体细胞具备生物钟转录-翻译反馈环路、生物钟基因呈现节律性表达不同,小鼠胚胎干细胞(embryonic stem cell,ESC)中的生物钟基因缺乏生物钟转录-翻译反馈环路,并不呈现节律性表达;小鼠ESC体外分化后,生物钟节律振荡重新出现[4]。siRNA干扰生物钟基因Clock或Bmal1表达可以抑制神经干细胞向神经元方向分化[5]。生物钟基因Timeless促进ESC的分化[6]。诱导性多能干细胞(induced pluripotent stem cell,iPSC)由已分化的体细胞诱导而成,具有与ESC相似的特性。然而生物节律对iPSC分化的影响在国内尚无报道,因此本研究拟建立稳定的小鼠iPSC细胞系,并在此细胞系基础上探讨生物钟基因Clock对小鼠iPSC(miPSC)非定向分化的影响,为干细胞治疗提供新的思路。
材 料 和 方 法
实验动物及细胞系来源孕13天C57BL/6J小鼠(n=8)购自于南京模式动物所,293 FT细胞、小鼠E14 ESC均由复旦大学上海医学院分子病毒实验室馈赠。
主要试剂质粒Teto-FUW-OSKM、PsPAX2、PMD2.G、M2rtTA均购自于美国Addgene公司;质粒pWPI-EGFP由复旦大学医学分子病毒学重点实验室惠赠;DMEM培养基、KnockoutTMD-MEM、敲除血清替代物(knockout serum replacement,KSR)、含谷氨酰胺非必需氨基酸均购自美国Gibico公司;碱性磷酸酶染色试剂盒购自上海斯丹赛生物科技有限公司;逆转录及PCR试剂盒购自日本TOYOBO公司。
小鼠iPS细胞系的建立质粒转染前一天,接种293FT细胞至10 cm细胞培养板中。转染前1 h将DMEM培养液换成无血清DMEM培养液600 μL。按照以下比例配制3种DNA-Hily Max转染液:Teto-FUW-OSKM/M2rtTA/pWPI 20 μg、PsPAX2 15 μg、PMD2.G 5 μg。将上述3种不同的DNA-HilyMax转染混合物分别悬空滴入293FT细胞培养皿中。将培养皿放于37 ℃培养箱培养,48 h后在荧光显微镜下观察慢病毒包装情况并拍照记录。然后将病毒上清吸入至15 mL的离心管中,4 ℃ 3 000 r/min(离心半径13 cm)离心5 min,收集上清,并用0.45 μm的小滤器抽滤,分装保存。将1×105个MEF细胞接种于含有1 mL的DMEM培养液(10% FBS不含双抗)的六孔板中。各取1 mL抽滤好的Teto-FUW-OSKM-慢病毒、M2rtTA-慢病毒加入上述六孔板中。放于37 ℃,CO2浓度为5%的细胞培养箱中培养。12 h后换成小鼠iPSC培养液3 mL,并加入强力霉素,使其终浓度为2 μg/mL,继续培养并逐日观察拍照记录。之后每2天换一次液,12 天后去除强力霉素,直到克隆长到可挑出扩增。
小鼠iPSC的鉴定取状态良好的iPSC克隆,Trizol法提取总RNA,RT-PCR检测多能性基因Oct4、Sox2、Klf4、c-Myc以及Nanog、Dax-1等的表达,其相应的引物如表1所示。
选取生长状态良好的iPSC,弃去培养基,用1×PBS清洗3次;加入4%多聚甲醛固定1~2 min;弃去固定液,用1×PBS清洗2次;吸出PBS,用TBST润洗1次;加入适量的碱性磷酸酶染液,染色10~15 min,吸出AKP染色液,用1×PBS缓冲液润洗一次,最后保存于PBS缓冲液中,显微镜下观察染色结果。
细胞免疫荧光染色Oct 4、SSEA-1、Nanog (1∶400)检测iPSC多能性的分子标记。将细胞用预冷的1×PBS缓冲液润洗3次,4%多聚甲醛室温固定15 min,用预冷的1×PBS缓冲液润洗3次,再用5% TritonX 100室温处理细胞15 min;然后加入3% BSA孵育细胞,室温封闭1 h;加入一抗, 4 ℃过夜或室温1 h;用PBST清洗细胞3次,每次约10 min;将荧光二抗按1:1 000进行稀释,加到细胞上,室温置1 h;用PBST清洗细胞3次,每次约10 min;将DAPI按1:1 000稀释,加到细胞上,室温染核5 min;观察免疫荧光并拍照记录。
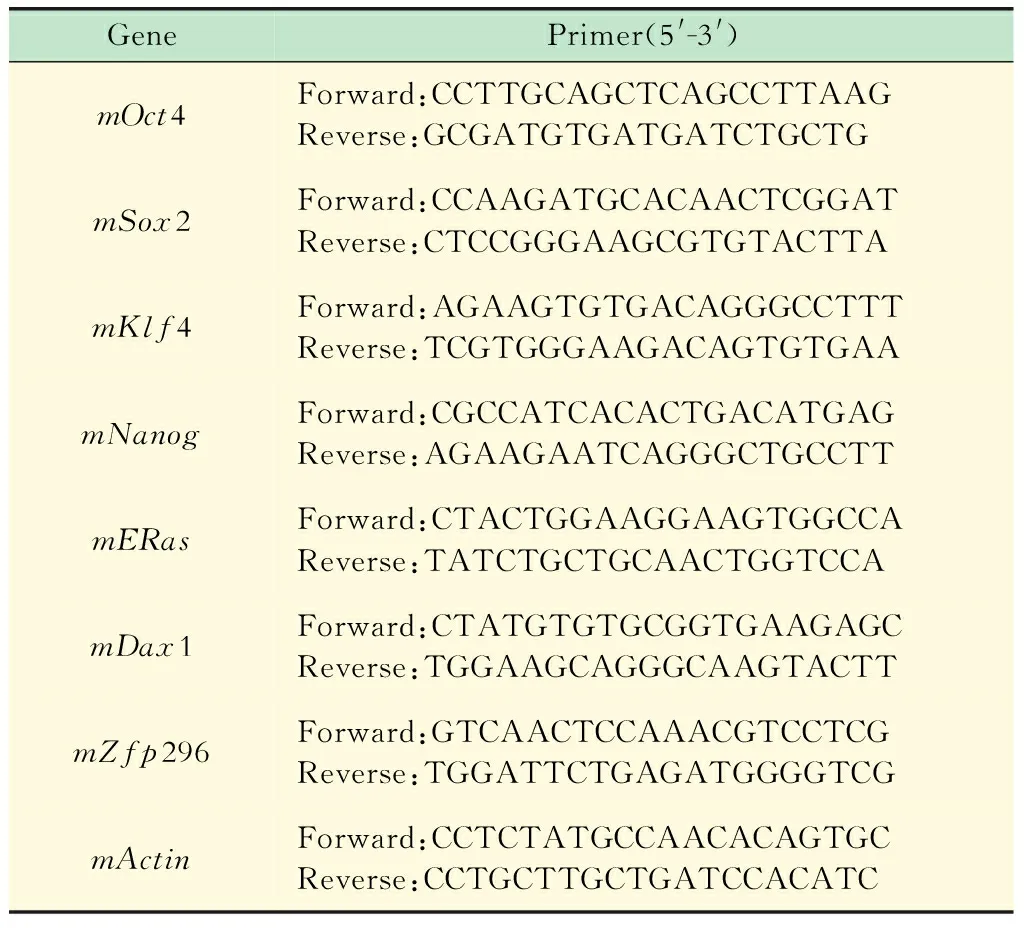
表1 iPSC 标志性多能性基因的PCR引物序列
在悬浮细胞皿中,将适量纯化后的iPSC接种于含拟胚体的(embryoid body, EB)完全培养液中,观察EB的形成并拍照。
生物钟基因对小鼠iPSC非定向分化的影响将纯化的iPSC接种在明胶包被的无滋养层细胞的细胞培养板中进行培养,分别提取培养0、1、2、3天的细胞总RNA,通过Real-time PCR检测生物钟基因的表达变化。将纯化的iPSC接种在悬浮细胞板中,分别提取培养0、1、3、5、7、9、11天的细胞总RNA,通过Real-time PCR检测生物钟基因的表达变化。生物钟基因引物如表2所示。
接种5×104个纯化的iPSC于含有1.5 mL培养液的细胞培养板中。制备siRNA-LipofectamineTM2000转染复合物:将20 μmol/L的Clock-siRNA 10 μL、Control-SiRNA分别与240 μL的Opti-Medium轻轻混匀,室温孵育5 min,同时将5 μL LipofectamineTM2000与245 μL Opti-Medium轻轻混匀,室温孵育5 min。
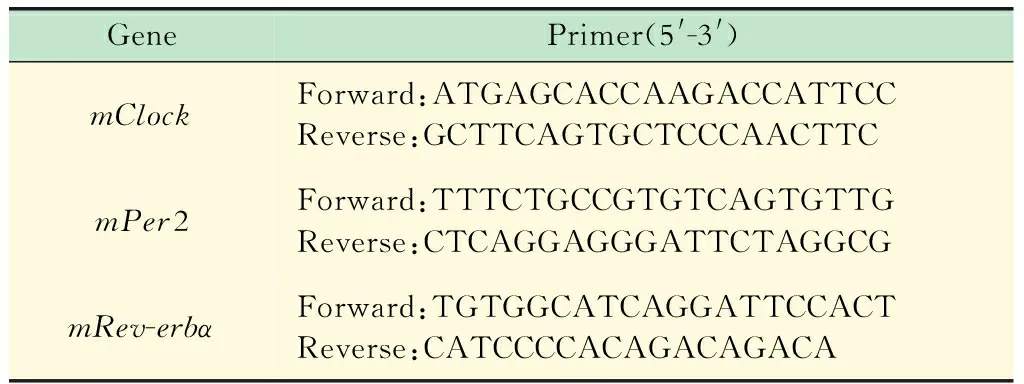
表2 生物钟基因的PCR引物序列
将上述两种混合液轻轻混匀,室温孵育20 min。将500 μL siRNA-LipofectamineTM2000转染复合物悬空滴加到细胞中,轻轻晃动混匀。细胞培养箱中培养,4~6 h后换液,转染48 h后显微镜下观察细胞形态变化,并抽提RNA,通过Real-time PCR检测目的基因的干扰效果及多能性基因Sox2、Oct4、Klf4的表达。Clock-siRNA序列(5′-3′)为GGACAAGUCUACUGUUCUAUAGAACAGUAGA-CUUGUCC。
结 果
慢病毒的包装与转染效率将慢病毒表达质粒pWPI、Teto-FUW-OSKM、M2rtTA分别与慢病毒包装质粒PsPAX2、PMD2.G共转染293FT细胞48 h,可见绿色荧光蛋白(green fluorescent protein,GFP)表达(图1A、B),72 h后收集病毒,将pWPI-慢病毒感染小鼠MEF,48 h可见GFP表达(图1C、D)。
小鼠iPSC的诱导为了研究生物钟基因与iPSC分化的关系,我们通过慢病毒转染方法建立了小鼠iPSC细胞系。将Teto-FUW-OSKM-慢病毒感染MEF(图2A)后,第1天MEF细胞伪足变少,形态由梭形逐渐变为圆形(图2B);第3天细胞局部聚集成簇生长,体积变小(图2C);第7天细胞局部聚集更加明显,与边缘分界逐渐清晰(图2D);第9~12天细胞形成小鼠ESC样克隆,边界清晰,表面光滑,结构紧密,隆起生长(图2E、F)。
小鼠iPSC多能性的鉴定为了确认由MEF重编程获得的iPSC具有多能性,我们采用了碱性磷酸酶染色、RT-PCR和免疫荧光法检测多能性基因、拟胚体形成实验等方法进行鉴定。碱性磷酸酶染色显示小鼠iPSC碱性磷酸酶呈阳性(图3A)。RT-PCR结果显示小鼠iPSC表达内源性Nanog、Sox2、Oct4、Dax1、Klf4,且与小鼠ESC相比差异无统计学意义(图3B)。消化后的iPSC在悬浮培养皿中培养呈三维立体的球形生长,形成拟胚体(图3C)。细胞免疫荧光结果显示小鼠iPSC表达ESC的特异性分子标记SSEA-1、OCT4、NANOG (图3D)。
A:293FT cells transfected with plasmid pWPI after 48 h (×4);B:The GFP expression of 293FT cells transfected with plasmid pWPI after 48 h (×4);C:MEF infected with lentivirus after 48 h (×4);D:The GFP expression of MEF infected with lentivirus after 48 h (×4).
图1慢病毒包装与转染效率
Fig 1Detection of lentiviral packaging and infection efficiency
iPSC非定向分化过程中生物钟基因的表达RT-PCR结果显示小鼠iPSC在自分化过程中生物钟基因Clock、Per2、Rev-erbα表达逐渐升高,且差异有统计学意义(图4A);RT-PCR结果显示生物钟基因Clock、Per2、Rev-erbα在EB形成前3天内逐渐升高,且在EB形成后3天时出现高峰,随后降低但仍高于EB形成后0天,之后又逐渐升高,且差异具有统计学意义(图4B)。
A:Mouse embryo fibroblast (×4);B-F:The 1st,3rd,7th,9thand 12thday of iPSC,separately (×4).
图2利用转染Teto-FUW-OSKM慢病毒的方法将小鼠MEF 转化为iPSC
Fig 2Generation of iPSC cell lines into MEF cells in mouse by introducing Teto-FUW-OSKM lentivirus
生物钟基因Clock对iPSC多能性的影响为了明确核心生物钟Clock基因与iPSC非定向分化之间的关系,我们利用siRNA干扰的方法下调Clock基因的表达,结果显示Clock的表达下降了约70%(图5B)。在此基础上,我们进行了miPSC细胞的非定向分化,结果显示对照组的miPSC克隆边缘不光滑,有伪足伸出;而实验组(Clock-siRNA)miPSC克隆仍保持边缘光滑,极少有伪足伸出(图5A);与Control-siRNA组相比,Clock-siRNA组48 h后,多能性基因Sox2、Oct4、Klf4表达升高(P<0.05)(图5B)。提示Clock基因能够影响干细胞的分化。
讨 论
昼夜节律是自然界普遍存在的一种生物节律,它使机体的行为、生理表现为近似24 h的节律性,由机体的内源性生物钟调控和驱动;同时又受到外界环境因子的影响[7]。目前,在所有的生物钟系统中,生物钟分子基础模型主要包括了由一组高度保守的“生物钟基因”组成的转录-翻译正负反馈回路[8-9]。生物钟基因Clock、Bmal1组成哺乳动物的核心生物钟,参与细胞分化、增殖、死亡等,调节生命体的各种生理活动。本课题组前期研究发现,生物节律紊乱的小鼠血脂水平显著异常,高脂饮食喂养的apoE-/-小鼠中,生物钟基因Clock表达的节律和幅度发生改变。因此一旦生物节律发生紊乱,将会导致多种疾病的产生[10-13]。
A:Alkaline phosphatase staining of miPSC (×10);B:RT-PCR analysis of miPSC for pluripotent marker genes expression;C:Embryoid body (×10);D:Immunostaining of miPSC for SSEA1,OCT4 and NANOG expression(×10).iPSC vs. ESC,(1)P=0.004 1 (t=15.49);(2)P=0.005 1 (t=13.98) (n=3).
图3小鼠iPSC的多能性标记基因检测
Fig 3Detection of miPSC for pluripotent marker
iPSC于2006年由Yamanaka实验室通过外源性表达Oct4、Sox2、Klf4、c-Myc成功诱导小鼠的体细胞重编程而成[14],具有与ESC相似的多能性,在体外已被成功地分化为生殖细胞、心血管细胞和肝细胞等多种体细胞[15-17]。目前,iPSC被广泛应用于再生医学和疾病模型的建立,为临床治疗提供理论基础。在本实验中,我们首先利用MEF在体外通过诱导的方法建立小鼠iPSC细胞系,其主要特征表现为能够形成ESC样克隆,细胞核较大,核质比例高,碱性磷酸酶染色呈阳性,表达内源性Oct4、Sox2、Nanog、SSEA1等多能性标记分子。诱导的细胞在体外能够进行自分化,形成拟胚体,这些特征都说明我们成功在体外诱导建立了小鼠iPSC细胞系。
A:The expression of Clock,Per2,Rev-erbαgene during the miPSC spontaneous differentiation;B:The expression of Clock,Per2,Rev-erbαgene during EB formation.The results suggested that Clock genes have some influence on the process of miPSC differentiation and maturation.A:Each time point vs. its previous time point,(1)P<0.05.Clock P=0.032,0.025,0.041 (t=5.48,6.26,4.77);Per2 P=0.012,0.065,0.010 (t=9.00,3.74,9.84);Rev-erbαP=0.005 4,0.022,0.038 (t=13.53,6.57,4.96);B:EB 1 d,3 d,5 d,7 d,9 d,11 d vs. EB 0 d,(2)P<0.01.Clock P=0.005 2,0.000 5,0.0022.0.0038.0.0003,0.000 3 (t=13.81,43.26,21.41,16.14,60.12,61.76);Per2 P=0.001 5,0.000 1,0.0006,0.001 0,0.000 2,0.000 1 (t=25.66,94.93,41.22,31.55,63.99,82.33);Rev-erbαP=0.003 3,0.000 5,0.001 8,0.001 1,0.000 8,<0.000 1 (t=17.32,43.31,23.30,29.58,34.39,128.5) (n=3).
图4RT-PCR 检测小鼠iPSC自分化及EB形成过程中生物钟基因的表达
Fig 4The expression of circadian Clock genes during the miPSC spontaneous differentiation and EB formation
A:The morphology of control-siRNA iPSC and Clock-SiRNA iPSC(arrows indicate the pseudopods formation);B:Pluripotency genes expressions of miPSC after the suppression of circadian Clock gene expression.Clock-siRNA group vs. control-siRNA group(n=3),(1)P=0.004 1 (t=13.52);(2)P=0.011 (t=9.65);(3)P=0.045 7 (t=4.52);(4)P=0.011 (t=9.48) .
图5生物钟基因Clock下调48 h后miPSC形态和多能性基因的表达情况
Fig 5Morphological change and pluripotency genes expressions of miPSC after the suppression of circadian Clock gene for 48 h
生物钟基因与成体干细胞之间关系密切。据文献报道,在培养的人神经干细胞的分化过程中生物钟基因表达谱发生改变,Bmal1基因出现节律性表达[5]。生物钟基因Per2可通过影响内皮祖细胞的分化,导致缺血性心脏病小鼠新生血管形成减少[18]。Clock、Per2基因缺失可抑制人间充质干细胞向脂肪细胞的分化[19]。Rev-erbα基因过表达促进骨间充质干细胞的分化成熟,但在骨生成的最后阶段作为负性调节因素发挥抑制作用[20]。然而,生物钟基因与ESC之间的关系却研究甚少。
Yagita等[4]首次研究了ESC与生物钟基因的关系,其结果表明ESC的生物钟基因不表达或呈无节律性表达,而分化的ESC表达生物钟基因且具有节律性,如果将成体细胞重新诱导为iPSC则生物钟节律又消失。O′Reilly等[6]发现生物钟基因Timeless表达缺失的ESC中多能性基因表达水平增加,形成的拟胚体数目降低、体积减小。根据这些结果,我们通过进一步的实验来研究生物钟基因与多能干细胞的多能性及分化功能的关系。结果显示,iPSC自发分化过程中生物钟基因Clock、Per2、Rev-erbα表达水平逐渐升高;拟胚体形成过程中,生物钟基因Clock、Per2、Rev-erbα表达水平同样升高。这些结果都与Yagita等[4]的结果相吻合。
目前,生物钟基因与干细胞分化之间的关系尚未明确。事实上,生物钟基因在胚胎时期已经有了表达[21],但是生物钟节律的出现和成熟是在出生前几天[22]。利用条件性敲除生物钟基因Bmal1后发现,本来在普通Bmal1-/-小鼠中出现的细胞衰老表现(如年龄缩短、生殖功能退化和关节病等表型)不明显,而动脉粥样硬化和毛发生长等在条件性敲除Bmal1的小鼠中反而有所改善[23]。该结果提示了生物钟基因的确在胚胎发育时期发挥了重要作用。
因此,我们希望研究生物钟基因是否对干细胞的分化功能产生了影响。Clock与Bmal1、Per(Per1、Per2、Per3)和 Cry(Cry1、Cry2)是4个主要的生物钟核心基因。其中CLOCK与BMAL1形成的异二聚体可以与受生物钟调节基因(包括了Per和Cry)上游的E-box结合,启动节律性基因转录;而Per与Cry表达升高后,形成的异二聚体可与Clock和Bmal1结合,反馈性抑制其转录功能,该调节周期近似24 h。单独抑制Bmal1或者Clock都可以显著抑制生物钟基因及其下游基因的节律性表达,从而破坏生物钟调节。Per和Cry由于有多个亚型的存在,同时抑制几个Per (Per1、Per2、Per3)或Cry (Cry1、Cry2)基因亚型的表达可以达到类似的效果,但是由于操作上的复杂性,很少作为研究靶点。如前述,体内外实验均已发现,Clock在细胞分化、增殖、死亡以及成体干细胞分化等过程中起着重要作用,但是其在ESC的分化过程中是否具有重要作用尚未知。因此我们首先利用RNA干扰的方式建立了生物钟基因Clock表达下调的iPSC细胞系。结果表明,与对照组相比,Clock表达下调的小鼠iPSC自分化3天后仍保持边缘光滑,极少有伪足伸出;同时多能性基因Sox2、Oct4、Klf4表达相较于对照组升高。这些结果均提示生物钟基因Clock促进了小鼠iPSC的非定向分化。
目前仍未明确生物钟基因究竟是通过何种机制促进了干细胞的分化。根据已有的文献报道,生物节律对成体干细胞分化的影响可能是通过调节细胞周期及一些信号通路如Notch、Wnt等发挥作用。研究发现,生物钟基因通过调节细胞周期影响肠道干细胞(intestinal stem cell,ISC)的自我更新,生物钟基因Per的存在维持着ISC有丝分裂的节律性,Per的缺失则使ISC停留在细胞周期的S期,另一生物钟基因CYC的缺失使ISC停留在细胞周期的G1期[24]。Bouchard-Cannon等[25]也提到生物钟基因通过参与神经祖细胞的细胞周期进而调节神经发生。Li等[26]研究发现,在胚胎发育过程中Clock基因表达与组织分化进程相一致,抑制Clock或Timeless基因表达可以干扰Notch、Wnt信号通路分子的表达。而经典的Wnt信号通路相关基因受到生物钟基因Bmal1的直接转录调控,Wnt信号通路可恢复Bmal1-/-小鼠肌细胞分化的能力,因此Bmal1可能通过调节Wnt信号通路影响肌细胞分化[27]。然而,上述机制是否在多能干细胞的分化过程中具有作用有待研究。
综上所述,本研究发现生物钟基因Clock在iPSC非定向分化中发挥促进作用,为iPSC分化机制研究、临床药物筛选和干细胞治疗提供了新的思路和方向。但本实验仍具有一定的局限性,生物钟基因Clock是否通过调节细胞周期及Wnt等信号通路影响小鼠iPSC分化将是我们下一步研究的目标。
[1]REPPERT SM,WEAVER DR.Coordination of circadian timing in mammals[J].Nature,2002,418(6901):935-941.
[2]ANTOCH MP,SONG EJ,CHANG AM,et al.Functional identification of the mouse circadian Clock gene by transgenic BAC rescue[J].Cell,1997,89(4):655-667.
[3]MALIK A,KONDRATOV RV,JAMASBI RJ,et al.Circadian clock genes are essential for normal adult neurogenesis,differentiation,and fate determination.[J].PLoSOne,2015,10(10):e139655.
[4]YAGITA K,HORIE K,KOINUMA S,et al.Development of the circadian oscillator during differentiation of mouse embryonic stem cells in vitro[J].Proc Natl Acad Sci U S A,2010,107(8):3846-3851.
[5]KIMIWADA T,SAKURAI M,OHASHI H,et al.Clock genes regulate neurogenic transcription factors,including NeuroD1,and the neuronal differentiation of adult neural stem/progenitor cells[J].Neurochem Int,2009,54(5-6):277-285.
[6]O’REILLY L,WATKINS S,SMITHGALL T.An unexpected role for the clock protein timeless in developmental apoptosis[J].PLoSOne,2011,6(2):e17157.
[7]YAMAZAKI S,NUMANO R,ABE M,et al.Resetting central and peripheral circadian oscillators in transgenic rats[J].Science,2000,288(5466):682-685.
[8]DUNLAP J.Molecular bases for circadian clocks[J].Cell,1999,96(2):271-290.
[9]WANG C,ZHANG ZM,XU CX,et al.Interplay between Dioxin-mediated signaling and circadian clock:a possible determinant in metabolic homeostasis.[J].Int J Mol Sci,2014,15(7):11700-11712.
[10]OTWAY DT,MANTELE S,BRETSCHNEIDER S,et al.Rhythmic diurnal gene expression in human adipose tissue from individuals who are lean,overweight,and type 2 diabetic.[J].Diabetes,2011,60(5):1577-1581.
[11]CORELLA D,ASENSIO EM,COLTELL O,et al.CLOCK gene variation is associated with incidence of type-2 diabetes and cardiovascular diseases in type-2 diabetic subjects:dietary modulation in the PREDIMED randomized trial[J].Cardiovasc Diabetol,2016,15(1):4.
[12]LI Q,LOH DH,KUDO T,et al.Circadian rhythm disruption in a mouse model of Rett syndrome circadian disruption in RTT[J].Neurobiol Dis,2015,77:155-164.
[13]VIEIRA E,RUANO EG,FIGUEROA AL,et al.Altered clock gene expression in obese visceral adipose tissue is associated with metabolic syndrome.[J].PLoSOne,2014,9(11):e111678.
[14]TAKAHASHI K,YAMANAKA S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[15]LI YF,WANG XX,FENG X,et al.Generation of male germ cells from mouse induced pluripotent stem cells in vitro[J].Stem Cell Res,2014,12(2):517-530.
[16]LIN B,KIM J,LI Y,et al.High-purity enrichment of functional cardiovascular cells from human iPS cells.[J].Cardiovasc Res,2012,95(3):327-335.
[17]NAKAMORI D,TAKAYAMA K,NAGAMOTO Y,et al.Hepatic maturation of human iPS cell-derived hepatocyte-like cells by ATF5,c/EBPalpha,and PROX1 transduction[J].Biochem Biophys Res Commun,2016,469(3):424-429.
[18]SUN YY,BAI WW,WANG B,et al.Period 2 is essential to maintain early endothelial progenitor cell function in vitro and angiogenesis after myocardial infarction in mice[J].J Cell Mol Med,2014,18(5):907-918.
[19]BOUSHER H,VANNEAUX V,DOMET T,et al.Circadian clock genes modulate human bone marrow mesenchymal stem cell differentiation,migration and cell cycle[J].PLoSOne,2016,11(1):e146674.
[20]HE Y,LIN FW,CHEN YQ,et al.Overexpression of the circadian clock gene Rev-erbalpha affects murine bone mesenchymal stem cell proliferation and osteogenesis[J].Stem Cells Dev,2015,24(10):1194-1204.
[21]JOHNSON MH,LIM A,FERNANDO D,et al.Circadian clockwork genes are expressed in the reproductive tract and conceptus of the early pregnant mouse[J].Reprod Biomed Online,2002,4(2):140-145.
[22]SUMOVA A,BENDOVA Z,SLADEK M,et al.Setting the biological time in central and peripheral clocks during ontogenesis[J].FEBS Lett,2006,580(12):2836-2842
[23]YANG G,CHEN LH,GRANT GR,et al.Timing of expression of the core clock gene Bmal1 influences its effects on aging and survival[J].Sci Transl Med,2016,8(324):316r-324r.
[24]KARPOWICZ P,ZHANG Y,HOGENESCH JB,et al.The circadian clock gates the intestinal stem cell regenerative state[J].Cell Rep,2013,3(4):996-1004.
[25]BOUCHARD-CANNON P,MENDOZA-VIVEROS L,YUEN A,et al.The circadian molecular clock regulates adult hippocampal neurogenesis by controlling the timing of cell-cycle entry and exit[J].Cell Rep,2013,5(4):961-973.
[26]LI ZX,RUAN LJ,LIN SB,et al.Clock controls timing of mouse pancreatic differentiation through regulation of Wnt-and Notch-based and cell division components[J].Biochem Biophys Res Commun,2007,359(3):491-496.
[27]CHATTERJEE S,NAM D,GUO BY,et al.Brain and muscle Arnt-like 1 is a key regulator of myogenesis[J].J Cell Sci,2013,126(Pt 10):2213-2224.
E-mail:rzqian@shmu.edu.cn
The influences of circadian gene Clock on differentiation of induced pluripotent stem cells in mouse
ZHAO Ran, YANG Yang, XU Chen, LU Chao, SUN Ning, QIAN Rui-zhe△
(Department of Physiology and Pathophysiology,School of Basic Medical Sciences,Fudan University,Shanghai 200032,China)
ObjectiveTo study the relationship between circadian gene Clock and induced pluripotent stem cell (iPSC) differentiation in mouse.MethodsTeto-FUW-OSKM,M2rtTA,PsPAX2 and PMD2.G plasmid were transfected into 293FT cells.Then virus-containing supernatants were harvested to infect mouse embryo fibroblast (MEF).The characteristics of mouse iPSC (miPSC) were analyzed by pluripotent marker expression levels and the differentiation capacity in vitro.Real-time PCR was used to detect the expression of circadian Clock gene during spontaneous differentiation and the formation of embryoid body.After reducing the Clock gene expression level of miPSC,the cell morphological changes and the expression of pluripotency genes in miPSC were compared with wild type cells.ResultsWe established miPSC by lentivirus inducing.The expression levels of circadian Clock gene,Per2 and Rev-erbαincreased in miPSC spontaneous differentiation process.After knocking down Clock gene,the differentiation of miPSC ability decreased as well as the expression levels of pluripotency genes increased,such as Sox2,Oct4 and Klf4.ConclusionsThe circadian Clock genes had an important influence on miPSC spontaneous differentiation.
circadian gene Clock;induced pluripotent stem cell;spontaneous differentiation;mouse
R363
Adoi:10.3969/j.issn.1672-8467.2016.05.001
2016-03-28;编辑:张秀峰)
*This work was supported by the National Science Foundation Fostering Talents in Basic Research of China (J1210041) and the National Natural Science Foundation of China (81570771).
国家基础科学人才培养基金(J1210041);国家自然科学基金(81570771)

