四氧化三铁磁性纳米颗粒人工模拟酶在快速检测二硝基甲苯中的研究及应用
聂冬霞施国跃于妍妍(上海市农业科学院,农产品质量标准与检测技术研究所,上海 040)(华东师范大学化学系,上海 004)(徐州医学院药学院,徐州 004)
四氧化三铁磁性纳米颗粒人工模拟酶在快速检测二硝基甲苯中的研究及应用
聂冬霞1施国跃*2于妍妍31
(上海市农业科学院,农产品质量标准与检测技术研究所,上海 201403)
2(华东师范大学化学系,上海 200241)3(徐州医学院药学院,徐州 221004)
通过共沉淀法制备了具有类过氧化物酶催化活性的四氧化三铁磁性纳米颗粒(Fe3O4MNPs)。研究表明,Fe3O4MNPs可以催化H2O2氧化2,2'-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(ABTS)二铵盐,生成有色的氧化态ABTS,同时也可催化H2O2氧化二硝基甲苯(DNT)的反应,消耗反应物H2O2。基于上述原理,构建了Fe3O4MNPs-ABTS-H2O2-DNT反应体系,用于检测DNT。结果表明,氧化态ABTS在417 nm处的吸收值随着DNT含量的增加而降低,与DNT浓度在5×10-7~2.0×10-5mol/L范围内呈良好的线性关系,检测限为1.5×10-7mol/L(S/N=3)。采用紫外-可见分光光度法对Fe3O4MNPs-ABTS-H2O2-DNT体系的反应机理、反应条件等进行了深入探讨。所建立的硝基苯类化合物含量的比色分析方法简便、快速、灵敏、可靠,对环境水样中硝基苯类化合物的在线监测具有潜在的应用价值。
二硝基甲苯;四氧化三铁磁性纳米颗粒;过氧化物模拟酶;分光光度法
1 引言
四氧化三铁(Fe3O4)纳米颗粒除具有普通纳米颗粒所具有的特性外,还具有磁性强、制备简单、生物兼容性好等优点,被广泛应用于生物分离[1,2]、催化、传感器等领域[3,4]。Gao等[5]发现,Fe3O4磁性纳米颗粒(MNPs)具有类似天然过氧化物酶的特性,可以催化特定过氧化物酶底物与H2O2的反应。与天然过氧化物酶相比,Fe3O4MNPs具有化学稳定性好、储存方便、制备简单且成本低、易于实现磁性分离等优势,因而引起广泛的研究兴趣[6~9]。如Wei等[6]利用Fe3O4MNPs催化H2O2氧化2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)的反应,建立了用于H2O2和葡萄糖检测的比色分析法。Ding等[7]根据H2O2和三聚氰胺混合生成新的物质从而消耗H2O2这一机理,构建了Fe3O4MNPs-H2O2-ABTS比色分析方法,实现了牛奶中三聚氰胺的定量检测。
硝基苯类化合物具有较高毒性和致癌性,对人和动植物都有很大危害[10,11],已引起广泛关注[12~16],关于硝基苯类化合物的降解原理及方法已经有很多报道[17~20]。Chen等[17]采用Fenton试剂矿化二硝基甲苯(2,4-DNT)和三硝基甲苯(TNT),发现Fenton试剂在纯化工业废酸中的硝基苯类化合物中有潜在的应用价值。Matta等[18]采用不同的氧化剂(包括Fenton试剂、高锰酸钾等)和不同的铁矿物质(包括磁铁矿、黄铁矿、赤铁矿等)作为催化剂降解溶液中的TNT,发现只有Fenton试剂及类似Fenton(Fenton-like)试剂的磁铁矿和黄铁矿才能降解溶液中的TNT。Lee等[19]基于电化学反应,通过辣根过氧化酶(HRP)及电化学反应器中原位反应产生的H2O2催化降解溶液中2,4,6-TNT,发现采用电化学酶催化方法去除TNT的效率远高于其它电化学或生物化学法。Yang等[20]基于TNT在降解的过程中会消耗溶液中的H2O2的原理,研制了Nafion/MWCNTs/HRP生物传感器,用于痕量TNT的检测。
本研究基于Fe3O4MNPs的类过氧化物酶催化活性,构建了Fe3O4MNPs-ABTS-H2O2-DNT反应体系,探讨了Fe3O4MNPs在催化降解硝基苯类化合物中的应用;根据在硝基苯类化合物降解中会消耗H2O2,进而会影响Fe3O4-MNPs-ABTS-H2O2-DNT反应体系中有色氧化态ABTS的生成机理,建立了一种快速检测DNT的比色分析方法。本方法仪器设备简单、准确度高、分析成本低,易于实现现场检测,具有潜在应用价值。
2 实验部分
2.1 仪器与试剂
Cary 50紫外-可见分光光度计(美国瓦里安公司)。
二硝基甲苯(DNT)和2,2'-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)(ABTS)(美国Sigma-Aldrich公司);FeCl3,FeCl2,NH3·H2O和30%H2O2(上海化学试剂公司);其余试剂均为分析纯;实验用水为二次去离子水。乙酸-乙酸钠缓冲溶液(pH 4.0)。河水样品分别取自华东师范大学丽娃河水(样品1)及上海市农业科学院河水(样品2)。
2.2 实验方法
2.2.1 Fe3O4MNPs制备 参照文献[6]方法制备:将5.0 mL 1.0 mol/L FeCl3与1.0 mL 2.0 mol/L FeCl2溶液混合,通氮除氧10 min后,加入50 mL 0.7 mol/L NH3·H2O,在室温和氮气氛中搅拌30 min。制得的Fe3O4MNPs用磁铁分离,水洗3次后,在氮气氛中干燥。取0.16 g Fe3O4MNPs重新分散于30 mL水中(浓度为5.3 mg/mL),室温下放置待用。
2.2.2 Fe3O4MNPs的类过氧化物酶活性考察 将10 μL Fe3O4MNPs(5.3 mg/mL)、20 μL 0.1 mol/L H2O2和24 μL 0.1 mol/L ABTS加入到946 μL 0.2 mol/L乙酸盐缓冲溶液(pH=4.0)中,在50℃水浴中反应10 min。磁分离去除Fe3O4MNPs。反应液用水稀释10倍,测定紫外-可见吸收光谱。
2.2.3 Fe3O4MNPs催化降解DNT 除了在初始反应液中加入10 μL 1 mmol/L DNT外(DNT终浓度为10μmol/L),其余步骤与2.2.2节相同。
2.2.4 影响因素考察以及标准曲线的建立 在反应体系中,通过调节加入乙酸盐缓冲溶液的量,保持初始反应液体积为1 mL,分别研究了Fe3O4MNPs含量、反应体系温度、H2O2浓度、ABTS浓度、反应时间等对吸光度的影响。其它实验步骤与2.2.2和2.2.3节相同。在最优实验条件下,于Fe3O4MNPs-ABTS-H2O2反应体系中加入不同浓度的DNT,建立DNT浓度与吸光度值的标准曲线。
3 结果与讨论
3.1 DNT的检测机理
HRP可催化H2O2氧化TNT生成氧化态的TNT[19,20],而Fe3O4MNPs具有类似过氧化物酶活性,因此推测Fe3O4MNPs可以进行反应(1)。由于反应(1)会消耗溶液中的H2O2,进而会影响反应(2)中生成的有色的氧化态ABTS的量。因此,根据生成的氧化态ABTS的量的不同所导致吸光度的变化,可实现DNT的定量检测。

3.2 Fe3O4MNPs的类过氧化物酶活性及其在DNT检测中的应用
通过Fe3O4MNPs催化H2O2氧化ABTS的反应,考察了Fe3O4MNPs的类过氧化物酶活性。如图1曲线(a)所示,不加入H2O2时,ABTS与Fe3O4MNPs的反应液无可见吸收峰,为无色溶液;在加入H2O2后,如曲线(c)和(e)所示,在417 nm处出现氧化态ABTS的吸收峰,溶液颜色也表现为不同深浅的绿色,证明ABTS被H2O2氧化,生成氧化态ABTS。在加入Fe3O4MNPs后,生成的氧化态ABTS的吸收峰强度为不加入Fe3O4MNPs时的3.25倍,表明所制备的Fe3O4MNPs对于H2O2氧化ABTS具有较高的催化活性。
为验证Fe3O4MNPs是否可催化H2O2氧化DNT,在上述实验基础上,考察了反应液中加入DNT后吸收峰的变化。由图1可见,与不加DNT相比(如曲线c和e所示),在含有ABTS和H2O2溶液中加入DNT后(如曲线b和d所示),反应液在417 nm处的吸收峰强度都明显减小,表明无论是否存在Fe3O4MNPs,DNT都会消耗反应体系中的H2O2。另外,在无Fe3O4MNPs参与反应的条件下,吸光度值仅降低了0.054(曲线b和c),而在Fe3O4MNPs的催化下,加入DNT后反应液的吸光度值降低了0.215(曲线d 和e),表明Fe3O4MNPs可以催化H2O2氧化DNT的反应,由于反应体系中的H2O2被消耗,因此反应体系的吸光度值降低。

图1 含有2.4 mmol/L ABTS的乙酸缓冲溶液(pH 4.0)中分别加入(a)Fe3O4MNPs,(b)H2O2和DNT,(c)H2O2,(d)H2O2、DNT及Fe3O4MNP,(e)H2O2和Fe3O4MNPs后,在50℃水浴中反应10 min后的吸收光谱图。H2O2和DNT终浓度分别为2.0 mmol/L及10μmol/L。插图为各曲线对应的反应液的照片。Fig.1 Absorption spectra of NaAC-HAC buffer solution(pH 4.0)containing 2.4 mmol/L 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonate(ABTS)solutions in the presence of(a)Fe3O4magnetic nanoparticles(MNPs);(b)H2O2and 2,4-dinitrotoluene(DNT);(c)H2O2;(d)H2O2,DNT and Fe3O4MNP;(e)H2O2and Fe3O4MNPs after incubated at 50℃ for 10 min.The final concentrations of H2O2and DNT were 2.0 mmol/L and 10μmol/L,respectively.Inset is the typical photograph of the corresponding curve.
3.3 Fe3O4MNPs-ABTS-H2O2-DNT反应体系影响因素的考察
3.3.1 Fe3O4MNPs浓度的影响 Fe3O4MNPs不仅可以催化H2O2与ABTS的反应,同时可以催化H2O2与DNT的反应。从图2可见,在加入DNT后,随着Fe3O4MNPs含量的增大,反应液吸光度值的减小值(ΔA)也逐渐变大。当Fe3O4MNPs含量大于50 mg/L时,其吸光度差值趋于稳定。因此,后续实验中采用50 mg/L Fe3O4MNPs。
3.3.2 反应温度的影响 研究了反体系在417 nm的吸光度值随温度在40℃ ~70℃范围内的变化关系。如图3所示,无论是否加入DNT,反应液的吸光度值都随着温度的升高而线性增大。当加入DNT后,Fe3O4MNPs-ABTS-H2O2-DNT反应体系的斜率值明显小于未加DNT时反应体系的斜率;且随着温度的升高,反应液吸光度值的减小值(ΔA)也增大。考虑到反应温度过高会限制本反应体系的实际应用,本研究选择50℃作为体系最佳反应温度。

图2 Fe3O4MNPs-ABTS-H2O2反应体系在不加入及加入10μmol/L DNT后,吸光度值随Fe3O4磁性纳米粒子含量变化曲线。H2O2与ABTS浓度分别为2.0 和2.4 mmol/L,反应温度为50℃,反应时间为10 min。Fig.2 Fe3O4MNPs concentration-absorbance(417 nm)curve of Fe3O4MNPs-ABTS-H2O2system in the absence and presence of 10μmol/L DNT;The concentrations of H2O2and ABTS are 2.0 and 2.4 mmol/L,respectively. The reaction temperature is 50℃.The reaction time is 10 min.
3.3.3 H2O2浓度的影响 研究了反应液的吸光度值随H2O2浓度在0.5~10 mmol/L范围内的变化关系。如图4所示,Fe3O4MNPs-ABTS-H2O2反应体系的吸光度值随着H2O2浓度增大而增大,当H2O2浓度大于8 mmol/L时,吸光度达到最大值。加入DNT后,反应液的吸光度值随着H2O2浓度在0.5~10 mmol/L范围内升高而呈增大趋势。当H2O2浓度为2.0 mmol/L时,二者的吸光度差值(ΔA)接近最大值。然而当H2O2增加到10 mmol/L时,ΔA反而大幅度降低,表明在反应体系中加入过量的H2O2反而不利于DNT的检测,这与文献[21]报道相似。推测主要有两个原因:(1)H2O2与DNT在Fe3O4MNPs表面上吸附存在竞争性关系,在Fe3O4MNPs含量一定的条件下,过量H2O2吸附在Fe3O4MNPs表面,会抑制DNT在Fe3O4MNPs表面的吸附,使Fe3O4MNPs表面上参与反应的DNT含量减少,进而不利于DNT的检测;(2)过量H2O2会诱导产生 —OH自由基作为自由基清除剂,抑制H2O2氧化反应的进行,降低反应效率。因此,选择2.0×10-3mol/L为最佳H2O2浓度。

图3 Fe3O4MNPs-ABTS-H2O2反应体系在不加及加入10μmol/L DNT后,吸光度值随温度变化曲线。H2O2与ABTS浓度分别为2.0和2.4 mmol/L,反应时间为10 min。Fig.3 Temperature-response curve for Fe3O4MNPs-ABTS-H2O2in the absence and presence of 10μmol/L DNT.The concentration of H2O2and ABTS is 2.0 and 2.4 mmol/L,respectively.The reaction time is 10 min

图4 Fe3O4MNPs-ABTS-H2O2反应体系在不含有DNT及加入10μmol/L DNT后,其吸光度值随H2O2浓度变化曲线;其中ABTS浓度为2.4 mmol/L,反应温度和反应时间为50℃和10 min。Fig.4 H2O2concentration-response curve for Fe3O4MNPs-ABTS-H2O2in theabsenceand presenceof 10μmol/L DNT. The concentration of ABTS is 2.4 mmol/L.The reaction temperature and time is 50℃and 10 min,respectively
3.3.4 ABTS浓度 考察了ABTS浓度在0.02~4.0 mmol/L范围内反应液的吸光度值的变化情况。如图5所示,在Fe3O4MNPs-ABTS-H2O2反应体系中,无论是否加入DNT,反应液的吸光度值均随着ABTS浓度的增大而增大。当ABTS浓度大于3.2 mmol/L时,吸光度值趋于稳定。当ABTS浓度为2.4 mmol/L时,二者的吸光度差值(ΔA)接近最大值。而当ABTS浓度为4.0 mmol/L时,ΔA降低,这是由于ABTS与DNT均可与H2O2反应,二者存在一定竞争关系。当ABTS浓度过量时,会抑制DNT与H2O2反应,使得H2O2与DNT反应中消耗的H2O2量变少,从而不利于DNT的检测。因此选择ABTS最佳浓度为2.4 mmol/L。
3.3.5 反应时间的优化 考察了反应时间对该反应体系的影响。如图6所示,对于Fe3O4MNPs-ABTS-H2O2-DNT和Fe3O4MNPs-ABTS-H2O2反应体系,反应体系的吸光度值均随反应时间的增加而线性增大,而且前者的斜率略小于后者。当反应时间大于10 min,二者的吸光度差值(ΔA)变化不大,为节约反应时间,本工作确定10 min为最佳反应时间。
通过对实验参数的优化,确定反应体系的最佳条件为:反应温度为50℃,反应时间为10 min,H2O2浓度为2.0 mmol/L,ABTS浓度为2.4 mmol/L。
3.4 线性范围、检出限、重现性及稳定性
在最优化实验条件下,测定Fe3O4MNPs-ABTS-H2O2-DNT反应体系中,加入不同浓度的DNT后的吸光度值。如图7所示,417 nm处的吸光度值与DNT浓度在5×10-7~2.0×10-5mol/L范围内呈线性关系,检出限为1.5×10-7mol/L(S/N=3),低于文献[22,23]报道的采用大孔碳材料及分子印迹材料修饰电极电化学检测DNT的检测限,表明在Fe3O4MNPs催化作用下,所建立的检测方法对DNT具有较高的灵敏度。
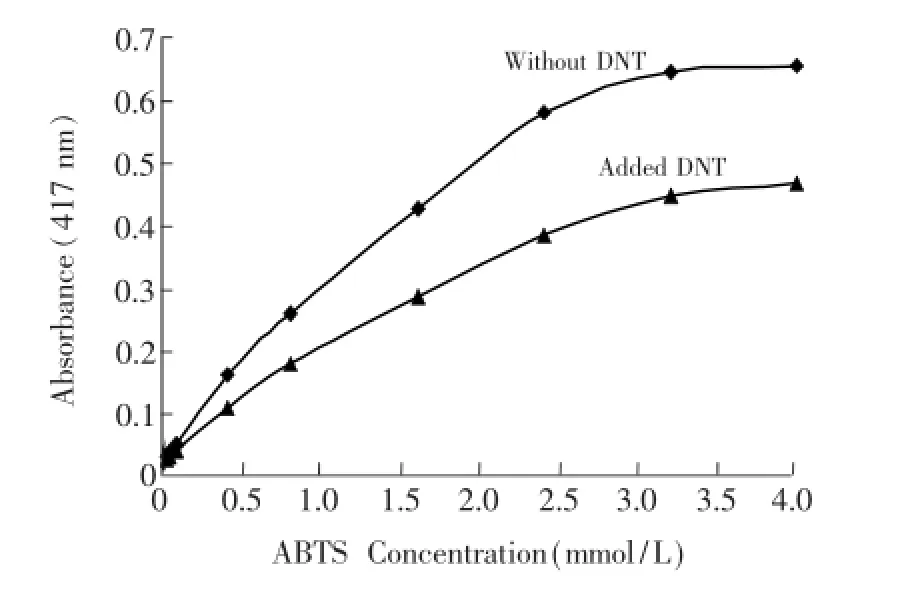
图5 Fe3O4MNPs-ABTS-H2O2反应体系在不含有DNT及加入10μmol/L DNT后,其吸光度值随ABTS浓度变化曲线;其中H2O2浓度为2.0 mmol/L,反应温度为50℃,反应时间为10 min。Fig.5 ABTS concentration-response curve for Fe3O4MNPs-ABTS-H2O2system in the absence and presence of 10μmol/L DNT;The concentration of H2O2and ABTS is 2.0 and 2.4 mmol/L,respectively.Reaction temperature is 50℃ and reaction time is 10 min,respectively.

图6 Fe3O4MNPs-ABTS-H2O2反应体系在不含有DNT及加入10μmol/L DNT后,吸光度值随反应时间变化曲线;其中 H2O2与 ABTS浓度分别为2.0和2.4 mmol/L,反应温度为50℃。Fig.6 Reaction time-response curve for Fe3O4MNPs-ABTS-H2O2system in the absence and presence of 10μmol/L DNT,respectively. The concentration of H2O2and ABTS is 2.0 and 2.4 mmol/L.The reaction temperature is 50℃
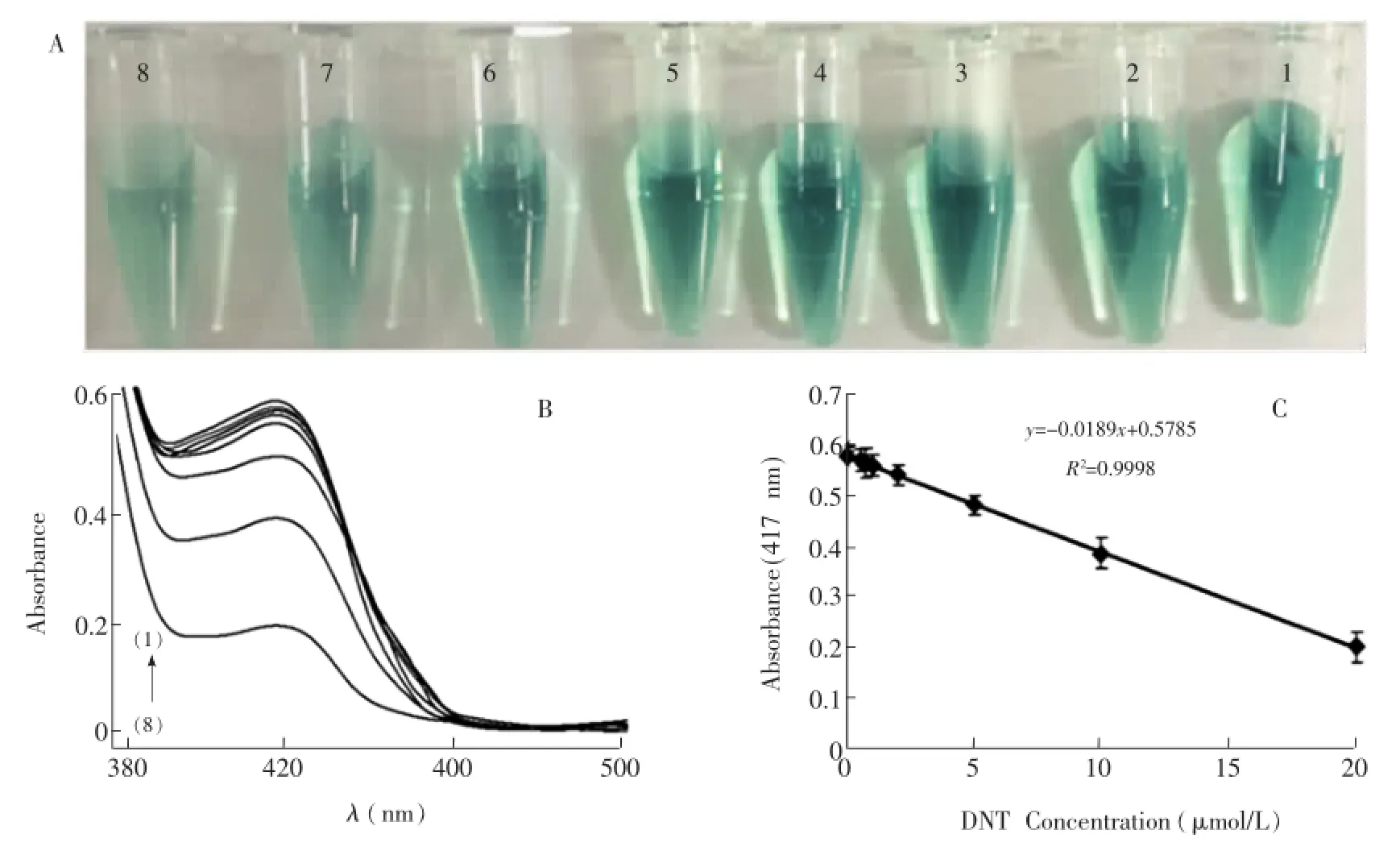
图7 Fe3O4MNPs-ABTS-H2O2-DNT反应体系在加入不同浓度DNT后溶液颜色变化(A)以及吸收光谱(B)。其中反应温度为50℃,反应时间为10 min,H2O2浓度为2.0 mmol/L,ABTS浓度为2.4 mmol/L。所加入DNT浓度分别为(1)0,(2)0.5,(3)0.75,(4)1.0,(5)2.0,(6)5.0,(7)10,(8)20μmol/L。图(C)为反应体系在417 nm处吸光度值与DNT浓度线性关系曲线。Fig.7 Typical photographs(A)and absorption spectra(B)of Fe3O4MNPs-ABTS-H2O2-DNT reaction solutions incubated at 50℃ for 10 min in the presence of different concentrations of DNT:(1)0,(2)0.5,(3)0.75,(4)1.0,(5)2.0,(6)5.0,(7)10,(8)20μmol/L,respectively.2.0 mmol/L H2O2,2.0 mmol/L ABTS. (C)gives the linear correlation between the DNT concentrations and absorbance at 417 nm.
在5组Fe3O4MNPs-ABTS-H2O2反应体系中,分别加入5.0μmol/L DNT,测定的吸光度值相对标准偏差仅为2.5%,表明建立的比色分析法对DNT的检测具有良好的重现性。另外,采用所建立的方法对5.0μmol/L DNT每天测定一次,连续测定10天,吸光度值的相对标准偏差仅为3.5%,表示所建立的检测方法具有很好的稳定性。
3.5 实际水样测定
将所建立的方法用于河水样品DNT的分析测定,考察所建立检测方法的实用性。在两种水样中均未检出DNT。在上述水样中DNT的标准加入实验结果如表1所示。在河水样品中DNT的平均回收率为85.0%~95.1%,RSD小于5.0%(n=5),表明在实际样品测定中,采用本方法所得实验数据可靠,有望用于其它环境水样的分析。

表1 实际水样中回收率的测定Table 1 Recoveries of DNT in spiked water samples(n=5)
4 结论
四氧化三铁磁性纳米颗粒由于具有类过氧化物酶的催化活性,可以催化H2O2氧化ABTS反应,同时可以催化H2O2氧化DNT反应,消耗反应物H2O2。基于上述原理,本研究构建了Fe3O4MNPs-ABTS-H2O2-DNT反应体系,体系在417 nm处的吸光度值与DNT浓度在5× 10-7~2.0×10-5mol/L呈良好的线性关系,检出限为1.5×10-7mol/L(S/N=3),所建立的比色分析方法简便、快速、灵敏、可靠,在现场快速监测环境中硝基苯类化合物方面具有潜在应用价值。根据文献[21,24]报道,Fe3O4MNPs还可以催化多种过氧化物酶底物(如硝基苯类化合物、芳香胺化合物、酚类化合物等)与H2O2反应。因此,基于该反应原理,本研究所建立的反应体系也适用于其它硝基苯类化合物、芳香胺化合物、酚类化合物的检测。本工作为Fe3O4MNPs模拟酶在硝基苯类化合物、芳香胺化合物、酚类化合物等环境污染物的快速检测应用及相关理论研究开辟了新途径,提供了重要参考。
1 HUANG Hua-Bin,ZHUANG Zhi-Xia,YANG Chao-Yong,WANG Xiao-Ru.Chinese J.Anal.Chem.,2014,42(11): 1598-1603
黄华斌,庄峙厦,杨朝勇,王小如.分析化学,2014,42(11):1598-1603
2 CHEN Shuai,YAO Jian-Lin,GUO Qing-Hua,GU Ren-Ao.Spectroscopy and Spectral Analysis,2011,31(12):3169-3174
陈帅,姚建林,郭清华,顾仁敖.光谱学与光谱分析,2011,31(12):3169-3174
3 Liu Y,Yuan M,Qiao L J,Guo R.Biosens.Bioelectron.,2014,52(1):391-396
4 WEI Xiao-Ping,TAN Yan-Ji,LI Jian-Ping.Chinese J.Anal.Chem.,2015,43(3):424-428
魏小平,谭艳季,李建平.分析化学,2015,43(3):424-428
5 Gao L Z,Zhuang J,Nie L,Zhang J B,Zhang Y,Gu N,Wang T H,Feng J,Yang D L,Perrett S,Yan X Y.Nat.Nanotechnol.,2007,2(9):577-583
6 Wei H,Wang E.Anal.Chem.,2008,80(6):2250-2254
7 Ding N,Yan N,Ren C L,Chen X G.Anal.Chem.,2010,82(13):5897-5899
8 Liang M M,Fan K L,Pan Y,Jiang H,Wang F,Yang D L,Lu D,Feng J,Zhao J J,Yang L,Yan X Y.Anal.Chem.,2013,85(1):308-312
9 Yang M Z,Guan Y P,Yang Y,Xia T T,Xiong W B,Wang N,Guo C.J.Colloid Interface Sci.,2013,405(1): 291-295
10 Shi G Y,Qu Y H,Zhai Y Y,Liu,Y,Sun Z Y,Yang J G,Jin L T.Electrochem.Commun.,2007,9(7):1719-1724
11 Chen X,Cheng X Y,Gooding J J.Anal.Chem.,2012,84(20):8557-8563
12 Sablok K,BhallaV,Sharma P,Kaushal R,Chaudhary S,Suri C R.J.Hazard.Mater.,2013,248-249(1):322-328
13 GAO Song,LIU Yuan-Yuan,LIU Na,LV Chun-Xin,WANG Lin,ZHANG Lan-Ying,PANG Ying-Ming.Chinese J. Anal.Chem.,2012,40(9):1353-1359高松,刘园园,刘娜,吕春欣,王琳,张兰英,庞英明.分析化学,2012,40(9):1353-1359
14 Gingras A,Sarette J,Shawler E,Lee T,Freund S,Holwitt E,Hicks B W.Biosens.Bioelectron.,2013,48(1): 251-257
15 Liang Y,Gu L,Liu X Q,Yang Q Y,Kajiura H,Li Y M,Zhou T S,Shi G Y.Chem.Eur.J.,2011,17(21): 5989-5997
16 Preiss A,Bauer A,Berstermann H M,Gerling S,Haas R,Joos A,Lehmann A,Schmalz L,Stinbach K.J.Chromatogr. A,2009,1216(25):4968-4975
17 Chen W S,Juan C N,Wei K M.Chemosphere.,2005,60(8):1072-1079
18 Matta R,Hanna K,Chiron S.Sci.Total Environ.,2007,385(1-3):242-251
19 Lee K B,Gu,M B,Moon S H.Water Res.,2003,37(5):983-992
20 Yang Q Y,Liang Y,Zhou,T S,Shi G Y,Jin L T.Electrochem.Commun.,2008,10(8):1176-1179
21 Wang N,Zhu L H,Wang M Q,Wang D L,Tang H Q.Ultrason.Sonochem.,2010,17(1):78-83
22 Fierke M A,Olson E J,Bühlmann P,Stein A.Appl.Mater.Interfaces,2012,4(9):4731-4739
23 Apodaca D C,Pernites R B,Del Mundo F R,Advincula R C.Langmuir.,2011,27(11):6768-6779
24 Zhang,S X,Zhao X L,Niu H Y,Shi Y L,Cai Y Q,Jiang G B.J.Hazard.Mater.,2009,167(1-3):560-566
This work was supported by the National Natural Science Foundation of China(No.31301494).
Fe3O4Magnetic Nanoparticles as Peroxidase Mimetics Used in Colorimetric Determination of 2,4-Dinitrotoluene
NIE Dong-Xia1,SHI Guo-Yue*2,YU Yan-Yan31(Institute of Agro-food Standards and Testing Technologies,
Shanghai Academy of Agricultural Sciences,Shanghai 201403,China)
2(Department of Chemistry,East China Normal University,Shanghai 200062,China)
3(Department of Pharmaceutical Analysis,Xuzhou Medical College,Xuzhou 221004,China)
Fe3O4magnetic nanoparticles(Fe3O4MNPs)were prepared by co-precipitation method,which possessed intrinsic peroxidase-like activity.It was found that the as-prepared Fe3O4MNPs could not only catalyze the oxidation of peroxidase substrate,diammonium 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonate)(ABTS)by H2O2to produce the colored product with maximum absorbance at 417 nm,but also catalyze the oxidation of 2,4-dinitrotoluene(DNT)by H2O2and thus consume H2O2in the reaction system.On the basis of the reaction described above,a novel colorimetric reaction system based on Fe3O4MNPs-ABTS-H2O2-DNT was established for determination of trace amount of DNT.Some key influencing factors of the proposed Fe3O4MNPs-ABTS-H2O2-DNT system were systematically discussed and optimized.Under the optimal conditions,the absorbance of the system at 417 nm displayed a good linear response with DNT concentration in the range from 5×10-7to 2.0×10-5mol/L with a detection limit of 1.5 ×10-7mol/L(S/N=3).These results demonstrated that the constructed colorimetric method was simple,rapid and sensitive enough for colorimetric detection of DNT,which would have a great potential in the application of on-line monitoring of DNT in environmental water samples.
2,4-Dinitrotoluene;Ferroferric oxide magnetic nanoparticles;Peroxidase mimetics;Colorimetric method
20 April 2015;accepted 15 October 2015)
10.11895/j.issn.0253-3820.150319
2015-04-20收稿;2015-10-15接受
本文系国家自然科学基金(No.31301494)项目资助
* E-mail:gyshi@chem.ecnu.edu.cn

