携带不同HBV抗原基因片段的重组腺相关病毒转染树突状细胞诱导CTL的效应研究*
安 选,刘 勇,向 毅,魏 芳,夏莉娜,钟 庆,杜 彪,巫贵成△
(1.重庆三峡中心医院肝病中心,重庆 404000;2.美国阿肯色医科大学,小石城 72205)
·论著·doi:10.3969/j.issn.1671-8348.2016.27.001
携带不同HBV抗原基因片段的重组腺相关病毒转染树突状细胞诱导CTL的效应研究*
安选1,刘勇2,向毅1,魏芳1,夏莉娜1,钟庆1,杜彪1,巫贵成1△
(1.重庆三峡中心医院肝病中心,重庆 404000;2.美国阿肯色医科大学,小石城 72205)
目的了解携带不同HBV抗原基因片段的重组腺相关病毒(rAAV-HBV-S、C、E、X)转染慢性乙型肝炎患者来源的树突状细胞(DC)诱导细胞毒性T淋巴细胞(CTL)的效应。方法采用携带不同HBV抗原基因片段的rAAV-HBV-S、C、E、X转染慢性乙型肝炎患者外周血中分离出的单核细胞,并在GM-CSF、IL-4和TNF-α作用下继续培养7 d获得成熟的DC。通过观察DC的状态和流式细胞仪(FACS)检测各段HBV转染后DC分化抗原(CD)的表达,评价其成熟与功能。将同一个体的DC与T细胞混合培养制备CTL,通过四甲基偶氮唑盐(MTS)细胞杀伤实验研究被激活的CTL对HBV感染的靶细胞HepG2.2.15特异性的细胞毒作用。结果不同HBV抗原基因rAAV-HBV-S、C、E、X 转染DC后CD14、CD80、CD83、CD86的表型表达中,CD80、CD83差异有统计学意义(P<0.05);rAAV/HBV-X转染的DC其CD80表达最高,rAAV/HBV-S转染的DC其CD83表达最高。转染不同HBV抗原基因片段rAAV(S、C、E、X)的DC诱导的CTL对MHC-Ⅰ类抗原阳性且有HBV的靶细胞(HepG2.2.15)的特异性杀伤效率显著高于对无HBV的靶细胞(HepG2)的非特异性杀伤效应(P<0.01),但不同rAAV-HBV组间差异无统计学意义(P>0.05)。结论rAAV-HBV-S、C、E、X转染DC均可诱导CTL引起MHC-Ⅰ依赖的特异性细胞毒效应。
肝炎病毒,乙型;树突细胞;T淋巴细胞,细胞毒性;人主要组织相容性复合物;腺相关病毒
慢性乙型病毒性肝炎的治疗目前仍然是临床医师面临的重大挑战,主要的药物有核苷(酸)类药物和干扰素两大类[1];前者虽然具有较好的抑制病毒复制的作用,却由于血清学应答率容易复发而难以停药,后者虽然血清学应答优于前者,但抗原转阴和转换率仍然不理想[2-3]。因此,寻求新的方法以期实现满意以至理想的治疗终点一直是近年来临床工作者追求的目标[4]。本研究旨在比较以腺相关病毒(adenovirus associated virus,AAV)2型为载体,携带不同乙型肝炎基因片段S(C基因型)、C、E、X即重组腺相关病毒(rAAV-HBV-S,C,E,X)感染树突状细胞(DCs)诱导细胞毒性T淋巴细胞(CTL)的细胞毒效应,为慢性乙型肝炎免疫治疗提供理论依据。
1 材料与方法
1.1主要试剂及重组腺相关病毒GM-CSF、IL-4、TNF-α等细胞因子购自美国Peprotech公司,AIM-V培养基购自美国Gibco公司。人HBV-S、E、C和X抗体购自美国Chemicon公司,荧光FITC标记二抗及同型对照购自美国BD公司。rAAV-HBV-S、E、C、X病毒由美国阿肯色州立医科大学基因治疗中心刘勇教授惠赠,其构建、扩增和纯化均在阿肯色州立医科大学基因治疗中心完成,病毒滴度可以达到107copy/mL以上。靶细胞人肝癌细胞系HepG2及HepG2.2.15细胞株购自中国典型培养物保藏中心(CCTCC)。HepG2.2.15细胞是在HepG2细胞转染了HBV基因并稳定表达HBV的细胞株。
1.2主要仪器流式细胞仪(FACS,美国Millipore公司),高速离心机(美国Thermo公司),酶标仪(美国Thermo公司)。
1.3研究对象与靶细胞人主要组织相容复合物Ⅰ类分子(MHC-Ⅰ)HLA配型按照2010年《慢性乙型肝炎防治指南》的诊断标准,经过伦理委员会同意,在知情同意的基础上选取重庆三峡中心医院18~60岁e抗原阳性的慢性乙型病毒性肝炎住院患者为研究对象,排除甲、丙、丁、戊型病毒性肝炎,酒精性肝炎,自身免疫性肝炎,药物性肝炎,重型乙型肝炎和肝癌。抽取患者的外周血分离单个核细胞与实验靶细胞(HepG2及HepG2.2.15细胞)进行MHC-Ⅰ类抗原位点检测配型。
1.4DC的分离培养和转染rAAV-HBV-S、E、C和X用淋巴细胞分离液分离外周血单个核细胞(PBMCs)后,将细胞重悬于AIM-V培养基中,于六孔培养板中37 ℃,6% CO2培养3 h,将未贴壁细胞用PBS轻洗后用含有重组IL-2(终浓度为20 U/mL)的AIM-V培养基重悬后以2×106/孔加入到六孔板中用于T细胞(CTL的前期细胞)体外诱导扩增,隔日换半量换液备用。在贴壁细胞中每孔分别加入100 μL重组rAAV-HBV-S、E、C和X病毒(按照每1×108细胞加入200 μL的比例,MOI相当于400)感染细胞,同时在AIM-V培养基中加入900 U/mL GM-CSF于37 ℃,6%CO2,过夜培养。病毒感染后第1天,将细胞培养上清液去除。隔天半量更换培养液,同时加入GM-CSF(终浓度为900 U/mL)和IL-4(终浓度为1 000 U/mL)。在培养第5天加入10 ng/mL TNF-α,培养第7天收获细胞。
1.5rAAV-HBV-S、E、C和X重组病毒感染DC的检测流式细胞仪间接荧光法检测DC内HBV相应抗原的表达:将感染的DC经PBS洗涤3次后,用4%多聚甲醛室温固定15 min,750 r/min离心5 min,弃上清液;将穿透剂(含1% BSA,0.1%皂素,0.24% Hepes的PBS)按每1×106个细胞加入1.5 mL的比例加入,室温作用15 min后离心弃上清液。在细胞沉淀中加入10 μL抗HBV相应抗体室温闭光标记60 min,洗涤后加FITC标记的二抗,再用穿透剂洗涤一次,500 μL的PBS重悬细胞,上机检测。
1.6DC成熟状态的检测将收获的两组细胞用PBS 洗涤两遍后,1 200 r/min离心5 min,弃上清液,细胞沉淀用50 μL含1% 胎牛血清的PBS 重悬。细胞管中加入抗CD14-FITC、抗CD80-CY5各20 μL,在细胞管中加入抗CD83-FITC,抗CD86-CY5各20 μL,同时做一管FITC/PE/CY5三标同型对照,闭光标记30 min后,各管分别加入3 mL PBS洗涤两遍,1 200 r/min,离心5 min,弃上清液,细胞沉淀用500 μL PBS重悬,上机检测。
1.7DC诱导CTL在6孔板内,以AIM-V为培养基,参照前期实验及文献[5]研究报道按DC∶T =1∶20的比例混合DC和T细胞.同时加入IL-2(终浓度为100 U/mL)以及IL-7(终浓度为40 U/mL)共培养,每隔1天半量换液,以充分诱导激活特异性的CTL。
1.8四甲基偶氮唑盐(MTS)法分析HBV特异性的CTL 杀伤作用使用CellTiter 96 AQerous One Solution Cell Proliferation Assay 试剂盒,收获HBV抗原特异性AAV激活的成熟CTL,并按照20∶1(前期研究结果最佳效靶比)将其与靶细胞(转染HBV基因的HepG2.2.15细胞或无HBV的HepG2细胞)混合并接种于96孔板中,置于37 ℃,6%CO2培养箱中。孵育6 h后,加入MTS试剂,再置于37℃,6%CO2培养箱孵育1 h后,使用酶标仪读取波长为570 nm的吸光度(A)值,计算杀伤率。杀伤率(%)=[1-(实验孔A值-效应孔A值)/靶细胞孔A值]×100%。
1.9流式细胞仪间接荧光细胞内染色检测HBV目的基因的表达分别使用4种携带不同HBV抗原的AAV感染单核细胞,使用AIM-V培养基、GM-CSF、IL-4、TNF-α等试剂将其在7 d内诱导为成熟的DC细胞,收获DC细胞,进行流式胞内检测处理后,使用流式细胞仪检测4种HBV抗原的表达率。

2 结 果
2.1HLA配型靶细胞(HepG2及HepG2.2.15细胞)与慢性乙型肝炎患者外周血进行MHC-Ⅰ成功配型,保证被激活的CTL细胞特异性杀伤靶细胞具有严格的MHC-Ⅰ型限制性。
2.2DC细胞的体外培养分离出的PBMCs于AIM-V培养液中培养4 h即有部分细胞贴壁,经rAAV-HBV感染刺激后,在含有GM-CSF/IL-4/TNF-α的AIM-V培养液中,单核细胞向DC分化及成熟。各实验组AAV感染组在细胞形态及细胞数量上差异无统计学意义(P>0.05)。
2.3不同rAAV感染DC效率FACS检测感染DC中荧光标记的阳性细胞内HBV-S、C、E、X相应抗原的表达,分别为86.87%、85.03%、89.51%和89.40%,各组间差异无统计学意义(P>0.05),见表1。
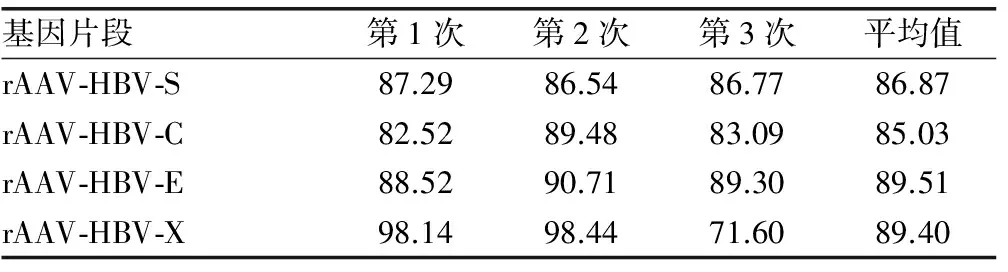
表1 携带不同HBV基因片段腺相关病毒感染效率(%)
2.4DC细胞表型的检测携带不同乙肝病毒抗原的rAAV感染外周血单核细胞后,在含有GM-CSF/IL-4/TNF-α的AIM-V培养液中,单核细胞向DC分化及成熟。在培养后第6天,流式分析收获DC的表型CD14、CD80、CD83、CD86,组间CD80和CD83的表达差异有统计学意义(P<0.05),其中CD80以rAAV-HBV-X为最高,CD83以rAAV-HBV-S最高,见表2和图1。
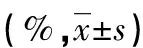
表2 携带不同HBV基因片段腺相关病毒对DC的表型和功能的影响

图1流式细胞仪检测不同HBV基因片段腺相关病毒转染DC对其表型的影响
2.5不同rAAV-HBV转染DC 诱导的CTL特异性的细胞毒效应rAAV-HBV-S、C、E、X转染DC诱导的CTL特异性的杀伤靶细胞HepG2.2.15(表达HBV抗原的靶细胞)与对照组HepG2(不表达HBV抗原的靶细胞)相比均差异有统计学意义(P<0.01),但不同基因片段之间对HepG2.2.15靶细胞的杀伤作用差异无统计学意义(P>0.05),见图2和表3。
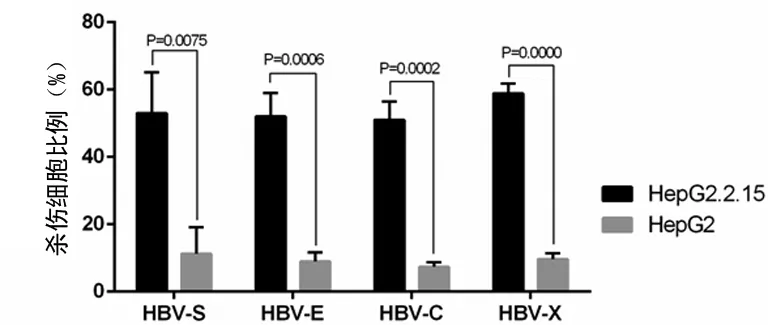
图2 携带乙型肝炎基因片段的rAAV转染DC诱导的CTL对靶细胞的杀伤效应
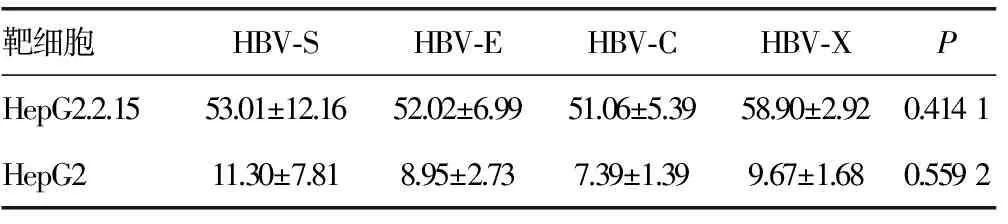
靶细胞HBV⁃SHBV⁃EHBV⁃CHBV⁃XPHepG2.2.1553.01±12.1652.02±6.9951.06±5.3958.90±2.920.4141HepG211.30±7.818.95±2.737.39±1.399.67±1.680.5592
3 讨 论
乙型肝炎是一个免疫相关性疾病,其中树突状细胞在HBV清除与慢性化中扮演了重要角色。以乙型肝炎疫苗负载的DC治疗乙型肝炎有一定的效果[6-7];但由于疫苗作为蛋白质抗原半衰期短、降解快,刺激DC不充分而效果不理想,如果用HBV基因片段转染树突状细胞诱导CTL治疗慢性乙型病毒性肝炎,有可能克服乙型肝炎疫苗负载DC刺激不充分的缺点[8-10]。
AAV是一种安全和稳定的载体,已被美国FDA宣布为最安全、最理想的病毒载体[11];以负载肿瘤基因的AAV在肿瘤治疗上已有较多的研究[12-14]。文献[15-16]已证明经扩增纯化的携带HBV的C基因片段的重组AAV能高效转染DC,并促进其成熟和功能表达,也能刺激CTL引起细胞的毒效应。本研究进一步比较了携带HBV S、C、E、X 4种基因片段的重组AAV转染DC后诱导CTL的细胞毒效应。不同rAAV刺激DC表型表达有一定差异,其中CD80和CD83差异有统计学意义,其中CD80以rAAV-HBV-X为最高,CD83以rAAV-HBV-S最高。
尽管在刺激DC表型的表达上携带不同HBV基因片段的rAAV-HBV-S、C、E、X之间差异有统计学意义,但4种抗原基因均能诱导CTL的特异性杀伤效应,4组间差异无统计学意义。提示4种基于重组腺相关病毒转染树突状细胞的治疗慢性乙型肝炎技术均可能成为治疗慢性乙型病毒性肝炎的新方向,有必要进行临床研究进一步评价。
[1]中华医学会肝病学分会、中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志,2011,19(1):13-24.
[2]顾生旺,高凯旋,刘欢.树突状细胞治疗42例核苷(酸)类似物和(或)干扰素经治慢性乙型肝炎患者的临床研究[J/CD].中国肝脏病杂志(电子版),2015,7(3):85-88.
[3]HagiwaraS,NishidaN,KudoM.AntiviraltherapyforchronichepatitisB:Combinationofnucleosideanalogs and interferon[J].World J Hepatol,2015,7(23):2427-2431.
[4]Minami M.Future therapy for hepatitis B virus infection[J].Clin J Gastroenterol,2015,8(4):167-171.
[5]Liu Y,Chiriva-Internati M,You C,et al.Use and specificity of breast cancer antigen/milk protein BA46 for generating anti-self-cytotoxic T lymphocytes by recombinant adeno-associated virus-based gene loading of dendritic cells[J].Cancer Gene Ther,2005,12(3):304-312.
[6]Manzoor S,Saalim M,Imran M,et al.Hepatitis B virus therapy:What′s the future holding for us? [J].World J Gastroenterol,2015,21(44):12558-12575.
[7]Liu T,Song HL,Zheng WP,et al.Inhibition of HBV replication in HepG2.2.15 cells by human peripheral blood mononuclear cell-derived dendritic cells[J].Ann Clin Lab Sci,2015,45(5):495-501.
[8]邱燕,杨彬,柳纪省.重组腺相关病毒载体的研究进展[J].生物技术通报,2012,11:49-53.
[9]You CX,Shi M,Liu Y,et al.AAV2/IL-12 gene delivery into dendritic cells (DC) enhances CTL stimulation above other IL-12 applications Evidence for IL-12 intracrine activity in DC[J].Oncoimmunology,2012,1(6):847-855.
[10]刘勇,吴邦富,胡媛媛.抗HBV-DC联合药物治疗乙型肝炎病毒携带者的临床疗效[J].中国药物经济学,2014,9(z1):37-38.
[11]Gaudet D,Méthot J,Déry S,et al.Efficacy and long-term safety of alipogene tiparvovec(AAV1-LPL S447X) gene therapy for lipoprotein lipase deficiency:an open-label trial[J].Gene Ther,2013,20(4):361-369.
[12]Büning H,Perabo L,Coutelle O,et al.Recent developments in adeno-associated virus vector technology[J].J Gene Med,2008,10(7):717-733.
[13]Rey-Rico A,Cucchiarini M.Controlled release strategies for rAAV-mediated gene delivery[J].Acta Biomater,2016,29(29):1-10.
[14]Dai SL,Zhuo M,Song LL,et al.Dendritic cell-based vaccination with lentiviral vectors encoding ubiquitinated hepatitis B core antigen enhances hepatitis B virus-specific immune responses in vivo[J].Acta Biochim Biophys Sin (Shanghai),2015,47(11):870-879.
[15]丛敏,王萍,阎钟钰,等.含乙型肝炎病毒C基因的重组腺相关病毒对树突状细胞的作用[J].中华肝脏病杂志,2005,13(1):17-19.
[16]You H,Liu Y,Cong M,et al.HBV genes induce cytotoxic T-lymphocyte response upon adeno-associated virus (AAV) vector delivery into dendritic cells[J].J Viral Hepat,2006,13(9):605-612.
Study on the killing effect of cytotoxic T lymphocytes induced by dendritic cells transduced recombinant adenovirus associated virus with different hepatitis B virus gene fragment*
An Xuan1,Liu Yong2,Xiang Yi1,Wei Fang1,Xia Lina1,Zhong Qing1,Du Biao1,Wu Guicheng1△
(1.ChongqingThreeGorgesCentralHospital,Chongqing404000,China;2.Gene&BiotherapyCenter,UniversityofArkansasforMedicalSciences,LittleRock,Arkansas72205,USA)
ObjectiveTo compare the killing effect of cytotoxic T lymphocytes(CTLs) induced by dendritic cells transduced recombinant adenovirus associated virus(rAAV)with different hepatitis B virus gene fragment(rAAV-HBV-S,C,E,X).MethodsPeripheral blood mononuclear cells(PBMCs) from chronic hepatitis B patients were isolated and transduced recombinant adeno-associated virus with different hepatitis B virus (HBV) antigen gene fragment (rAAV-HBV-S,C,E,X),then GM-CSF,IL-4 and TNFα were added to cultivate for 7 days to generate mature dendritic cells (DCs).The state of DCs were observed and differentiation antigen molecules (CD)were detected by flow cytometry(FACS)to evaluate their maturation and function.Cytotoxic T lymphocytes (CTLs) were induced by the mixed cuture of DCs with prepared T lymphocytes.HepaG2.2.15 and HepaG2 were targed cells and the killing effect of CTLs wered compared using MTS assay.ResultsThe expression of phenotype CD14,CD80,CD83,CD86 from DCs transduced with rAAV-HBV-S,C,E,X were compared,respectively.Of which,CD80,CD86 were significantly different(P<0.05).CD80 in group rAAV-HBV-X was the highest,and CD83 in group rAAV-HBV-S was the highest.Cytotoxic effect of CTL induced by DC transduced with HBV antigen gene fragment of rAAV (S,C,E,X) to target cells with HBV (HepG2.2.15 cells) were significantly higher than that of without HBV target cells (HepG2 cells) (P<0.01),but the four groups were no significant difference,respectively(P>0.05).ConclusionHBV-S,C,E,X genes all induce MHC-I dependently cytotoxic T-lymphocytes specific response based adeno-associated virus (AAV) vector delivery into dendritic cells.
hepatitis B virus;dendritic cells;T-lymphocytes,cytotoxic;major histocompatibihity complex;adeno-associated virus
重庆市自然科学基金资助项目(csts2012jjA10110)。作者简介:安选(1978-),主治医师,硕士,主要从事各种肝病的研究。△
,E-mail:351094703@qq.com。
R392.12
A
1671-8348(2016)27-3745-03
2016-04-18
2016-07-06)

