酿酒酵母糖酵解途径的动态模拟
张 元 圣, 田 晶, 高 鹏
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.中国科学院大连化学物理研究所 分离分析化学重点实验室, 辽宁 大连 116023 )
酿酒酵母糖酵解途径的动态模拟
张 元 圣1,2,田 晶1,高 鹏2
( 1.大连工业大学 生物工程学院, 辽宁 大连116034;2.中国科学院大连化学物理研究所 分离分析化学重点实验室, 辽宁 大连116023 )
利用葡萄糖脉冲对酿酒酵母厌氧连续培养物施加扰动,通过不同时间点取样,定量细胞内外主要化合物的含量。利用测定的数据和细胞内糖酵解途径模型进行各反应途径的参数估计,结果发现实际测量值与预测值接近。代谢控制分析发现,糖酵解途径中,磷酸果糖激酶、己糖激酶和己糖转运系统具有较大的通量控制系数。随机改变细胞内外化合物的浓度对细胞能荷状态的模拟结果显示,酿酒酵母能在1 min内将细胞的能荷状态恢复到初始水平。
酿酒酵母;糖酵解;动态模拟
0 引 言
酿酒酵母是最先完成基因组测序并且在工业生物技术领域被广为使用的单细胞真核生物。随着认识能力和认识手段的不断提高和改善,经验式的单个基因的遗传操作已经很难满足大幅度提高目标产物产量的目的。因此代谢工程的概念在20世纪90年代初被提出,并不断在实践中得到发展和完善[1],继而代谢通量分析(metabolic flux analysis, MFA)、代谢控制分析(metabolic control analysis, MCA)等许多方法都被引入代谢工程领域,以辅助更好地了解细胞的代谢特征和筛选潜在的改造靶点。但是无论MCA还是MFA都基于一个基本的假设和前提——细胞处于代谢的拟稳态[2-3]。但实际发酵过程中拟稳态通常很难实现,而且细胞的生长代谢是个动态过程,仅仅考察一个状态下的特征不能反映细胞的真实代谢特性和代谢潜能,而动态模拟(dynamic modeling)却能反映出细胞的瞬时代谢特征[4],在应用上不受细胞培养状态的限制。动态模拟的一个主要障碍来源于细胞内许多代谢过程的动力学参数相对缺乏[5],因此对细胞进行实时动态分析显得尤为重要。许多胞内代谢物的转换时间非常短暂,特别是中间代谢产物和辅因子,比如ATP和6-磷酸葡萄糖的转换时间都在1~2 s[6],相应的快速取样装置也应运而生,并且伴随产生了一系列分析测定方法。在本研究中,结合实际工艺需要,为了获取厌氧糖酵解过程中的所有动力学参数,首先对处于拟稳态的酿酒酵母培养物施加葡萄糖底物脉冲,在不同时间点取样,分别测定细胞内外主要化合物的量,以该数据进行参数估计。利用所得数据分别进行MCA和细胞能荷状态模拟,找到糖酵解途径的关键控制步骤并分析细胞对能荷状态的调整情况。
1 材料与方法
1.1菌株和培养方法
酿酒酵母菌株为CEN.PK113-7D培养基为葡萄糖限制培养基[7]。连续培养稀释速率为D=0.1 h-1,补料速率为0.2 L/h,葡萄糖浓度为277.7 mmol/L,培养温度为30 ℃,2.0 L厌氧发酵罐KLF 2000(Bioengineering,Wald,瑞士)内培养。厌氧条件实现为1.76 L/min恒流氮气。2 mol/L NaOH 控制pH=5.0。该条件下恒化培养物CDW为3.491 g/L。培养液中比生物量为420 g/L(以细胞溶质体积计)。经7倍罐体积后施加4.682 mL的400 g/L葡萄糖脉冲。细胞内和发酵液内化合物测定使用GC-MS和HPLC方法完成[8-9],取样间隔2 s。
1.2模型和软件
厌氧酿酒酵母的糖酵解模型参考文献[10],微分方程和反应方程式见参考文献[11]。参数估计利用SBPD和SBTOOLBOX 2.0在Matlab v7.4平台下完成。MCA和能荷模拟利用COPASI 4.5软件完成。
2 结果与讨论
2.1参数估计结果
细胞内化合物在稳态条件下的浓度见表1[12]。参数估计利用测定的葡萄糖脉冲后不同时间点的细胞内AMP、ADP、ATP、NAD,果糖-6-磷酸(F6P),葡萄糖-6-磷酸(G6P),丙酮酸(Pyr)和磷酸烯醇式丙酮酸(PEP)的浓度信息进行拟合。参数估计的结果见图1,从图中可见实际测量值与利用参数估计值对化合物细胞内含量的计算基本吻合,说明模型参数基本合理[8]。
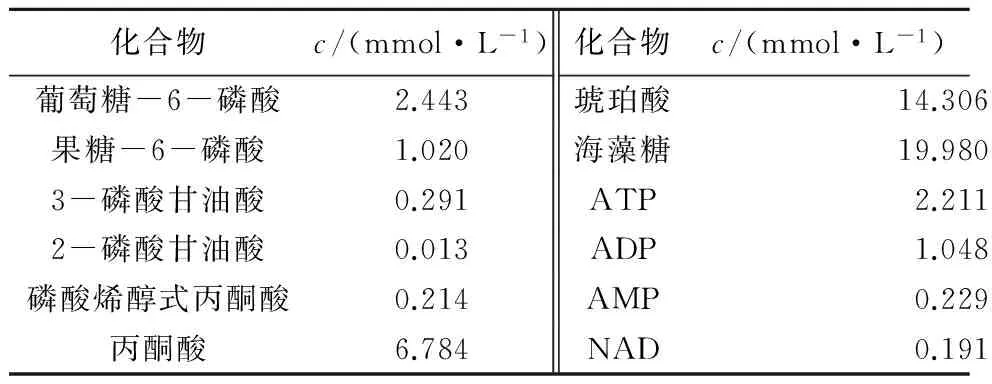
表1 细胞内部分化合物稳态条件下的浓度
2.2MCA结果
利用“2.1”模型参数,系统可以达到一个稳态,对该状态下的MCA分析结果发现,有3个酶的催化步骤的通量控制系数(FCC)最大,分别是HXT、HK和PFK,如图2所示。
2.3能荷模拟结果
随机改变细胞内化合物的浓度在1/2~2倍、细胞外葡萄糖浓度在20~80 mmol/L,模拟时长5 min。做200次细胞内的能荷状态模拟,结果如图3所示。从图3中可见,细胞在1 min内将能荷状态调整到初始水平为0.8左右。
动态模拟在以下方面具有其他计算生物学方法所不具备的优势:(1)可以通过模拟过程动态跟踪某化合物或过程的变化细节;(2)能通过对细胞内相对容易定量的化合物推算无法定量或不容易准确定量的化合物,因此动态模拟比静态分析能提供更多细节信息。本研究中发现影响细胞厌氧状态下糖酵解途径的限速步骤主要体现在初始几个步骤,特别是葡萄糖利用的第一步具有较大的FCC,几乎都超过0.5。而传统意义上认为的限速步骤即PFK催化的不可逆反应的FCC不足0.2,说明葡萄糖的吸收速度决定了糖酵解途径的运转效率。此结果的发现与文献[9]中的描述相一致。该结果也提示在提高目标产物的改造中,可能更应该关注葡萄糖转运体的特征,因为已有资料证实酿酒酵母在12和30 ℃生长时,糖酵解途径的酶并无显著表达量变化,但HXT表达量却显著不同,因此证明代谢控制比基因表达量的变化对糖酵解途径的效率影响更为显著[11]。
能量代谢是细胞进行其他生理活动的基础,在葡萄糖限制性培养基和有氧条件下,酿酒酵母通常能维持能荷状态在0.8~0.9[12]。虽然保持
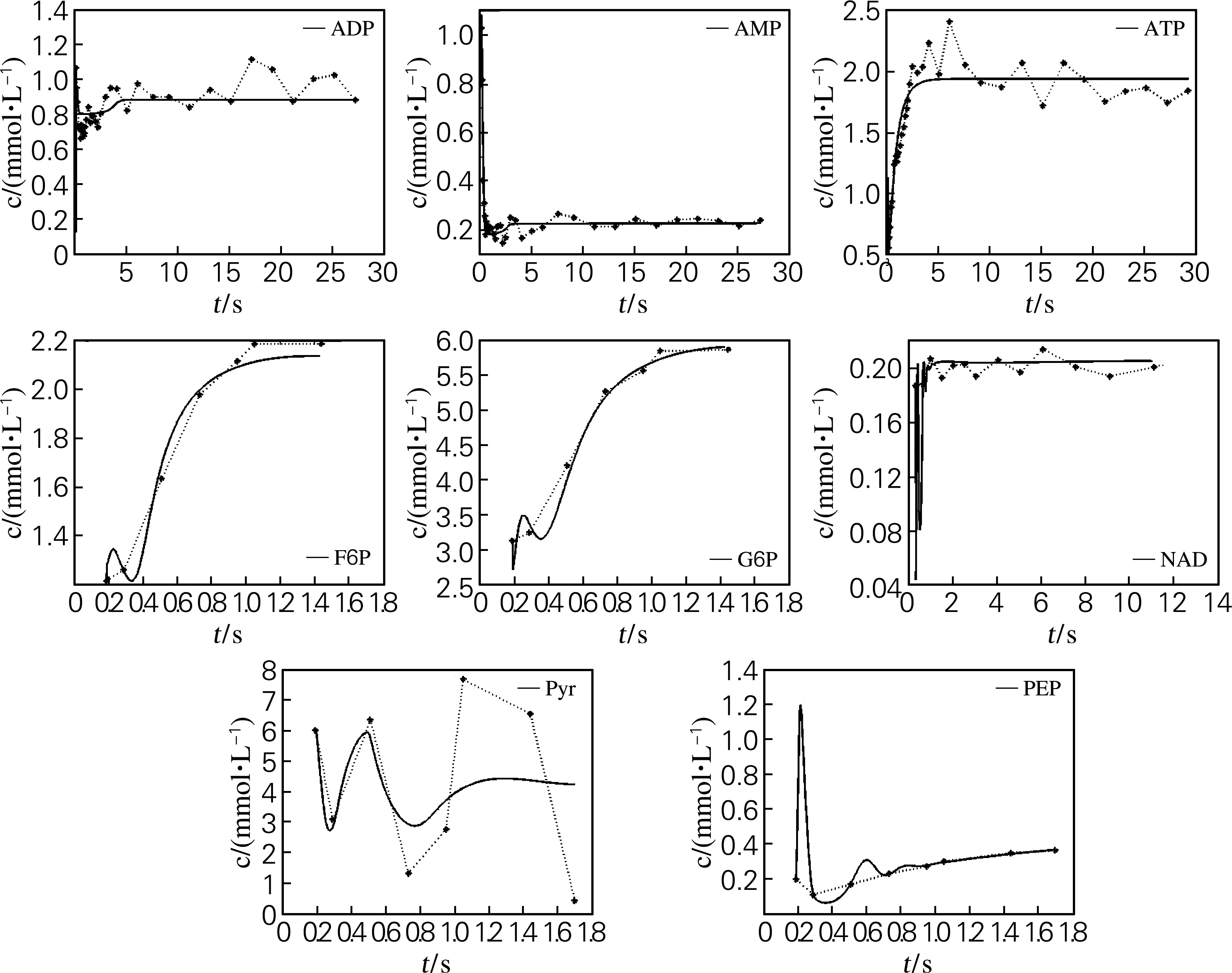
图1 细胞内化合物预测结果(实线)与实际结果(虚线)的比较
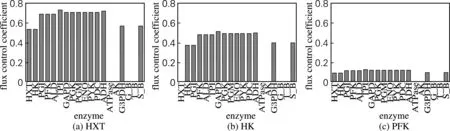
图2 3种通量控制系数较大的酶的通量控制系数比较
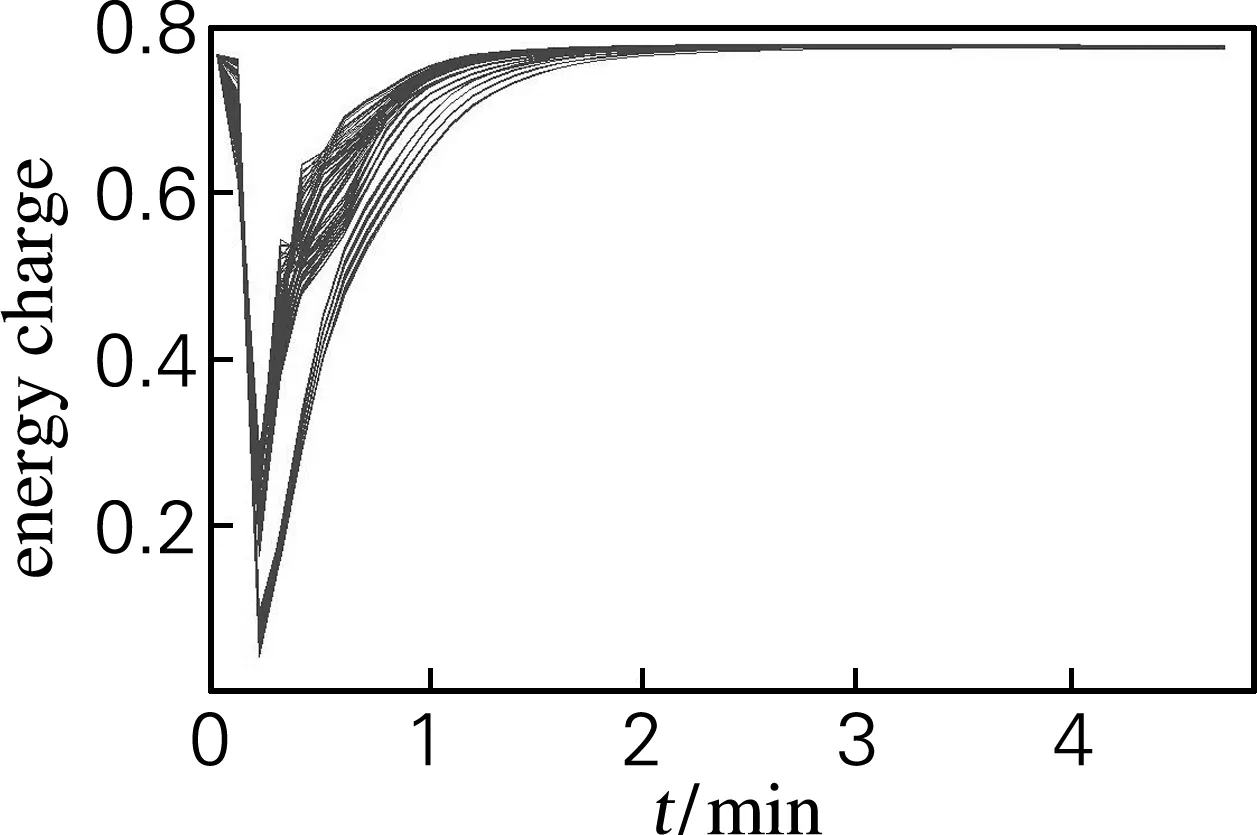
图3 随机模拟细胞内能荷变化
能量代谢的稳定十分重要,但是能荷状态并不总是十分稳定,比如在同型乳酸发酵过程中,ATP可以被大量消耗而低水平的再生,细胞虽然仍能保持生活状态,但是合成代谢等许多基本活动会受到抑制[13]。在不同温度培养条件下,低温会导致能荷水平一定程度的提高,以满足代谢需要[10]。本研究的结果提示,在一定范围内的代谢物浓度变化,仅在初始阶段会显著降低细胞的能荷状态,但是随后细胞就会在极短时间内将其恢复到初始状态水平,图1中的结果也提示细胞内多数代谢物的大幅度波动都发生在最初1 min内,说明细胞对外界的变化响应十分迅速。
3 结 论
本研究通过测定葡萄糖脉冲扰动后酿酒酵母厌氧连续培养物细胞内外主要化合物的含量变化,并以此为基础结合细胞内糖酵解途径模型进行了各反应途径的参数估计,证明糖酵解途径中,磷酸果糖激酶、己糖激酶和己糖转运系统具有较大的通量控制系数,同时细胞能荷状态的模拟显示,酿酒酵母能在1 min内将细胞的能荷状态恢复到初始水平。
[1] BAILEY J. Toward a science of metabolic engineering[J]. Science, 1991, 252(5013): 1668-1675.
[2] CASCANTE M, BOROS L G, COMIN-ANDUIX B, et al. Metabolic control analysis in drug discovery and disease[J]. Nature Biotechnology, 2002, 20(3): 243-249.
[3] WIECHERT W, M LLNEY M, PETERSEN S, et al. A universal framework for13C metabolic flux analysis[J]. Metabolic Engineering, 2001, 3(3): 265-283.
[4] USUDA Y, NISHIO Y, IWATANI S, et al. Dynamic modeling ofEscherichiacolimetabolic and regulatory systems for amino-acid production[J]. Journal of Biotechnology, 2010, 147(1): 17-30.
[5] OVADI J, SRERE P A. Metabolic consequences of enzyme interactions[J]. Cell Biochemistry and Function, 1996, 14(4): 249-258.
[6] 孙茂成,李艾黎,霍贵成,等.乳酸菌代谢组学研究进展[J].微生物学通报,2012,39(10):1499-1505.
[7] THEOBALD U, MAILINGER W, BALTES M, et al.Invivoanalysis of metabolic dynamics inSaccharomycescerevisiae: I. experimental observations[J]. Biotechnology and Bioengineering, 1997, 55(2): 305-316.
[8] RIZZI M, BALTES M, THEOBALD U, et al.Invivoanalysis of metabolic dynamics inSaccharomycescerevisiae: II. mathematical model[J]. Biotechnology and Bioengineering, 1997, 55(4): 592-608.
[9] CHASSAGNOLE C, NOISOMMIT-RIZZI N, SCHMID J W, et al. Dynamic modeling of the central carbon metabolism ofEscherichiacoli[J]. Biotechnology and Bioengineering, 2002, 79(1): 53-73.
[10] KELL D B, PRITCHARD L. Schemes of flux control in a model ofSaccharomycescerevisiaeglycolysis[J]. European Journal of Biochemistry, 2002, 269: 3894-3904.
[11] CHRISTOPHE C, NARUEMOL N R, JOACHIM W. Dynamic modeling of the central carbon metabolism ofE.coli[J]. Biotechnology and Bioengineering, 2002, 79(5): 53-57.
[12] VISSER D, van der HEIJDEN R, MAUCH K, et al. Tendency modeling: a new approach to obtain simplified kinetic models of metabolism applied toSaccharomycescerevisiae[J]. Metabolic Engineering, 2000, 2(3): 252-275.
[13] TAI S L, DARAN-LAPUJADE P, LUTTIK M A, et al. Control of the glycolytic flux inSaccharomycescerevisiaegrown at low temperature: a multi-level analysis in anaerobic chemostat cultures[J]. Journal of Biological Chemistry, 2007, 282(14): 10243-10251.
[14] BALL W, ATKINSON D E. Adenylate energy charge inSaccharomycescerevisiaeduring starvation[J]. Journal of Bacteriology, 1975, 121(3): 975-982.
[15] ABBOTT D A, van den BRINK J, MINNEBOO I M, et al. Anaerobic homolactate fermentation withSaccharomycescerevisiaeresults in depletion of ATP and impaired metabolic activity[J]. FEMS Yeast Research, 2009, 9(3): 349-357.
Dynamic modeling glycolysis pathway ofSaccharomycescerevisiae
ZHANGYuansheng1,2,TIANJian1,GAOPeng2
( 1.School of Biological Engineering, Dalian Polytechnic University, Dalian 116034, China;2.Key Laboratory of Separation Science for Analytical Chemistry, Dalian Institute of Chemical Physics,Chinese Academy of Sciences, Dalian 116023, China )
AglucosepulsewasexertedonthecontinuouscultureofSaccharomyces cerevisiae.Themajorintercellularmetabolitesweredeterminedfromculturessampledatdifferenttimepoints.Parameterestimationwasconductedusingthequantitationdataandaglycolysismodel,whichshowedagoodmatchoftheobservedandcalculatedresults.Metaboliccontrolanalysisshowedthathexosetransportsystem,hexosekinaseandphosphofructokinasehadhighfluxcontrolcoefficients.Simulationresultperformedbyrandomlychangingtheinter-andintra-cellularconcentrationsofthemetabolitesindicatedthatcellscouldrestoretheirenergychargestateswithinoneminute.
Saccharomycescerevisiae; glycolysis; dynamic modeling
2015-03-13.
辽宁省自然科学基金资助项目(2013020167).
张元圣(1989-),男,硕士研究生;通信作者:田 晶(1966-),女,教授.
TS261.1;Q932
A
1674-1404(2016)05-0313-04
张元圣,田晶,高鹏.酿酒酵母糖酵解途径的动态模拟[J].大连工业大学学报,2016,35(5):313-316.
ZHANG Yuansheng, TIAN Jian, GAO Peng. Dynamic modeling glycolysis pathway ofSaccharomycescerevisiae[J]. Journal of Dalian Polytechnic University, 2016, 35(5): 313-316.

