清开灵注射液中水难溶性成分在不同条件下的表观溶解度测定△
刘瑞新,李宇辉,高晓洁,史新元,乔延江*
(1.河南中医学院第一附属医院 药学部,河南 郑州 450000;2.河南中医学院,河南 郑州 450008;3.北京中医药大学 中药学院,北京 100102)
清开灵注射液中水难溶性成分在不同条件下的表观溶解度测定△
刘瑞新1,2,李宇辉2,高晓洁2,史新元3,乔延江3*
(1.河南中医学院第一附属医院 药学部,河南 郑州 450000;2.河南中医学院,河南 郑州 450008;3.北京中医药大学 中药学院,北京 100102)
目的测定清开灵注射液中3种水难溶性成分黄芩苷(BCL)、胆酸(CA)、猪去氧胆酸(HA)在不同条件下的表观溶解度,为增溶研究提供基础。方法将BCL、CA、HA制成水及不同pH值缓冲液的饱和溶液,采用HPLC法,借鉴《中华人民共和国药典》2010版一部中清开灵注射液中难溶性成分含量测定方法进行测定。结果(25.0±0.5)℃、pH 5.78的去离子水中,BCL的表观溶解度为0.048 7 mg·mL-1,为“几乎不溶或不溶”范畴;CA的表观溶解度为0.147 9 mg·mL-1,为“极微溶解”范畴;HA的表观溶解度非常小,在该高效液相色谱-二级阵列管检测器(HPLC-DAD)条件下未能检出;但在一定pH范围的缓冲溶液中,BCL、CA、HA的溶解度随pH增大而激增,在pH 7.6的缓冲液中,BCL、CA的溶解度分别相当于pH 5.78的去离子水中的1555倍、131倍。结论在不同pH条件下,3种水难溶性成分的表观溶解度差异较大,应调节适宜的pH以满足制剂质量标准中对各成分含量的要求。
清开灵注射液;表观溶解度;黄芩苷;胆酸;猪去氧胆酸
溶解性是制药工业的重要课题[1]。现代制药工业中公认,新发现的候选药物平均有多于40%的是水难溶的[2]。中药品种繁多、成分复杂、性质各异,其有效成分从小分子到大分子,从水溶性到脂溶性甚至脂水均难溶都有存在。目前亦有较多通过体外方法证明有一定药理活性、具备开发潜力的中药成分或成分群,常因其溶解性不佳而无法直接制成用于临床的、安全、有效、稳定的制剂[3-4]。此外,中药制剂尤其是中药液体制剂[5],在其制备或储藏过程中,可能因杂质未除尽、pH值不适当,或各种成分之间互相增溶,使药液暂时处于稳定状态,而在放置过程中极易发生氧化、聚合及pH值的改变,导致不溶性物质逐渐生成而使微粒数增加[6],最终出现浑浊、沉淀、乳光等现象[7],甚至引发一系列不良反应等[8-9]。因此,除前期对某些单体难溶性成分进行结构修饰,如结合增溶基团等化学方法之外,寻找适宜的药剂学方法解决中药难溶性成分的增溶问题意义重大[10-12],这也是中药制剂研究中的关键和热点问题之一。
清开灵注射液(QKL)由北京中医药大学研制,衍生于清代吴鞠通《温病条辨》中的安宫牛黄丸,由胆酸、猪去氧胆酸、水牛角(粉)、珍珠母(粉)、黄芩苷等组成,是国家中医药管理局推荐治疗急性热病必备的中成药,为临床常用药。方中胆酸(Cholic Acid,CA)、猪去氧胆酸(Hyodeoxycholic Acid,HA)代替了传统的牛黄作为君药,黄芩苷(Baicalin,BCL)为佐药,三者溶解度均低于10 mg·mL-1,属微溶(为广义难溶范畴),在制备和贮藏过程中有可能受pH、温度、工艺过程等因素的影响而沉淀析出。
本文对清开灵注射剂中3个难溶性成分的表观溶解度等物理、化学属性进行研究,为后续的增溶研究提供依据[13]。笔者主要研究了3个水难溶性成分在去离子水、不同pH的磷酸盐缓冲液中的表观溶解度,以及某些成分在乙醇中的表观溶解度。在新药研发过程中重视水难溶性成分,在遵循中医方剂组方的基础上,要确保液体制剂中水难溶性有效成分的含量达到标准。
1 材料
1.1 试药
BCL、CA、HA标准品(中国药食品药品检定研究院,批号分别为110715-200514,100078-200414,100087-200610);BCL原料(山东鲁抗大禹制药有限公司,批号:08041150,经实际测定纯度以BCL标准品计为93.2%);CA原料(福建仙游生化有限公司,批号:08040947,经实际测定纯度以CA标准品计为97.7%);HA原料(福建仙游生化有限公司,批号:07092265,经测定纯度以HA标准品计为79.8%);甲醇、乙腈为色谱纯;水为去离子水、娃哈哈纯净水;其他试剂均为分析纯。
1.2 仪器
Agilent-1100高效液相色谱仪(包括在线脱气机、四元泵、自动进样器、柱温箱、DAD二极管阵列检测器、HP ChemStation数据处理工作站);Waters 2695 高效液相色谱仪、2996型DAD二极管阵列检测器、Millennium 色谱管理工作站;Sartorius BP211D型电子天平;PHS-3C精密pH计(上海雷磁仪器厂);SHA-CA水浴恒温振荡器(荣华仪器);TDL-5-A台式离心机(上海安亭科学仪器厂)。
2 方法
2.1 BCL在水及不同pH值缓冲液中的表观溶解度测定
2.1.1 不同pH值缓冲液的制备 分别取一定量的十二水磷酸氢二钠(Na2HPO4·12H2O)和柠檬酸制成100 mL的不同pH的缓冲溶液[14],见表1。

表1 不同pH的缓冲液
2.1.2 饱和液制备 BCL饱和溶液的制备:称取BCL原料适量(使适当过量),置50 mL磨口三角瓶中,加适量去离子水(经实测pH 5.78)盖好,旋涡混合30 s[15],放入(25.0±0.5) ℃水浴恒温振荡器中振荡24 h,1000 r·min-1离心10 min,取上清液以0.45 μm微孔滤膜过滤,取续滤液,即得。
BCL在缓冲液中的饱和溶液的制备:分别称取BCL原料适量(使适当过量),置50 mL磨口三角瓶中,加上述不同pH的缓冲溶液,塞紧,旋涡混合30 s,放入(25.0±0.5) ℃水浴恒温振荡器中振荡24 h,1000 r·min-1离心10 min,取上清液以0.45 μm微孔滤膜过滤,取续滤液,即得。
2.1.3 含量测定方法 借鉴《中华人民共和国药典》2010版药典一部[16]中清开灵注射液中的BCL含量测定方法进行测定,经进一步的有关验证,方法可靠。色谱图见图1。
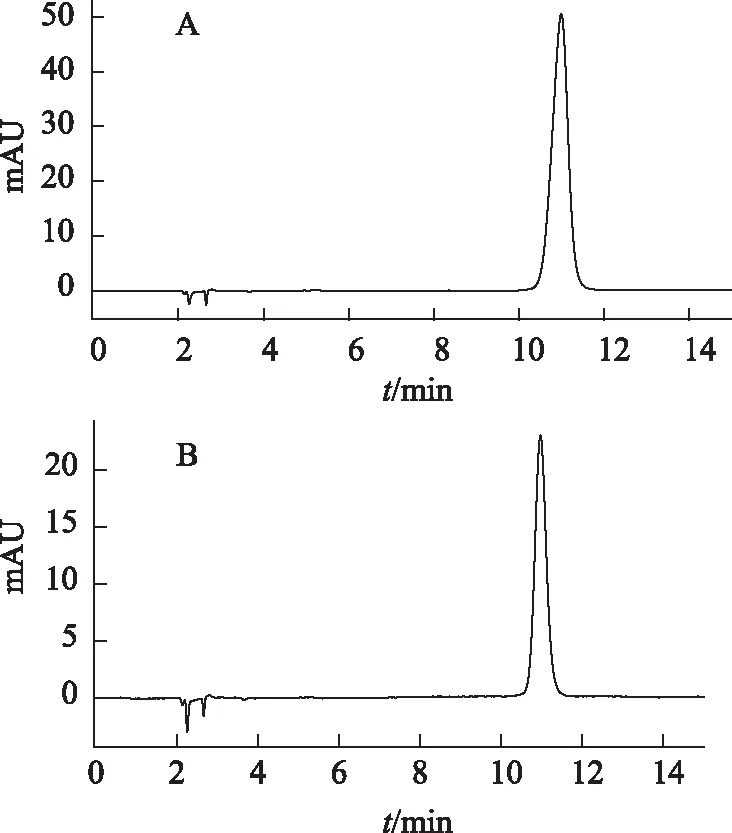
注:A.标准品;B.原料。图1 黄芩苷HPLC图
色谱条件:Agilent C18柱(250 mm×4.6 mm,5 μm);甲醇-水-磷酸(47∶53∶0.2)为流动相;检测波长为276 nm;柱温为30 ℃;流速为1 mL·min-1。
对照品溶液的制备:精密称取BCL对照品适量,置100 mL量瓶中,加70%乙醇适量,使溶解,加流动相1 mL,再加70%乙醇稀释至刻度,摇匀,制成质量浓度为0.052 9 mg·mL-1的对照品溶液Ⅰ;取对照品溶液Ⅰ,用70%乙醇稀释5倍,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液,即得对照品溶液Ⅱ(质量浓度为0.010 6 mg·mL-1)。
供试品溶液的制备:精密量取上述BCL饱和液的续滤液2.0 mL,置于10 mL容量瓶中,加70%乙醇稀释至刻度,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液,即得。
测定法:分别精密吸取对照品溶液Ⅱ与供试品溶液各10 μL,注入液相色谱仪,测定,即得。
2.2 CA在水及在不同pH值缓冲液中的表观溶解度测定
2.2.1 不同pH值缓冲液的制备 参照2.1.1。
2.2.2 饱和液制备 CA饱和溶液的制备:称取CA原料适量(使适当过量),置50 mL磨口三角瓶中,分别加适量去离子水(经实测其pH为5.78),盖好,旋涡混合30 s,放入恒温摇床中振荡24 h,1000 r·min-1离心10 min,取上清液以0.45 μm微孔滤膜过滤,取续滤液,即得。
CA在缓冲液中的饱和溶液的制备:分别称取CA原料适量(使适当过量),置50 mL磨口三角瓶中,加上述不同pH的缓冲溶液,塞紧,旋涡混合30 s,放入恒温摇床中振荡24 h,1000 r·min-1离心10 min,取上清液以0.45 μm微孔滤膜过滤,取续滤液,即得。
2.2.3 含量测定方法 借鉴《中华人民共和国药典》2010版一部[16]中清开灵注射液中的CA含量测定方法进行测定,经进一步的有关验证,方法可靠。色谱图见图2。
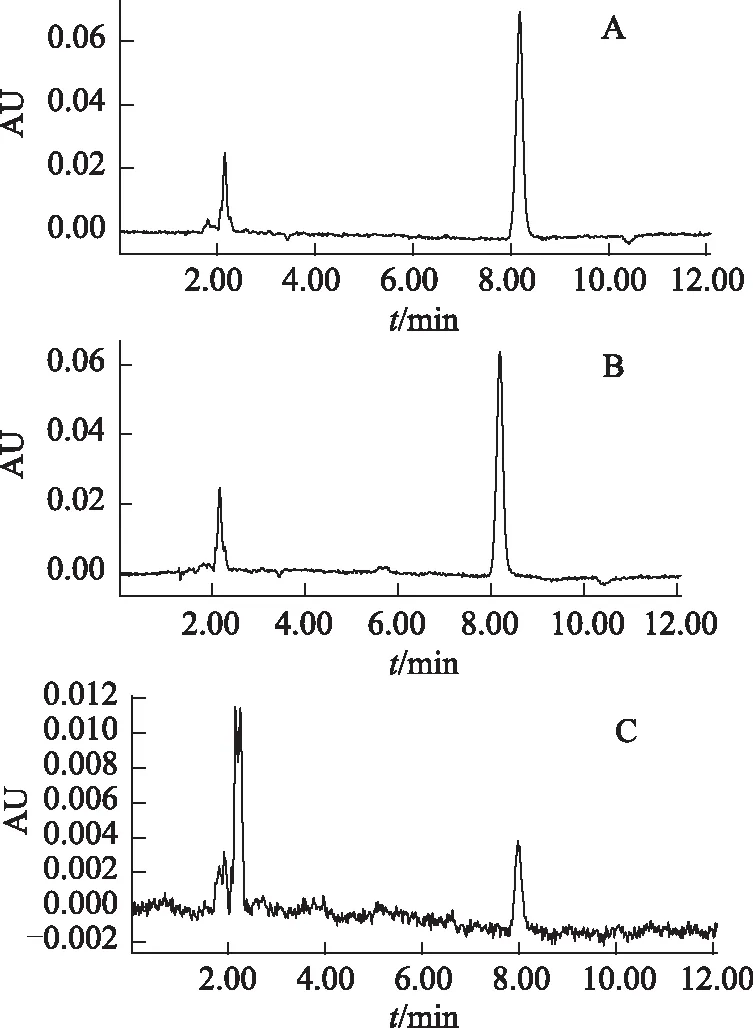
注:A.标准品;B.原料;C.样品。图2 胆酸的HPLC图
色谱条件:Agilent C18柱(250 mm×4.6 mm,5 μm);乙腈-水-磷酸(45∶55∶0.1)为流动相;检测波长为192 nm;柱温为40 ℃;流速为1 mL·min-1。
对照品溶液的制备:精密称取CA对照品适量,置10 mL量瓶中,加60%乙腈使溶解,并稀释至刻度,摇匀,制成质量浓度为1.099 mg·mL-1的CA对照品溶液Ⅰ;取对照品溶液Ⅰ,用60%乙腈稀释10倍,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液,即得CA对照品溶液Ⅱ(质量浓度为0.110 mg·mL-1)。
供试品溶液的制备:精密量取上述CA饱和液的续滤液适量,用适宜溶剂(乙腈)稀释1倍,稀释液用微孔滤膜(0.45 μm)滤过,取续滤液,即得。
测定法:分别精密吸取适宜的CA对照品溶液与供试品溶液各10 μL,注入液相色谱仪,测定,即得。
2.3 HA在水、75%乙醇(潜溶)和不同pH值缓冲液中的溶解度测定
2.3.1 不同pH值缓冲液的制备 参照2.1.1。
2.3.2 HA饱和液制备 HA饱和液制备:称取HA原料适量(使适当过量),置50 mL磨口三角瓶中,分别加适量去离子水(经实测pH 5.78)、75%乙醇、pH 7.0、pH 7.6、pH 7.8 和pH 8.0的磷酸盐缓冲液,盖好,旋涡混合30 s,放入恒温摇床中振荡24 h,1000 r·min-1离心10 min,取上清液以0.45 μm微孔滤膜过滤,取续滤液,即得。
2.3.3 含量测定方法 借鉴《中华人民共和国药典》2010版一部[16]中清开灵注射液中的HA含量测定方法以及文献方法[17]进行测定,经进一步的有关验证,方法可靠。色谱图见图3。
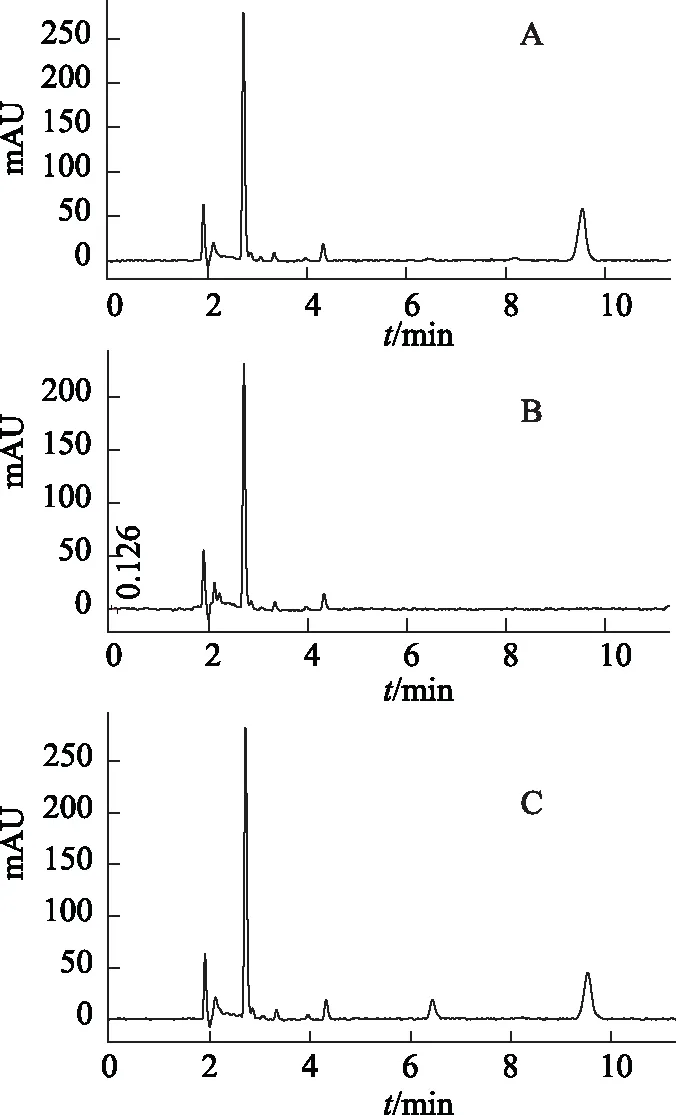
注:A.标准品;B.原料;C.样品。图3 猪去氧胆酸的HPLC图
色谱条件:同2.2.3。
对照品溶液的制备:精密称取HA对照品适量,置10 mL量瓶中,加60%乙腈使溶解,并稀释至刻度,摇匀,制成质量浓度为1.028 mg·mL-1的HA对照品溶液Ⅰ;取对照品溶液Ⅰ,用60%乙腈稀释10倍,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液,即得HA对照品溶液Ⅱ(质量浓度为0.102 8 mg·mL-1)。
供试品溶液的制备:精密量取上述HA饱和液的续滤液适量,用适宜溶剂(适宜浓度的乙腈)稀释1倍,稀释液用微孔滤膜(0.45 μm)滤过,取续滤液,即得。
测定法:分别精密吸取适宜的HA对照品溶液与供试品溶液各10 μL,注入液相色谱仪,测定,即得。
3 结果与讨论
3.1 BCL、CA、HA在水中的表观溶解度
(25.0±0.5)℃、pH 5.78的去离子水中,BCL原料中BCL表观溶解度以BCL对照品计,为0.048 7 mg·mL-1,属几乎不溶或不溶范畴。CA原料中CA的表观溶解度以CA对照品计,为0.147 9 mg·mL-1,属极微溶解范畴。HA原料中HA的表观溶解度非常小,在该HPLC-DAD条件下未能检出。从后续试验中不同pH缓冲液中的溶解度及检测器的检测限推断,其溶解度应远低于0.3 mg·mL-1,应属极微溶解范畴或更低溶解度范畴。文献[18]中为0.06 mg·mL-1(20 ℃),属几乎不溶或不溶范畴。此外,在(25.0±0.5)℃、75%乙醇中,在该测定条件下,HA原料中HA的表观溶解度为187.3 mg·mL-1。
清开灵注射液质量标准对HA的浓度未做适当限定和要求。按照其处方组成,假定制备工艺的收率为80%,其浓度应为3.0 mg·mL-1。从上述结果可以看出,其溶解度远远达不到该浓度。在75%乙醇中,其溶解度较大,故制备工艺中采用75%乙醇溶解。但因其在水中和中性缓冲液中的溶解度非常小,故水沉步骤HA的损失非常大。
3.2 BCL、CA、HA在不同pH缓冲液中的表观溶解度
结果见图4。
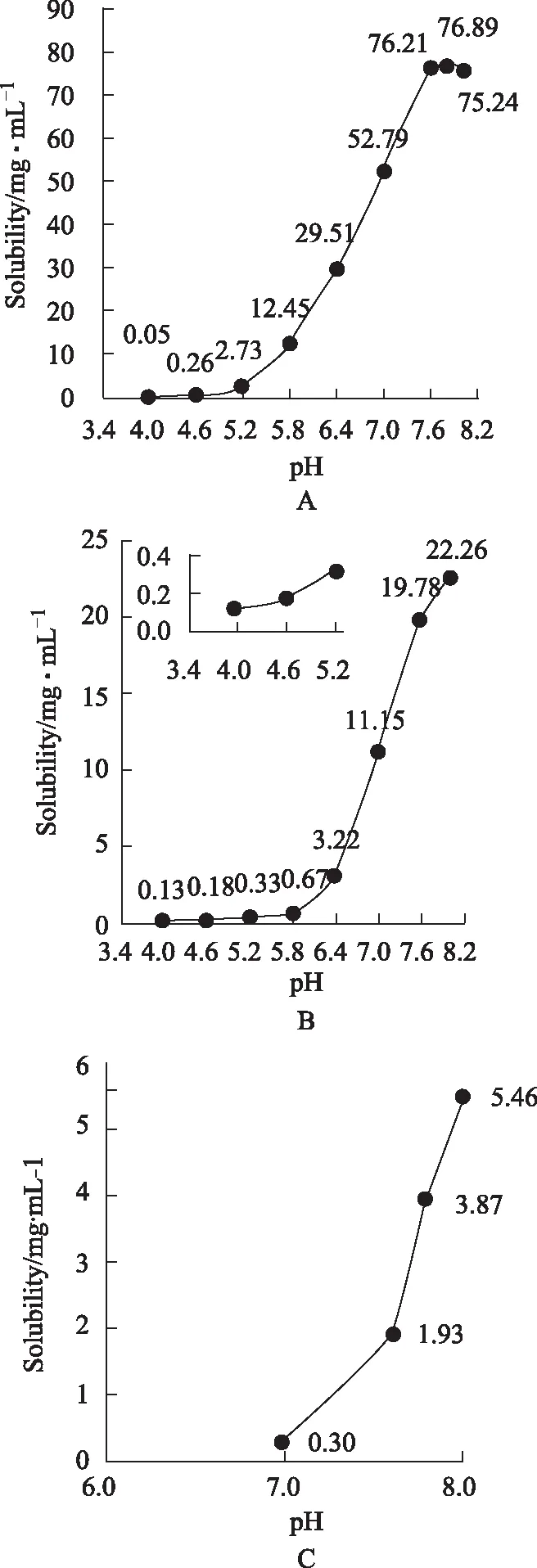
注:A.BCL;B.CA;C.HA。图4 不同pH环境难溶性成分的表观溶解度
由图可知,三成分溶解度均随pH升高而显著升高。结果显示,BCL、CA、HA自身溶解度均非常小,但在一定pH范围内,其溶解度随pH增大而激增。如在pH 7.6的缓冲液中,BCL、CA的溶解度分别相当于pH 5.8的去离子水中的1555倍、131倍。按中华人民共和国药典标准,在该溶解度条件下,随着pH值由4.0逐渐增加至7.8,BCL溶解性能逐步由极微溶解(0.1~1 mg·mL-1)变化至溶解(33~100 mg·mL-1);随着pH值由4.0逐渐增加至8.0,CA溶解性能逐步由极微溶解(0.1~1 mg·mL-1)变化至略溶(10~33 mg·mL-1)。
BCL在pH 7.6~8.0时,其溶解度不再升高,甚至有所降低。这是因为BCL在碱性条件下不稳定,发生化学变化,使得溶解度不再随pH升高而继续升高。由于该磷酸盐缓冲体系的最大pH为8.0,因此无法预知pH 8.0以上时BCL的溶解度情况。测试了硼酸缓冲体系在pH 8.0以上时BCL的溶解情况,发现较上述磷酸盐缓冲体系中pH 8.0处的溶解度大为降低,但随着pH升高又逐步升高。缓冲体系的差异使得二者不能统一比较。
清开灵注射液质量标准要求其pH应在6.8~7.5,BCL浓度应为3.5~5.8 mg·mL-1,CA浓度应不低于1.5 mg·mL-1。对该缓冲体系中相应pH值条件下BCL、CA的表观溶解度进行类比,其溶解度均能够达到质量标准要求。
在一定pH值范围内,可以对BCL等成分的溶解度进行直观预测。可分别给出以下预测方程:在pH 5.2~7.6时,Y=6.670X2-54.16X+103.3(r=0.998 0),在pH 4.0~5.8时,Y=2×10-7-07e3.108X(r=0.992 0)。
4 小结
结果表明,在(25.0±0.5) ℃、pH 5.78的去离子水中,BCL的表观溶解度为0.048 7 mg·mL-1,属几乎不溶或不溶范畴;CA的表观溶解度为0.147 9 mg·mL-1,属极微溶解范畴;HA的表观溶解度非常小,在该HPLC-DAD条件下未能检出;但在一定pH范围的缓冲溶液中,BCL、CA、HA的溶解度随pH增大而激增,如在pH 7.6的缓冲液中,BCL、CA的溶解度分别相当于pH 5.8的去离子水中的1555倍、131倍。根据清开灵注射液质量标准,在pH 6.8~7.5条件下,BCL浓度应为3.5~5.8 mg·mL-1,CA浓度应不低于1.5 mg·mL-1,HA的浓度未做适当限定的要求,对缓冲体系中相应pH值条件下BCL、CA的表观溶解度进行类比,其溶解度均能够达到质量标准要求。
[1] 钟慧,朱源,余江南,等.难溶性天然药物增溶方法的研究进展[J].中国中药杂志,2014,39(17):3226-3231.
[2] Liu R.Water-insoluble Drug Formulation[M].2nd ed.Crc Press,2008.
[3] 黄敬.针对不溶性药物的注射给药系统的设计和研发[C].//2014第十二届国际新药发明年会.苏州:国家外国专家局国外人才信息研究中心,2014.
[4] 李绪翠.中药注射剂质量标准与用药安全的相关性[J].药物流行病学杂志,2012,21(11):38-40.
[5] 张海燕,齐云,廖永红,等.注射剂常用增溶性药用辅料的安全与增溶研究[J].中国实验方剂学杂志,2011,17(11):1-4.
[6] 刘睿.中药注射剂质量控制的研究进展[J].中国执业药师,2013,10(03):37-42.
[7] 刘春兰,许月峰.增溶剂的增溶原理及其在制剂生产中的应用[J].中国药业,2008,17(04):13-14.
[8] 崔宏玉,梁爱华.从中药注射剂质量标准分析其不良反应成因[J].中国中药杂志,2014,39(05):934-940.
[9] 杨杰锋.中药注射剂安全性再评价管理探究及对策[D].济南:山东大学,2012.
[10] 张波,张东娜,王洪权,等.难溶性药物增溶技术的研究进展[J].解放军药学学报,2009,25(05):425-428.
[11] 宁宁.难溶性药物增溶材料的研究进展[J].新材料产业.2014(06):46-49.
[12] 汪菊芬,吴旭日,陈依军.注射用难溶药物增溶技术的研究进展[J].药物生物技术,2014,21(03):253-259.
[13] 金云峰,刘瑞新,李宇辉,等.非离子型表面活性剂对清开灵注射液中难溶性成分的增溶研究[J].中国现代中药,2016,18(02):213-218.
[14] 梁生旺.中药制剂分析[M].北京:中国中医药出版社,2003.
[15] 仇峰.黄芩苷和氧化苦参碱的物理化学性质和药物动力学研究[D].沈阳:沈阳药科大,2002.
[16] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010.
[17] 张莉,缪建国.HPLC法测定清开灵注射液中猪去氧胆酸的含量[J].中国中医药信息杂志,2007,14(10):46-47.
[18] NLM,ChemIDplus Advanced.[EB/OL] [2010-04-13].http://chem.sis.nlm.nih.gov/chemidplus/.
ApparentSolubilityDeterminationofInsolubleIngredientsinQingkailingInjectionunderDifferentConditions
LIURuixin1,2,LIYuhui2,GAOXiaojie2,SHIXinyuan3,QIAOYanjiang3*
(1.DepartmentofPharmacy,theFirstAffiliatedHospitalofHenanUniversityofTraditionalChineseMedicine(TCM),Zhengzhou450000,Henan,China; 2.HenanUniversityofTCM,Zhengzhou450008,Henan,China; 3.BeijingUniversityofChineseMedicine,Beijing100102,China)
Objective:Qingkailing Injection which contains three insoluble ingredients:baicalin (BCL),cholic acid (CA) and hyodeoxycholic acid (HA),the above three ingredients were used as research carriers and determine the Apparent Solubility under different conditions.MethodsThe saturated solution of BCL,CA,HA into water and buffer solution of different pH value,HPLC was used to determine the contents of insoluble ingredients of Qingkailing Injection and reference to “Chinese Pharmacopoeia” 2010 Edition of method.ResultsIn the deionized water (25.0±0.5) ℃,pH 5.78,the Apparent Solubility of BCL and CA were 0.048 7,0.147 9 mg·mL-1,respectively;BCL belong to the category of “very slightly soluble”,CA belong to the category of “slightly soluble”.The Apparent Solubility of HA were under the LOD by HPLC-DAD;The solubility of BCL,CA and HA all increased remarkably with buffer of a certain pH value,In buffer solution(pH 7.6),the solubility of BCL,CA were equivalent to 1555 times,131 times of the deionized water (pH 5.78),respectively.ConclusionUnder the conditions of different pH value,the difference of apparent solubility of three insoluble ingredients is relatively large,and the appropriate value should be adjusted to meet the requirements of the content of each component in the quality standard of the preparation.
Qingkailing Injection;apparent solubility;baicalin;cholic acid;hyodeoxycholic acid
2015-09-28)
国家自然科学基金(81001646);国家中医药管理局中医药行业科研专项(200708006)
*
乔延江,博士生导师,研究方向:中药质控方法学与中药信息学;Tel:(010)84738620,E-mail:yjqiao@263.net
10.13313/j.issn.1673-4890.2016.8.023

