胃动素受体在狗胃肠道的表达及比较
何 雨,王成燕,刘 彤,杨岚岚,金春香*
(1.吉林大学中日联谊医院 超声科,吉林 长春130033;2.吉林省肿瘤医院;3.吉林大学第二医院)
胃动素受体在狗胃肠道的表达及比较
何雨1,王成燕2,刘彤1,杨岚岚3,金春香1*
(1.吉林大学中日联谊医院 超声科,吉林 长春130033;2.吉林省肿瘤医院;3.吉林大学第二医院)
目的通过比较胃动素受体在狗胃肠道各部位的表达情况,探索胃动素在胃肠道各部位不同功能的结构基础。方法分别取狗胃窦、十二指肠、空肠、回肠、近段结肠、中段结肠和远段结肠,用免疫组化方法研究狗胃动素受体在胃肠道的分布,用半定量RT-PCR检测比较各部位胃动素受体mRNA的表达情况。结果除远段结肠外,在胃肠道其他部位的肠神经系统中均可检测到胃动素受体表达;但不同部位的胃动素受体mRNA表达量有显著性差异(P<0.01);胃动素受体mRNA在十二指肠的表达量最高,其次是回肠,空肠,近段结肠,胃窦和中、远段结肠。结论胃动素受体在狗胃肠道不同部位的表达量是不同的,狗胃动素受体的最高表达部位在十二指肠。
胃动素受体;狗胃肠道;表达
(ChinJLabDiagn,2016,20:1432)
胃动素是调节消化间期胃肠运动的重要激素,它通过与其受体结合诱导胃肠移行性复合肌电运动(migrating motor complex,MMC) Ⅲ相的发生[1],从而促进消化间期肠内容物向前推进,完成胃肠道机械性和化学性排空,又被称为饥饿激素。胃动素受体(motilin receptor,MTLR)作为一种G蛋白偶联受体(G-protein coupled receptor,GPR),业已成为临床治疗胃肠运动障碍性疾病的药物靶点[2],研究其在胃肠道的分布及功能对于治疗此类疾病(比如肠梗阻、肠易激综合征、功能性消化不良等)具有潜在的临床应用价值。 然而,不同种属间MTLR在胃肠道的分布是不同的,目前,在人类、树鼩、狗、牛、鼠和兔体内均有MTLR表达[3],但啮齿类动物体内却只存在一种MTLR假基因,这与该种属胃肠道在进化过程中丧失呕吐功能有关[3,4],因为胃动素的作用可引发哺乳动物的呕吐行为。 但是,兔却是唯一不会呕吐的哺乳动物,它进化过程中保留MTLR的原因是需要胃动素来调节食粪这个特殊的消化行为[5]。因此,生存环境、饮食习惯等决定了MTLR在不同种属的解剖分布及由此而衍生出的不同功能。而在同一种属胃肠道不同部位MTLR的分布情况尚不十分清楚,本研究通过比较MTLR在狗胃肠道各部位的表达情况,探索胃动素在同种属内胃肠道各部位不同功能的结构基础,有助于提高临床上以MTLR为靶点治疗的针对性和可行性。
1 材料和方法
1.1材料
该研究经过吉林大学第三医院动物医学伦理委员会批准。将6条狗(雌雄随机)禁食24小时,氯胺酮麻醉,固定四肢,暴露腹部皮肤,备皮(15 cm),强力碘消毒,切开腹部皮肤,皮下脂肪,肌肉,腹膜后进入腹腔,分别取狗的胃窦、十二指肠、空肠、回肠、近端结肠(近回盲部)、中端结肠(近横结肠)和远端结肠(近降结肠),用预冷的生理盐水冲洗所取标本至洁净,然后均匀分成两份,其中一份放入10%的中性福尔马林固定用于免疫组织化学染色;另外一份将各部位标本分装于做好标记的1.5 ml Eppendorf管中,先迅速置于液氮中速冻,之后转移至-80℃冰箱保存用于提取组织总RNA。
1.2方法
1.2.1免疫组化染色分析胃动素受体表达将组织切块,固定,石蜡包埋,切片(厚度为4 μm),烤片,常规二甲苯中脱蜡、水化、修复,PBS冲洗;用正常羊血清封闭30分钟,弃去,加入兔抗狗MTLR抗体(1∶200,由日本RaQualia,Taketoyo馈赠)4℃孵育过夜,PBS冲洗后,室温下与生物素标记的羊抗兔抗体和抗生物素偶联的辣根过氧化物酶孵育30分钟,DAB显色(Sigma,美国),酒精梯度脱水,透明,封片。 以PBS代替一抗作为阴性对照,阳性反应以出现棕黄色颗粒沉着为准。
1.2.2RT-PCR检测MTLR mRNA表达总RNA提取按Trizol试剂(Invitrogen Life Technologies,美国)说明书操作,按二步法(Takara,日本)合成cDNA,以cDNA为模板,MTLR引物序列为:5′-ACC ACC GCC TAC TTC TTC CT-3′和 5′-GCC TGT TTC CCT ACA CAC CT-3′[6],以GAPDH 作为内参,其引物序列为:5′-CCA TCA CCA TCT TCC AGG AG-3′和5′-CCT GCT TCA CCA CCT TCT TG-3′[6]。PCR反应总体积为20 μl,反应条件为94℃30 s,56℃30 s,72℃30 s,40个循环,72℃10 min。PCR产物进行1.5%琼脂糖凝胶电泳(Invitrogen,美国),应用Quantity one 4.6.2凝胶成像分析系统(美国)进行分析、观察,用内参照(GAPDH)光密度值标化MTLR mRNA的光密度值进行半定量分析,得到MTLR mRNA表达的相对含量。
1.3统计学处理
结果以均数±标准误表示,应用SPSS19.0软件进行统计分析,多组间差异采用单因素方差分析(One-way ANOVA),多个样本均数两两比较采用最小显著差法(LSD),P<0.05认为差异有统计学意义。
2 结果
2.1MTLR在狗胃肠道的分布
在胃窦、十二指肠、空肠、回肠、近段结肠、中段结肠环形肌和纵形肌之间的肌间神经纤维和肠肌间神经丛均发现MTLR的阳性表达,远段结肠内未发现MTLR的阳性表达,整个胃肠道的平滑肌内均未检测到MTLR的阳性表达(图1)。
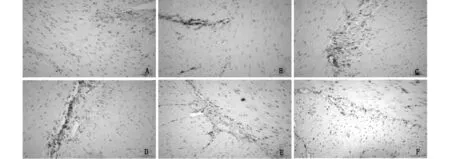
A:胃窦;B:十二指肠;C:空肠;D:回肠;E:近段结肠;F:中段结肠.图1 胃肠道各部位肠肌间神经丛MTLR的分布(SP法,×400)
2.2MTLR mRNA在狗胃肠道各部位的表达及比较
MTLR mRNA的PCR扩增产物为549 bp。六条狗的胃窦、十二指肠、空肠、回肠、近段结肠、中段结肠均扩增出目的基因片段,远段结肠均未扩增出目的基因片段(图2)。
各部位之间两两比较后显示,MTLR mRNA表达强度由高到低的排序为:十二指肠→回肠→空肠→近段结肠→胃窦→中段结肠。其中,中段结肠的表达量最少,与其他部位相比差异均有统计学意义(P<0.01),其余各部位的表达与其相邻排序部位表达之间无显著差异,但与其不相邻排序部位表达差异有统计学意义(P<0.01)(表1,图3)。
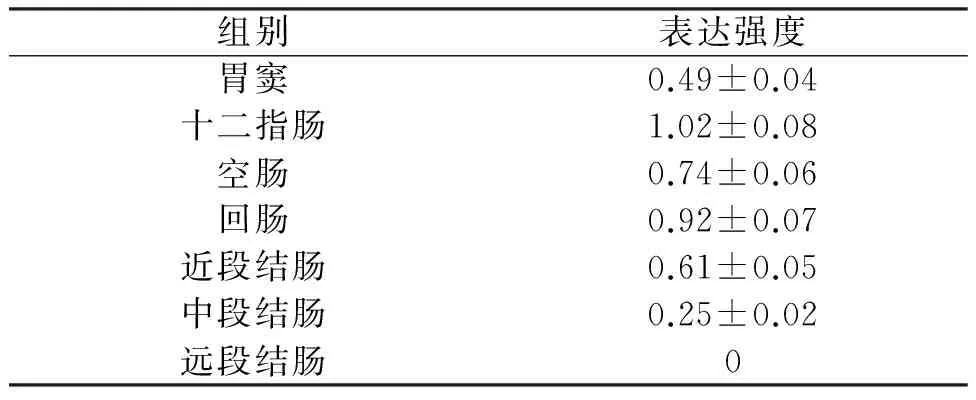
表1 MTLR mRNA在胃肠道各部位的表达强度
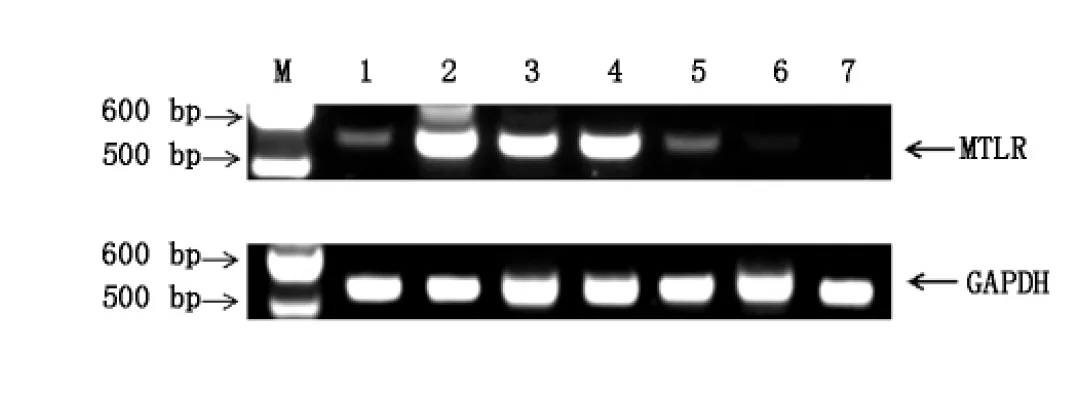
1:胃窦;2:十二指肠;3:空肠;4:回肠;5:近端结肠;6:中端结肠;7:远端结肠
图2MTLR mRNA在狗胃肠道的表达
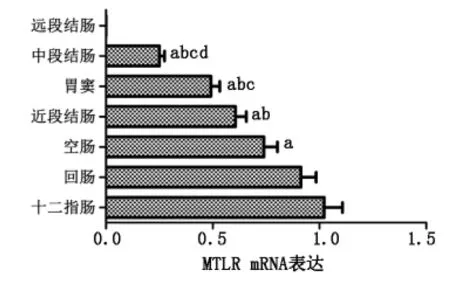
aP<0.01 与十二指肠MTLR mRNA比较;bP<0.01 与回肠MTLR mRNA比较;cP<0.01 与空肠MTLR mRNA比较;dP<0.01 与近段结肠或胃窦MTLR mRNA比较
图3胃肠道不同部位MTLR mRNA 表达的排序及比较
3 讨论
关于MTLR在不同种属的分布及表达已有报道,本研究则针对同一种属胃肠道各部位胃动素受体表达及分布的差异进行探讨,试图更深入理解胃动素对胃肠道运动的作用。研究发现,在总体分布趋势上,从胃肠道近端至远端MTLR表达呈现逐渐降低的趋势;在表达部位上,与文献报道一致[6],MTLR只表达在狗胃肠道的肠神经系统中,并不表达在平滑肌细胞中;在表达量上,十二指肠的表达量最高,以下依次为回肠、空肠、近段结肠、胃窦、中段及远段结肠。
本文以狗为研究对象,是因为胃动素的生理特点在狗和人类之间存在诸多相似性,在消化间期,胃MMC Ⅲ出现时,血中内源性胃动素浓度达到峰值,这种吻合在狗和人体内都得到证实[7];当用中和抗体中和循环中的胃动素抑制正常MMC Ⅲ运动后,以一定浓度静脉输注外源胃动素,在狗和人体内均可诱导出提前的MMC Ⅲ[7]。本研究显示,狗胃动素受体在胃肠道总体分布趋势,也与人类相似,呈现由近端到远端逐渐降低的趋势[8]。已有研究发现胃动素衍生物,如红霉素,不仅对人的上消化道如回肠、上段结肠等运动障碍有作用[9,10],而且也能刺激健康人胃和十二指肠MMCⅢ运动[11],但是对远段结肠动力问题却没有影响[12],这正与MTLR在下消化道的低表达相吻合。实际上,许多种属胃动素免疫阳性细胞(Mo cells)主要位于近端小肠,向肛门方向明显减少,这也与MTLR在胃肠道近端到远端表达逐渐降低一致。
然而,虽然分布总体趋势类似,但不同种属间MTLR分布及高表达部位仍然存在差异[6,13]。在人和兔的肠神经系统和平滑肌上均可检测到MTLR表达,而狗MTLR仅位于肠神经系统;人MTLR的最高表达部位在胃窦[8],兔在结肠[14],而本研究发现狗则以十二指肠表达最多。已知MTLR存在两种亚型,肌肉型和神经型,这两个亚型的结合特性和药理特征是不同的[14],通过对受体功能的研究显示神经受体较肌肉受体对红霉素的刺激更敏感[8]。不仅如此,Sanger等指出胃动素的作用优先表现为促进肠胆碱能神经活动而不是直接收缩平滑肌[15],因此MTLR的神经型应该是其最原始、最本能的表现形式,也是狗体内的唯一形式,人MTLR的最高浓度主要就是在胃窦的神经成分中测得的[8]。
关于MTLR的优势表达部位应与胃动素在该处的功能密切相关。胃动素被认为是调节胃肠MMC的重要的内源性物质,MMC是在消化间期发生在胃和小肠的周期性的、反复的运动模式,进食可使其终止。Ⅲ相是MMC中最主动的、爆发性的收缩,起源于胃窦或十二指肠并逐渐向远端移行。人体内,MMC Ⅲ相收缩起源自胃窦[16],而狗的MMC Ⅲ相起源并无明确说明,但研究已发现十二指肠MMC Ⅲ相常常发生在胃MMC Ⅲ相之前[17]。已经证实,在胃MMC Ⅱ相和Ⅲ相时,5-HT浓度增加发生在十二指肠内[17],而不是胃等其他部位,由此提示胃动素与5-HT之间的正反馈作用发生在十二指肠。当十二指肠被切除后,胃MMC样运动消失,大概1-4个月以后,又重新出现,此时空肠好像变成了十二指肠发挥作用[18]。这些研究都表明十二指肠在胃肠MMC中的关键作用,也提示十二指肠是狗胃肠MMC的起源。本研究中得出的MTLR mRNA在十二指肠表达最多的结果无疑为十二指肠的重要功能提供了结构基础和客观证明.
本研究中,我们发现胃动素受体在狗肠神经系统内差异表达,但是我们并没有确定表达胃动素受体的细胞类型。因为十二指肠的正反馈机制,Takahashi推测胃动素受体位于十二指肠黏膜的EC细胞,并介导了胃MMC Ⅲ相[19]。然而,Xu等通过免疫荧光三标法检测到胃动素受体位于兔间质细胞(interstitial cells of Cajal,ICC)膜上[20],并将胃动素与ICC偶联介导胃运动。无论MTLR是位于ICC上或EC上,都需要进一步研究判断是否存在种属差异。目前,从十二指肠黏膜释放的胃动素与十二指肠EC细胞释放的5-HT之间的信号转导过程还有待证明,但可以肯定的是十二指肠在启动狗胃肠MMC的过程中具有重要的地位[17],这也是本研究所发现的狗MTLR最高表达部位。
[1]Deloose E,Vos R,Corsetti M,et al.Endogenous motilin,but not ghrelin plasma levels fluctuate in accordance with gastric phase III activity of the migrating motor complex in man[J].Neurogastroenterol Motil,2015,27(1):63.
[2]Sanger GJ,Furness JB.Ghrelin and motilin receptors as drug targets for gastrointestinal disorders[J].Nature reviews Gastroenterology & hepatology,2016,13(1):38.
[3]He J,Irwin DM,Chen R,et al.Stepwise loss of motilin and its specific receptor genes in rodents[J].Journal of Molecular Endocrinology,2010,44(1):37.
[4]Sanger GJ,Holbrook JD,Andrews PLR.The translational value of rodent gastrointestinal functions:a cautionary tale[J].Trends in Pharmacological Sciences,2011,32(7):402.
[5]Sanger GJ,Westaway SM,Barnes AA,et al.GSK962040:a small molecule,selective motilin receptor agonist,effective as a stimulant of human and rabbit gastrointestinal motility[J].Neurogastroenterol Motil,2009,21(6):657.
[6]Ohshiro H,Nonaka M,Ichikawa K.Molecular identification and characterization of the dog motilin receptor[J].Regulatory Peptides,2008,146(1-3):80.
[7]Takahashi T.Interdigestive migrating motor complex-its mechanism and clinical importance[J].J Smooth Muscle Res,2013,49:99.
[8]Miller P,Roy A,St-Pierre S,et al.Motilin receptors in the human antrum[J].Am J Physiol Gastrointest Liver Physiol,2000,278(1):G18.
[9]Van Assche G,Depoortere I,Thijs T,et al.Contractile effects and intracellular Ca2+signalling induced by motilin and erythromycin in the circular smooth muscle of human colon[J].Neurogastroenterol Motil,2001,13(1):27.
[10]Whitehead K,Cortes Y,Eirmann L.Gastrointestinal dysmotility disorders in critically ill dogs and cats[J].Journal of veterinary emergency and critical care,2016,26(2):234.
[11]Deloose E,Vos R,Janssen P,et al.The motilin receptor agonist erythromycin stimulates hunger and food intake through a cholinergic pathway[J].Am J Clin Nutr,2016,103(3):730.
[12]Venkatasubramani N,Rudolph CD,Sood MR.Erythromycin lacks colon prokinetic effect in children with functional gastrointestinal disorders:a retrospective study[J].BMC gastroenterology,2008,8:38.
[13]Leming S,Broad J,Cozens SJ,et al.GSK962040:a small molecule motilin receptor agonist which increases gastrointestinal motility in conscious dogs[J].Neurogastroenterology and Motility,2011,23(10):958.
[14]Miller P,Trudel L,St-Pierre S,et al.Neural and muscular receptors for motilin in the rabbit colon[J].Peptides,2000,21(2):283.
[15]Sanger GJ,Wang Y,Hobson A,et al.Motilin:towards a new understanding of the gastrointestinal neuropharmacology and therapeutic use of motilin receptor agonists[J].British Journal of Pharmacology,2013,170(7):1323.
[16]Deloose E,Janssen P,Depoortere I,et al.The migrating motor complex:control mechanisms and its role in health and disease[J].Nature Reviews Gastroenterology & Hepatology,2012,9(5):271.
[17]Nakajima H,Mochiki E,Zietlow A,et al.Mechanism of interdigestive migrating motor complex in conscious dogs[J].Journal of Gastroenterology,2009,45(5):506.
[18]Suzuki H,Mochiki E,Haga N,et al.Effect of duodenectomy on gastric motility and gastric hormones in dogs[J].Ann Surg,2001,233(3):353.
[19]Takahashi T.Mechanism of Interdigestive Migrating Motor Complex[J].Journal of Neurogastroenterology and Motility,2012,18(3):246.
[20]Xu WD,Jiang X,Lan L,et al.Motilin receptor expression in the interstitial cells of Cajal[J].Zhonghua Er Ke Za Zhi,2011,49(4):255.
Comparison and expression of motilin receptor throughout dog gastrointestinal tract
HEYu,WANGCheng-yan,LIUTong,etal.
(China-JapanUnionHospitalofJilinUniversity,Changchun130033,China)
ObjectiveTo compare the expression of motilin receptor in different gastrointestinal regions and explore the structural basis of effect of motilin on various parts of dog gastrointestinal tract.MethodsAntrum,duodenum,jejunum,ileum,proximal colon,middle colon and distal colon were removed from the gastrointestinal tract of six dogs.The localization of motilin receptor was evaluated by immunohistochemistry.Semi-quantitative RT-PCR was performed to measure the expression levels of motilin receptor mRNA in different regions.ResultsMotilin receptor was expressed in the enteric nervous system throughout the gastrointestinal tract in dogs,except distal colon.The motilin receptor mRNA expressions among various regions were significantly different (P<0.01).Motilin receptor mRNA was highly expressed in duodenum,followed by ileum,jejunum,proximal colon,antrum,middle and distal colon.ConclusionThe expressions of motilin receptor in various parts of gastrointestinal tract are different.It is the duodenum that the significantly high expression of motilin receptor mRNA is observed.
motilin receptor;dog gastrointestinal tract;expression
国家自然科学基金项目(31271235,81201094);吉林省自然科学基金项目(201115070);吉林省科技厅项目(2012073,20130413005GH)
1007-4287(2016)09-1432-04
R574.4
A
2015-07-26)

