CD137表达与慢性乙型肝炎患者肝脏免疫病理损伤程度的相关性研究
王 博,吴俊英,2,徐 超
·基础医学·
CD137表达与慢性乙型肝炎患者肝脏免疫病理损伤程度的相关性研究
王博1,吴俊英1,2,徐超3
目的:探讨CD137表达与慢性乙型肝炎(chronic hepatitis B,CHB)患者肝脏免疫病理损伤程度的相关性。方法:采用ELISA法检测受试者外周血中CD137L的水平;免疫荧光法检测肝组织中CD137的表达;Western blot法检测肝组织中CD137和CD28蛋白水平表达;荧光定量PCR检测肝组织中CD137和CD28 mRNA的表达。结果:重度CHB组患者血清CD137L的表达水平均明显高于健康对照组、轻度和中度CHB组患者(P<0.01)。肝组织中CD28 mRNA在中度CHB组和重度CHB组患者的表达水平均较健康对照组及轻度CHB组患者明显升高(P<0.01)。重度CHB组患者CD137 mRNA表达水平均较健康对照组、轻度CHB组和中度CHB组患者显著升高(P<0.01)。肝组织中CD28蛋白在中度CHB组和重度CHB组患者的表达水平均较健康对照组及轻度CHB组患者明显升高(P<0.01)。重度CHB组患者CD137蛋白表达水平均较健康对照组、轻度CHB组和中度CHB组患者中CD137蛋白表达水平显著升高(P<0.01)。结论:CD137的活化参与CHB患者肝组织免疫病理损伤过程,与其损伤程度有相关性。
慢性乙型肝炎;CD137;免疫病理损伤;肝损伤
我国是乙型肝炎病毒(hepatitis B Virus,HBV)感染的高发区,其中慢性HBV感染携带者约1亿例,慢性乙型肝炎(chronic hepatitis B,CHB)患者约2 000万例[1-2]。CHB患者的肝脏损伤与机体的免疫调控息息相关,在此过程中众多的调控因子和细胞参与其中,如共刺激分子、细胞因子、T细胞、自然杀伤细胞和树突状细胞等,但其具体机制如何,尚有待进一步研究[3-4]。T细胞活化后介导的免疫反应是HBV病毒清除和肝细胞损伤的主要机制[3]。T淋巴细胞活化需要双信号,除了T细胞接受抗原提呈细胞提供的第一信号(抗原信号)外,共刺激分子结合为T细胞活化提供第二信号,如CD28/B7和CD137/CD137L等。已有研究表明CHB患者外周血中共刺激分子的表达变化与肝脏病理损伤程度有一定相关性[5],然而对于其在人肝组织中表达情况的研究尚不充分。目前多通过检测患者外周血淋巴细胞活化的方法来推测患者免疫状态,指导临床治疗[6]。事实上,CHB患者肝组织中共刺激分子的表达情况可以更直观地反映其与肝脏损伤程度的相关性。已有研究表明CD28在中度CHB组和重度CHB组肝组织中的表达水平明显高于健康对照组[7],但未进一步探讨其他共刺激分子与肝脏免疫病理损伤程度是否有相关性。本研究探讨CD137在肝组织中的表达及其与肝脏免疫病理损伤程度间的相关性并与CD28作比较。
1 材料与方法
1.1试剂及仪器兔抗人CD137、CD137L、CD28(北京博奥森生物技术有限公司),FITC标记的山羊抗兔荧光二抗(武汉三鹰生物技术有限公司),hRP标记的羊抗兔二抗(上海碧云天生物技术有限公司),TRIZOL试剂(美国Invitrogen公司),RT-PCR试剂盒(北京天根生化科技有限公司),7500型实时荧光定量PCR仪(美国ABI公司)。
1.2方法
1.2.1病例选择病例取自2014年10月至2015年6月中国人民解放军一二三医院和蚌埠医学院第一附属医院CHB住院患者60例,其中男46例,年龄20~59岁;女14例,年龄18~55岁。CHB的诊断按2010年中华医学会肝病学分会和感染病学分会共同修订的《慢性乙型肝炎防治指南》标准,所有患者均不合并其他病毒性肝炎并排除酒精性肝病、药物性肝病以及有自身免疫性疾病的患者。外周血的对照组标本来自于蚌埠医学院第一附属医院体检中心的健康体检者,共30名;肝组织的对照组标本取自于蚌埠医学院第一附属医院肝胆外科和急诊外科,选取癌旁组织(>5 cm)或外伤所致肝破裂的患者,共10例。所有受试者年龄、性别等一般资料均具有可比性。
1.2.2病理学诊断经皮肝穿刺法取肝组织,进行病理学诊断,肝组织炎症分级包括G0~G4五级,纤维化分期包括S0~S4五期,依据2000年西安全国病毒性肝炎及肝病学术会议的修订标准[8]将CHB患者分为轻度CHB组14例、中度CHB组29例和重度CHB组17例。
1.2.3ELISA检测外周血中CD137L表达水平于反应板微孔中加受试者血清100 μL,37 ℃孵育2 h,洗涤5次,每次3 min,加CD137L抗体100 μL,37 ℃孵育1 h,加入TMB显色液显色,在450 nm波长下比色,获取吸光度值,与标准曲线比较得到CD137L浓度。
1.2.4免疫荧光检测肝组织中CD137表达水平石蜡切片脱蜡,用0.1 mol/L、pH 6.0的枸橼酸缓冲液进行抗原修复,3%过氧化氢封闭内源性过氧化物酶,PBS洗涤3次,每次5 min,正常山羊血清封闭30 min,甩去血清,加CD137抗体孵育,4 ℃过夜,次日取出室温平衡30 min,PBS洗涤3次,每次5 min,滴加FITC标记的二抗,37 ℃避光孵育2 h,PBS洗涤3次,每次5 min,滴加DAPI,室温15 min,PBS洗涤5次,每次5 min,甘油封片,用正置荧光显微镜显微观察并摄影。
1.2.5RT-PCR法检测肝组织中CD28和CD137mRNA表达水平向1 mL玻璃匀浆器中加入收集到的肝组织和1 mL Trizol 提取细胞总RNA,反转录合成cDNA,PCR反应体系为20 μL(SybrGreen mix 10 μL,ROX 0.4 μL,上、下游引物(10 μmol/L)各0.6 μL,cDNA模版2.0 μL,ddH2O 6.4 μL)设定条件为95 ℃预变性5 min,95 ℃变性10 s,57 ℃退火30 s,72 ℃延伸30 s,40个循环,再72 ℃平衡10 min,实验独立重复3次。所有基因引物由美国通用生物公司设计并合成,具体序列如下:CD28上游:5′-AGG CTC CTG CAC AGT GAC TA-3′,CD28下游:5′-GAG CGA TAG GCT GCG AAG-3′,产物长度107 bp。CD137上游:5′-TGC TTG TGA ATG GGA CGA AGG AGA-3′,CD137下游:5′-AGA AAC GGA GCG TGA GGA AGA ACA-3′,产物长度195 bp。GAPDh上游:5′-CAG CCT CAA GAT CAT CAG CA-3′;GAPDh下游:5′-TGT GGT CAT GAG TCC TTC CA-3′,产物长度106 bp。
1.2.6Western blot法检测肝组织中CD28和CD137蛋白表达水平向1 mL玻璃匀浆器中加入收集到的肝组织和100 μL蛋白裂解液,研磨提取组织总蛋白,BCA法测蛋白浓度。95 ℃ 5 min后上样,10%SDS-PAGE凝胶中电泳,再转膜至PVDF膜上,封闭液封闭2 h。孵一抗4 ℃,过夜,TBS-Tween20缓冲液洗3×10 min,孵二抗37 ℃,2 h,TBS-Tween20缓冲液洗3×10 min。加曝光液在Bio-Rad凝胶成像仪上成像并分析。实验独立重复3次。
1.3统计学方法采用方差分析和q检验及多个样本比较的秩和检验。
2 结果
2.1对照组和不同程度CHB患者血清中CD137L表达水平比较中度和重度组CHB患者血清CD137L表达水平均高于对照组(P<0.05和P<0.01),重度组CHB患者血清CD137L表达水平亦明显高于轻度和中度组(P<0.01),而对照组和轻度组CHB患者血清CD137L表达水平差异无统计学意义(P>0.05)(见表1)。

q检验:与对照组比较*P<0.05,**P<0.01;与轻度组比较△△P<0.01;与中度组比较##P<0.01
2.2对照组和不同程度CHB患者肝组织中CD28 mRNA和CD137 mRNA表达水平比较中度和重度组CHB患者肝组织中CD28 mRNA表达水平均明显高于对照组及轻度组(P<0.01)。重度CHB组患者CD137 mRNA表达水平均较对照组、轻度CHB组和中度CHB组显著升高(P<0.01)(见表2)。
表2对照组和不同程度CHB患者肝组织中CD28 mRNA和CD137 mRNA相对表达量比较
两两比较秩和检验:与对照组比较*P<0.05,**P<0.01;与轻度组比较△P<0.05,△△P<0.01;与中度组比较##P<0.01
2.3对照组和不同程度CHB患者肝组织中CD28和CD137蛋白表达水平比较中度和重度组CHB患者肝组织中CD28蛋白表达水平均明显高于对照组及轻度组(P<0.01)。重度CHB组患者CD137蛋白表达水平均显著高于对照组、轻度CHB组和中度CHB组(P<0.01)(见图1、表3)。免疫荧光检测CD137蛋白在重度CHB患者肝组织中的表达(见图2)。
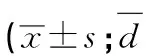
q检验:与对照组比较**P<0.01;与轻度组比较△△P<0.01;与中度组比较##P<0.01
3 讨论
HBV感染后对肝脏细胞造成的损害,并非由HBV自身直接所致,而是通过HBV诱导的T淋巴细胞活化后产生的细胞免疫所致[9],因此,T细胞的活化在CHB患者疾病发生发展的过程中发挥了重要作用。T细胞的活化需要双重信号刺激,第一信号为T细胞接受抗原提呈细胞提供的抗原信号,第二信号则为淋巴细胞表面的共刺激分子,如CD28/B7和CD137/CD137L等[10]。本研究将CD28和CD137两种共刺激分子进行对比研究,探讨它们与CHB患者肝脏病理损伤程度间的相关性。
本研究首先在CHB患者血清中检测CD137L的表达,发现其在中度和重度CHB患者血清中的表达均高于健康对照组(P<0.05和P<0.01),但在轻度CHB组,患者血清中CD137L的表达与健康对照组差异无统计学意义(P>0.05),与既往报道[11]一致。提示在患者因HBV感染发展成为CHB的过程中,共刺激分子CD137L在其中发挥了一定作用,但其具体机制,还需更多的研究探讨。
在CHB患者的血清中检测到CD137L的变化后,研究了肝组织中CD137的表达,发现重度CHB组CD137的表达明显高于健康对照组(P<0.01),但轻度CHB组和中度CHB组变化不明显。此外,较之对照组,CD28在中度CHB组和重度CHB组中的表达也明显增高(P<0.01),但轻度CHB组变化不明显,与既往研究[7]一致。推测CHB患者肝脏组织中CD28和CD137的表达增加可能与机体的免疫状态有关,在HBV早期侵入时,机体对病毒的清除力不强,T细胞活化数目较少,肝组织病理改变也轻,共刺激信号分子的表达则弱。随着疾病的进展,肝组织的病理改变加重,但对病毒的杀伤作用增强,活化的T细胞数目亦增加,此时共刺激分子CD28和CD137的表达也增高[12]。本研究发现,中度CHB组和重度CHB组CD28表达差异无统计学意义(P>0.05),但CD137在重度CHB组的表达则明显高于中度CHB组(P<0.01)。这可能与二者在T细胞活化的不同时段发挥主要作用有关。虽然CD28和CD137同为第二信号,但CD28在静止和活化的T细胞上都表达,而CD137主要表达于活化的T细胞上。在重度CHB患者的肝组织中,机体对病毒的清除能力强,病理改变较重,活化的T细胞数目也较多,此时CD137的升高会更加显著。同时,由于CD28是T细胞活化时表达最早的共刺激分子,而CD137则在T细胞活化晚期发挥主要作用,且CD137既可提供协同CD28的共刺激信号,也可提供不依赖于CD28共刺激分子的第二信号[13-14]。因此,在CHB患者肝脏组织病理改变的重度期,提供第二信号,活化T细胞的过程中,CD137较CD28起到了更加重要的作用[15-16]。
由于CHB患者在做肝脏穿刺术前多已接受过治疗,且因个体化差异治疗效果不一,因此本研究中所得结果是否稳定可靠,仍需大批量的标本证明。综上所述,机体肝脏组织的免疫病理损伤程度加重,CD28和CD137的表达亦升高,重度时CD137的表达变化更加显著,联合检测CD28和CD137能更准确地判断肝组织病理损伤程度,同时,这也为CHB的免疫治疗提供新思路。
[1]European Association for the Study of the Liver.EASL clinical practice guidelines:management of chronic hepatitis B virus infection[J].J Hepatol,2012,57(1):167.
[2]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南2010年更新版[J/CD].中华实验和临床感染病杂志(电子版),2011,5(1):79.
[3]ZHANG Z,ZHANG JY,WANG LF,etal.Immunopathogenesis and prognostic immune markers of chronic hepatitis B virus infection[J].J Gastroenterol Hepatol,2012,27(2):223.
[4]GANEM D,PRINCE AM.Hepatitis B virus infection-natural history and clinical consequences[J].N Engl J Med,2004,350(11):1118.
[5]BEI Z,MAO PH,GUO QY,etal.Effects of costimulation on intrahepatic immunopathogenesis in patients with chronic HBV infection[J].Inflamm Res,2014,63(3):217.
[6]KHAIROVA RA,MACHADO VR,DU J,etal.A potential role for pro-inflammatory cytokines inregulating synaptic plasticity in major depressive disorder[J].Int J Neuropsychopharmacol,2009,12(4):561.
[7]涂远航,荣梅生,马勇.乙型肝炎患者肝组织中乙型肝炎病毒抗原与 CD8+CD28+T 细胞表达的关系及其临床意义[J].蚌埠医学院学报,2011,36(12):1373.
[8]中华医学会传染病与寄生虫分会,肝病分会.病毒性肝炎治疗方案[J].中华传染病杂志,2001,19(1):56.
[9]LAURA JP,UPKAR SG,ALBERTO Q,etal.Metabolic regulation of hepatitis B immunopathology by myeloid-derived suppressor cells[J].Nat Med,2015,21(6):591.
[10]SHAO Z,HARFUDDIN Z,PANG WL,etal.Trogocytic CD137 transfer causes an internalization of CD137 ligand on murine APCs leading to reduced T cell costimulation[J].J Leukoc Biol,2015,pii:jlb.3A0213.
[11]WANG J,ZHAO WX,CHENG L,etal.CD137-Mediated pathogenesis from chronic hepatitis to hepatocellular carcinoma in hepatitis B virus-transgenic mice[J].J Immunol,2010,185(12):7654.
[12]SANMAMED MF,PASTOR F,RODRIGUEZ A,etal.Agonists of co-stimulation in cancer immunotherapy directed against CD137,OX40,GITR,CD27,CD28 and ICOS[J].Semin Oncol,2015,42(4):640.
[13]INGRID E,DUMITRIU PB,CAROLINE JF,etal.high levels of costimulatory receptors OX40 and 4-1BB characterize CD4+CD28null T cells in patients with acute coronary syndrome[J].Circ Res,2012,110(6):857.
[14]TESCHNER D,WENZEL G,DISTLER E,etal.In vitro stimulation and expansion of human tumour-reactive CD8+ cytotoxic T lymphocytes by anti-CD3 CD28 CD137 magnetic beads[J].J Immunol,2011,74(2):155.
[15]高元元,吴俊英,李柏青,等.4-1BBL/4-1BB信号对系统性红斑狼疮患者外周血淋巴细胞活化的影响[J].蚌埠医学院学报,2011,36(11):1177.
[16]王芳,吴俊英,吴正中,等.Pristane诱导狼疮模型鼠共刺激分子的表达变化[J].现代免疫学,2014,34(4):324.
(本文编辑刘璐)
Relationship between the CD137 expression and immunopathological injury degree of liver in patients with chronic hepatitis B
WANG Bo1,WU Jun-ying1,2,XU Chao3
(1.LabofClinicalLaboratoryDiagnostics,BengbuMedicalCollege,BengbuAnhui233030;2.DepartmentofLaboratoryMedicine,BengbuMedicalCollege,BengbuAnhui233030;3.DepartmentofInfectiousDiseases,The123rdHospitalofPLA,BengbuAnhui233000,China)
Objective:To investigate the correlation of the expression of CD137 and immunopathological injury degree of liver in patients with chronic hepatitis B(CHB).Methods:The levels of CD137 in peripheral blood and liver tissue were measured by ELISA and immunofluorescent assay,respectively.The levels of the protein and mRNA expressions of CD137 and CD28 in liver tissue were detected using Western blot and qPCR,respectively.Results:The level of serum CD137 in severe CHB group was significantly higher than that in healthy control group,mild and moderate CHB groups(P<0.01).The expression levels of CD28 mRNA in liver tissue in moderate and severe CHB groups were higher than that in healthy control group and mild CHB group(P<0.01).The expression level of CD137 mRNA in liver tissue in severe CHB group was significantly higher than that in healthy control group,mild and moderate CHB groups(P<0.01).The expression levels of CD28 protein in liver tissue in moderate and severe CHB groups were higher than that in healthy control group and mild CHB group(P<0.01).The expression level of CD137 protein in liver tissue in severe CHB group was higher than that in healthy control group,mild and moderate CHB groups(P<0.01).Conclusions:The activation of CD137 involves in the immunopathological injury process of liver in CHB patients,and is related to the degree of liver.
chronic hepatitis B;CD137; immunopathological injury;liver injury
2015-10-28
安徽省高校省级自然科学研究重点项目(KJ2012A195);蚌埠医学院研究生科研创新计划(byycx1408)
单位] 蚌埠医学院1.临床检验诊断学实验中心,2.医学检验系,安徽 蚌埠 233030;3.中国人民解放军第123医院 传染科,安徽 蚌埠 233000
[作者简介] 王博(1989-),男,硕士研究生.
吴俊英,硕士研究生导师,教授.E-mail:jywu@126.com
1000-2200(2016)09-1125-04
R 392.32
ADOI:10.13898/j.cnki.issn.1000-2200.2016.09.002

